A pesar del tratamiento con hipotermia, el 40% de los neonatos con encefalopatía hipóxico-isquémica fallecen o sufren discapacidad moderada-grave. La espectroscopia cercana al infrarrojo (NIRS) se propone como una herramienta útil y no invasiva para establecer el pronóstico.
ObjetivosEvaluar el valor pronóstico de la NIRS en el resultado del neurodesarrollo entre los 18-36 meses en neonatos con encefalopatía hipóxico-isquémica, y establecer el tiempo y los puntos de corte de la saturación cerebral de oxígeno que mejor se relacionan con el pronóstico.
Pacientes y métodosSe incluyeron todos los neonatos a término con encefalopatía hipóxico-isquémica, sometidos a hipotermia y NIRS, entre 2013-2016. Con respeto al resultado se constituyeron 3 grupos: neurodesarrollo normal, discapacidad moderada y grave.
ResultadosSe incluyeron 28 neonatos (edad gestacional mediana: 39 semanas; peso al nacimiento mediano: 3.195g). La saturación cerebral de oxígeno tendió a aumentar desde una mediana de 65% hasta 85% a las 48horas de vida. El resultado del neurodesarrollo fue normal en 28,6%, el 35,7% adquirió discapacidad moderada y el 35,7% discapacidad grave (3 fallecieron). Se halló una diferencia estadística entre los grupos a las 48horas (p=0,005) y después de la hipotermia (p=0,03), con valores más altos en los pacientes con discapacidad. Teniendo en cuenta el grupo con discapacidad grave frente a los otros, la curva de ROC a las 48horas resultó en un área debajo de la curva (AUC) significativa de 0,872 (p=0,001), con un punto de corte de saturación cerebral de oxígeno de 83,5%. Después de la hipotermia los valores de saturación cerebral de oxígeno por debajo del 66,0% (AUC 0,794; p=0,017) predijeron el desarrollo normal, mientras que valores por encima del 82% (AUC 0,881; p=0,001) predijeron discapacidad grave.
ConclusionesEl NIRS parece constituir una herramienta útil en la predicción del resultado del neurodesarrollo de pacientes con encefalopatía hipóxico-isquémica, incluso después de la hipotermia, con valores más altos de saturación cerebral de oxígeno en pacientes con discapacidad.
Despite treatment with hypothermia, 40% of newborns with hypoxic-ischaemic encephalopathy die or suffer moderate to severe disability. Near-infrared spectroscopy (NIRS) could be a useful, non-invasive tool to establish the prognosis.
ObjectivesTo evaluate the prognostic value of NIRS in predicting neurodevelopmental outcomes at 18 to 36 months in newborns with hypoxic-ischaemic encephalopathy, and to establish the time points and cut-off values of regional cerebral oxygen saturation that exhibit the strongest correlation to these outcomes.
Patients and methodsThe study included all term newborns with hypoxic-ischaemic encephalopathy managed with hypothermia and NIRS between 2013 and 2016. We established 3 outcome categories: normal neurodevelopment, moderate disability and severe disability.
ResultsThe sample comprised 28 newborns (median gestational age, 39 weeks; median birth weight, 3195g). The median regional cerebral oxygen saturation increased from 65% to 85% at 48hours post birth. Neurodevelopmental outcomes were normal in 28.6%, while 35.7% developed moderate disability and 35.7% severe disability; 3 patients died. We found a statistically significant difference between groups at 48hours (P=.005) and after hypothermia (P=.03), with higher values in patients with disability. When we compared patients in the severe disability group with the other groups, we found a statistically significant area under the ROC curve at 48hours of 0.872 (P=.001) applying a regional cerebral oxygen saturation cutoff of 83.5%. After hypothermia, regional cerebral oxygen saturation values below 66.0% (AUC, 0.794; P=.017) predicted normal development, while values above 82% (AUC, 0.881; P=.001) predicted severe disability.
ConclusionsNIRS seems to be a valuable tool to predict neurodevelopmental outcomes in patients with hypoxic-ischaemic encephalopathy, even after hypothermia, with higher cerebral oxygen saturation values in patients with disability.
La encefalopatía hipóxico-isquémica (EHI) asociada a asfixia perinatal es una de las causas más frecuentes de daño cerebral en neonatos nacidos a término, a pesar de los avances en el campo de la medicina1. Su incidencia en países desarrollados es de 2-6 casos por 1.000 nacidos vivos2. La hipotermia de inicio temprano es la única terapia que se ha mostrado beneficiosa, reduciendo el daño cerebral por reperfusión postasfixia3,4 y, posiblemente, la mortalidad y la discapacidad futura, incluyendo la parálisis cerebral5,6.
El daño cerebral puede causar problemas de comportamiento, cognitivos, psicomotores o del lenguaje y epilepsia7. Existen varias técnicas para la evaluación de la función cerebral en neonatos con EHI y para establecer el pronóstico neurológico1. Entre ellas se encuentra la electroencefalografía integrada por amplitud (aEEG), que parece ser útil en la predicción de la evolución tras la asfixia perinatal8,9. La aEEG debe iniciarse lo antes posible con el fin de guiar decisiones respecto a la iniciación de la hipotermia terapéutica, si bien sus resultados no son necesarios para la toma de decisiones. Datos previos han demostrado la asociación entre un trazado normal de aEEG y una mayor probabilidad de supervivencia sin secuelas2. Parece que la hipotermia terapéutica puede reducir el valor predictivo positivo de la aEEG al retrasar la normalización del trazado de base y el inicio de los ciclos vigilia-sueño1,3,10–12. Además, los registros de aEEG pueden verse afectados por el efecto depresor de los anticonvulsivos y sedantes empleados durante el enfriamiento, y por el edema del cuero cabelludo común en estos neonatos10.
También se ha demostrado la asociación entre los hallazgos de la resonancia magnética (RM) y la evolución neurológica a los 12-24 meses de edad, aunque solo si la RM se realiza un mínimo de 24horas tras el nacimiento13. La RM es importante para confirmar el diagnóstico y establecer el pronóstico, pero no se puede utilizar para la monitorización continua7.
Otro posible predictor de los resultados del neurodesarrollo, menos investigado, es la saturación regional cerebral de oxígeno (SrcO2), medida por medio de espectroscopia cercana al infrarrojo (NIRS, por sus siglas en inglés). Se trata de un método no invasivo a pie de cama, empleado para monitorizar la SrcO2 en neonatos en diferentes entornos clínicos7. Poco después del nacimiento la SrcO2 aumenta del 40-56% al 78% en los primeros 2 días, para luego estabilizarse entre el 55-85%7. Estudios previos han mostrado que estos valores son mayores en niños con evolución desfavorable debido a un metabolismo cerebral disminuido con un consumo menor de oxígeno, hiperperfusión cerebral y alteraciones en la autorregulación del lecho vascular cerebral, resultante en vasodilatación tras el daño cerebral agudo1,7,8,10,14. Los datos sobre los valores de la SrcO2 tras la hipotermia terapéutica son escasos1. La monitorización conjunta con NIRS y aEEG parece tener un mayor valor predictivo para la evolución del neurodesarrollo a largo plazo3,9.
El objetivo del estudio era evaluar el valor pronóstico de la NIRS en la predicción de la evolución del neurodesarrollo a los 18-36 meses, en neonatos con EHI ingresados en una unidad de cuidados intensivos pediátricos y sometidos a hipotermia terapéutica.
Los objetivos secundarios eran establecer los puntos de corte óptimos de la SrcO2 para la predicción de discapacidad grave y moderada y el momento de medición de la SrcO2 que mejor se relacionaba con el pronóstico.
Pacientes y métodosEstudio exploratorio con recolección retrospectiva de datos en la Unidad de Cuidados Intensivos Pediátricos terciaria del Centro Hospitalar e Universitário de Coimbra, el centro de referencia para la hipotermia en la asfixia perinatal de la región central de Portugal. Se incluyeron todos los recién nacidos a término ingresados con diagnóstico de EHI moderada-grave monitorizados mediante NIRS, durante y tras la hipotermia terapéutica entre enero de 2013 y diciembre de 2016. Se definió asfixia perinatal como un Apgar≤5 a los 10minutos de vida, duración de maniobras de reanimación cardiopulmonar de más de 10minutos, pH de sangre periférica o de cordón umbilical<7,0 y/o un déficit de base de al menos 16mmol/l en los primeros 60minutos de vida en un paciente con crisis clínicas o eléctricas o hallazgos compatibles con encefalopatía moderada o grave en la evaluación por un profesional cualificado (alteración del nivel de conciencia, tono muscular o reflejos o ausencia de respiración independiente)2. Los criterios de exclusión fueron: edad gestacional al nacer≤36 semanas, neonato no sometido a hipotermia, anomalía congénita seria (por ejemplo, cardiopatía congénita), clínica sugerente de cromosomopatía, error innato del metabolismo o infarto cerebral, pérdida de seguimiento o datos incompletos.
Se recogieron datos clínicos de las historias clínicas electrónicas (SClínico®, B-ICU.Care®, FileMaker®). Se analizaron las siguientes variables: sexo, complicaciones durante el parto, edad gestacional, tipo de parto, puntuación de Apgar, duración total de maniobras de reanimación, peso al nacer, pH de sangre periférica o del cordón umbilical, exceso de base en los primeros 60minutos de vida, temperatura central al ingreso, tiempo de inicio de la hipotermia, hallazgos de la aEEG y la RM, valores de SrcO2 obtenidos mediante NIRS, presencia de crisis clínicas y duración de la estancia en la unidad de cuidados intensivos pediátricos.
La hipotermia se administró con el sistema CritiCool™ (Belmont Medical Technologies, Billerica, Massachusetts, EE. UU.), estableciéndose una temperatura diana de 33,5°C a mantener 72horas. El recalentamiento se realizó a una velocidad de 0,2°C/hora. El equipo de aEEG utilizado fue el monitor de función cerebral Pulmocor®, empleándose 3 canales derivados de electrodos en las regiones parietal y frontal. Se analizaron los patrones de la aEEG y la actividad epileptiforme. Se definió patrón de aEEG anormal como trazado discontinuo de voltaje normal, patrón de brote-supresión o trazado continuo plano o de bajo voltaje. Se registró el patrón de aEEG más desfavorable detectado en cada paciente. La SrcO2 se midió con el monitor INVOS™ (Medtronic) con un sensor neonatal. El sensor se colocó en la región frontal izquierda o derecha de la cabeza del neonato. Aunque la monitorización de la SrcO2 fue continua, se decidió de manera arbitraria documentar los valores a las 12, 24, 36, 48, 72horas y tras la hipotermia (día 4 o 5 de vida). Para el análisis se recogieron los valores obtenidos con el dispositivo INVOS™ en estos puntos temporales. Se clasificaron las alteraciones detectadas en la RM empleando la puntuación RM desarrollada por Weeke et al.15.
Se recogieron datos evolutivos de los registros de las evaluaciones clínicas llevadas a cabo entre los 18 y los 36 meses de edad, incluyendo información sobre las siguientes variables: exitus, parálisis cerebral, epilepsia, trastornos sensoriales y hallazgos de la evaluación del neurodesarrollo.
En la evaluación del neurodesarrollo se emplearon 2 instrumentos. El desarrollo cognitivo se evaluó por medio de las escalas de desarrollo mental (Griffiths Mental Development Scales). Este instrumento da lugar a una puntuación global y a puntuaciones en 6 subescalas (locomotriz, personal-social, audición y lenguaje, coordinación visomotora, ejecución y razonamiento práctico)16. El funcionamiento adaptativo se evaluó mediante las escalas de Vineland (Vineland Adaptive Behavior Scales). Este instrumento evalúa las habilidades cognitivas, sociales y prácticas desarrolladas por el niño para encarar los requerimientos de la vida cotidiana en varias áreas o subdominios (comunicación, habilidades de la vida diaria, socialización y habilidades motoras)16. Se calcularon puntuaciones estandarizadas tipo cociente intelectual y puntuaciones z para los resultados en ambas escalas. Se definió desarrollo normal como puntuaciones entre –1 desviación estándar (DE) y+1 DE (puntuación estandarizada: 85-114). Se definió retraso global del desarrollo como una puntuación z≤–2DE en 2 o más subescalas o áreas en uno o ambos instrumentos, que correspondería a una puntuación estandarizada ≤70, y retraso del desarrollo limítrofe como una puntuación z en 2 o más subescalas o áreas en uno o ambos instrumentos entre –1 y –2 DE (puntuación estandarizada: 71-85). Los test fueron administrados por un psicólogo con experiencia en la evaluación del neurodesarrollo.
El diagnóstico de parálisis cerebral se realizó de acuerdo con los criterios establecidos por la Red Europea de Vigilancia de Parálisis Cerebral (Surveillance of Cerebral Palsy in Europe, 2000)17.
La epilepsia se diagnosticó aplicando los criterios de la Liga Internacional contra la Epilepsia de 201718.
En cuanto a la evolución del neurodesarrollo se definió discapacidad grave como muerte, parálisis cerebral con nivel iii o superior en el Sistema de Clasificación de la Función Motora Gruesa (Gross Motor Function Classification System), retraso global del desarrollo, déficit auditivo que requiriese audífono o ceguera. Se definió discapacidad moderada como retraso del desarrollo limítrofe, déficit sensorial leve o moderado (hipoacusia que no requiriese dispositivos auditivos o déficit visual sin ceguera) o epilepsia (crisis que requiriesen terapia anticonvulsiva en el momento de la evaluación). Se definió neurodesarrollo normal como desarrollo sin secuelas neurológicas.
El análisis estadístico se llevó a cabo con el software SPSS® versión 24. Se calcularon medidas de tendencia central y de dispersión para las variables cuantitativas, y frecuencias absolutas y relativas para las variables cualitativas. Se compararon las variables nominales mediante la prueba Chi cuadrado y las cuantitativas mediante la prueba de Kruskal-Wallis (habiéndose verificado previamente su normalidad mediante la prueba de Kolmogorov-Smirnov). Se aplicó la corrección de Bonferroni a los valores de p obtenidos. Realizamos análisis de curvas de las características operativas del receptor (ROC) para evaluar la capacidad de la NIRS en la predicción de la evolución del neurodesarrollo, calculando el índice de Youden con el fin de establecer los puntos de corte óptimos de los valores de la SrcO2 para maximizar la sensibilidad y la especificidad para la predicción de la discapacidad grave y el neurodesarrollo normal. El nivel de significación estadística se estableció en el 5%.
ResultadosEn el período de estudio 38 neonatos ingresaron con EHI grave o moderada, de los que 28 cumplieron los criterios de inclusión. Se excluyeron 10 neonatos: uno con cardiopatía congénita, 2 por falta de datos sobre la SrcO2 y 7 por pérdida de seguimiento en los primeros meses de vida.
Aplicando la clasificación de Sarnat modificada 7 neonatos tenían EHI grave y el resto EHI moderada.
La edad gestacional mediana al nacimiento fue de 39 semanas (rango intercuartílico [RIC]: 38-40). La mediana del peso al nacer fue de 3.195g (RIC: 2.975-3.515). El 71,4% de los pacientes (n=20) eran varones. La mediana de la puntuación Apgar fue 5 (RIC: 5-7) a los 5minutos y 6 (RIC: 6-8) a los 10minutos. En la primera hora de vida la mediana del pH en sangre fue de 6,9 (RIC: 6,9-7,1) y la mediana del exceso de base fue de –18,9 mmol/l (RIC: 14-23).
El parto fue complicado en el 85,7% de los casos (n=24/28): líquido amniótico teñido de meconio en 11, circular de cordón en 6, rotura uterina en 3, desprendimiento de placenta en 2, transfusión fetomaternal en uno e hipotensión aguda y anemia maternas en otro.
La mayoría de los neonatos nacieron por cesárea (67,9%, n=19/28), y el 28,6% (n=8/28) por parto con fórceps o ventosa. Un único paciente nació por parto eutócico.
La hipotermia terapéutica se inició una mediana de 5,5horas tras el nacimiento (RIC: 3,5-7,4). Todos los pacientes fueron sometidos a hipotermia pasiva antes de ser transferidos al hospital. Al ingreso la temperatura central era inferior a 35,0°C en 23 de los 24 neonatos en los que se registró este dato.
El trazado de la aEEG estaba alterado en el 82,1% de los pacientes (n=23/28), principalmente los 3 primeros días de vida y tras iniciarse el enfriamiento: patrón de brote-supresión en 11, trazado de bajo voltaje en 8 y trazado discontinuo de voltaje normal en 4. Se detectaron crisis eléctricas en el 64,3% de los pacientes (n=18/28), en ausencia de crisis clínicas en 4. Cuatro pacientes sin crisis eléctricas tenían manifestaciones clínicas compatibles con crisis.
La RM, realizada a una edad posnatal mediana de 7 días (RIC: 6-11), estaba alterada en el 67,9% de los neonatos (n=19/28). La puntuación RM mediana de la muestra fue de 6,5 (RIC: 1-14), con un máximo de 26.
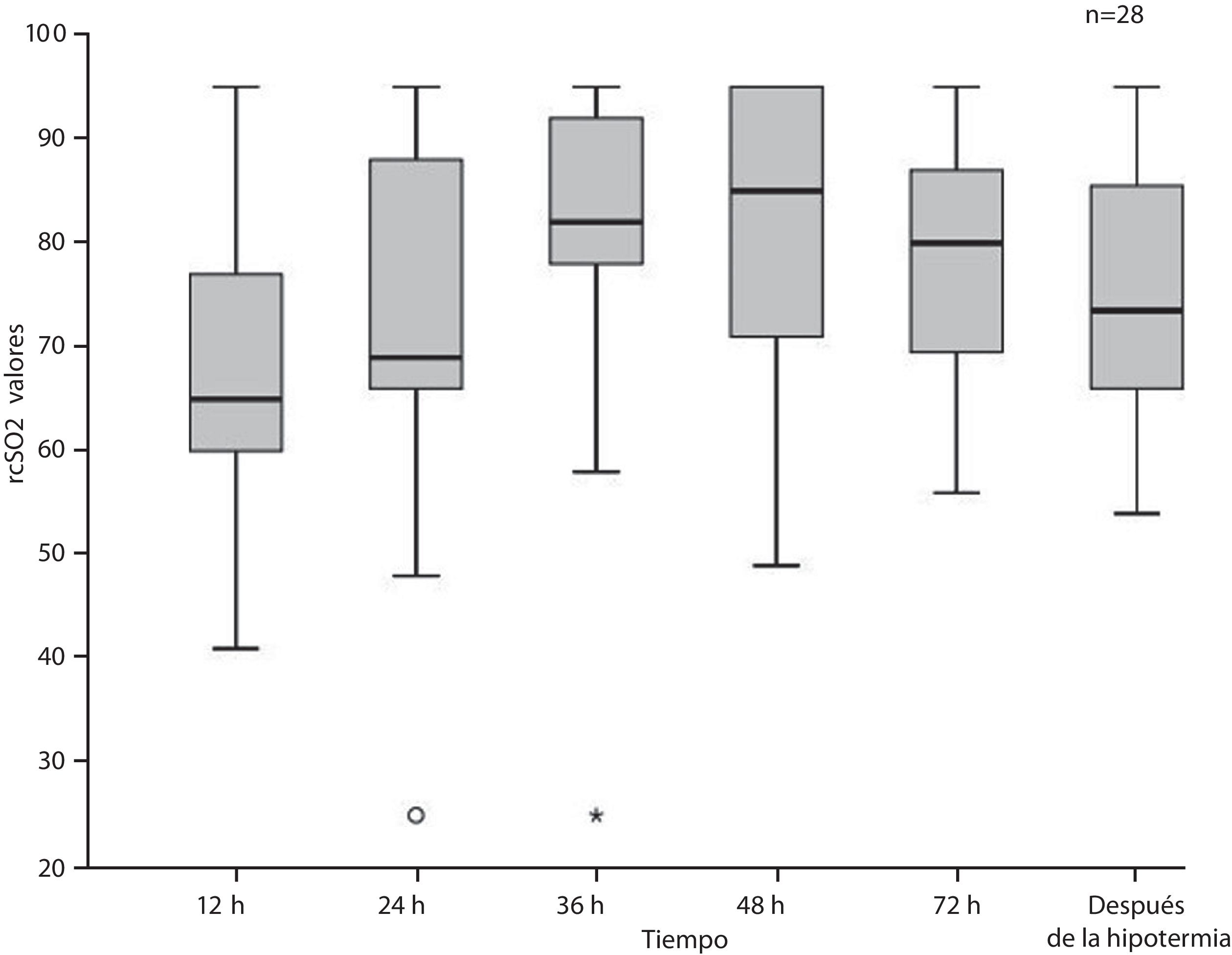
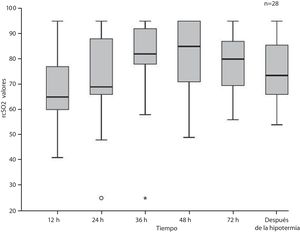
La figura 1 presenta los valores medianos de la SrcO2 en toda la muestra durante y tras la hipotermia. La SrcO2 mediana aumentó del 65% (RIC: 60-78) a las 12horas a un máximo de 85% (RIC: 70,5-95) a las 48horas de vida, para luego decrecer. Los valores registrados tras la hipotermia se obtuvieron en una mediana de 16horas tras iniciarse el recalentamiento (RIC: 15-21,5), con los pacientes con una temperatura central mediana de 36,4°C (RIC: 36,2°C-36,5°C).
La evolución del neurodesarrollo fue normal en el 28,6% de los pacientes (n=8/28), mientras que el 35,7% (n=10/28) desarrollaron discapacidad moderada y el 35,7% (n=10/28) discapacidad grave. Tres neonatos fallecieron (a los 6, 9 y 16 días del nacimiento) tras limitarse el esfuerzo terapéutico en función de la presencia de daño cerebral grave con pronóstico desfavorable.
Veinte pacientes fueron evaluados mediante la Griffiths Mental Development Scales a una edad mediana de 21 meses (RIC: 18-24,7). Veintiuno fueron evaluados con la Vineland Adaptive Behavior Scales a una edad mediana de 18 meses (RIC: 18-23,5). Estas escalas detectaron retraso global del desarrollo en 5 pacientes y retraso del desarrollo limítrofe en 9. En el 64,3% de los pacientes (n=18/28) se utilizaron ambas escalas en la evaluación. Se detectó parálisis cerebral en 5 pacientes con nivel iv o v en la Gross Motor Function Classification System. Ocho pacientes se diagnosticaron de epilepsia. Un paciente tenía hipoacusia moderada.
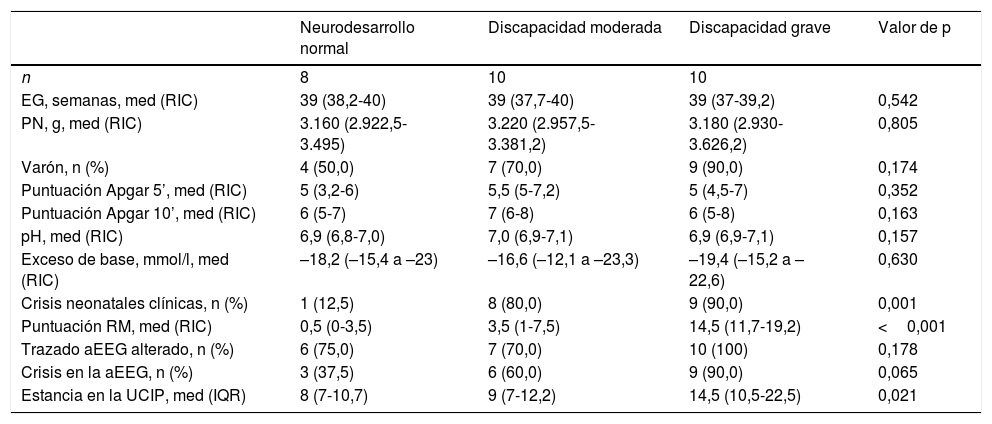
La tabla 1 presenta el estudio clínico y diagnóstico realizado en los 3 grupos de neurodesarrollo.
Estudio clínico y diagnóstico por grupo de neurodesarrollo
| Neurodesarrollo normal | Discapacidad moderada | Discapacidad grave | Valor de p | |
|---|---|---|---|---|
| n | 8 | 10 | 10 | |
| EG, semanas, med (RIC) | 39 (38,2-40) | 39 (37,7-40) | 39 (37-39,2) | 0,542 |
| PN, g, med (RIC) | 3.160 (2.922,5-3.495) | 3.220 (2.957,5-3.381,2) | 3.180 (2.930-3.626,2) | 0,805 |
| Varón, n (%) | 4 (50,0) | 7 (70,0) | 9 (90,0) | 0,174 |
| Puntuación Apgar 5’, med (RIC) | 5 (3,2-6) | 5,5 (5-7,2) | 5 (4,5-7) | 0,352 |
| Puntuación Apgar 10’, med (RIC) | 6 (5-7) | 7 (6-8) | 6 (5-8) | 0,163 |
| pH, med (RIC) | 6,9 (6,8-7,0) | 7,0 (6,9-7,1) | 6,9 (6,9-7,1) | 0,157 |
| Exceso de base, mmol/l, med (RIC) | –18,2 (–15,4 a –23) | –16,6 (–12,1 a –23,3) | –19,4 (–15,2 a –22,6) | 0,630 |
| Crisis neonatales clínicas, n (%) | 1 (12,5) | 8 (80,0) | 9 (90,0) | 0,001 |
| Puntuación RM, med (RIC) | 0,5 (0-3,5) | 3,5 (1-7,5) | 14,5 (11,7-19,2) | <0,001 |
| Trazado aEEG alterado, n (%) | 6 (75,0) | 7 (70,0) | 10 (100) | 0,178 |
| Crisis en la aEEG, n (%) | 3 (37,5) | 6 (60,0) | 9 (90,0) | 0,065 |
| Estancia en la UCIP, med (IQR) | 8 (7-10,7) | 9 (7-12,2) | 14,5 (10,5-22,5) | 0,021 |
aEEG: electroencefalografía integrada por amplitud; EG: edad gestacional; med: mediana; PN: peso al nacer; RIC: rango intercuartílico; RM: resonancia magnética; UCIP: unidad de cuidados intensivos pediátricos.
Se encontró una diferencia estadísticamente significativa en la puntuación RM entre los distintos resultados del neurodesarrollo, con puntuaciones peores en el grupo con discapacidad grave. Las crisis clínicas también fueron más frecuentes en los grupos con discapacidad grave y discapacidad moderada (tabla 1).
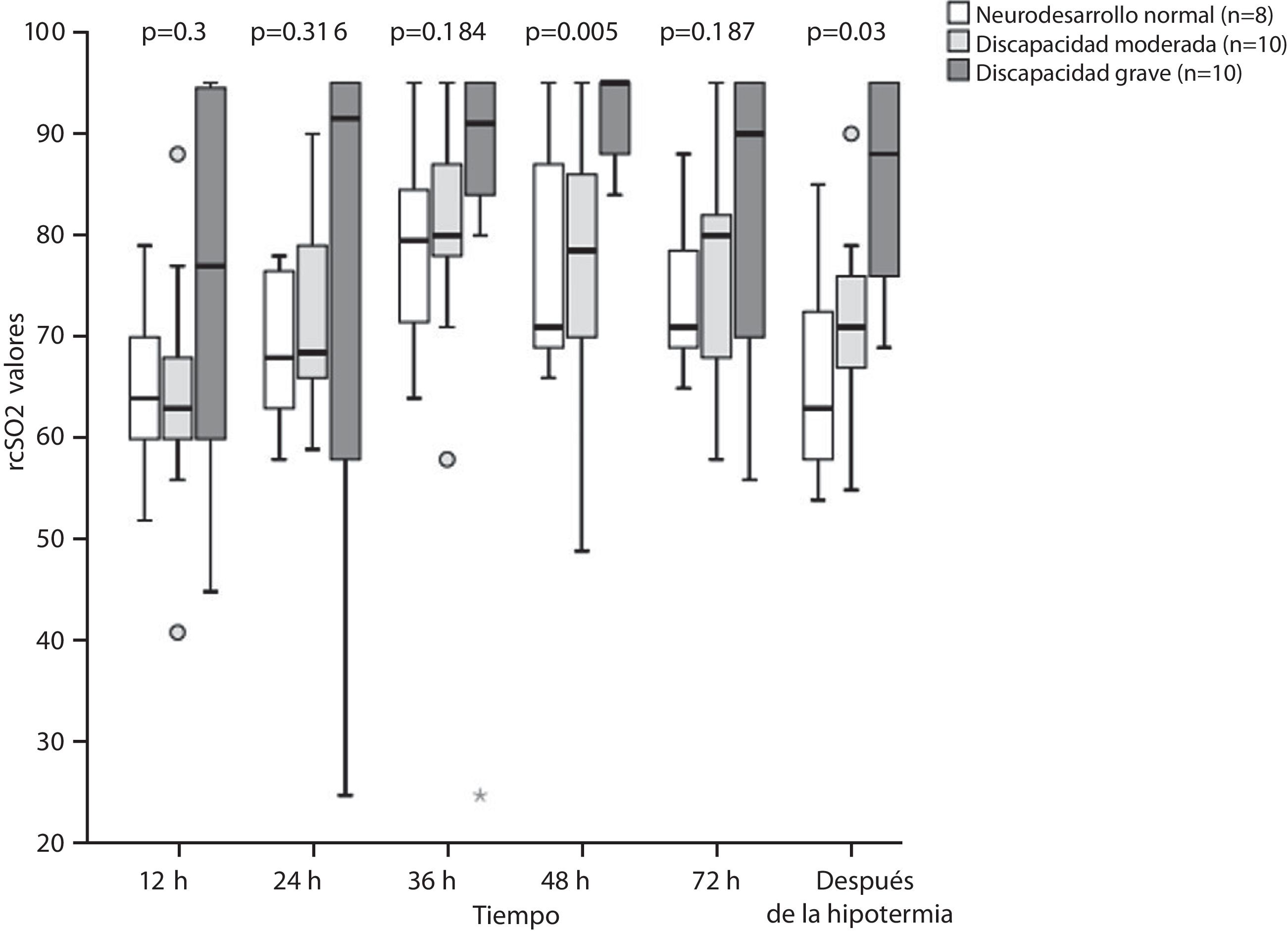
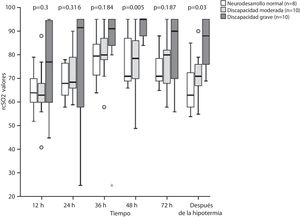
La comparación de la SrcO2 entre los distintos grupos de neurodesarrollo (fig. 2) reveló diferencias estadísticamente significativas a las 48horas de vida entre los grupos con discapacidad moderada y con discapacidad grave (p=0,019), y los grupos con discapacidad grave y con neurodesarrollo normal (p=0,013). También se detectaron diferencias significativas tras la hipotermia entre los grupos con discapacidad grave y con neurodesarrollo normal (p=0,003) y entre los grupos con discapacidad moderada y con discapacidad grave (p=0,043).
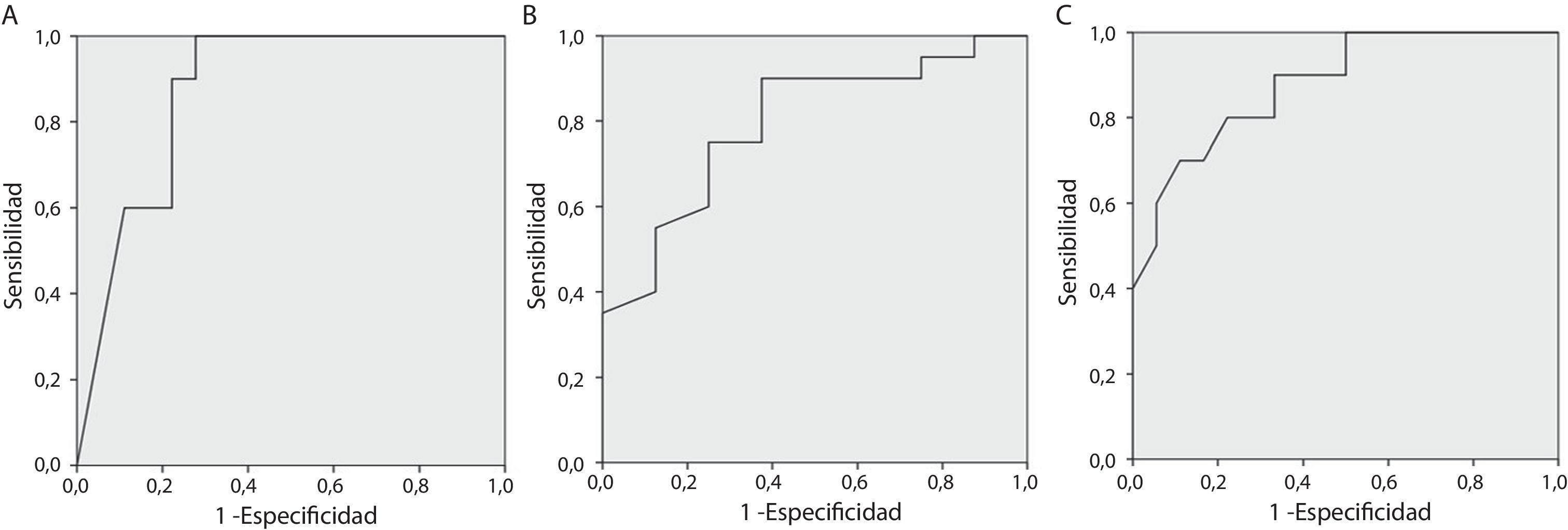
Se encontró una diferencia estadísticamente significativa en el área bajo la curva (AUC) ROC a las 48horas en la comparación del grupo con discapacidad grave, en comparación con el resto de la muestra (AUC=0,872; intervalo de confianza [IC] del 95%: 0,742-1; p=0,001). Aplicando un punto de corte del 83,5% se obtenía una sensibilidad del 100% y una especificidad del 72,2%, un valor predictivo positivo (VPP) del 66,7% y un valor predictivo negativo (VPN) del 100%. Tras la hipotermia la curva ROC mostró una diferencia estadísticamente significativa entre el grupo con neurodesarrollo normal y el grupo compuesto de discapacidad moderada o grave (AUC=0,794; IC 95%: 0,614-0,974; p=0,017), con un punto de corte óptimo del 66,0% (sensibilidad=90%; especificidad=62,5%; VPP=85,7%; VPN=71,4%), así como entre el grupo con discapacidad grave y el grupo compuesto de neurodesarrollo normal y discapacidad moderada (AUC=0,881; IC 95%: 0,752-1; p=0,001), con un punto de corte óptimo de 82,0% (sensibilidad=70,0%; especificidad=88,9%; VPP=77,8%; VPN=88,9%) (fig. 3).
Curvas ROC de los valores de la NIRS (A) a las 48horas, comparación de discapacidad grave con discapacidad moderada o neurodesarrollo normal. B. Tras la hipotermia, comparación de neurodesarrollo normal con discapacidad grave. C. Tras la hipotermia, comparación de discapacidad grave con neurodesarrollo normal o discapacidad moderada.
En el presente estudio la mediana de la SrcO2 mostró una tendencia creciente en pacientes con EHI moderada o grave durante el enfriamiento, aumentando del 65% al 85% a las 48horas de vida y con valores mayores en pacientes que desarrollaron discapacidad. Las diferencias en la SrcO2 entre los grupos de neurodesarrollo normal, discapacidad moderada y discapacidad grave fueron significativas a las 48horas y tras la hipotermia.
La mediana de la SrcO2 aumentó durante el enfriamiento, probablemente debido a una menor captación de oxígeno durante la hipotermia. Los valores de SrcO2 aumentados detectados durante el enfriamiento, incluso en neonatos con evolución favorable, también podrían explicarse por el uso de sedantes, que ralentizan el metabolismo y disminuyen el requerimiento de oxígeno1.
En concordancia con otros estudios se observaron valores más altos de la SrcO2 en pacientes con evolución desfavorable, lo que podría atribuirse a una menor captación de oxígeno y a un metabolismo basal disminuido debido a la pérdida neuronal1,9,14. En el estudio de Peng et al. en neonatos con asfixia perinatal tratados con hipotermia, aquellos que desarrollaron daño cerebral exhibieron saturaciones cerebrales de oxígeno consistentemente más altas durante el enfriamiento y el recalentamiento. No obstante, la diferencia entre los pacientes con asfixia perinatal que desarrollaron daño cerebral y los que no lo desarrollaron solo fue significativa durante las primeras 10horas de enfriamiento14. En nuestro estudio la SrcO2 fue significativamente mayor en el grupo de discapacidad a las 48horas, con valores que superaban el 83,5% en todos los pacientes, y también tras la hipotermia terapéutica. Todos los pacientes con valores de la SrcO2 superiores al 82% tras la hipotermia pertenecían al grupo de discapacidad grave. Por el contrario, casi todos los pacientes con valores de la SrcO2 inferiores al 66% tras la hipotermia tuvieron una evolución favorable.
Toet et al. observaron que los valores de la SrcO2 superaron el rango de normalidad a partir de las 24horas en el grupo de neonatos con evolución adversa. No obstante, estos autores solo compararon valores de SrcO2 hasta las 48horas de vida, y realizaron el estudio antes de la introducción de la hipotermia terapéutica8. En su estudio en neonatos sometidos a hipotermia Lemmers et al. observaron que la SrcO2 aumentó tanto en el grupo de evolución favorable como en el de evolución desfavorable, aunque el aumento fue más modesto en el grupo de evolución favorable a las 24, 36, 48 y 84horas de vida. Estos autores aplicaron un punto de corte del 77% para definir la alteración de la SrcO2 durante el enfriamiento3. En un estudio de Goeral et al. que solo incluyó pacientes con EHI moderada, la SrcO2 media no difirió significativamente entre los grupos con hallazgos de la RM normales y patológicos, aunque los valores de la SrcO2 fueron menores en el grupo con RM normal, especialmente a partir de las 36horas de vida9. El AUC de la SrcO2 alcanzó el máximo entre las 90 y 96horas9. Niezen et al. reportaron que los valores de la SrcO2 de las primeras 48horas no se asociaban al pronóstico, pero que los valores a las 72horas de vida y 24horas tras el recalentamiento eran significativamente mayores en neonatos con evolución desfavorable1. Dix et al. recomiendan la monitorización de la saturación cerebral de oxígeno mediante NIRS durante al menos los 3 primeros días de vida7.
Nuestros resultados coinciden con los de estudios anteriores en apoyar una duración mayor de la monitorización con NIRS, ya que los valores de la SrcO2 tras la hipotermia parecen tener un alto valor pronóstico. Los puntos de corte obtenidos en nuestro estudio podrían ser de utilidad para predecir los resultados del neurodesarrollo. No obstante, en función de la existencia disponible en la actualidad, parece que las tendencias de los valores de la SrcO2 son más útiles que las determinaciones aisladas de la SrcO211.
En nuestra muestra una proporción considerable de los pacientes tuvieron una evolución neurológica desfavorable, a pesar de que en la mayoría la hipotermia se inició precozmente con una temperatura central por debajo de 35,0°C, que es la temperatura considerada segura para la neuroprotección hasta la iniciación del enfriamiento controlado2. La mortalidad descrita en la literatura en pacientes con EHI sometidos a hipotermia es mayor en comparación con la encontrada en nuestra muestra4,19,20. En lo referente a la supervivencia con discapacidad, es difícil comparar resultados de distintos estudios debido a las diferencias metodológicas, aunque cabe mencionar que en el estudio del grupo de trabajo TOBY la proporción de supervivientes sin secuelas neurológicas fue mayor en comparación con nuestro estudio. La incidencia de parálisis cerebral es similar a la encontrada en estudios previos4,19, mientras que la proporción de pacientes que desarrollaron epilepsia fue mayor en nuestro estudio19-21.
Como cabía esperar, la puntuación RM fue mayor en pacientes con discapacidad moderada o grave en el seguimiento, lo que apoya la alta capacidad predictiva de esta puntuación15. En cuanto al patrón de la aEEG estudios previos no han encontrado diferencias significativas, posiblemente porque la monitorización se lleva a cabo durante el enfriamiento1,3,10–12. Cabe destacar que, en nuestro estudio, todos los pacientes en el grupo de discapacidad grave tuvieron alteraciones en la aEEG, aunque estas también se observaron en algunos pacientes con neurodesarrollo normal, y la proporción de estos pacientes en cuanto a la puntuación RM fue menor, lo que de nuevo corrobora el alto valor pronóstico de este test.
En el presente estudio las crisis eléctricas detectadas mediante aEEG fueron más frecuentes en ambos grupos de discapacidad, aunque la diferencia no fue significativa. No obstante, se observó una diferencia estadísticamente significativa en la presencia de crisis clínicas, que fueron más frecuentes en los neonatos que exhibieron discapacidad en el seguimiento. Gucuyener et al. han propuesto que la asociación de las crisis recurrentes y un índice de oxigenación tisular bajo se debe a que el estado de excitotoxicidad lleva a un alto consumo neuronal de oxígeno11, y Niezen et al. encontraron que la ausencia de actividad epileptiforme durante el enfriamiento era un buen predictor de evolución favorable1,9.
En este estudio se emplearon distintas técnicas (aEEG, NIRS, técnicas de imagen) que podrían orientar a los clínicos en el pronóstico de procesos complejos tales como la EHI. La evaluación del neurodesarrollo se realizó con instrumentos validados y ampliamente reconocidos administrados por un psicólogo experimentado. Tal y como recomienda el Manual diagnóstico y estadístico de los trastornos mentales, quinta edición (DSM-5), la evaluación cubrió tanto las capacidades cognitivas como el comportamiento funcional. La secuela más frecuente fue el retraso del desarrollo, pero también se encontraron porcentajes significativos de epilepsia y parálisis cerebral, en consonancia con la literatura médica22,23. Cabe destacar que 9 niños exhibieron retraso del desarrollo limítrofe antes de los 36 meses, lo que se asocia a una probabilidad alta de trastornos de aprendizaje y problemas de comportamiento serios en el futuro.
Nuestro estudio tiene limitaciones, principalmente el reducido tamaño muestral y la pérdida de datos asociada a su diseño retrospectivo. Además, se ha demostrado que ciertos parámetros pueden afectar la oxigenación cerebral, como el hematocrito, la presión arterial, el nivel de soporte ventilatorio y ciertos fármacos que, al no haberse tenido en consideración en el estudio, pueden haber producido sesgos en los resultados.
No obstante, y en conclusión, la NIRS parece ser un método a pie de cama útil para la predicción del neurodesarrollo en pacientes con EHI sometidos a hipotermia, y ofrece la ventaja de no ser invasiva y permitir la monitorización continua durante el enfriamiento. Esta técnica puede ser útil incluso después de la hipotermia. El empleo de técnicas como la NIRS para el pronóstico del neurodesarrollo en neonatos con EHI puede ser importante a efectos de individualizar las estrategias neuroprotectoras a emplear en su momento y en el futuro. Son necesarios estudios prospectivos con muestras mayores para corroborar estos hallazgos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio fue presentado como póster electrónico en la 30 Reunión Anual de la European Society of Paediatric and Neonatal Intensive Care, 19 de junio de 2019; Salzburgo, Austria.