Evaluar el perfil de utilización de medicamentos en situaciones no autorizadas en una unidad de cuidados intensivos pediátricos de un hospital universitario.
MétodosSe realizó un estudio observacional descriptivo prospectivo durante 6 semanas en una unidad de cuidados intensivos pediátricos. Se incluyeron pacientes ingresados con edades entre 0-18años. Se evaluó cada uno de los medicamentos prescritos, indicación o condición de uso, según la información reflejada en las fichas técnicas autorizadas por la Agencia Europea de Medicamentos. Se definió un algoritmo secuencial para clasificar de manera estandarizada los medicamentos según la condición de prescripción en unlicensed, off-label o aprobado.
ResultadosSe incluyeron 42 pacientes, analizándose un total de 696 prescripciones, que implicaron 102 fármacos diferentes. Todos los pacientes tuvieron al menos un tratamiento off-label. El 8,6% del total de tratamientos analizados se utilizaron en condiciones unlicensed y el 53,9% en off-label. El principal motivo de uso off-label fue por indicación, seguido de la edad y dosis. Existe una relación lineal entre frecuencia de uso de medicamentos en condiciones off-label y la edad del paciente, aumentando esta frecuencia según disminuye la edad del paciente. Los medicamentos más utilizados en condiciones off-label fueron: atropina, etomidato, metamizol y ranitidina, y en condiciones unlicensed fueron: espironolactona, sildenafilo, acetazolamida e hidroclorotiazida.
ConclusiónLa unidad de cuidados intensivos pediátricos se caracteriza por una alto ratio de medicamentos prescritos en condiciones no autorizadas. La realización de estudios de estas características permite documentar la práctica clínica respecto al uso de medicamentos en condiciones distintas a las autorizadas.
To analyze the prevalence of use of off-label and unlicensed drugs in a pediatric intensive care unit of a University Hospital.
MethodAn observational, descriptive, prospective six week pilot study in a Pediatric Intensive Care Unit. Hospitalized patients aged between 0 and 18 years were included. Each prescribed drug was evaluated taking into account indication and condition of use, according to the information available on the Summary of Product Characteristics established by the European Medicines Agency. A sequential algorithm was defined allowing drug classification in unlicensed, off-label or approved.
ResultsForty-two patients were included. A total of 696 prescriptions, involving 102 different drugs, were analyzed. All patients had at least one off-label prescription, and a median of 8.9 off-label prescriptions was obtained. Of the total prescriptions, 8.6% were unlicensed and 53.9% corresponded to off-label use. The main reason for off-label use was by indication, followed by age and dose. A lineal tendency between off-label drug use and patient age was observed, where off-label use increased as patient age decreased. The drugs most commonly used off-label were: atropine, etomidate, dipyrone and ranitidine, and unlicensed drugs: spironolactone, sildenafil, acetazolamide and hydrochlorothiazide.
ConclusionPediatric Intensive Care Units are characterized by a high ratio of off-label and unlicensed prescriptions. The scarce number of studies performed in this specific and complex sub-population added inconveniency to the current lack of data on safety and efficacy for drugs in paediatrics. Performing studies with these characteristics allows us to document practice on paediatric drug utilisation are required.
Fomentar el uso eficaz y seguro de los medicamentos en niños es una necesidad actual a nivel mundial. Desde hace años se intenta resolver el problema asociado a la utilización de los medicamentos en niños. El objetivo es claro, proporcionar a los niños medicamentos eficaces y seguros provistos de una información precisa y actualizada. Sin embargo a pesar de los esfuerzos realizados por médicos, investigadores, sociedades científicas y políticas relacionadas con la salud, hasta la fecha, siguen existiendo una serie de obstáculos que impiden un adecuado desarrollo de fármacos para pediatría. Estas barreras son bien conocidas, y entre ellas se encuentran1,2: el coste de realización de los estudios correspondientes, las dificultades para el diseño de los ensayos, el tiempo necesario para completar los periodos de estudio contemplados en los protocolos para niños, muy superiores a los de los adultos, los largos procesos de aprobación, los complejos y específicos aspectos éticos que rodean toda investigación en niños; y por último, el lograr la obtención de un consentimiento que contemple el balance beneficio/riesgo en pacientes que no pueden darlo por sí mismos.
Debido a la ausencia de datos de eficacia y seguridad, el uso no autorizado de fármacos en pediatría siempre ha conllevado un riesgo para los pacientes. Los fármacos empleados siguiendo las especificaciones marcadas por su ficha técnica, y establecidas en el momento inicial de su autorización de comercialización, tienen menos tendencia a producir efectos adversos que aquellos fármacos cuyo uso en niños no está autorizado, o bien está prescrito en condiciones diferentes a las marcadas por su ficha técnica3–9. La propia Agencia Europea de Medicamentos (EMA) lo revisó, concluyendo que el uso de fármacos no aprobados incrementa la incidencia y gravedad de las reacciones adversas a medicamentos10.
Sin embargo, dado que el porcentaje de fármacos que no tienen indicación pediátrica es tan amplio (50-90%), y que esto afecta aproximadamente al 20% de la población de la Unión Europea (entorno a 150 millones de personas menores de 18 años)2, el uso de fármacos bajo estas circunstancias es casi obligado. Es importante que a los niños no se les niegue el acceso al uso de fármacos claramente beneficiosos. No es ni práctico ni apropiado restringir el uso únicamente de fármacos autorizados para este grupo de edad. Los profesionales sanitarios están obligados a tratar a los niños de la mejor manera posible, lo cual invariablemente implica el uso no autorizado de fármacos, o el uso de medicamentos en condiciones distintas a las autorizadas7,11,12.
Los objetivos de este estudio son evaluar el perfil de utilización de medicamentos en situaciones no autorizadas (off-label and unlicensed), y analizar su prevalencia en niños ingresados en una Unidad de Cuidados Intensivos Pediátricos (UCIP) de un hospital universitario.
MétodosSe realizó un estudio piloto observacional, descriptivo y prospectivo en una UCIP, durante un período de 6 semanas consecutivas entre septiembre y octubre de 2011. El estudio se llevó a cabo en la UCIP de un Hospital General Universitario, público, terciario, localizado en Madrid (España). La UCIP consta de 11 camas para pacientes de 0-18años de edad. Dada la elevada prevalencia de enfermedades cardiovasculares atendidas en ella (patologías médicas y quirúrgicas), se trata fundamentalmente de una Unidad de Cuidados Intensivos Cardiológica. La UCIP cuenta con sistema de prescripción médica electrónica y posterior validación farmacéutica, y armarios automatizados de dispensación.
El estudio consistió en la recogida de datos de variables concernientes a los pacientes y a los medicamentos prescritos, que se extrajeron de las historias clínicas electronicas y de información provista por el equipo sanitario. El acceso a datos clínicos se realizó conforme a los protocolos establecidos en el hospital, y los autores firmaron una declaración en la que se comprometían a mantener la confidencialidad y utilizar los datos recogidos exclusivamente para fines de publicación científica.
El estudio se llevó a cabo tras la aprobación del Comité Ético de Investigación Clínica del centro. Se obtuvieron los consentimientos informados de los participantes.
En el estudio se incluyeron pacientes de entre 0-18años de edad, ingresados en la UCIP entre septiembre y octubre de 2011. Fueron excluídos los pacientes con edad superior a los 18 años, así como todos aquellos pacientes de los cuales no se dispusiese de sus datos de filiación, además de su edad, peso y diagnóstico. También se excluyeron los siguientes medicamentos: preparados nutricionales, solución intravenosa cristaloide estándar, oxígeno y heparina utilizada para el mantenimiento de las vías intravenosas.
Se diseñó una base de datos (Microsoft Access_ 2007; Microsoft Corporation, Redmond, WA, USA) donde se recogieron las variables para cada uno de los pacientes incluidos en el estudio: edad y grupo de edad al que corresponde, sexo, tipo de paciente (médico o quirúrgico), sistema anatómico relacionado con el motivo de ingreso, el diagnóstico principal, y de modo optativo, diagnósticos secundarios, así como los medicamentos prescritos. La clasificación de los pacientes por edades se realizó según las recomendaciones establecidas por “The International Conference on Harmonisation” de la EMA (Topic E11_Clinical Investigation of Medicinal Products in the Paediatric Population)13.
Para el cálculo del número total de tratamientos prescritos, se consideró como un tratamiento nuevo, las siguientes situaciones: cuando se trataba de un fármaco distinto, en el caso de que se modificase la vía de administración, si se trataba de una forma farmacéutica diferente, si se trataba de un mismo fármaco cuyo tratamiento se había interrumpido y al cabo de unos días se volvía a reiniciar, o bien, un mismo fármaco que cambiaba la dosis de una reflejada en ficha técnica a una dosis diferente a las indicada en ficha técnica, o a la inversa.
Para cada fármaco prescrito se registró la clasificación ATC (Anatomical, Therapeutic, Chemical classification system), según la actual clasificación del Nordic Council14 y reflejada en el Nomenclator del Ministerio de Sanidad, Servicios Sociales e Igualdad, la vía de administración y la dosis empleada. Además, para cada fármaco incluido se tuvo en cuenta la indicación y condición de uso según lo reflejado en las fichas técnicas aprobadas por la EMA. De acuerdo a su uso, se consideró unlicensed o bien off-label, según lo consensuado en el año 2008 por un panel de expertos15: Unlicensed use fue definido por dicho consenso, y avalado por el grupo pediátrico de trabajo dependiente de la EMA- como la utilización de un medicamento que no ha recibido autorización de comercialización europea como producto medicinal de uso en humanos, sea en niños o en adultos. Off-label use fue definido por el consenso como cualquier uso de un fármaco comercializado y no detallado en ficha técnica, incluyendo indicación, grupo de edad sobre el que se va a emplear, dosis, forma farmacéutica o vía de administración.
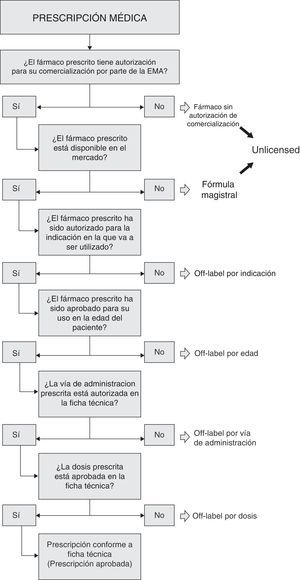
En este sentido, y para su consideración uniforme, revisada toda la bibliografía al respecto, se definió un algoritmo secuencial que permite, para cada prescripción, observar de forma secuencial la información en ella contenida, con el fin de definir la condición de uso del fármaco prescrito (figura 1). En primer lugar se observa si el medicamento prescrito se trata de un medicamento con autorización para su comercialización. Si no es así, se considera “unlicensed” (por ejemplo, los productos en fase de investigación clínica). También se consideraron unlicensed los medicamentos formulados como preparados magistrales, elaborados por el Servicio de Farmacia de Hospital (Fórmulas Magistrales)16, al considerarse que la manipulación del medicamento, así como la falta de información sobre las propiedades fisicoquímicas resultantes, pueden afectar a características farmacológicas importantes. Por otro lado, en los casos en los que se utilizó un medicamento comercializado, se evaluó la condición de prescripción según su indicación, si su uso estaba o no autorizado para el grupo de edad correspondiente, la vía de administración y, por último, la dosis. Esto quiere decir, que en este estudio, los medicamentos comercializados han sido clasificados bajo un único motivo de uso off-label (de acuerdo al algortimo establecido). En el caso de fórmulas magistrales preparadas en la farmacia del hospital —clasificadas inicialmente como unlicensed - se evaluaron de manera secundaria según el algoritmo, su posible uso off-label según indicación, edad u otros motivos.
El análisis estadístico de los datos se realizó con el paquete SPSS 15.0 (IBM Corporation, Armonk, NY, EE.UU.). Se utilizó la prueba χ2 de tendencia lineal para estudiar la asociación entre variables.
ResultadosDurante las 6 semanas del estudio se recogieron datos concernientes a un total de 42 pacientes. Las características de los pacientes incluidos en el estudio se presentan en la tabla 1. Se analizaron 696 prescripciones que implicaron un total de 102 fármacos diferentes, pertenecientes fundamentalmente a los siguientes grupos terapéuticos: Sistema Nervioso (N: 36,1%), sistema cardiovascular (C: 21,6%) y sistema digestivo (A: 10,5%). Los fármacos prescritos con mayor frecuencia fueron el fentanilo (7,9%), el midazolam (7,9%), la atropina (5,2%), el etomidato (5,2%) y suxametonio (cloruro) (5,2%).
Características de los pacientes
| Datos | n (%) |
|---|---|
| Número total de pacientes | 42 (100) |
| Rango de Edad | |
| 0-24 meses | 5 (11,9) |
| ≥2-3 años | 8 (19) |
| ≥3-7 años | 15 (35,7) |
| ≥7-13 años | 11 (26,2) |
| ≥13 años | 3 (7,1) |
| Sexo | |
| Varón | 30 (71,4) |
| Mujer | 12 (28,6) |
| Sistema anatómico asociado al ingreso | |
| Cardiovascular | 31 (73,8) |
| Respiratorio | 4 (9,5) |
| Neurología | 1 (2,4) |
| Traumatología | 2 (4,8) |
| Otro | 4 (9,5) |
| Tipo de paciente | |
| Quirúrgico | 30 (71,4) |
| Médico | 12 (28,6) |
En cuanto a los tratamientos farmacológicos prescritos, los pacientes recibieron un promedio de 16,5 fármacos (mediana: 14, SD: 9,3; P25: 11; P75: 21). El paciente más «sencillo» recibió solo 4 prescripciones distintas, mientras que el paciente más “complejo” recibió 48 prescripciones diferentes a lo largo de su ingreso hospitalario.
Del total de medicamentos diferentes evaluados en el estudio (102), 54 de ellos (52,9%) fueron prescritos en condiciones off-label y 16 (15,7%) en condiciones unlicensed.
Todos los pacientes recibieron como mínimo una prescripción off-label, y 18 pacientes al menos una prescripción unlicensed. Un único paciente recibió solamente un fármaco off-label, mientras que el resto (41) recibieron más de uno. El número medio de fármacos utilizados en condiciones off-label por paciente fue 8.9 (Mediana: 7, SD: 5,8; P25: 5; P75: 12).
El resumen de los parámetros estadísticos relativos al análisis de las prescripciones queda reflejado en la tabla 2.
Resumen de parámetros analizados
| Datos estadísticos | Frecuencia |
|---|---|
| Número total de prescripciones | 696 |
| Promedio de prescripciones por paciente | 16,57 |
| Promedio de prescripciones off-label por paciente | 8,93 |
| Número de prescripciones unlicensed | 60 (8,6) |
| Número de prescripciones off-label | 375 (53,9) |
| Número de prescripciones unlicensed y off-label | 35 (5) |
| Número de pacientes que recibieron al menos un fármaco off-label | 42 (100) |
| Número de pacientes que recibieron al menos un fármaco unlicensed | 18 (42,9) |
Los valores entre paréntesis indican porcentajes.
Siguiendo el algoritmo establecido, inicialmente se identificaron 340 prescripciones utilizadas en condiciones off-label por distintos motivos y 60 prescripciones utilizadas en condiciones unlicensed (8,6% del total de las prescripciones, correspondiendo todas ellas a fórmulas magistrales preparadas en la farmacia), de las que 35 (5% de todas las prescripciones) también se consideraron off-label. Los resultados globales muestran que 375 prescripciones (53,9%) se utilizaron en condiciones off-label: el 55,7% (209 prescripciones) por indicación diferente a la aprobada, el 31,2% (117 prescripciones) por edad distinta a la autorizada, el 12,0% (45 prescripciones) por dosis «no aprobada», y, por último, el 1,1% (4 prescripciones) por vía de administración no contemplada en la ficha técnica. El uso de fármacos en condiciones aprobadas se observó en 296 prescripciones (42,5%).
El subanálisis por grupos de edad mostró que, en niños menores de 2años, un 63% de las prescripciones correspondieron a uso off-label y el 13,7% a uso unlicensed; los porcentajes de prescripciones off-label y unlicensed tienden a ir en disminución en niños de mayor edad, reduciéndose al 45,2% y 0% respectivamente en los adolescentes (≥13años). La prueba χ2 de tendencia lineal fue significativa (p=0,025), corroborando la existencia de una relación lineal entre la frecuencia de uso off-label y la edad del paciente; en cambio, esta tendencia lineal no se constató en el caso de los fármacos utilizados en condiciones unlicensed, posiblemente debido al menor tamaño muestral.
El motivo por el cual se utilizaron los fármacos en condiciones off label, fue independiente de la edad del paciente, hallándose los mismos resultados que en el análisis global: la indicación fue el motivo más frecuente de uso off-label en todos los grupos de edad, seguido de la edad, la dosis y finalmente la vía de administración (tabla 3).
Distribución de la utilización off-label, unlicensed y aprobada de fármacos por grupos de edad
| Condición de utilización del fármaco | Rango de edad | |||||
|---|---|---|---|---|---|---|
| 0-24meses | ≥2-3años | ≥3-7años | ≥7-13años | ≥13años | Total | |
| Off-label | 46 (63) | 80 (55,2) | 134 (55,6) | 96 (49,2) | 19 (45,2) | 375 (53,9) |
| Motivo de utilización off-label | ||||||
| Indicación | 21 (45,7) | 37 (46,3) | 78 (58,2) | 59 (61,5) | 14 (73,7) | 209 (55,7) |
| Edad | 20 (43,5) | 30 (37,5) | 40 (29,9) | 25 (26) | 2 (10,5) | 117 (31,2) |
| Dosis | 4 (8,7) | 11 (13,8) | 15 (11,2) | 12 (12,5) | 3 (15,8) | 45 (12) |
| Vía | 1 (2,2) | 2 (2,5) | 1 (0,7) | 0 (0) | 0 (0) | 4 (1,1) |
| Unlicensed | 10 (13,7) | 11 (7,6) | 19 (7,9) | 20 (10,3) | 0 (0) | 60 (8,6) |
| Aprobada | 23 | 62 | 100 | 88 | 23 | 296 |
| Total de prescripciones | 73 | 145 | 241 | 195 | 42 | 696 |
Nota: la suma de off-label y unlicensed, en cada grupo de edad, no coincide con el número total de prescripciones, ya que hay que tener en cuenta que hay 35 casos considerados unlicensed que también cumplen requisitos de off-label (y se han contabilizado en ambas categorías). Los valores entre paréntesis indican el porcentaje con respecto al número total de prescripciones para cada grupo de edad. En el caso del subanálisis según el motivo off-label, el porcentaje se calcula con respecto al total de prescripciones off-label de cada grupo de edad.
Respecto a los fármacos implicados en las prescripciones, en la tabla 4 se muestran los fármacos utilizados mayoritariamente en esta UCIP, en las diferentes categorías de uso, indicando el número total de prescripciones de cada fármaco y el porcentaje utilizado en condiciones off-label, unlicensed o aprobado, respectivamente. El análisis de los resultados de acuerdo al motivo de uso off-label mostró que los fármacos utilizados más frecuentemente con indicación distinta de la aprobada fueron: atropina, etomidato, ranitidina, furosemida y dopamina; con uso off-label debido a la edad del paciente: milrinona, fentanilo, enoxaparina y clorazepato; debido a la dosis: metamizol y adrenalina, y debido a la vía de administración: adrenalina, vancomicina y morfina. En cuanto al uso unlicensed de fármacos, la espironolactona (20%), el sildenafilo (13,3%), la acetazolamida (13,3%) y la hidroclorotiazida (10%) fueron los fármacos más frecuentes, correspondiendo en el 100% de los casos a fórmulas magistrales.
Fármacos utilizados más comúnmente en la UCIP dentro de cada categoría de uso
| Condición de uso | Fármacos prescritos más frecuentemente | Total de prescripciones | %a | Motivo de uso off-label/unlicensed |
|---|---|---|---|---|
| Off-label | Atropina | 36 | 100 | Indicación |
| Etomidato | 35 | 100 | Indicación | |
| Metamizol | 31 | 100 | Dosis | |
| Ranitidina | 30 | 100 | Indicación | |
| Furosemida | 29 | 100 | Indicación | |
| Dopamina | 26 | 92,3 | Indicación | |
| Milrinona | 24 | 87,5 | Edad | |
| Fentanilo | 55 | 36,4 | Edad | |
| Espironolactona | 13 | 100 | Indicación | |
| Vecuronio | 12 | 91 | Indicación | |
| Omeprazol | 11 | 100 | Indicación | |
| Adrenalina | 9 | 88,9 | Dosis y vía | |
| Enoxaparina | 8 | 100 | Edad | |
| Nitroprusiato | 8 | 87,5 | Edad | |
| Propofol | 7 | 85,7 | Edad | |
| Unlicensed | Espironolactona | 13 | 92,3 | Fórmula magistral |
| Sildenafilo | 10 | 80 | Fórmula magistral | |
| Acetazolamida | 8 | 100 | Fórmula magistral | |
| Hidroclorotiazida | 8 | 75 | Fórmula magistral | |
| Metadona | 5 | 100 | Fórmula magistral | |
| Furosemida | 29 | 17,2 | Fórmula magistral | |
| Aprobado | Midazolam | 55 | 100 | - |
| Succinilcolina | 35 | 97 | - | |
| Paracetamol | 26 | 100 | - | |
| Dexametasona | 8 | 100 | - | |
| Meropenem | 8 | 100 |
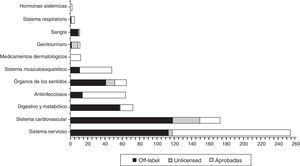
En la figura 2 se puede apreciar cómo se distribuyen, dentro de cada grupo ATC, el total de fármacos prescritos en función de su categoría de utilización, destacando que la mayor parte de los fármacos empleados en condiciones no autorizadas (off label y unlicensed) se concentran en el Grupo B: sangre y órganos formadores de sangre (100%), grupo C (sistema cardiovascular: 84,7%), grupo G (aparato genitourinario: 83,3%), grupo A (digestivo: 79,5%) y grupo S (órganos de los sentidos: 79,4%).
DiscusiónEl presente proyecto se engloba dentro de una estrategia europea común, establecida de acuerdo a los artículos 42 y 43 del Reglamento Pediátrico – Regulation (EC) N° 1901/2006 del Parlamento y del Consejo Europeo para el uso pediátrico de los medicamentos-. Dicha regulación se publica con la intención de facilitar el desarrollo y mejorar la accesibilidad de los medicamentos en la población pediátrica y para asegurar que los medicamentos que se emplean en el tratamiento de los niños son sometidos a una investigación de alta calidad y que son autorizados de forma adecuada para su uso en esta población.
Uno de los requisitos legales de este Reglamento Pediátrico es el de reunir todos los datos disponibles de todos los usos para los cuales se emplean los fármacos en la población pediátrica. Incluso tres países no pertenecientes a la Unión Europea fueron invitados a participar en el proceso (Islandia, Noruega y Liechtenstein). El informe sobre el perfil de utilización off-label y unlicensed de medicamentos en la Unión Europea17 destacó, como una de sus limitaciones, que varios países que representaban aproximadamente el 50% de la población pediátrica europea no habían presentado sus resultados y que, por consiguiente, el perfil de utilización no comprendía esos datos.
Por otro lado se han realizado pocos estudios en subpoblaciones tan específicas y complejas como la de los pacientes pediátricos críticos. En cualquier caso, todos ellos muestran que las unidades de cuidados intensivos pediátricas se caracterizan por un porcentaje alto de fármacos prescritos en condiciones «no aprobadas»18-28. Nuestro estudio encontró un perfil de prescripción con un 53,9% de uso off-label y un 8,6% de uso unlicensed, similar a los resultados de otros estudios.
En la comparación con estudios realizados en otras UCIP, hemos de mencionar que aunque la duración y la población en nuestro estudio puedan parecer menores, la muestra final obtenida (número total de prescripciones analizadas) es muy similar a las de otros estudios18-22. Tras estudiar las condiciones de utilización de medicamentos en una UCIP en Gran Bretaña, en 1996 Turner et al.18 publicaron que un 31% del total de prescripciones conllevaban el uso no autorizado de medicamentos (condiciones off-label o unlicensed) y que el 70% de todos los pacientes habían recibido como mínimo un medicamento en estas condiciones. Si bien los porcentajes que describieron fueron ligeramente inferiores a los obtenidos en estudios posteriores, no hay duda de que estos resultados son significativos. Un estudio de características similares al nuestro realizado por Carvalho et al.19 en el que se analizaron 747 prescripciones de medicamentos a 51 pacientes en el transcurso de 6 semanas mostró que el 60% de las prescripciones correspondían a medicamentos utilizados en condiciones «no aprobadas», y que se prescribió al menos un medicamento en estas condiciones al 88% de los pacientes. En Israel, Gavrilov et al.20 concluyeron que el 81% de las prescripciones correspondieron a «utilización no aprobada» y que el 83% de los pacientes recibieron algún medicamento en condiciones distintas a las autorizadas. Ferreira et al.21 analizaron 1.054 prescripciones de medicamentos en un hospital brasileño y encontraron que el 23,4% del total de los fármacos recetados correspondían a uso off-label y el 12,6% a uso unlicensed. El porcentaje de prescripciones off-label en este análisis fue inferior al encontrado en otros estudios realizados en UCIP.
Un estudio reciente realizado en España y publicado por Blanco-Reina et al.22 obtuvo resultados similares a los nuestros. Se estudió el perfil de utilización y el estado de autorización de los fármacos empleados en una unidad de cuidados intensivos neonatales y pediátricos, analizándose un total de 601 prescripciones, con la conclusión de que algo más de la mitad de las prescripciones (el 52% del total) fueron de tipo off-label. Su estudio resulta de especial relevancia ya que proporciona datos de nuestra área geográfica. La diferencia es que el estudio de Blanco-Reina et al.22 incluye a pacientes neonatales.
Entre otros estudios publicados, hay uno a gran escala realizado en la India por Bavdekar et al.23 en el que también se determinó el uso off-label en una UCIP con resultados similares a los nuestros (70,6% de uso off-label de fármacos), y otro estudio amplio diseñado por Lee et al.24 para determinar el grado de prescripción unlicensed y off-label de fármacos en niños ingresados en las 3 unidades de cuidados intensivos de un hospital en Malasia durante un período de 8 semanas, observándose que de las 1.295 prescripciones, el 34,1% fueron off-label y el 27,3% unlicensed.
No obstante, a pesar, de la concordancia de los resultados presentados, también encontramos diferencias con otros estudios publicados. Por ejemplo, el estudio realizado por’t Jong et al.25, en el que el total de prescripciones unlicensed alcanzó el 52% y el de las off-label el 16%. Estos resultados se explican por el alto porcentaje de medicamentos preparados por el servicio de farmacia del hospital (35%) y los criterios aplicados en su estudio para la definición del uso unlicensed de un fármaco, claramente mucho más amplios que los establecidos en estudios similares.
De manera general, podemos concluir que en estas unidades, alrededor del 55% de las prescripciones (entre el 23 y el 81%) y las prescripciones en aproximadamente el 80% de los pacientes (entre el 70 y el 88%), conllevan el uso de fármacos fuera de las condiciones autorizadas, datos que fundamentalmente concuerdan con lo observado en nuestro estudio. No obstante, un aspecto en el que encontramos diferencias significativas fue la causa por la que el fármaco fue utilizado en condición off-label. En otros estudios similares, la dosis fue el motivo principal de uso off-label19,21,22,23,25, seguido de la edad23 y la frecuencia de administración19, mientras que en nuestro estudio la causa principal fue la indicación del fármaco, seguida de la edad y, por último, la dosis. Estas diferencias pueden deberse a distintas razones, como las diferencias en la práctica de la prescripción médica, según la zona geográfica, manifiestas en la gran variabilidad encontrada entre distintos países en el uso de los medicamentos empleados más comúnmente, las referencias bibliográficas empleadas en cada estudio para evaluar las condiciones de utilización de medicamentos, o, incluso, la metodología de nuestro propio estudio, ya que cada fármaco comercializado se asignó exclusivamente a una de las posibles categorías de uso off-label (de acuerdo con el algoritmo establecido), mientras que otros estudios19,22,23,25 tuvieron en cuenta y evaluaron todas las posibles causas de uso off-label para cada fármaco prescrito. En cualquier caso, y teniendo en cuenta el escaso número de estudios que analizan esta variable y, por tanto, la falta de información concerniente a este tema, los datos deben interpretarse con cautela.
El análisis de la frecuencia de la utilización off-label o unlicensed de medicamentos en distintos grupos de edad no está bien documentado, y los resultados obtenidos hasta la fecha no son concluyentes. Carvalho et al.19 no encontraron diferencias significativas entre los distintos grupos de edad. Bavdekar et al.23 y Ferreira et al.21, en línea con nuestros resultados, localizaron los porcentajes más altos de utilización off-label en los grupos de menor edad.
En lo concerniente a los fármacos utilizados más frecuentemente en condiciones «no aprobadas» en las UCIP, los datos publicados hasta la fecha muestran una gran variabilidad que, posiblemente, se deba a diferencias en la práctica médica habitual entre diferentes zonas geográficas, a los distintos perfiles de enfermedad atendidos en cada UCIP y a los avances progresivos en el uso de medicamentos en pediatría. En cualquier caso, la dopamina, furosemida, ranitidina o adrenalina, entre otros, se encuentran entre los fármacos mencionados con mayor frecuencia en estudios realizados en UCIP, y también se incluyeron en nuestros resultados.
El nuestro es un estudio piloto realizado en una población pequeña y diseñado con objeto de analizar aspectos metodológicos antes de llevar a cabo el estudio definitivo. Así, hemos podido identificar varias áreas a mejorar en investigaciones futuras; por ejemplo: la adición de otra variable de medicación para recoger la frecuencia de administración, o la clasificación de los medicamentos que han de importarse de otros países como unlicensed en lugar de aprobados (fármacos no autorizados para su comercialización en nuestro entorno, España, y que por lo tanto no deberían considerarse en la misma categoría de uso que aquellos medicamentos con sí poseen autorización de comercialización en España).
Por otro lado, este estudio tiene limitaciones similares a las de otros trabajos: no comprende todas las estaciones y, por lo tanto, puede que haya medicaciones que no se cubrieron, especialmente las empleadas en enfermedades estacionales específicas. Dicho esto, es posible que la limitación más importante de nuestro estudio sea el obvio perfil cardiológico de los pacientes ingresados en nuestra UCIP. Los diferentes perfiles clínicos o quirúrgicos de las unidades de cuidados intensivos pueden dar lugar a resultados diferentes en su estudio, y las UCIP como la nuestra, que tratan a pacientes con cirugías cardiovasculares, tienden a usar más medicamentos en condiciones off-label y unlicensed26,27.
Todos estos resultados permiten establecer comparaciones con nuestro medio más cercano e identificar áreas de mejora señaladas por este reglamento que permitan garantizar la utilización efectiva, segura y eficiente de medicamentos en niños. Este tipo de estudios pueden proveer de información valiosa a las agencias de medicamentos con el fin de priorizar la investigación de fármacos específicos en la población pediátrica, especialmente aquellos utilizados más frecuentemente en condiciones off-label o unlicensed.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.