Los tumores de células germinales intracraneales son un grupo poco frecuente de tumores en niños. Comprenden un grupo heterogéneo de neoplasias, que aunque comparten un origen común, presentan comportamientos clínicos muy diferentes.
Pacientes y métodosAnálisis retrospectivo de las características epidemiológicas e histológicas, las manifestaciones clínicas y la evolución de 20 pacientes diagnosticados de tumor de células germinales intracraneal en el Hospital Infantil Universitario Niño Jesús de Madrid durante los años 1994-2014.
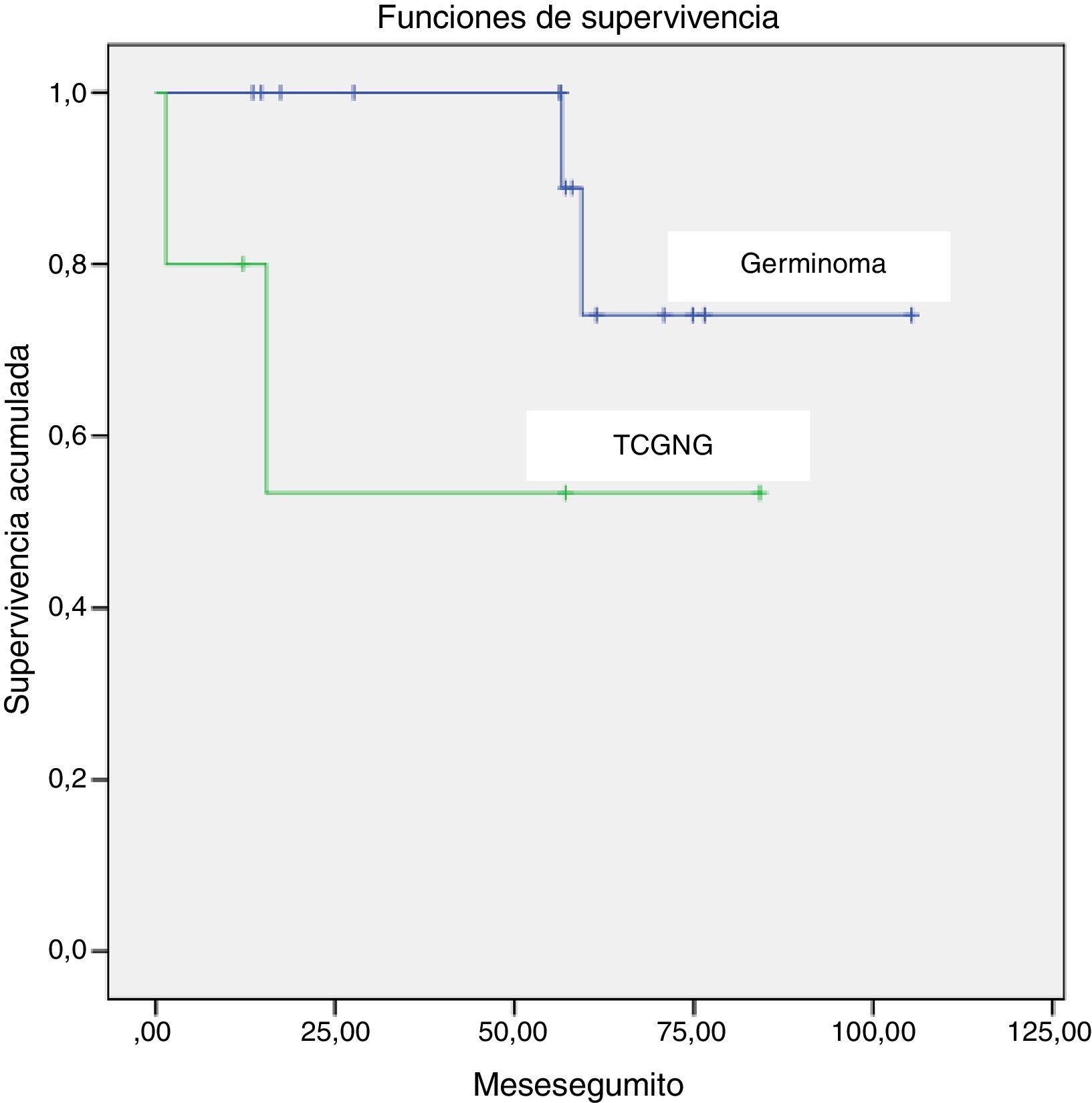
ResultadosSe obtuvieron 20 pacientes: 14 niños y 6 niñas. La edad media fue de 11,1 años (rango 2-18 años). Se realizó confirmación histológica en el 95% de los pacientes. De los 20 pacientes, 14 fueron germinomas puros (70%) y 6 tumores de células germinales no germinomas (30%). Las localizaciones más frecuentes fueron pineal (45%) y supraselar (45%). Los síntomas más frecuentes en el momento del diagnóstico en los tumores de localización pineal fueron cefalea y vómitos (77,77%), seguido de alteraciones visuales (44,4%), y en los tumores de localización supraselar, polidipsia y poliuria (100%). En el momento del diagnóstico recibieron radioterapia el 90% de los pacientes y quimioterapia asociada a la radioterapia el 55%. Presentaron recaída tumoral 4 pacientes (20%), de los cuales 3 fallecieron. La supervivencia global fue del 80%, siendo un 85,7% para los germinomas y un 60% para los no germinomas.
ConclusiónEl tipo histológico más frecuente fue el germinoma. Los tumores de células germinales son un grupo heterogéneo de tumores que conllevan un pronóstico diferente, por lo que un adecuado diagnóstico y estadificación es fundamental para planear el tratamiento.
Intracranial germ cell tumours are rare in children. They are a heterogeneous group of neoplasms that show different clinical manifestations despite having a common origin.
Patients and methodsA retrospective analysis was carried out on the epidemiological and histological characteristics, clinical manifestations, and outcomes of 20 patients diagnosed with intracranial germ cell tumours in the Niño Jesús Children's Hospital of Madrid from 1994-2014.
ResultsA total of 20 patients were identified: 14 boys and 6 girls. The mean age was 11.1 years (range 2-18 years). Histological confirmation of the diagnosis was obtained in 95% of the patients. Of the 20 patients, 14 were pure germinoma (70%) and 6 non-seminomatous germ cell tumours (30%). The most frequent locations were pineal (45%) and suprasellar (45%). The most frequent clinical symptoms in pineal tumours at diagnosis were headache and vomiting (77.77%), followed by visual disturbances (44.4%). In suprasellar tumours it was polydipsia and polyuria (100%). At diagnosis, 90% of the patients received radiotherapy, and 55% received chemotherapy combined with radiotherapy. There was a relapse in 4 patients (20%), and 3 of them died. Overall survival was 80%; 85.7% for pure germinomas and 60% for non-seminomatous germ cell tumours.
ConclusionsThe most common histological subtype was pure germinoma. Germ cell tumours include heterogeneous disease entities that have a variable prognosis. Thus, an accurate diagnosis is vital for patient counselling and treatment planning.
Los tumores de células germinales intracraneales (TCG IC) son un grupo poco frecuente y heterogéneo de tumores que afectan a adolescentes y adultos jóvenes. Su incidencia varía mucho según la región geográfica, comprendiendo el 2-4% de los tumores cerebrales entre 0-19 años en Europa1,2.
Los TCG derivan de las células germinales primordiales, que en su proceso de migración durante la fase embrionaria desde el saco vitelino hasta el esbozo gonadal pueden anidar ectópicamente en el sistema nervioso central (SNC) y experimentar una transformación neoplásica. Según el grado de diferenciación que las células germinales hayan alcanzado en ese momento se originan diferentes tumores.
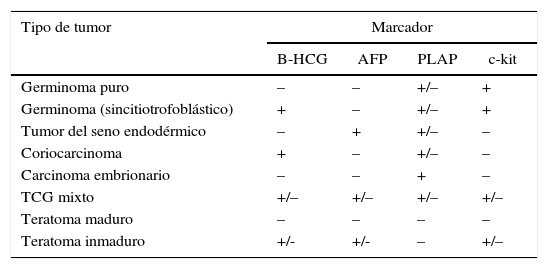
Los TCG originados en el SNC comparten características histológicas, genéticas y similitudes terapéuticas con los TCG extracraneales. La World Health Organization (WHO) divide los TCG en 2 grandes grupos: germinomas y TCG no germinomas (TCGNG)3,4, basándose en la histología y en la presencia de marcadores tumorales (tablas 1 y 2). Otras clasificaciones dividen los TCG en tumores secretores y no secretores. Los tumores secretores presentan alfafetoproteína (AFP) positiva o betagonadotropina coriónica humana (BHCG) por encima de 50 UI/l en líquido cefalorraquídeo (LCR) o cualquier positividad de AFP o BHCG en suero5,6 (tabla 1).
Clasificación de tumores de células germinales intracraneales propuesta por la WHO
| Tumores de células germinales |
| Germinomas |
| Tumores de células germinales no germinomas Carcinoma embrionario Tumor del saco vitelino Coriocarcinoma Teratoma Teratoma benigno Inmaduro Maduro Teratoma con transformación maligna Tumores mixtos de células germinales |
Tomado de Louis et al., editores3.
Clasificación de TCG según los marcadores tumorales
| Tipo de tumor | Marcador | |||
|---|---|---|---|---|
| B-HCG | AFP | PLAP | c-kit | |
| Germinoma puro | – | – | +/– | + |
| Germinoma (sincitiotrofoblástico) | + | – | +/– | + |
| Tumor del seno endodérmico | – | + | +/– | – |
| Coriocarcinoma | + | – | +/– | – |
| Carcinoma embrionario | – | – | + | – |
| TCG mixto | +/– | +/– | +/– | +/– |
| Teratoma maduro | – | – | – | – |
| Teratoma inmaduro | +/- | +/- | – | +/– |
AFP: alfafetoproteína; B-HCG: betagonadotropina coriónica humana; PLAP: fosfatasa alcalina placentaria.
Tomado de Louis et al., editores3.
La presentación clínica depende de la localización y el tamaño del tumor. La localización más frecuente es la pineal, seguido de la supraselar7. Los síntomas de presentación más frecuentes son anomalías endocrinas, signos de hipertensión intracraneal y alteraciones visuales.
Una correcta estadificación y la histología son factores importantes para clasificar el paciente en grupos pronósticos4,8. Los estudios de imagen no permiten diferenciar los TCG de otros tumores, por lo que es necesario confirmación histológica, excepto en casos en los que existe elevación de marcadores tumorales, como AFP y BHCG3. El manejo quirúrgico está limitado por la localización del tumor. Históricamente, el tratamiento consistía en irradiación craneoespinal. En las 2 últimas décadas los avances en las técnicas de imagen, radioterapia (RT) y cirugía y la asociación de tratamiento quimioterápico han mejorado significativamente el pronóstico de los TCG malignos, especialmente los germinomas, cuya supervivencia global a los 10 años es > 90%3,9,10.
Pacientes y métodosElección de los pacientesSe realizó un estudio retrospectivo de los pacientes diagnosticados de TCG IC en el Servicio de Oncología del Hospital Universitario Infantil Niño Jesús de Madrid durante los años 1994-2014. Los criterios de inclusión fueron: a) pacientes de edad menor o igual a 18 años, y b) diagnosticados de TCG IC según la clasificación de WHO3. Se identificó a 20 pacientes.
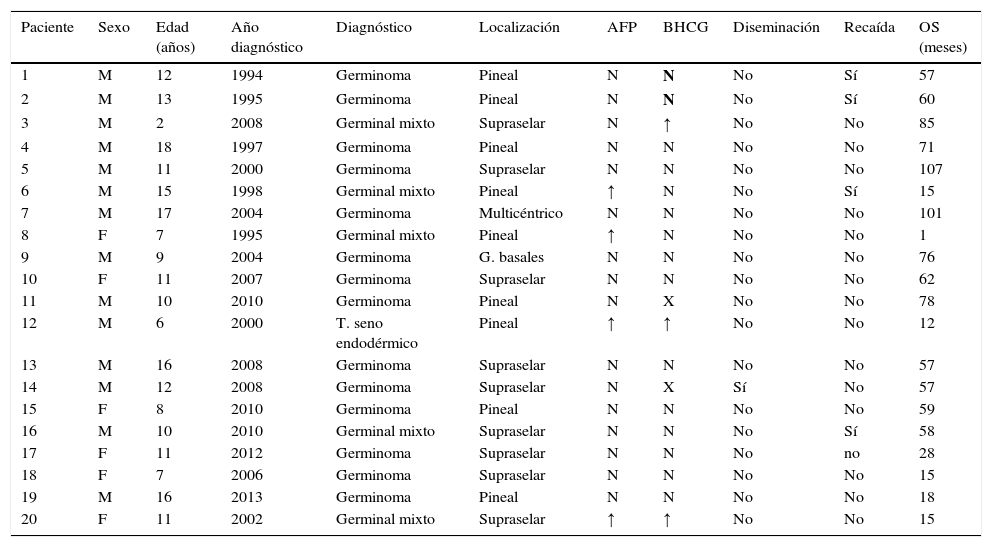
Las variables recogidas fueron edad, sexo, localización del tumor, síntomas al diagnóstico y duración de los mismos, diseminación leptomeníngea, histología, marcadores tumorales en sangre y/o LCR, tipo de cirugía realizada y complicaciones, tipo de quimioterapia (QT) y/o RT administrada y complicaciones, recaída tumoral, alteraciones durante el seguimiento a largo plazo (tabla 3).
Características de los pacientes con TCG intracraneales
| Paciente | Sexo | Edad (años) | Año diagnóstico | Diagnóstico | Localización | AFP | BHCG | Diseminación | Recaída | OS (meses) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | 12 | 1994 | Germinoma | Pineal | N | N | No | Sí | 57 |
| 2 | M | 13 | 1995 | Germinoma | Pineal | N | N | No | Sí | 60 |
| 3 | M | 2 | 2008 | Germinal mixto | Supraselar | N | ↑ | No | No | 85 |
| 4 | M | 18 | 1997 | Germinoma | Pineal | N | N | No | No | 71 |
| 5 | M | 11 | 2000 | Germinoma | Supraselar | N | N | No | No | 107 |
| 6 | M | 15 | 1998 | Germinal mixto | Pineal | ↑ | N | No | Sí | 15 |
| 7 | M | 17 | 2004 | Germinoma | Multicéntrico | N | N | No | No | 101 |
| 8 | F | 7 | 1995 | Germinal mixto | Pineal | ↑ | N | No | No | 1 |
| 9 | M | 9 | 2004 | Germinoma | G. basales | N | N | No | No | 76 |
| 10 | F | 11 | 2007 | Germinoma | Supraselar | N | N | No | No | 62 |
| 11 | M | 10 | 2010 | Germinoma | Pineal | N | X | No | No | 78 |
| 12 | M | 6 | 2000 | T. seno endodérmico | Pineal | ↑ | ↑ | No | No | 12 |
| 13 | M | 16 | 2008 | Germinoma | Supraselar | N | N | No | No | 57 |
| 14 | M | 12 | 2008 | Germinoma | Supraselar | N | X | Sí | No | 57 |
| 15 | F | 8 | 2010 | Germinoma | Pineal | N | N | No | No | 59 |
| 16 | M | 10 | 2010 | Germinal mixto | Supraselar | N | N | No | Sí | 58 |
| 17 | F | 11 | 2012 | Germinoma | Supraselar | N | N | No | no | 28 |
| 18 | F | 7 | 2006 | Germinoma | Supraselar | N | N | No | No | 15 |
| 19 | M | 16 | 2013 | Germinoma | Pineal | N | N | No | No | 18 |
| 20 | F | 11 | 2002 | Germinal mixto | Supraselar | ↑ | ↑ | No | No | 15 |
El diagnóstico de TCG IC se basó en biopsia de tejido tumoral, niveles de AFP y BHCG en sangre y LCR, y resonancia magnética (RM). Se realizó en todos los pacientes estudio de LCR y resonancia craneoespinal para valorar la existencia de diseminación leptomeníngea. Se consideró el diagnóstico de TCGNG cuando se obtuvo confirmación histológica y/o elevaciones de AFP en sangre o LCR>25ng/ml y/o BHCG mayor de 50 UI/l. Se realizó evaluación del eje HPT-HPH al diagnóstico en todos los pacientes.
TratamientoCirugíaSe realizó algún procedimiento neuroquirúrgico para obtener muestra para confirmación histológica en 18 pacientes. Se realizó biopsia en 6 pacientes (una biopsia transesfenoidal y 5 a través de trépano frontal derecho guiadas con euronavegador) y resección parcial en 12 pacientes (6 craneotomías occipitales, 3 craneotomías frontales y 2 pterionales. En un paciente se desconoce la vía de abordaje). Once pacientes presentaron hidrocefalia al diagnóstico; en 8 de ellos se colocó válvula de derivación ventriculoperitoneal (VDVP).
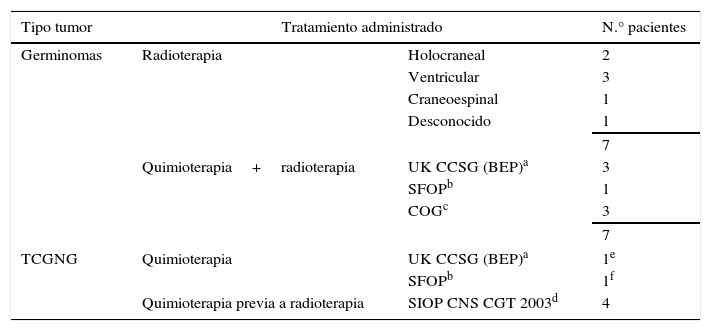
QuimioterapiaLos pacientes recibieron varios regímenes de QT basados en cisplatino. Se emplearon diferentes protocolos: UK CCSG (BEP)11, Societé Francaise d¿Oncologie Pédiatrique (SFOP)12, Children Oncology Group (COG), Pediatric Blood Cancer 200713 y SIOP CNS CGT 2003. Los fármacos y las dosis administrados se muestran en la tabla 4.
Tratamientos administrados
| Tipo tumor | Tratamiento administrado | N.° pacientes | |
|---|---|---|---|
| Germinomas | Radioterapia | Holocraneal | 2 |
| Ventricular | 3 | ||
| Craneoespinal | 1 | ||
| Desconocido | 1 | ||
| 7 | |||
| Quimioterapia+radioterapia | UK CCSG (BEP)a | 3 | |
| SFOPb | 1 | ||
| COGc | 3 | ||
| 7 | |||
| TCGNG | Quimioterapia | UK CCSG (BEP)a | 1e |
| SFOPb | 1f | ||
| Quimioterapia previa a radioterapia | SIOP CNS CGT 2003d | 4 | |
UK CCSG (BEP): cisplatino (100 mg/m2 día 1), etopósido (120 mg/m2/día, días 1-3) y bleomicina (15 mg/m2, día 2)11.
Societé Francaise d¿Oncologie Pédiatrique: ciclos 1 y 3: carboplatino (600 mg/m2, día 1); etopósido (150 mg/m2/día, días 1-3), ciclos 2 y 4: ifosfamida (1,8 g/m2/día, días 21-25) y etopósido (150 mg/m2/día, días 21-23). Administración de radioterapia tras 4 ciclos de quimioterapia12.
Children Oncology Group, Pediatric Blood Cancer 2007: ciclo A: etopósido (100 mg/m2/día, días 1-5) y cisplatino (20 mg/m2/día, días 1-5). Ciclo B: ciclofosfamida (1 g/m2/día, días 1 y 2) y vincristina (1,5 mg/m2/día, días 1, 8 y 15)13.
SIOP CNS CGT 2003: PEI: cisplatino (20 mg/m2/día, días 1-5), etopósido (100 mg/m2/día, días 1-3), ifosfamida (1.500 mg/m2/día, días 1-5).
Recibieron RT 18 pacientes (4 pacientes en el Hospital Puerta de Hierro de Madrid, 11 en el Hospital Gregorio Marañón de Madrid y 3 en otros centros externos). Se aplicaron diferentes modalidades de RT: 2 pacientes recibieron RT holocraneal (dosis 30 y 34Gy), 7 pacientes recibieron RT ventricular (dosis 30-45Gy) y 5 pacientes recibieron RT craneoespinal (23,4-30Gy). Todos estos pacientes recibieron una sobreimpresión sobre el lecho tumoral (21-59,4Gy). Tres pacientes recibieron solo irradiación focal sobre el volumen tumoral inicial (dosis 30,6-54Gy). Un paciente estaba pendiente de iniciar RT en el momento del análisis.
Análisis estadísticoSe definió la supervivencia global como el tiempo transcurrido desde el diagnóstico hasta el momento de la muerte por cualquier causa o la última visita de seguimiento. La supervivencia global se calculó usando el método de Kaplan-Meier. Se utilizó el test de Long-Rank para comparar la supervivencia global entre los diferentes tipos histológicos (germinoma puro comparado con TCGNG). El punto de referencia para este estudio se consideró la fecha de la intervención neuroquirúrgica.
ResultadosDurante los años 1994-2014 se diagnosticó a 438 pacientes con neoplasias intracraneales malignas, de los cuales 20 fueron TCG IC.
La edad media al diagnóstico fue de 11,1 años (rango 2-18 años). El pico de incidencia varía según la histología, observándose diferencias entre germinomas (edad media: 12,21 años) y TCGNG (edad media: 8,5 años). Se obtuvieron 14 niños y 6 niñas, observándose una prevalencia global mayor en el sexo masculino (2,3:1).
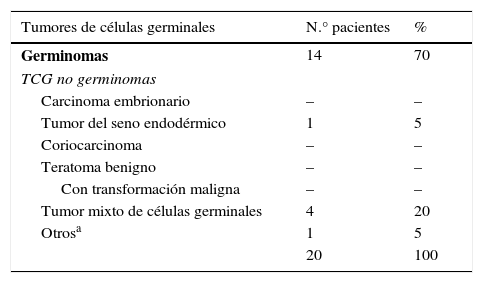
Los TCG IC encontrados se clasificaron según la clasificación propuesta por la WHO3. El tipo histológico más frecuente fue el germinoma (tabla 5).
Tipos histológicos encontrados, según la clasificación de TCG propuesta por la WHO
| Tumores de células germinales | N.° pacientes | % |
|---|---|---|
| Germinomas | 14 | 70 |
| TCG no germinomas | ||
| Carcinoma embrionario | – | – |
| Tumor del seno endodérmico | 1 | 5 |
| Coriocarcinoma | – | – |
| Teratoma benigno | – | – |
| Con transformación maligna | – | – |
| Tumor mixto de células germinales | 4 | 20 |
| Otrosa | 1 | 5 |
| 20 | 100 | |
Se observó elevación de AFP > 25ng/ml en sangre o LCR en 4 casos (2 tumores germinales mixtos, un tumor del seno endodérmico y un TCGNG secretor no biopsiado) y elevación de BHCG > 50 UI/l en 3 de 18 pacientes (un tumor germinal mixto, un tumor del seno endodérmico y un TCGNG secretor no biopsiado).
Se registraron 9 casos de localización pineal (45%), 9 supraselar (45%), un caso en ganglios basales y tálamo (5%) y un tumor multicéntrico (5%).
El 77,7% de los tumores de localización pineal fueron varones. En las mujeres, la localización más frecuente fue en la región supraselar (66,6%).
El tiempo medio de presentación de síntomas hasta el diagnóstico fue de 7,6 meses (rango 0,1-27 meses).
Los síntomas más frecuentes al diagnóstico en los tumores de localización pineal fueron cefalea y vómitos (77,7%), seguidos de alteraciones visuales (44,44%): diplopía, síndrome de Parinaud y movimientos oculares erráticos. Los síntomas más frecuentes en los tumores de localización supraselar fueron polidipsia y poliuria (100%).
El 55,5% de los tumores de localización supraselar presentaron otras alteraciones endocrinas al diagnóstico, siendo las más frecuentes hipotiroidismo (55,5%), déficit de hormona del crecimiento (11,1%) y pubertad precoz (22,2%).
El tumor con localización en los ganglios basales comenzó con hemiparesia izquierda, que fue interpretada en la resonancia inicial como infarto cerebral. El paciente era portador heterocigoto de la mutación 20201 en el gen de la protrombina y presentaba alteración de la lipoproteína A, siendo ambas posibles causas e infarto cerebral en niños. Se decidió tratamiento antiagregante y control evolutivo. En control de RM realizado 7 meses después se observó aumento de la lesión compatible con tumor neuroectodérmico, por lo que fue biopsiado.
El 44,4% de los pacientes con tumores de localización supraselar fueron diagnosticados previamente de diabetes insípida (DI) central de causa desconocida por no ser la resonancia craneal inicial concluyente con diagnóstico de tumor germinal. El tiempo medio en que se llegó a demostrar la existencia de un tumor germinal en resonancias posteriores fue de 21 meses (rango 15-24 meses).
Se realizó confirmación histológica en el 95% de los pacientes. El único caso en el que no se realizó estudio histológico fue un tumor hipofisario con AFP y BHCG elevadas. En un paciente no se obtuvo confirmación anatomopatológica al diagnóstico pero sí en la recidiva.
El 77,7% de los pacientes no presentó ninguna complicación relacionada con el procedimiento quirúrgico. Un paciente presentó un hematoma epidural tras colocación de la VDVP que precisó drenaje, 2 pacientes presentaron neumoencéfalo que evolucionó favorablemente y un paciente presentó un seudomeningocele occipital que precisó drenaje. No se produjo ningún fallecimiento relacionado con la cirugía.
Solo uno de los pacientes mostró diseminación leptomeníngea con células tumorales en el LCR (5%) en el momento del diagnóstico.
Al diagnóstico recibieron RT el 90% de los pacientes y QT asociada a RT el 55%. El 66% de los pacientes presentó buena tolerancia a la RT. Los efectos adversos relacionados con la RT fueron: toxicidad cutánea (n=1), toxicidad hematológica grado ii (n=1), vómitos grado i(n=1) y síndrome post-RT con cefalea, astenia y somnolencia que precisó tratamiento con dexametasona (n=2).
Recibieron QT en el tratamiento inicial 12 pacientes. Se administraron en total 41 ciclos de QT. Las complicaciones asociadas a la QT fueron toxicidad hematológica (grados 3 y 4: n=4), digestiva (grados 3 y 4: n=3), neutropenia febril sin documentación microbiológica (n=2) y un episodio de convulsión hiponatrémica debida a descompensación de la DI durante la hiperhidratación empleada para la administración de QT.
Los tratamientos administrados tras la confirmación histológica pueden observarse en la tabla 4.
Presentaron recaída tumoral 4 pacientes (20%), de los cuales 3 fallecieron y otro continúa en remisión completa tras trasplante autólogo. En todos los casos se trató de recaída con diseminación leptomeníngea y todos ellos presentaron síntomas clínicos en el momento de la recaída (anorexia, dolor y dificultad para la relajación de extremidades inferiores, hemiparesia, dolor lumbar, empeoramiento del habla y brasdipsiquia) En uno de los 4 pacientes la recaída se produjo fuera del campo de RT.
El tiempo medio hasta la recaída en los germinomas fue de 49 meses y en los TCGNG de 12,5 meses. En todos los casos de recaída se realizó trasplante autólogo tras QT de rescate.
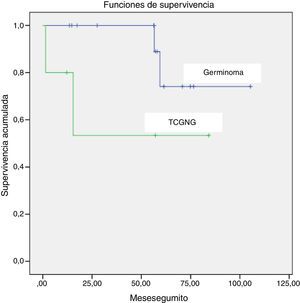
La supervivencia global fue del 84% (el 85,7% para germinomas y el 60% para TCGNG), con una mediana de seguimiento de 58 meses (rango 1,43-106.9 meses) (fig. 1).
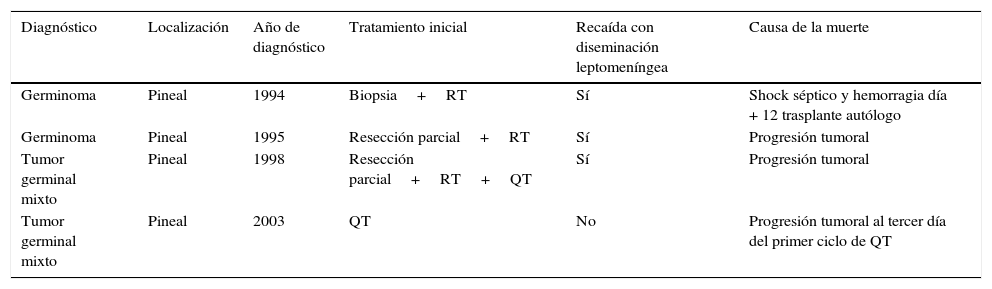
Un paciente diagnosticado de tumor de saco vitelino fue perdido a los 12 meses del diagnóstico por trasladarse a otra Unidad. Los datos de los pacientes fallecidos se muestran en la tabla 6.
Pacientes fallecidos
| Diagnóstico | Localización | Año de diagnóstico | Tratamiento inicial | Recaída con diseminación leptomeníngea | Causa de la muerte |
|---|---|---|---|---|---|
| Germinoma | Pineal | 1994 | Biopsia+RT | Sí | Shock séptico y hemorragia día + 12 trasplante autólogo |
| Germinoma | Pineal | 1995 | Resección parcial+RT | Sí | Progresión tumoral |
| Tumor germinal mixto | Pineal | 1998 | Resección parcial+RT+QT | Sí | Progresión tumoral |
| Tumor germinal mixto | Pineal | 2003 | QT | No | Progresión tumoral al tercer día del primer ciclo de QT |
Durante el seguimiento, los efectos secundarios relacionados con la enfermedad y el tratamiento observados a largo plazo fueron: alteración hormonales del eje hipotálamo-hipofisario que precisaron tratamiento hormonal sustitutivo (45%), dificultad para la concentración y fallo de memoria (20%), enfermedad renal crónica (10%), carcinoma papilar de tiroides (5%) y hemianopsia bitemporal (5%).
DiscusiónLos TCG IC son poco frecuentes en niños. En nuestro caso, representaron el 4,5% de todos los tumores malignos intracraneales diagnosticados durante los años 1994-2004 en el Hospital Niño Jesús. Estos porcentajes son similares a los descritos en otras series en Norteamérica y Europa4,14.
Existe predominio en varones14-16, siendo esta diferencia aún mayor en TCGNG14,17. Las localizaciones más frecuentes fueron pineal y supraselar7. En nuestra serie, al igual que lo descrito en la literatura14,18, existe predilección por la localización supraselar en mujeres.
La localización en los ganglios basales es poco frecuente, representando el 4-15% de los pacientes con TCG IC, pero merece la pena comentarla debido a sus características clínicas y dificultad para el diagnóstico. La hemiparesia es el síntoma más frecuente1,19. En nuestra serie, un caso con un tumor localizado en ganglios basales comenzó con hemiparesia izquierda, que fue interpretada en la resonancia inicial como infarto cerebral, dadas las características del paciente (portador de mutación en el gen de la protrombina y alteración de la lipoproteína A). El seguimiento con prueba de imagen llevó al diagnóstico del tumor.
La sintomatología descrita es similar a la encontrada por otros autores. Los tumores de localización pineal suelen asociar síntomas de hipertensión intracraneal7,15. Anomalías oftalmológicas han sido descritas en el 25-50% de los pacientes y síndrome de Parinaud hasta 72,4%4,7,15. Es importante considerar la posibilidad de un tumor pineal ante sintomatología de hipertensión intracraneal o síntomas oculares.
Los tumores de localización supraselar suelen presentar DI, retraso del desarrollo sexual, hipotiroidismo y pubertad precoz15,20,21. Además, pueden presentar anomalías oftalmológicas. En nuestra serie, el 44,4% de los pacientes con TCG de localización supraselar inicialmente fueron diagnosticados de DI central idiopática por no existir evidencia de tumor en la RM inicial. En estos pacientes el tiempo medio desde el inicio de la sintomatología con RM normal hasta la demostración de tumor supraselar en la RM fue de 21 meses; esto ha sido descrito previamente en la literatura7,22,23. Los síntomas endocrinos son frecuentes en pacientes con TCG IC y pueden estar presentes mucho tiempo antes de que se pueda verificar por prueba de imagen. Es importante considerar TCG cuando existan alteraciones endocrinas y realizar estudios periódicos de imagen, porque el retraso en el diagnóstico aumenta el riesgo de enfermedad diseminada24.
En nuestro caso, de modo similar a otros estudios5, un 45% de los pacientes precisaron tratamiento hormonal sustitutivo tras finalizar el tratamiento, por lo que es necesario un seguimiento endocrino a largo plazo.
Los TCG pueden dividirse en 2 grandes grupos: germinomas y no germinomas. Los germinomas representan aproximadamente el 50-70% de los casos4,20. Esta diferenciación es de gran relevancia clínica, ya que el subtipo histológico es el factor pronóstico aislado más importante en el TCG IC7,14,16.
Se han descrito clasificaciones terapéuticas de TCG IC basadas en la clasificación histológica15,25, que dividen los TCG IC en pronóstico bueno, intermedio y malo (tabla 7).
Clasificación terapéutica de tumores de células germinales intracraneales
| Grupo con buen pronóstico |
| Germinoma puro |
| Teratoma maduro |
| Grupo con pronóstico intermedio |
| Germinoma con células sincitiotrofoblásticas |
| Teratoma inmaduro |
| Teratoma con transformación maligna |
| Tumores mixtos compuestos principalmente de germinoma o teratoma |
| Grupo con mal pronóstico |
| Coriocarcinoma |
| Tumor del seno endodérmico |
| Carcinoma embrionario |
| Tumores mixtos compuestos principalmente de coriocarcinoma, tumor del seno endodérmico o carcinoma embrionario. |
Tomado de Matsutani et al.15.
Los germinomas son tumores extremadamente quimio y radiosensibles. Durante los últimos 20 años, la irradiación craneoespinal ha sido el gold standard del tratamiento y ha conseguido tasas de supervivencia > 90% a los 5 años4,6,10,26. Sin embargo, esta conlleva efectos adversos sobre el SNC, la función tiroidea y el crecimiento5,27-29. En el caso de TCGNG, a pesar del uso de QT intensiva y altas dosis de RT, la supervivencia a los 10 años sigue siendo del 30-80%22,23,30. Actualmente se están llevando a cabos estudios multicéntricos (International Society of Pediatric Oncology CTG phase ii) con el objetivo de encontrar la mínima dosis y volumen de radiación posible sin afectar la supervivencia en germinomas localizados4,14,15 y en el caso de TCGNG con el objetivo de mejorar la supervivencia en pacientes de alto riesgo intensificando el tratamiento, especialmente en niños < 6 años al diagnóstico y pacientes con AFP > 1.000ng/ml.
En nuestra serie, la supervivencia para el grupo de los germinomas es menor que la descrita en la literatura. Fallecieron 2/14 pacientes diagnosticados de germinomas puros, pero cabe destacar que estos fueron diagnosticados en los años 1994 y 1995, respectivamente. Ninguno de los 12 germinomas diagnosticados durante los años 1996-2014ha fallecido. En nuestro caso, la diferencia entre la supervivencia global para germinomas y no germinomas no es estadísticamente significativa, pero esto probablemente sea debido al pequeño tamaño de la muestra.
En nuestra muestra, se realizó confirmación histológica en el 95% de los pacientes. El único caso en el que no se realizó estudio histológico fue un tumor hipofisario con AFP y BHCG elevadas. Dado el diferente pronóstico de este grupo de tumores, establecer un diagnóstico exacto con confirmación histológica es fundamental para plantear un adecuado tratamiento. Estudios de neuroimagen no pueden diferenciar TCG de otros tumores y, por lo tanto, el diagnóstico requiere confirmación histológica7, salvo en los casos en los que existen marcadores tumorales elevados.
Históricamente, los riesgos asociados a la cirugía llevaron al uso de métodos diagnósticos alternativos como el ensayo de irradiación terapéutica para confirmar el diagnóstico de germinoma. Actualmente, los avances en las técnicas neurocirugía han hecho la cirugía de los tumores pineales mucho más segura, con una mortalidad < 5%15,31.
Dada la buena respuesta de los germinomas al tratamiento quimiorradioterápico, la cirugía en este caso se encuentra limitada por la preservación de la función visual y neuroendocrina5. Sin embargo, una cirugía más agresiva cobra más importancia en TCGNG y se han descrito tasas de supervivencia mayores en pacientes en los que se ha realizado cirugía radical5,15,32 En los casos de teratoma maduro, la resección amplia es generalmente curativa.
La adecuada estadificación es fundamental para plantear el tratamiento4,33. No existe un sistema de estadificación específico uniformemente aceptado para germinomas y la mayoría de los investigadores utilizan sistema TNM usado para meduloblastomas23. Todos los pacientes al diagnóstico deberían tener RM craneoespinal, AFP y BHCG en sangre y LCR, punción lumbar para estudio de citología de LCR, evaluación funcional del eje hipotálamo-hipofisario, exploración del campo visual y evaluación neuropsicológica4,5,34.
En nuestro caso, presentaron recaída 2/14 pacientes diagnosticados de germinoma (14,2%). Ambos habían recibido RT holocraneal y sobreimpresión sobre el lecho tumoral. En el caso de los TCGNG, se observaron un 33,3% de recaídas. El tiempo medio hasta la recaída en los germinomas fue de 49 meses y en los TCGNG, de 12,5 meses. En la literatura se ha descrito recaída en el 10% de los germinomas5,35 y hasta en el 55,7% de TCGNG15. El tiempo medio hasta la recurrencia en los germinomas oscila de 30 a 50 meses1,36. Recurrencias tardías después de 8-15 años no son infrecuentes, por lo que es necesaria la observación durante un período ≥ 10 años1.
En los 4 casos de recaída descritos en nuestra serie, se observó diseminación leptomeníngea en la recaída. Según lo descrito en la literatura, los TCG IC recaen más frecuentemente en el tumor primario pero en el 30% de los casos existe diseminación leptomeníngea. El pronóstico de los pacientes con recaída, especialmente TCGNG, continúa siendo pobre4,37. El tratamiento de rescate incluye QT, RT y QT mieloablativa con trasplante autólogo38,39.
ConclusiónLos TCG IC son un grupo heterogéneo de tumores, que conllevan un pronóstico diferente por lo que un adecuado diagnóstico y estadificación es vital para planear el tratamiento. Dado que cada vez son más los pacientes que se curan de estos tumores, deberíamos identificar a pacientes de bajo riesgo en los que el tratamiento se puede minimizar para reducir el impacto en la calidad de vida de los supervivientes manteniendo la supervivencia e intensificar el tratamiento en los grupos de alto riesgo para conseguir mayor tasa de curación1,5.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.