Desde su aprobación por la Agencia Europea del Medicamento, el tratamiento con hormona de crecimiento recombinante ha sido empleado en un gran número de pacientes nacidos pequeños para la edad gestacional en España. El propósito de este estudio es conocer objetivamente los resultados del mismo en la práctica habitual.
MétodosSe ha recogido información procedente de los registros existentes en los comités asesores que autorizan dichos tratamientos en los hospitales públicos de 6 comunidades autónomas.
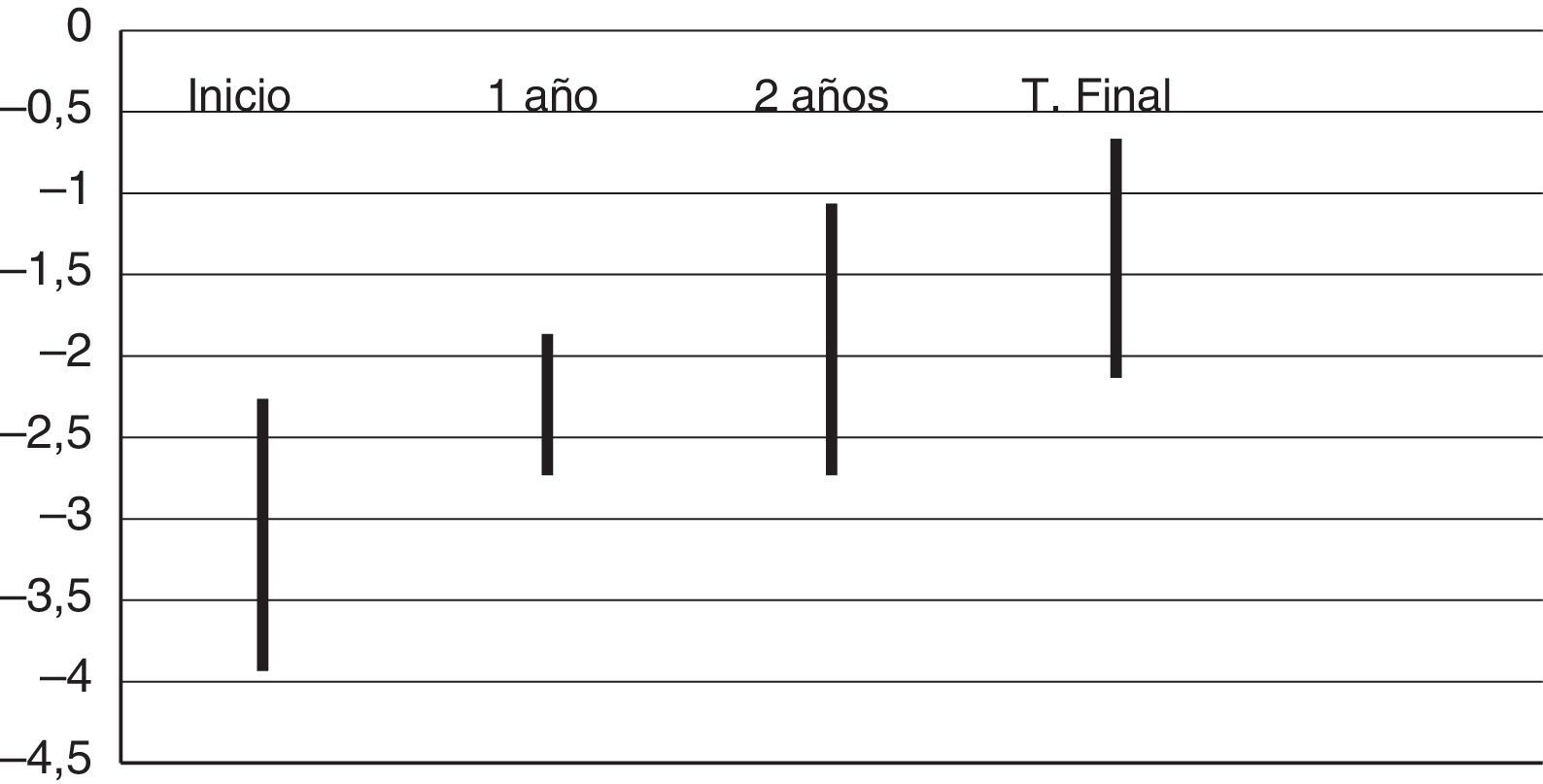
ResultadosSe han obtenido datos válidos de 974 pacientes. Todos ellos cumplían los criterios exigidos por la Agencia Europea del Medicamento. Los pacientes que recibieron el tratamiento se caracterizaron por tener la longitud al nacer más afectada que el peso, talla diana inferior a –1 desviación estándar (DE) y un 23% con antecedentes de prematuridad. La talla al iniciar el tratamiento fue de −3,1±0,8 DE (media±DE) y la edad de comienzo 7,2±2,8 años. La ganancia de talla en el primer año fue de 0,7±0,2 DE, y de 1,2±0,8 DE hasta los 2 años. La talla final, alcanzada por un 8% de pacientes, fue de –1,4±0,7 DE.
ConclusionesLos resultados concuerdan con las series nacionales e internacionales publicadas y son representativos de la práctica habitual en nuestro país.
Se constata un inicio tardío del tratamiento, observándose, sin embargo, un adecuado crecimiento, tanto a corto plazo como en la talla final. En el primer año se identifica un 24% de pacientes con respuesta deficiente.
Since its approval by the European Medicines Agency, a great number of patients born small for gestational date have received recombinant growth hormone treatment in Spain. The aim of this study is to analyse its outcome in the setting of ordinary clinical practice.
MethodsInformation was gathered from the registers of the assessment boards that authorise all growth hormone treatments prescribed in public hospitals in six autonomic communities (regions).
ResultsValid data from 974 patients was obtained. All of them complied with criteria established by the European Medicines Agency. Patients in the sample were smaller in length than weight at birth, with their median target height being below 1 standard deviation (SD), and 23% of them had been delivered prematurely. Treatment was started at 7.2±2.8 years (mean±SD). The mean patient height at start was −3.1±0.8 SD. They gained 0.7±0.2 SD in the first year, and 1.2±0.8 SD after two years. Final height was attained by 8% of the sample, reaching –1.4±0.7 SD.
ConclusionsThese results are similar to other Spanish and international published studies, and are representative of the current practice in Spain.
Despite treatment being started at a late age, adequate growth is observed in the short term and in the final height. Up to a 24% of patients show a poor response in the first year.
El término pequeño para la edad gestacional engloba a todos aquellos recién nacidos con un peso y/o longitud vértex-talón inferior a la media para su sexo y tiempo de gestación respecto a una población de referencia1. Desde la autorización en 2003 por la Agencia Europea del Medicamento (EMA) de la indicación de la hormona de crecimiento recombinante (HCr) en niños nacidos pequeños para la edad gestacional (PEG) o crecimiento intrauterino restringido (CIR) y sin recuperación de talla posnatal, en nuestro país han recibido dicho tratamiento un gran número de pacientes. Sin embargo, desconocemos la cifra exacta, su distribución geográfica, la edad de comienzo, la respuesta clínica y los posibles efectos adversos detectados. Gran parte de esta información consta en los registros de los comités asesores que autorizan los tratamientos en las distintas comunidades autónomas (CC. AA.). Con el fin de conocer de forma objetiva las características del uso de la HCr en los niños PEG en España, se han obtenido los datos de dichos registros en varias CC.AA., fase preliminar de un estudio de ámbito estatal.
Esta información, una vez analizada y depurados posibles errores en los valores calculados, se contrasta con los estudios nacionales e internacionales sobre el tratamiento con HCr en PEG.
MétodosSe procedió a la recogida exhaustiva de la información contenida en los registros de los comités asesores que regulan la dispensación de la HCr por la Sanidad Pública en las distintas CC. AA. de los pacientes con autorización de tratamiento, a excepción de los datos personales de carácter confidencial. Dicha información incluye la talla de los padres, la edad gestacional, el peso y la longitud al nacimiento. Igualmente se recogen la edad, el peso, la talla, el estadio puberal y la velocidad de crecimiento del paciente al inicio del tratamiento y en los controles sucesivos, así como las dosis prescritas y la talla final alcanzada en aquellos que completaron el tratamiento durante el periodo estudiado. En las chicas, se registró la edad de la menarquia.
La somatometría se valoró según las curvas del Estudio Colaborativo Español 20082 y los estadios puberales según Tanner3. Se muestran los resultados como medias ± desviaciones estándar (DE). En el análisis estadístico se utilizó el programa IBM SPSS Statistics 19.0 para PC. Los estudios estadísticos planteados fueron la t de Student bilateral y la prueba T para muestras relacionadas. Significación de p<0,05 con un intervalo de confianza del 95% dentro de las variables analizadas.
ResultadosSe analizan los tratamientos registrados (número) desde 2004 hasta 2014 en las CC. AA. de Aragón (76), Euskadi (87), Navarra (56), Catalunya (525), Cantabria (69) y Galicia (161). En total se obtuvieron datos válidos de 974 pacientes (48% varones). Representan aproximadamente el 21% del total de tratamientos con HCr autorizados en dichas CC. AA. Un 5% de ellos fueron embarazos múltiples y un 23% prematuros, siendo la edad gestacional del total de la muestra 38 (3) semanas.
El peso al nacimiento de los pacientes fue de –2±1 DE y la longitud al nacer de –2,6±0,9 DE.
El 81% de los pacientes tenía una longitud al nacer menor de – 2 DE, el 54% un peso menor de – 2 DE y el 42% se encontraba por debajo de – 2 DE tanto para el peso como para la longitud.
Un 27% de las tallas diana ([talla del padre+talla de la madre±13]/2) estaban por debajo de –2 DE. La media de la talla diana de la muestra fue de – 1,5±1 DE.
Los pacientes iniciaron el tratamiento con HCr a la edad de 7,2±2,8 años. A lo largo del periodo estudiado no se modificó significativamente la edad de comienzo del tratamiento en los nuevos pacientes.
La talla al inicio del tratamiento se situó en –3,1±0,8 DE y la velocidad de crecimiento previa al mismo fue de –1,4±1,5 DE. El estadio puberal al comienzo del tratamiento fue Tanner 1 en el 89%, Tanner 2 en el 7% y Tanner 3 en el 2%.
La dosis de HCr empleada inicialmente fue de 35±6 μg/kg/día, no observándose modificación significativa en la misma durante el seguimiento ni en relación con el año de comienzo, siendo independiente también de la edad de inicio y del estadio puberal. Todos los pacientes recibieron el tratamiento de forma continuada.
La ganancia de talla en respuesta al tratamiento durante el primer año fue de 0,7±0,2 DE, y de 1,2±0,8 DE hasta los 2 años. Aproximadamente un 30% de los pacientes alcanzaron una talla superior a –2 DE en el primer año y un 60% adicional durante el segundo año (fig. 1). Al quinto año de tratamiento, la talla había aumentado en 2±1,9 DE respecto a la talla inicial. La velocidad de crecimiento se incrementó respecto al año anterior al tratamiento en 3,9±2,3 DE. No se encontraron diferencias significativas en la respuesta en relación con la edad gestacional.
Un 14% de los pacientes mostraron una respuesta durante el primer año inferior en 2DE a la media de la muestra, equivalente a una ganancia menor de 0,3DE de talla, lo que definiría el umbral de respuesta insuficiente al tratamiento. Hasta un 24% ganó menos de 0,5DE de talla y un 55% de los pacientes incrementó su velocidad de crecimiento menos de 3cm/año.
La respuesta en el primer año de tratamiento correlacionó significativamente (p<0,05) con la talla inicial (r –0,40) y la edad de comienzo (r –0,36) negativamente, y positivamente con la dosis (r 0,24).
La talla final se alcanzó en el 8% de la muestra durante el seguimiento, quedando en –1,4±0,7 DE, muy similar a la talla diana, con una diferencia de –0,1±1 DE.
La edad de la menarquia, disponible en el 13% de las chicas, se situó en 13,3±2 años.
DiscusiónLa eficacia y la seguridad del tratamiento con HCr en niños PEG sin recuperación de talla posnatal están avaladas por diversas publicaciones internacionales4,5. Desde la aprobación por la EMA, el Ministerio Español de Sanidad incluyó la indicación bajo el epígrafe de Crecimiento intrauterino retardado. Durante los últimos años, en nuestro país se han dado a conocer los resultados del tratamiento en varias series que reúnen pacientes de algunos centros hospitalarios6-10.
Sin embargo, hasta ahora carecíamos de información acerca del número de tratamientos y su proporción respecto a otras indicaciones de la HCr, de su distribución geográfica y del seguimiento del conjunto de pacientes. El presente estudio está basado en una muestra constituida por el total de tratamientos de niños PEG con HCr en una zona geográfica, 6 CC. AA. del norte de España, fase preliminar de un estudio de ámbito estatal, e incluye a 974 pacientes que han recibido dicha terapia en el periodo 2004-2014. El estudio tiene las limitaciones inherentes a la fuente de información, que no recoge exhaustivamente los datos obstétricos, la patología intercurrente, los efectos secundarios o la adherencia al tratamiento. Sin embargo, por el importante número de pacientes y la ausencia de sesgo de selección (asistidos en diferentes centros hospitalarios, recibiendo HCr de diferentes fabricantes), este estudio es representativo del uso de HCr en la indicación de PEG (CIR) en nuestro país.
Los resultados revelan un perfil característico de los pacientes que acceden al tratamiento con HCr, con talla diana por debajo de la media, longitud más afectada que el peso al nacer, y casi en un 25% de la muestra, pretérmino. Este perfil permitiría identificar a aquellos PEG que requieren mayor vigilancia del crecimiento durante los primeros años. En otras series se observan también tallas diana en torno a –1 DE11,12 pero cabe destacar que un 27% de las tallas diana en nuestra serie eran inferiores a – 2DE, señalando un componente genético marcado en la talla baja de este grupo de pacientes.
Los prematuros, que representan un 5-9% de todos los nacimientos en Europa13, tienen una representación desproporcionada en la muestra, un 23%, aunque similar al de otro estudio realizado en España, el DATAC, donde suponen el 27%10. La respuesta al tratamiento en prematuros es comparable con la obtenida en nacidos a término14.
A pesar de que el tratamiento está autorizado por la EMA a partir de los 4 años, la media de edad de comienzo en nuestros pacientes es de 7,2 años, sin que esta demora se haya corregido a lo largo del periodo de observación. En otros estudios realizados en España encontramos una edad similar6,7,9,10. Nuestra hipótesis es que aún no se ha generalizado la práctica, dentro del seguimiento de los PEG, de remitir a las unidades de endocrinología pediátrica a todos aquellos que no recuperan el crecimiento en los primeros años.
La respuesta a la HCr, expresada por el incremento en DE de talla, es mayor cuanto menor es la edad de inicio, aspecto que se confirma en este estudio por la fuerte correlación negativa entre la edad y el aumento de talla en el primer año de tratamiento. En otras series hay hallazgos similares8,11,12. Un adecuado seguimiento de los niños PEG desde su nacimiento permitiría comenzar el tratamiento y normalizar la talla a edades más tempranas15.
Hemos comprobado que los pacientes han recibido de forma homogénea una dosis media de 35 μg/kg/día, que no se modifica durante el tiempo de observación, ni tampoco en función de la edad o del tiempo de evolución. Aunque el ajuste de la dosis en la pubertad es controvertido16,17, tampoco se observa cambio de las dosis en relación con el estadio puberal. Por otra parte, diferentes dosis de HCr no obtienen resultados significativamente distintos a largo plazo18,19.
Nuestro estudio confirma que, en términos generales, el tratamiento con HCr en PEG es eficaz, tanto en estadios iniciales como en aquellos pacientes que alcanzan la talla final, encontrándose esta dentro del rango de la talla diana, objetivo no siempre alcanzado en otros estudios18,20-22.
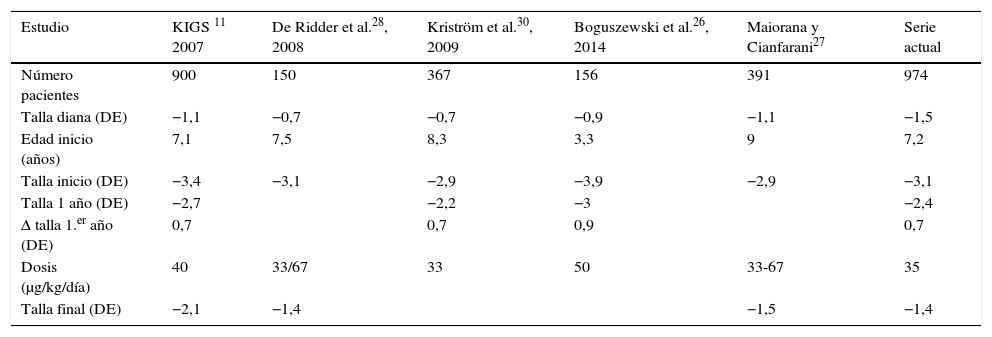
Sin embargo, se pone de manifiesto la variabilidad de la respuesta, encontrando un 14% de «no respondedores», definido en nuestra serie por un incremento de talla menor de 0,3DE en el primer año y hasta un 24% usando el criterio de < 0,5DE de incremento de talla23. En algunas publicaciones se define una respuesta insuficiente por un incremento menor de 3cm en la velocidad de crecimiento24. Con arreglo a ese criterio, un 55% de los pacientes del estudio se incluirían en la categoría de no respondedores. Aun así, los valores medios de respuesta en nuestros pacientes se corresponden con lo descrito en otros estudios25, tanto nacionales (tabla 1) como internacionales (tabla 2). En la serie de Carrascosa et al.7, como en la de Argente et al.8 y Boguszewski et al.26, se emplean dosis más elevadas, y los 2 últimos incluyen pacientes más jóvenes. En el metaanálisis de Maiorana y Cianfarani27, que agrupa varios estudios europeos, los pacientes no alcanzan la talla diana, pese a utilizar dosis más elevadas que en nuestra muestra, tal vez por iniciar el tratamiento a una edad más tardía. La serie más amplia publicada, basada en el estudio KIGS, patrocinado por Pfizer®, con 900 pacientes, y dosis media de 40 μg/kg/día, presenta un incremento de talla de 0,7DE en el primer año, como nuestro estudio, pero con tallas finales en torno a –2 DE11. En la serie de de Ridder et al.28, la talla final está muy por debajo de talla diana, aun empleando dosis de hasta 67 μg/kg/día. La recuperación de talla que se observa en nuestra muestra es similar a la obtenida en pacientes tratados bajo la indicación de déficit de hormona de crecimiento25,29.
Estudios realizados en España
| ESTUDIO | Luzuriaga Tomás et al.6, 2003 | Carrascosa et al.7, 2006 | Argente et al.8, 2007 | López Siguero et al.9, 2013 |
|---|---|---|---|---|
| Número pacientes | 42 | 68 | 76 | 147 |
| Talla dianaa (DE) | −2±0,6 | −1,2±0,9 | −1,0±0,5 | −0,9±0,7 |
| Edad inicio (años)a | 8,1±2,3 | 7,1±2,4 | 4,3 | 7,4±2,8 |
| Talla inicioa (DE) | −2,5±0,3 | −3,3±0,6 | −3,1±0,3 | −3,0±0,6 |
| Talla 1 añoa (DE) | −1,7±0,4 | −2,1±0,7 | −1,6 | −2,3±0,7 |
| Δ talla 1.er año (DE) | 0,8 | 1,2 | 1,5 | 0,7 |
| Dosis (μg/kg/día) | 65 | 66 | 60 | 35 |
Estudios internacionales
| Estudio | KIGS 11 2007 | De Ridder et al.28, 2008 | Kriström et al.30, 2009 | Boguszewski et al.26, 2014 | Maiorana y Cianfarani27 | Serie actual |
|---|---|---|---|---|---|---|
| Número pacientes | 900 | 150 | 367 | 156 | 391 | 974 |
| Talla diana (DE) | −1,1 | −0,7 | −0,7 | −0,9 | −1,1 | −1,5 |
| Edad inicio (años) | 7,1 | 7,5 | 8,3 | 3,3 | 9 | 7,2 |
| Talla inicio (DE) | −3,4 | −3,1 | −2,9 | −3,9 | −2,9 | −3,1 |
| Talla 1 año (DE) | −2,7 | −2,2 | −3 | −2,4 | ||
| Δ talla 1.er año (DE) | 0,7 | 0,7 | 0,9 | 0,7 | ||
| Dosis (μg/kg/día) | 40 | 33/67 | 33 | 50 | 33-67 | 35 |
| Talla final (DE) | −2,1 | −1,4 | −1,5 | −1,4 |
Los valores se expresan como media.
La respuesta observada en el primer año de tratamiento predice los resultados de talla final30,31. En nuestra muestra, los factores que determinan la respuesta inicial, a semejanza de otros estudios28,31, son la edad de comienzo del tratamiento, la talla de partida y la dosis de HCr.
Aunque no disponemos de información detallada sobre el inicio de la pubertad, la edad de la menarquía en un 13% de las mujeres fue de 13 años. Aunque en general el tratamiento con HCr no parece influir en el inicio y progresión de la pubertad32, se precisa un seguimiento más prolongado para corroborarlo. La población PEG inicia la pubertad a una edad similar a la media poblacional, aunque las niñas con bajo peso al nacer que experimentan una recuperación rápida de peso y talla tienden a iniciarla más precozmente33 y pueden presentar adrenarquia exagerada e hiperandrogenismo asociado a hiperinsulinismo34.
El análisis de la información obtenida de los registros oficiales de las CC. AA. no nos ha permitido extraer conclusiones acerca de la seguridad del tratamiento con HCr en los pacientes PEG. Sin embargo, las publicaciones coinciden en señalar hasta ahora que no existen riesgos significativos —por lo menos a medio plazo—, siendo frecuente el aumento reversible de las concentraciones séricas de insulina1,4,5,35.
Conclusiones- 1.
Presentamos un estudio basado en una población de PEG tratados con HCr en nuestro país, sin sesgos derivados del uso de una marca determinada de hormona recombinante, procedentes de diversos centros hospitalarios, tratados bajo los criterios de EMA y autorizados por los diferentes comités asesores de las CC. AA. Reúne casos desde el inicio de la indicación CIR/PEG hasta fechas recientes.
- 2.
La muestra de 974 pacientes es el grupo más numeroso publicado, comparable con estudios internacionales que agrupan pacientes de diferentes países. Consideramos que el estudio es representativo del uso de HCr en la indicación de CIR/PEG en España.
- 3.
Se constata una buena respuesta terapéutica en la mayoría de los casos desde el primer año de tratamiento y tallas finales similares a la talla diana o genética. Se identifica a un 24% de malos respondedores, que incrementan la talla en el primer año menos de 0,5DE.
- 4.
Los aspectos relativos a los acontecimientos adversos y al desarrollo puberal no están recogidos en la base de datos con suficiente precisión, debiendo ser investigados con distinta metodología.
- 5.
Se subraya la importancia de iniciar precozmente el tratamiento con HCr con el objetivo de normalizar la talla de los pacientes PEG. El niño PEG con el perfil clínico de longitud al nacer más afectada que el peso, padres bajos y prematuro debería tener un seguimiento estrecho durante los primeros 3 años, para iniciar el tratamiento con prontitud si no hay recuperación espontánea de la talla.
Los autores declaran no tener ningún conflicto de intereses.
Los autores expresan su agradecimiento a los pediatras prescriptores de Aragón, Cantabria, Cataluña, Euskadi, Galicia y Navarra, así como a los consejos y comités asesores de hormona de crecimiento de dichas CC. AA., por la cesión de los datos en los que se ha basado el estudio.