Los niños pequeños para la edad gestacional (PEG) sin crecimiento recuperador pueden beneficiarse del tratamiento con hormona de crecimiento (rhGH). Sin embargo, deben ser monitorizados de forma muy estrecha ya que son población de riesgo metabólico.
Material y métodosSe han incluido 28 niños PEG, con una media de edad de 8,79 años, sin crecimiento recuperador, tratados con rhGH. Hemos evaluado las modificaciones producidas en la antropometría, variables de riesgo metabólico y composición corporal durante 4 años de tratamiento.
ResultadosEl tratamiento con rhGH se acompañó de un aumento de talla (–2,76±0,11 DE hasta –1,53±0,17 DE; p=0,000), peso (–1,50±0,09 DE hasta –1,21±0,13 DE; p=0,016) y velocidad de crecimiento (–1,43±0,35 DE hasta 0,41±0,41 DE; p=0,009), sin producir modificaciones en el índice de masa corporal (IMC). Se han visto aumentos significativos de la insulinemia (9,33±1,93mU/ml hasta 16,55±1,72mU/ml; p=0,044) y del índice HOMA (3,63±0,76 hasta 6,43±0,67; p=0,042), sin producirse modificaciones en el perfil lipídico. En el estudio de composición corporal se ha comprobado un aumento significativo de la masa magra (73,19±1,26 hasta 78,74±1,31; p=0,037) con una disminución de la masa grasa (26,81±1,26 hasta 21,26±1,31; p=0,021).
ConclusiónEl tratamiento con rhGH se ha acompañado de una ganancia en la talla sin producir alteraciones en el IMC. Asimismo, se han observado cambios en la composición corporal, con un aumento de la proporción de masa magra a expensas de una disminución de la de masa grasa, que podrían conducir a un descenso del riesgo metabólico de estos pacientes. Sin embargo, se ha detectado cierta resistencia insulínica. Es importante continuar el seguimiento de estos niños para determinar las posibles repercusiones en la edad adulta.
Small for gestational age (SGA) children without catch-up growth can benefit from treatment with growth hormone (rhGH). However, they should be monitored very closely because they are at increased risk of metabolic syndrome.
Material and methodA group of 28 SGA children with a mean age of 8.79 years and undergoing treatment with rhGH were selected for evaluation. Over the course of 4 years, an annual evaluation was performed on the anthropometric variables (weight, height, body mass index [BMI], growth rate, blood pressure and waist perimeter), metabolic risk variables (glycaemia, glycosylated haemoglobin, cholesterol ratio, insulinaemia, insulin-like growth factor 1[IGF1], IGF binding protein-3 [IGFBP-3], IGF1/IGFBP3 ratio, and HOMA index), and body composition variables.
ResultsTreatment with rhGH was associated with a significant increase in height (–2.76±.11 SD to –1.53±.17 SD, P=.000), weight (–1.50±.09 SD to –1.21±.13 SD; P=.016), and growth rate (–1.43±.35 SD to .41±.41 SD; P=.009), without a corresponding change in the BMI. Insulinaemia (9.33±1.93mU/ml to 16.55±1.72mU/ml; P=.044) and the HOMA index (3.63±.76 to 6.43±.67; P=.042) increased, approaching insulin resistance levels. No changes were observed in the lipid profile. Body composition changes were observed, with a significant increase in lean mass (73.19±1.26 to 78.74±1.31; P=.037), and a reduction of fat mass (26.81±1.26 to 21.26±1.31; P=.021).
ConclusionTreatment with rhGH is effective for improving anthropometric variables in SGA patients who have not experienced a catch-up growth. It also produces changes in body composition, which may lead to a reduction in risk of metabolic syndrome. However, some insulin resistance was observed. It is important to follow up this patient group in order to find out whether these changes persist into adulthood.
Se estima que entre un 3 y un 5% de los recién nacidos son pequeños para la edad gestacional (PEG)1, con un aumento progresivo de la incidencia en la última década2. El PEG está definido como aquel recién nacido cuyo peso y/o longitud se encuentra 2 desviaciones estándar (DE) por debajo de la media establecida para su edad gestacional según los datos de la población de referencia3.
Las causas que dan lugar a recién nacidos PEG pueden agruparse en causas fetales, maternas, placentarias y ambientales, aunque en un tercio de los casos no es posible determinar el origen de la restricción del crecimiento fetal2.
Los niños PEG constituyen un grupo de mayor riesgo de alteraciones en la composición corporal, trastornos puberales, retrasos en el desarrollo neurológico, así como en el desarrollo de un síndrome metabólico, con un aumento de factores de riesgo predictores de enfermedad cardiovascular.
Un 80-90% de los niños PEG efectuarán un crecimiento recuperador (catch-up growth) de forma espontánea, normalizando su talla hacia los 2 años de edad4, poniéndose en disposición de alcanzar su potencial genético3-5. No obstante, un 10-20% de estos niños no lo realizarán, desconociéndose la causa. Después de los 4 años la recuperación espontánea es muy poco probable6,7. En este grupo de niños se aprobó el tratamiento con hormona de crecimiento (rhGH) por la European Agency for the Evaluation of Medical Products (EMEA) y la Food and Drug Administration (FDA) en 2003.
La rhGH produce un aumento de la velocidad de crecimiento que permite a estos niños alcanzar una talla final adulta normal8,9. Además del efecto sobre el crecimiento lineal, la rhGH es una hormona anabólica que modifica el metabolismo de las grasas e hidratos de carbono10, dando lugar a cambios en la composición corporal11.
El objetivo de nuestro trabajo ha sido analizar las modificaciones en las variables antropométricas, analíticas de riesgo metabólico y de composición corporal en un grupo de niños PEG antes del inicio del tratamiento con rhGH y durante 4 años de seguimiento.
MétodoDiseño del estudio y participantesSe trata de un estudio prospectivo longitudinal, con una cohorte de 28 niños nacidos en el Hospital Clínico Universitario de Zaragoza entre los años 1995 y 2009 con diagnóstico de PEG. La inclusión de todos los pacientes ha sido consecutiva. No existe grupo control. Se ha realizado un seguimiento durante 4 años donde se comparan los datos de la muestra a lo largo de este tiempo. El seguimiento completo ha sido alcanzado por el 71% de la muestra, encontrándose el 29% restante en fases más precoces del tratamiento al haber tenido lugar su inclusión en la muestra más tarde.
Los pacientes incluidos cumplían los criterios requeridos por el comité asesor para la rhGH del Ministerio de Sanidad, Servicios Sociales e Igualdad para niños PEG:
- –
Longitud y/o peso al nacer inferior a –2 DE de los estándares de referencia12.
- –
Talla a partir de los 4 años de edad inferior a –2,5 DE por debajo de los estándares de referencia13.
- –
No haber tenido a los 4 años de vida un crecimiento recuperador.
- –
Haber sido descartado cualquier problema médico o tratamiento como causa del trastorno de crecimiento.
Los criterios de exclusión han sido los siguientes:
- –
Incumplimiento de criterios auxológicos de inclusión.
- –
Ciertos cuadros sindrómicos potencialmente no beneficiables.
- –
Padecer diabetes mellitus u otros trastornos importantes del metabolismo de los hidratos de carbono.
Se han recogido los datos neonatales de la muestra: peso y longitud (Z score)12 al nacer. Edad gestacional (semanas). Se ha calculado la talla genética (DE).
Se han estudiado las siguientes variables antes del inicio del tratamiento y en los 4 años posteriores de seguimiento:
Variables clínicas y antropométricas- –
Variables antropométricas: peso (DE)13; talla (DE)13; índice de masa corporal en DE (IMC), y velocidad de crecimiento (VC) en DE.
- –
Variables clínicas: presión arterial sistólica y diastólica (PAS, PAD): se ha determinado con un tensiómetro automático realizando la elección de la anchura del manguito en función del perímetro del brazo. Se ha tomado en mmHg y en Z score según las gráficas de referencia14. Perímetro de cintura en cm (P cintura) y en Z score15.
Glucemia (mg/dl), hemoglobina glucosilada en % (Hb glucosilada), triglicéridos en mg/dl (TG), cociente colesterol total/HDL (CL/HDL), IGF1(ng/ml), IGF1BP3 (mcg/ml), cociente IGF1/IGF1BP3, insulinemia (mU/ml) y el índice HOMA (glucemia [mg/l] × insulinemia [mU/ml]/22,5)16,17.
Variables de composición corporalA todos los pacientes se les han realizado exploraciones anuales de composición corporal con densitómetro modelo HOLOGIC 2003-ExplorerTM, obteniéndose datos de total de masa magra (MM), total de masa grasa (MG) y el porcentaje de masa magra y grasa. Se ha calculado la proporción de masa grasa y masa magra sobre el conjunto de ambas (MG/MG+MM; MM/MG+MM), para valorar los cambios de composición corporal a lo largo del tiempo.
Análisis estadísticoPara describir las características basales de la muestra se ha realizado un estudio descriptivo de las variables cuantitativas (media, desviación estándar, mínimo, máximo, mediana y rango intercuartil), así como un método de distribución de frecuencias para variables cualitativas.
Para efectuar los contrastes de hipótesis se han utilizado técnicas paramétricas, ya que se cumplen los criterios de normalidad de Kolmogorov-Smirnov y Shapiro-Wilk, y de homocedasticidad de Levene.
Para describir las variaciones a lo largo de los años de seguimiento se ha utilizado la prueba de contraste de medias de ANOVA para datos pareados. En los casos en los que ANOVA arrojaba diferencias significativas se ha aplicado la prueba t de Student para analizar por rangos y poder determinar en qué momento se producen las diferencias encontradas. Para realizar el contrate de hipótesis según el sexo se ha utilizado la prueba t de Student para 2 muestras independientes. Se han considerado estadísticamente significativos valores de p<0,05.
El análisis estadístico de los datos se ha realizado con el programa SPSS 20.0 para Windows.
El estudio ha sido aprobado por el Comité Ético de Investigación Clínica en Aragón (CEICA) adscrito al departamento de Salud y Consumo del Gobierno de Aragón. Además se recogió el consentimiento informado de los pacientes y familiares.
ResultadosCaracterísticas basalesLa muestra está compuesta por 28 sujetos: 21 mujeres (75%) y 7 varones (25%). El 78,5% de la muestra estaba al inicio del estudio en Tanner I, y el 21,5% en Tanner II. El cociente entre la edad ósea y la edad cronológica es de 0,70±0,522. La dosis media de rhGH administrada ha sido 0,029mg/kg/día.
- –
Al nacimiento: la media de edad gestacional fue de 38,29±3,46 semanas, con unos datos auxológicos medios de 46,13±0,39cm de longitud (–2,42±0,20 DE) y 2.575±85,63g de peso (–1,38±0,23 DE). La media de la talla genética fue de –1,44±0,12 DE. No se encontraron diferencias significativas con respecto al sexo en ninguna de estas variables. Entre las causas recogidas en los datos gestacionales que pudiesen contribuir al crecimiento intrauterino restringido podemos destacar con un 35,7% causas ambientales (tabaco y trabajo materno), 10,7% causas maternas, 10,7% causas fetales y 7,1% causas placentarias, mientras que en un 35,7% se consideró idiopático.
- –
Al inicio del tratamiento: los datos antropométricos, analíticos y de composición corporal aparecen en la tabla 1. La edad media de inicio fue de 8,79±3,06 años. La talla media es de –2,76±0,45 DE, con una velocidad de crecimiento –1,43±1,79 DE. Los datos clínicos de PA y perímetro de cintura se encuentran en el rango de normalidad, al igual que los datos analíticos pretratamiento. Destacan únicamente unas mayores cifras de insulinemia e índice HOMA en mujeres, sin llegar a alcanzar niveles de resistencia insulínica (insulinemia varones: 5,07±2,42 vs. mujeres: 10,59±11,01; p=0,042 / índice HOMA varones: 1,89±0,98 vs. mujeres: 4,13±4,32; p=0,037). En la tabla 2 se puede observar cómo estas 2 variables mencionadas muestran diferencias significativas al analizarlas según el estadio puberal (insulinemia prepuberal 6,51±4,98mU/ml vs. insulinemia puberal de 19,13±16,41mU/ml; p=0,003, y un índice HOMA prepuberal 2,54±2,09 vs. HOMA puberal de 7,32±6,42; p=0,005).
Tabla 1.Datos antropométricos, clínicos y analíticos de la población al inicio del tratamiento
Media (± DE) Mínimo Máximo Mediana P25 P75 pa Datos antropométricos Edad (años) 8,79±3,06 4,62 14,07 9,73 7,04 12,42 ns Peso (DE) –1,50±0,50 –2,68 –0,83 –1,21 –1,52 –0,9 ns Talla (DE) –2,76±0,45 –4,90 –2,23 –2,77 –2,98 –2,56 ns IMC (DE) –0,68±0,68 –1,89 –0,91 –0,68 –1,16 –0,20 ns VC (DE) –1,43±1,79 –5,72 2,26 –1,47 –2,35 –0,59 ns Datos clínicos PAS (mmHg) 96,71±11,91 69 124 95 86,88 103,12 0,022* PAS (DE) 0,20±1,21 –1,88 3,16 0,59 –0,15 1,33 0,010* PAD (mmHg) 57,64±9,63 40 80 58 52 64 ns PAD (DE) 0,08±0,86 –1,50 2,14 0,08 –0,43 0,59 ns P. cintura (cm) 60±11,01 44 85 55 47,50 62,50 ns P. cintura (DE) –0,22±1,46 –2,50 3,50 –0,51 –1,10 0,08 ns Datos analíticos Glucemia (mg/dl) 85,67±8,88 65 100 89 84 94 ns Hb glucosilada (%) 5,01 ±0,49 4,00 6,50 5,10 4,80 5,40 ns Triglicéridos (mg/dl) 60,11±21,90 31 115 63 46 80 ns Colesterol total/HDL 2,72±0,62 1,50 4,30 2,80 2,49 3,11 ns Insulinemia (mU/ml) 9,33 ±11,26 2,00 40,07 7,79 2,66 12,92 0,042* IGF1 (ng/ml) 232,82±166,66 59 601 206 72 340 ns IGF1BP3 (mcg/ml) 4,77±1,31 2,79 7,13 5,09 3,85 6,33 ns IGF1/IGF1BP3 49,14±41,31 14,73 200,30 41,54 19,49 63,59 ns Índice HOMA 3,63±4,42 0,58 15,99 3,12 0,74 5,50 0,037* DEXA Masa grasa (g) 6.214,27±4.540,16 2.581,00 18.832,60 5.418,30 2.508,70 8.327,90 ns Masa grasa (%) 25,94±6,09 16 40,80 24 19,5 28,5 ns Masa magra (g) 16.303±5.686,05 8.669,9 29.080,50 16.589,20 11.602,60 21.575,80 ns Masa magra (%) 70,75±6,09 55,90 80,70 72,70 68,40 77 ns MG/MG+MM 26,81±6,90 16,05 40,80 25,44 20,93 29,95 ns MM/MG+MM 73,19±6,90 59,20 83,95 74,56 70,05 79,07 ns Datos disponibles para 28 pacientes.
DE: desviación estándar; DEXA: composición corporal; IMC: índice de masa corporal; MG: masa grasa total; MM: masa magra total; ns: no significativo; P cintura: perímetro de cintura; PAD: presión arterial diastólica; PAS: presión arterial sistólica; VC: velocidad de crecimiento.
Tabla 2.Datos analíticos al inicio del tratamiento según el estadio puberal de la muestra
Prepúber (Tanner I) Púber (Tanner II) pa n=22 n=6 Sexo % Varones 27,27 16,66 % Mujeres 72,72 83,33 Datos analíticos al inicio del tratamiento Glucemia (mg/dl) 85,32±8,31 85,17±6,40 ns Hb glucosilada (%) 4,97±0,54 5,15±0,26 ns Triglicéridos (mg/dl) 58,36±16,47 64,67±28,64 ns Colesterol total/HDL 2,74±0,62 2,58±0,47 ns Insulinemia (mU/ml) 6,51±4,98 19,13±16,41 0,003** IGF1 (ng/ml) 213,96±136,66 305,17±177,95 ns IGF1BP3 (mcg/ml) 4,62±1,22 5,22±1,16 ns IGF1/IGF1BP3 48,04±37,97 54,86±24,99 ns Índice HOMA 2,54±2,09 7,32±6,42 0,005** Datos disponibles para 28 pacientes.
La evolución de los datos podemos observarla en la tabla 3.
Evolución de los datos antropométricos, clínicos y analíticos durante 4 años de tratamiento con hormona de crecimiento
| Inicio (media±DE) | 1 año (media±DE) | 2 año (media±DE) | 3 año (media±DE) | 4 año (edia±DE) | pa | |
|---|---|---|---|---|---|---|
| n=28 | n=27 | n=26 | n=24 | n=20 | ||
| Datos antropométricos | ||||||
| Peso (DE) | –1,50±0,50 | –1,38± 0,40 | –1,28±0,42 | –1,22±0,37 | –1,21±0,49 | 0,016* |
| Talla (DE) | –2,76±0,45 | –2,09±1,03 | –1,87±0,60 | –1,63±0,60 | –1,53±0,62 | 0,000** |
| IMC (DE) | –0,68±0,68 | –0,69±0,46 | –0,77±0,52 | –0,74±0,43 | –0,72±0,52 | 0,585 |
| VC (DE) | –1,43±1,79 | 2,61±1,48 | 2,85±2,93 | 2,13±3,37 | 0,41±1,52 | 0,009** |
| Datos clínicos | ||||||
| PAS (mmHg) | 96,71±11,91 | 99,07±11,40 | 104,19±13,47 | 105,67±13,18 | 108,85±11,02 | 0,000** |
| PAS (DE) | 0,20±1,21 | 0,13±0,88 | 0,38±1,04 | 0,22±1,13 | 0,61±1,11 | 0,412 |
| PAD (mmHg) | 57,64±9,63 | 56,92±8,63 | 59,69±7,85 | 58,25±7,74 | 58,40±7,25 | 0,981 |
| PAD (DE) | 0,08±0,86 | –0,14±0,75 | –0,16±0,66 | –0,26±0,64 | –0,17±0,78 | 0,076 |
| P cintura (cm) | 60±11,01 | 62,88±7,76 | 64,38±7,40 | 67,00±9,72 | 62,61±7,74 | 0,280 |
| P cintura (DE) | –0,22±1,46 | –0,61±0,84 | –0,57±0,93 | –0,71±1,33 | –0,63±1,04 | 0,860 |
| Datos analíticos | ||||||
| Glucemia(mg/dl) | 85,67±8,88 | 87,46±8,35 | 86,92±8,76 | 84,14±9,86 | 87,43±6,28 | 0,542 |
| Hb glicosilada(%) | 5,01 ±0,49 | 5,21±0,38 | 5,24±0,21 | 5,29±0,25 | 5,30±0,30 | 0,002** |
| TG(mg/dl) | 60,11±21,90 | 70,88±23,33 | 71,96±27,86 | 76,50±31,45 | 68,21±38,81 | 0,095 |
| Colesterol/HDL | 2,72±0,62 | 2,68±0,51 | 2,77±0,53 | 2,64±0,57 | 2,60±0,60 | 0,859 |
| Insulina (mU/ml) | 9,33±11,26 | 9,74±6,39 | 10,82±6,64 | 11,71±7,08 | 16,55±6,22 | 0,044* |
| IGF1 (ng/ml) | 232,82±166,66 | 358,35±173,68 | 463,08± 196,05 | 518,23±184,59 | 574,65±156,28 | 0,000** |
| IGFBP3(mcg/ml) | 4,77±1,31 | 5,52±1,21 | 6,05±1,38 | 6,31±1,15 | 6,64±0,90 | 0,000** |
| IGF1/IGF1BP3 | 49,14±41,31 | 63,95±26,12 | 75,82±28,21 | 81,88±27,95 | 88,84±28,70 | 0,000** |
| Índice HOMA | 3,63±4,42 | 3,65±2,61 | 4,23±2,82 | 4,47±2,88 | 6,43±2,55 | 0,042* |
| DEXA | ||||||
| Masa grasa (g) | 6.214,27±4.540,16 | 6.439,33±2.975,38 | 7.664,18±2.582,16 | 8.121,49±2.905,37 | 8.346,57±2.293,24 | 0,234 |
| Masa grasa (%) | 25,94±6,09 | 23,91±4,39 | 23,82±4,43 | 22,45±5,42 | 21,04±4,81 | 0,015* |
| Masa magra (g) | 16.303±5.686,05 | 19.319,10±5.335,78 | 24.180,49±6.776,29 | 27.538,93±7.133,92 | 31.153,61±7.214,24 | 0,000** |
| Masa magra (%) | 70,75±6,09 | 72,79±4,38 | 72,87±4,43 | 73,81±5,38 | 74,92±4,62 | 0,034* |
| MM/MM+MG | 73,19±6,90 | 75,62±6,02 | 75,94±4,39 | 77,09±5,52 | 78,74±4,33 | 0,037* |
| MG/MM+MG | 26,81±6,90 | 24,37±6,02 | 24,06±4,39 | 22,88±5,39 | 21,26±4,33 | 0,021* |
DE: desviación estándar; DEXA: composición corporal; IMC: índice de masa corporal; MG: masa grasa total; MM: masa magra total; P cintura: perímetro de cintura; PAD: presión arterial diastólica; PAS: presión arterial sistólica; VC: velocidad de crecimiento.
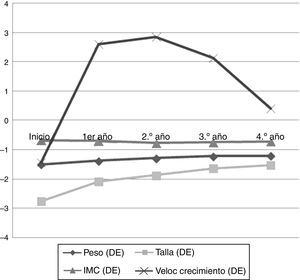
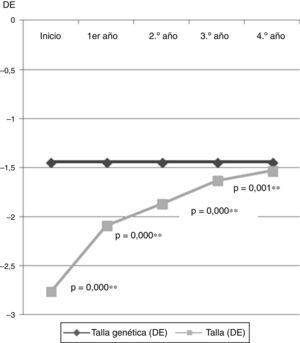
Datos antropométricos (fig. 1): la talla presentó un incremento paulatino a lo largo de los años (–2,76±0,45 DE hasta –1,53±0,62 DE; p=0,000), encontrando diferencias significativas en todos los años estudiados. En la figura 2 se puede observar cómo la talla se va acercando a la talla genética, y cómo la máxima ganancia de talla se produce en el primer año de tratamiento.
El peso mejoró a lo largo de los años (–1,50±0,50 DE hasta –1,21±0,49 DE; p=0,016). La velocidad de crecimiento fue aumentando progresivamente (–1,43±1,79 DE hasta 0,41±1,52 DE; p=0,009). No se evidenciaron diferencias con respecto al índice de masa corporal.
No hubo diferencias con respecto al sexo en ninguna variable.
Datos clínicos: no se han visto cambios en la presión arterial sistólica a lo largo del tiempo, aunque sí que aparecen cambios significativos de la presión arterial diastólica, que disminuye en el segundo año de tratamiento (–0,16±0,13 DE vs. –0,26±0,13 DE; p=0,037). No hay cambios en el perímetro de cintura. No hay cambios en las variables con respecto al sexo.
Datos analíticos: la hemoglobina glucosilada aumenta de forma significativa, aunque manteniéndose en rango normal, con unas cifras al inicio de 5,01±0,49%, y al cuarto año de 5,30±0,30% (p=0,002). El incremento más marcado se produce en el primer año de tratamiento.
Las cifras de insulinemia aumentan de forma significativa a lo largo de los años; los valores al inicio son de 9,33±11,26mU/ml, y al cuarto año son de 16,55±6,22mU/ml (p=0,044), con cifras dentro de rangos normales. No se observan en el seguimiento discrepancias con respecto al sexo, como se observaban en los valores basales.
Los valores de IGF1, IGF1BP3, así como su cociente, aumentan de forma significativa, siendo el primer y el segundo año los que dan lugar a estos aumentos.
El índice HOMA aumenta significativamente desde 3,63±4,42 hasta 6,43±2,55 (p=0,042) probablemente a expensas del aumento de la insulinemia, ya que no se observan cambios en la glucemia basal. No aparecen diferencias en el perfil lipídico a lo largo de los años. No se encuentran diferencias con respecto al sexo en ninguna de las variables analizadas.
Datos de composición corporal: la masa magra aumenta de forma significativa a lo largo del seguimiento (16.303±5.686,05g hasta 31.153,61±7.214,24g; p=0,000). La masa grasa experimenta un aumento progresivo debido al crecimiento de los pacientes, pero no muestra cambios significativos. Además se observa un aumento significativo del porcentaje de masa magra a expensas de las modificaciones que se dan en el primer año de tratamiento (70,75±6,09% hasta 74,92±4,62%; p=0,0034), así como una disminución del porcentaje de masa grasa (25,94±6,09% hasta 21,04±4,81%; p=0,015).
El cociente MM/MM+MG se incrementa a lo largo del seguimiento desde 73,19±6,90 hasta 78,74±4,33 (p=0,037), siendo este aumento más marcado en varones. Al ser su complementario, el cociente MG/MM+MG disminuye. Al analizar por rangos, las diferencias estadísticas se obtienen por las modificaciones ocurridas en el primer año de tratamiento.
DiscusiónLos PEG son un grupo de riesgo para el desarrollo de múltiples enfermedades en la edad adulta18. La mayor parte de estos niños realiza un crecimiento recuperador para alcanzar su potencial genético antes de los 4 años de edad. Sin embargo, en este grupo de pacientes, debido a un metabolismo ahorrador, se producen cambios en la composición corporal, con un aumento en el IMC19 a expensas de un aumento de la grasa central, con depósito intraabdominal20,21. Esto determina una serie de alteraciones, como una insulinorresistencia, que predisponen a padecer otras enfermedades en la vida adulta22, tales como enfermedad cardiovascular, diabetes o síndrome metabólico23. Se ha demostrado que tienen más riesgo los pacientes con un crecimiento espontáneo rápido que los tratados con rhGH24-26. Soto et al.26 describen una resistencia a la insulina en niños nacidos PEG con crecimiento recuperador que no presentan los que no lo experimentan, por lo que sugieren que es muy importante el efecto que tiene un rápido catch-up en las alteraciones metabólicas.
Los pacientes incluidos en nuestro estudio eran candidatos a tratamiento con rhGH al no haber realizado el crecimiento recuperador. Antes de empezar el tratamiento se objetivó que las variables analíticas metabólicas se encontraban dentro de rangos normales. Es importante recalcar que se han encontrado diferencias en las variables de insulinemia y del índice HOMA pretratamiento al analizar por grupos según su estadio puberal, siendo los pacientes puberales los que presentaban mayores valores. Las diferencias encontradas con respecto al sexo pueden estar influenciadas por la mayor presencia de pacientes femeninos en estadio puberal.
En este estudio, el análisis de las variables antropométricas a lo largo de los años de tratamiento revela un incremento significativo de la velocidad de crecimiento, más marcado en el primer año, que determina un aumento de la talla final, la cual se aproxima a la potencial talla genética de los pacientes. También se observa una normalización del peso corporal, que al principio del seguimiento se encontraba en el límite bajo de la normalidad. Estos hallazgos concuerdan con lo descrito en la bibliografía1,10.
Hemos objetivado también un aumento progresivo, aunque manteniéndose en rango de normalidad, en las cifras de insulinemia, hemoglobina glucosilada y del índice HOMA, que indican cierta tendencia a la resistencia insulínica. Esto ya ha sido descrito por Lebl et al., que demuestran también una normalización de estas variables tras suspender el tratamiento27. Es importante continuar el seguimiento de estos pacientes para valorar la transcendencia de estos aumentos encontrados en el metabolismo hidrocarbonado, y ver si se mantienen en el tiempo o son reversibles al finalizar el tratamiento, como ya se ha descrito.
Es conocida la respuesta dosis-dependiente de GH sobre el aumento de IGF1 e IGFBP328. Los niveles de ambos aumentaron a lo largo de todo el seguimiento, siendo mayor el incremento de IGF1, que determina un aumento del cociente IGF1/IGF1BP3. Durante el seguimiento las cifras han estado dentro de rangos de normalidad. No existe un claro consenso internacional sobre cuáles son los límites altos de la normalidad, con la consiguiente preocupación de los posibles efectos que pueden tener unas cifras altas mantenidas en el tiempo29.
No hemos encontrado cambios significativos en la presión arterial sistólica, en el IMC, en el perímetro de cintura, ni en el metabolismo lipídico. Sí que hemos observado un descenso en la presión arterial diastólica. Ya ha sido descrito que el tratamiento con rhGH es efectivo para normalizar las cifras tensionales, tanto sistólicas como diastólicas, en pacientes previamente hipertensos30,31, lo que puede contribuir a disminuir el riesgo cardiovascular inherente a los PEG. En nuestro caso, los pacientes presentaban al inicio cifras tensionales normales, razón por la que podrían no haberse visto grandes cambios. Algo similar nos ocurre en relación con el perfil lipídico, que en otros estudios mejora desde el primer año de tratamiento30. En nuestro caso, las cifras basales eran ya normales.
La composición corporal de los niños PEG es diferente a la de los adecuados para la edad gestacional: tienen una menor grasa corporal total, menor masa magra y menor contenido mineral óseo32. Su proporción masa grasa/masa magra está aumentada, siendo este un factor de riesgo para desarrollar síndrome metabólico. El punto fuerte de nuestro estudio radica en los cambios que se evidencian al analizar la composición corporal de los pacientes. Se puede observar, según la variación de los cocientes estudiados, cómo se produce un aumento significativo de la proporción de masa magra con respecto a la masa grasa a lo largo del tiempo, más evidente en los varones y durante el primer año de tratamiento. Las modificaciones descritas podrían determinar una disminución del riesgo metabólico inherente a los PEG, pudiendo por ello reducir la incidencia de problemas cardiovasculares en este grupo de pacientes una vez alcanzada la edad adulta. Este hecho refuerza la importancia del tratamiento con rhGH en niños PEG, más allá del objetivo principal, que es aumentar la talla. Resulta por todo ello fundamental continuar el seguimiento de estos niños, para valorar la evolución de estas variables con el paso del tiempo, una vez finalizado el tratamiento con rhGH.
ConclusiónEl tratamiento con rhGH en un grupo de niños PEG sin crecimiento recuperador ha sido efectivo al observarse una clara ganancia de talla, con normalización del peso y sin alterar el índice de masa corporal. Se han dado cambios importantes en la composición corporal, con un aumento de la masa magra a expensas de una disminución de la masa grasa. Además se ha descrito una cierta afectación del metabolismo hidrocarbonado, con datos de resistencia insulínica. No ha habido modificaciones en el perfil lipídico. Estos hechos requieren continuar el seguimiento hasta que la muestra alcance la talla adulta, para estudiar si se mantienen en el tiempo y sus consecuencias a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo fue presentado mediante comunicación libre en formato póster en el Congreso Extraordinario de la AEP y II Congreso Extraordinario Latinoamericano de Pediatría, celebrado en Madrid del 5 al 7 de junio del 2014, siendo galardonado con el premio de mención especial al mejor póster de dicho congreso.