En España, las vacunas frente a rotavirus (RV) están disponibles desde 2006 pero no están ni recomendadas ni financiadas por el Sistema Nacional de Salud. Sin embargo, a través de las recomendaciones de la Asociación Española de Pediatría se han alcanzado coberturas de vacunación intermedias.
Material y métodosSe ha realizado una revisión sistemática de la literatura sobre los estudios realizados en España en los últimos 12 años (2006-2018) en relación con la infección y las vacunas frente a RV.
ResultadosSe identifican 43 estudios que cumplían los criterios de selección. La carga de enfermedad en población <5 años en atención primaria oscila entre 15 y 19 casos por 1.000 niños y en hospitalaria entre 120 y 480 casos por 100.000, lo que supone una importante repercusión económica y social. Las vacunas frente a RV han mostrado en España una efectividad de entre el 83 y el 96% y un impacto de hasta un 70% de reducción de hospitalizaciones, que es dependiente de la cobertura de vacunación alcanzada. Se identifican además nuevas líneas de investigación relacionadas con el papel de la vacuna del RV y la protección frente a convulsiones, o el papel del microbiota, entre otros.
ConclusionesLa información actualmente disponible refrenda la importante carga de enfermedad por RV en España y la elevada efectividad de las vacunas disponibles. Estas evidencias permiten una reevaluación de las recomendaciones nacionales sobre vacunación frente a RV.
Vaccines against rotavirus (RV) have been available in Spain since 2006, but they are neither recommended nor financed by the National Health System. Nevertheless, through recommendations of the Spanish Association of Paediatrics vaccination has achieved intermediate coverage.
Material and methodsA systematic literature review was performed on studies carried out in Spain in the last 12 years (2006-2018) on RV infection and vaccination.
ResultsA total of 43 studies were identified that met the inclusion criteria. The disease burden in children less than 5 years in the Primary Care setting ranged from 15 to 19 cases per 1,000 children, and between 120 and 480 cases per 100,000 in the hospital setting, which has a significant economic and social impact. Vaccines against RV have shown an effectiveness of between 83% and 96%, and an impact of up to 70% in reducing hospital admissions, which is dependent on the achieved vaccine coverage. New research lines are identified, such as the role of the rotavirus vaccine and protection against seizures or the impact on the gut microbiota.
ConclusionsThe current available information supports the significant burden of rotavirus disease in Spain and the high effectiveness of the available vaccines. This evidence should allow for an updated re-evaluation of the national recommendations on rotavirus vaccination.
El RV es la principal causa de gastroenteritis aguda grave infantil en el mundo. Las mejoras higiénico-sanitarias tienen un impacto limitado en el control de la gastroenteritis aguda por RV (GEA-RV), por lo que la vacunación es la mejor manera de prevenir la enfermedad. Tras la utilización sistemática de las vacunas en más de 50 países, la mortalidad por RV se ha reducido en más de un 50%, según estimaciones de la OMS (http://www.who.int/immunization/diseases/rotavirus/en/).
En España, las vacunas frente a RV se introdujeron en 2006. Entonces, el Consejo Interterritorial del Sistema Nacional de Salud recomendó no incluir estas vacunas en su calendario de vacunación. Sin embargo, sí están recomendadas por la Asociación Española de Pediatría y se utilizan bajo prescripción de los pediatras, alcanzado coberturas de vacunación intermedias1. En 2010, la comercialización de ambas vacunas fue suspendida por la Agencia Española del Medicamento durante un periodo de 5 meses en el caso de la vacuna pentavalente (junio-noviembre 2010) y de 6 años en el de la monovalente (junio 2010-junio 2016) por motivos preventivos, sin impacto en la seguridad, relacionados con el hallazgo de fragmentos de circovirus2.
En el momento de la introducción de las vacunas, no se disponía en España de información suficiente sobre la carga de la enfermedad y se desconocía, por tanto, el impacto que tendría la vacunación. Desde entonces, se han realizado numerosos estudios evaluando estos aspectos en nuestro país. Este artículo hace una revisión de la literatura sobre los estudios realizados en España sobre el RV y sus vacunas desde que fueron aprobadas.
Material y métodosSe realizó una revisión sistemática de la literatura en las bases de datos PubMed y Embase identificando publicaciones de estudios realizados en España que evaluaban aspectos relacionados con la carga de enfermedad y/o los resultados de la vacunación frente a RV. Se restringió la búsqueda a trabajos publicados a partir del año 2006 (año de introducción de la vacuna RV) hasta la fecha en que se realizó la búsqueda (enero 2018), en inglés y español. Para ello, se combinaron los términos de búsqueda, incluidos en MeSH, relativos a la patología, la epidemiología y el impacto clínico, económico y social de la enfermedad por rotavirus y los términos relacionados con los resultados de la vacunación (efectividad, impacto, seguridad, eficiencia). Estos términos se combinaron asimismo con otros para restringir los estudios a aquellos realizados en España o en población española.
Se excluyeron estudios no epidemiológicos, no realizados en España, no realizados en humanos, y publicaciones diferentes a artículos originales (editoriales, revisiones, cartas, comentarios y resúmenes de comunicaciones a congresos).
Se clasificaron los estudios seleccionados en función del objetivo y se realizó una descripción de los resultados para analizar la situación de la epidemiología y la vacunación frente a RV en España.
Resultados y discusiónSe identificaron un total de 128 estudios de los cuales 43 cumplían los criterios de selección. Los principales resultados de estos estudios se resumen y discuten a continuación.
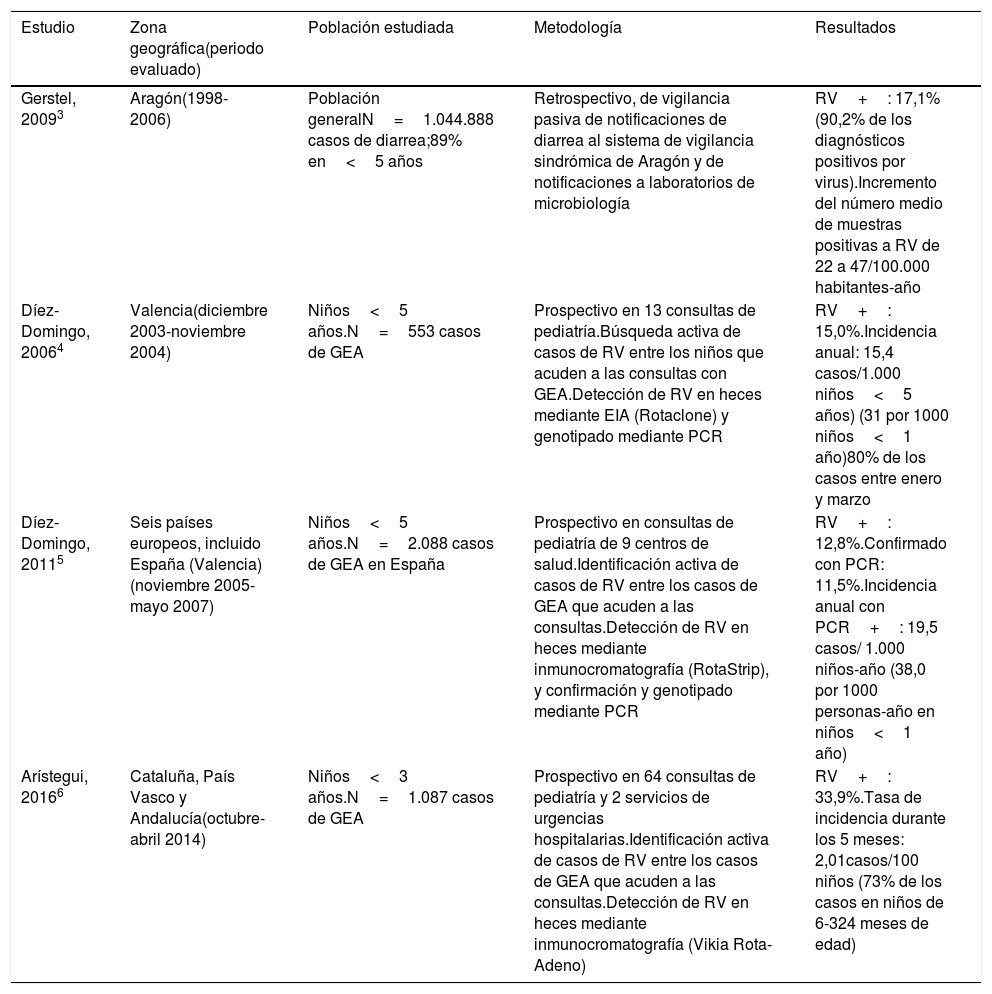
Carga de la enfermedad por rotavirusGastroenteritis por rotavirus atendida en Atención PrimariaLa incidencia anual de GEA-RV atendida en Atención Primaria observada oscila entre 15,4 y 19,5 casos por 1.000 niños<5 años y 20 casos por 1.000 niños<3 años (tabla 1). Esta variación podría ser consecuencia de la metodología y del periodo evaluado en los diferentes estudios. Se considera que las búsquedas activas de casos estarían, en general, menos sujetas a sesgos. La proporción de casos de GEA-RV con respecto a todas las GEA también varía.
Carga de la enfermedad por rotavirus en Atención Primaria en España
| Estudio | Zona geográfica(periodo evaluado) | Población estudiada | Metodología | Resultados |
|---|---|---|---|---|
| Gerstel, 20093 | Aragón(1998-2006) | Población generalN=1.044.888 casos de diarrea;89% en<5 años | Retrospectivo, de vigilancia pasiva de notificaciones de diarrea al sistema de vigilancia sindrómica de Aragón y de notificaciones a laboratorios de microbiología | RV+: 17,1% (90,2% de los diagnósticos positivos por virus).Incremento del número medio de muestras positivas a RV de 22 a 47/100.000 habitantes-año |
| Díez-Domingo, 20064 | Valencia(diciembre 2003-noviembre 2004) | Niños<5 años.N=553 casos de GEA | Prospectivo en 13 consultas de pediatría.Búsqueda activa de casos de RV entre los niños que acuden a las consultas con GEA.Detección de RV en heces mediante EIA (Rotaclone) y genotipado mediante PCR | RV+: 15,0%.Incidencia anual: 15,4 casos/1.000 niños<5 años) (31 por 1000 niños<1 año)80% de los casos entre enero y marzo |
| Díez-Domingo, 20115 | Seis países europeos, incluido España (Valencia)(noviembre 2005-mayo 2007) | Niños<5 años.N=2.088 casos de GEA en España | Prospectivo en consultas de pediatría de 9 centros de salud.Identificación activa de casos de RV entre los casos de GEA que acuden a las consultas.Detección de RV en heces mediante inmunocromatografía (RotaStrip), y confirmación y genotipado mediante PCR | RV+: 12,8%.Confirmado con PCR: 11,5%.Incidencia anual con PCR+: 19,5 casos/ 1.000 niños-año (38,0 por 1000 personas-año en niños<1 año) |
| Arístegui, 20166 | Cataluña, País Vasco y Andalucía(octubre-abril 2014) | Niños<3 años.N=1.087 casos de GEA | Prospectivo en 64 consultas de pediatría y 2 servicios de urgencias hospitalarias.Identificación activa de casos de RV entre los casos de GEA que acuden a las consultas.Detección de RV en heces mediante inmunocromatografía (Vikia Rota-Adeno) | RV+: 33,9%.Tasa de incidencia durante los 5 meses: 2,01casos/100 niños (73% de los casos en niños de 6-324 meses de edad) |
EIA: enzimoinmunoanálisis; PCR: reacción en cadena de la polimerasa; RV+: proporción de casos de GEA con un resultado positivo a la prueba de detección de rotavirus.
Estas diferencias se explicarían por: a) aspectos asistenciales (búsqueda de atención médica para enfermedades con distintos niveles de gravedad), b) la duración del estudio (análisis de todo el año o la temporada epidemiológica), c) los métodos diagnósticos utilizados, con diferencias en sensibilidad y especificidad, siendo el patrón de referencia la reacción en cadena de la polimerasa (PCR), utilizado exclusivamente en estudios de investigación, y d) la fluctuación natural en la frecuencia de RV de unas temporadas a otras.
Un estudio europeo previo a la introducción de las vacunas mostró una incidencia de GEA-RV en Atención Primaria entre 1,45 y 4,18 casos por 100 niños<5 años, y la proporción de casos de GEA positivos para RV evaluados mediante ELISA fue de entre 25,5% y el 41,3% dependiendo del país7.
Al incluirse solo casos que buscaron atención médica, la incidencia observada sería menor que la real ya que se estima que una proporción significativa no acuden al pediatra8.
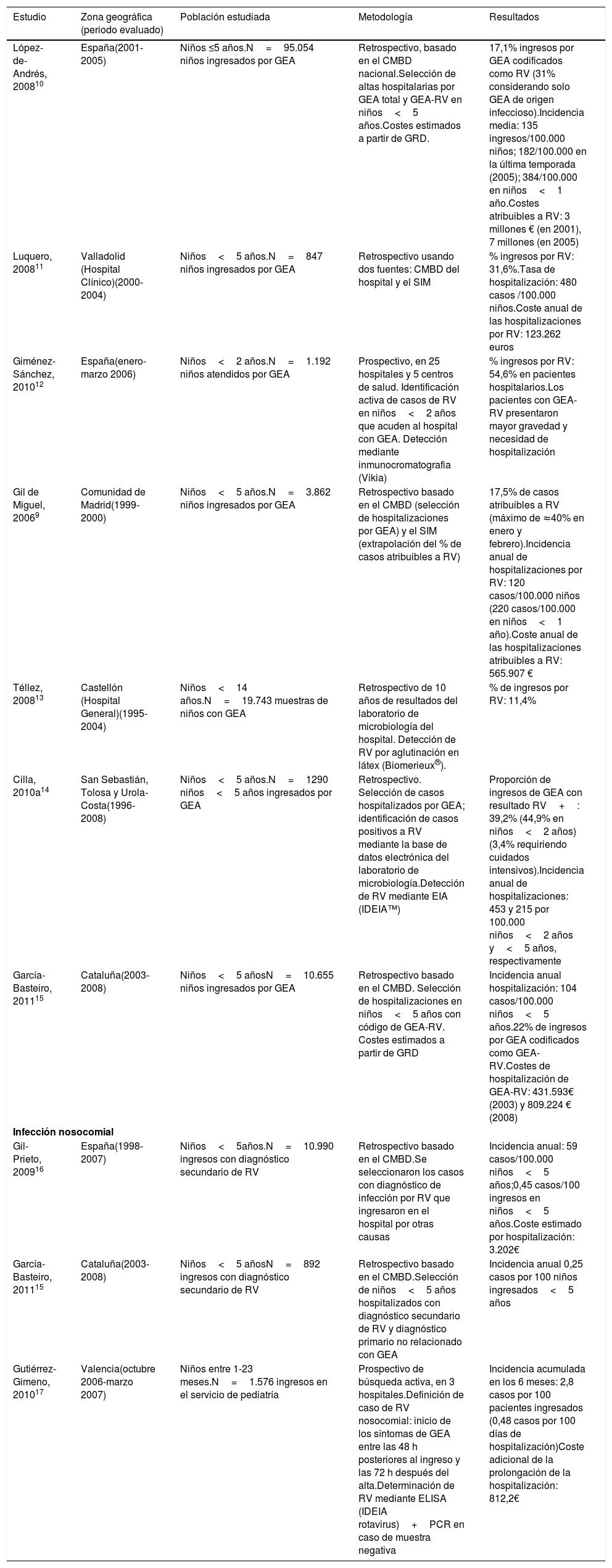
Gastroenteritis por rotavirus atendida en hospitalLa incidencia anual de hospitalización por RV en niños en España oscilaría entre 120 y 480 casos por 100.000 niños<5 años y la proporción de casos de GEA atribuibles a RV entre un 11% y un 55% (tabla 2). Estas diferencias estarían relacionadas principalmente con la metodología utilizada. La mayoría son estudios retrospectivos a partir de la base de datos de alta hospitalaria, Conjunto Mínimo Básico de Datos (CMBD), y en algunas ocasiones en combinación con el Sistema de Información Microbiológica (SIM). Además, la calidad y el proceso de codificación de las hospitalizaciones del CMBD en los diferentes hospitales podrían modificar estos resultados9,11,16. Otros factores pueden ser los criterios de selección de pacientes, los diferentes protocolos de hospitalización y de realización de test virológicos con distinto rendimiento diagnóstico14.
Carga de la enfermedad por rotavirus que requiere hospitalización en España
| Estudio | Zona geográfica (periodo evaluado) | Población estudiada | Metodología | Resultados |
|---|---|---|---|---|
| López-de-Andrés, 200810 | España(2001-2005) | Niños ≤5 años.N=95.054 niños ingresados por GEA | Retrospectivo, basado en el CMBD nacional.Selección de altas hospitalarias por GEA total y GEA-RV en niños<5 años.Costes estimados a partir de GRD. | 17,1% ingresos por GEA codificados como RV (31% considerando solo GEA de origen infeccioso).Incidencia media: 135 ingresos/100.000 niños; 182/100.000 en la última temporada (2005); 384/100.000 en niños<1 año.Costes atribuibles a RV: 3 millones € (en 2001), 7 millones (en 2005) |
| Luquero, 200811 | Valladolid (Hospital Clínico)(2000-2004) | Niños<5 años.N=847 niños ingresados por GEA | Retrospectivo usando dos fuentes: CMBD del hospital y el SIM | % ingresos por RV: 31,6%.Tasa de hospitalización: 480 casos /100.000 niños.Coste anual de las hospitalizaciones por RV: 123.262 euros |
| Giménez-Sánchez, 201012 | España(enero-marzo 2006) | Niños<2 años.N=1.192 niños atendidos por GEA | Prospectivo, en 25 hospitales y 5 centros de salud. Identificación activa de casos de RV en niños<2 años que acuden al hospital con GEA. Detección mediante inmunocromatografia (Vikia) | % ingresos por RV: 54,6% en pacientes hospitalarios.Los pacientes con GEA-RV presentaron mayor gravedad y necesidad de hospitalización |
| Gil de Miguel, 20069 | Comunidad de Madrid(1999-2000) | Niños<5 años.N=3.862 niños ingresados por GEA | Retrospectivo basado en el CMBD (selección de hospitalizaciones por GEA) y el SIM (extrapolación del % de casos atribuibles a RV) | 17,5% de casos atribuibles a RV (máximo de ≈40% en enero y febrero).Incidencia anual de hospitalizaciones por RV: 120 casos/100.000 niños (220 casos/100.000 en niños<1 año).Coste anual de las hospitalizaciones atribuibles a RV: 565.907 € |
| Téllez, 200813 | Castellón (Hospital General)(1995-2004) | Niños<14 años.N=19.743 muestras de niños con GEA | Retrospectivo de 10 años de resultados del laboratorio de microbiología del hospital. Detección de RV por aglutinación en látex (Biomerieux®). | % de ingresos por RV: 11,4% |
| Cilla, 2010a14 | San Sebastián, Tolosa y Urola-Costa(1996- 2008) | Niños<5 años.N=1290 niños<5 años ingresados por GEA | Retrospectivo. Selección de casos hospitalizados por GEA; identificación de casos positivos a RV mediante la base de datos electrónica del laboratorio de microbiología.Detección de RV mediante EIA (IDEIA™) | Proporción de ingresos de GEA con resultado RV+: 39,2% (44,9% en niños<2 años) (3,4% requiriendo cuidados intensivos).Incidencia anual de hospitalizaciones: 453 y 215 por 100.000 niños<2 años y<5 años, respectivamente |
| García-Basteiro, 201115 | Cataluña(2003-2008) | Niños<5 añosN=10.655 niños ingresados por GEA | Retrospectivo basado en el CMBD. Selección de hospitalizaciones en niños<5 años con código de GEA-RV. Costes estimados a partir de GRD | Incidencia anual hospitalización: 104 casos/100.000 niños<5 años.22% de ingresos por GEA codificados como GEA-RV.Costes de hospitalización de GEA-RV: 431.593€ (2003) y 809.224 € (2008) |
| Infección nosocomial | ||||
| Gil-Prieto, 200916 | España(1998-2007) | Niños<5años.N=10.990 ingresos con diagnóstico secundario de RV | Retrospectivo basado en el CMBD.Se seleccionaron los casos con diagnóstico de infección por RV que ingresaron en el hospital por otras causas | Incidencia anual: 59 casos/100.000 niños<5 años;0,45 casos/100 ingresos en niños<5 años.Coste estimado por hospitalización: 3.202€ |
| García-Basteiro, 201115 | Cataluña(2003-2008) | Niños<5 añosN=892 ingresos con diagnóstico secundario de RV | Retrospectivo basado en el CMBD.Selección de niños<5 años hospitalizados con diagnóstico secundario de RV y diagnóstico primario no relacionado con GEA | Incidencia anual 0,25 casos por 100 niños ingresados<5 años |
| Gutiérrez-Gimeno, 201017 | Valencia(octubre 2006-marzo 2007) | Niños entre 1-23 meses.N=1.576 ingresos en el servicio de pediatría | Prospectivo de búsqueda activa, en 3 hospitales.Definición de caso de RV nosocomial: inicio de los síntomas de GEA entre las 48 h posteriores al ingreso y las 72 h después del alta.Determinación de RV mediante ELISA (IDEIA rotavirus)+PCR en caso de muestra negativa | Incidencia acumulada en los 6 meses: 2,8 casos por 100 pacientes ingresados (0,48 casos por 100 días de hospitalización)Coste adicional de la prolongación de la hospitalización: 812,2€ |
CMBD: Conjunto Mínimo Básico de Datos, base de datos nacional de registro de altas hospitalarias; GRD: Grupos Relacionados de Diagnóstico; PCR: reacción en cadena de la polimerasa; RV+: proporción de casos de GEA codificados como GEA por RV.
En Europa, las incidencias de hospitalización y proporciones atribuibles a RV son superiores a las descritas para España (300-600 casos/100.000 niños<5 años y hasta un 69% de las hospitalizaciones por GEA-RV) (https://ecdc.europa.eu/en/publications-data/expert-opinion-rotavirus-vaccination-infancy). Los diferentes sistemas sanitarios y de vigilancia impiden la comparación directa, pero estas diferencias y el hecho de que se ha descrito en España un impacto de la vacunación similar en la GEA por cualquier causa que en la GEA-RV, apunta a que la identificación de las hospitalizaciones por RV utilizando el CMBD infraestima la carga hospitalaria de la enfermedad1.
Infección nosocomial por rotavirusDos estudios estimaron la incidencia de infección nosocomial por RV mediante el uso del CMBD (tabla 2), con las limitaciones propias de este registro para el análisis de enfermedad nosocomial. La tasa de incidencia osciló entre 0,25 y 0,45 casos por 100 niños<5 años hospitalizados. Por el contrario, en otro estudio prospectivo la incidencia fue entre 6 y 11 veces mayor17. En este último, se realizó una búsqueda activa de casos hasta 72 h después del alta hospitalaria, permitiendo una identificación más específica y una estimación más precisa de la frecuencia de enfermedad nosocomial.
En una revisión realizada en Europa, la mediana de la incidencia estimada fue de 6,2 casos por 100 hospitalizaciones (rango 0,3-27,7)18. El ECDC estimó que un 25-30% de las infecciones por RV en niños hospitalizados son infecciones adquiridas en el sistema sanitario, constituyendo la principal causa de diarrea pediátrica nosocomial (https://ecdc.europa.eu/en/publications-data/expert-opinion-rotavirus-vaccination-infancy). Esto supone una carga de enfermedad adicional al prolongar hospitalizaciones por otras causas.
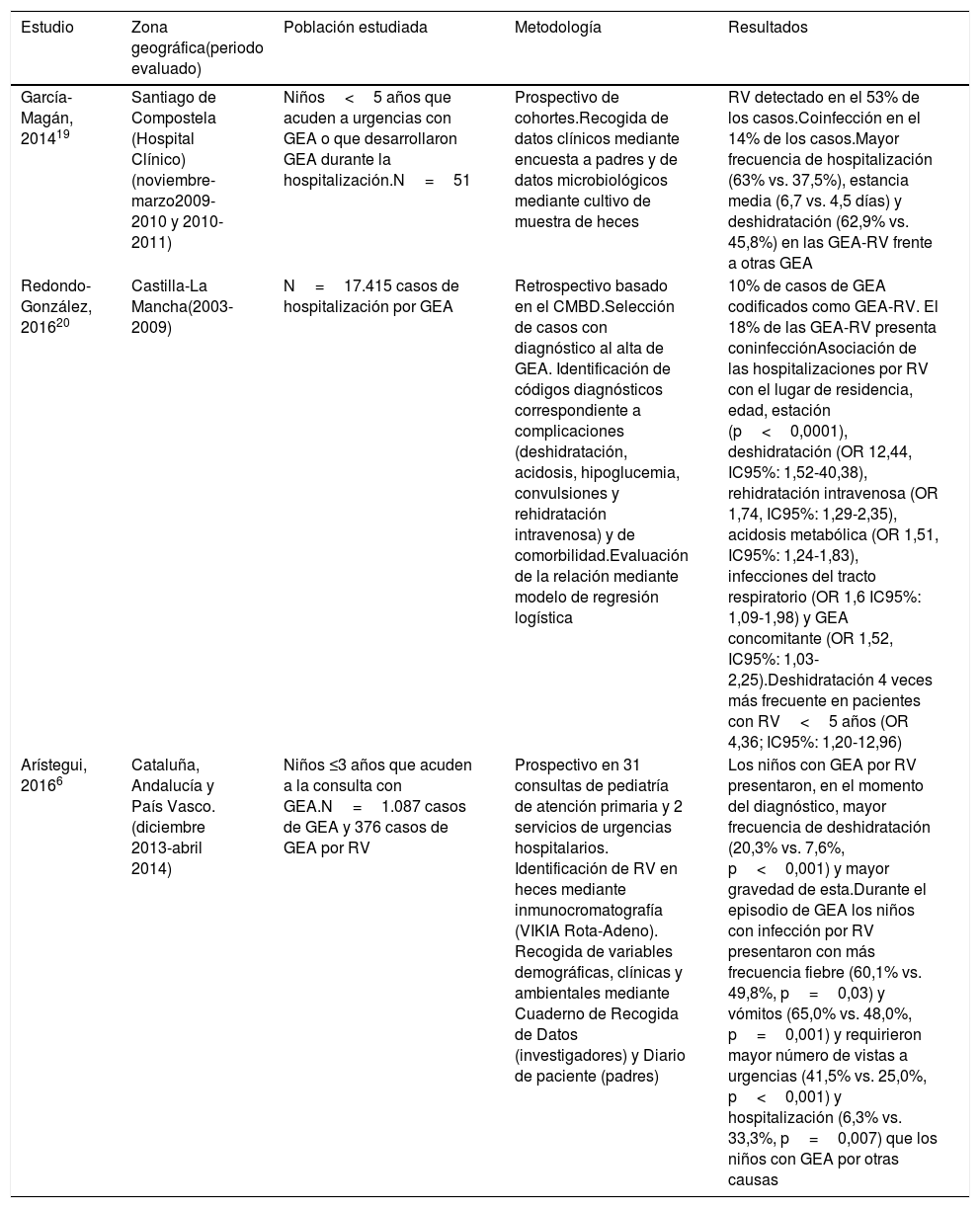
Caracterización clínica de la gastroenteritis por rotavirusDe manera consistente a lo descrito en otros países, en España, la presentación clínica de la GEA-RV es más grave y con más frecuencia de complicaciones que en otras diarreas (tabla 3), lo que supone un mayor consumo de recursos sanitarios, costes e impacto psicosocial6.
Características clínicas de la infección por rotavirus en España
| Estudio | Zona geográfica(periodo evaluado) | Población estudiada | Metodología | Resultados |
|---|---|---|---|---|
| García-Magán, 201419 | Santiago de Compostela (Hospital Clínico)(noviembre-marzo2009-2010 y 2010-2011) | Niños<5 años que acuden a urgencias con GEA o que desarrollaron GEA durante la hospitalización.N=51 | Prospectivo de cohortes.Recogida de datos clínicos mediante encuesta a padres y de datos microbiológicos mediante cultivo de muestra de heces | RV detectado en el 53% de los casos.Coinfección en el 14% de los casos.Mayor frecuencia de hospitalización (63% vs. 37,5%), estancia media (6,7 vs. 4,5 días) y deshidratación (62,9% vs. 45,8%) en las GEA-RV frente a otras GEA |
| Redondo-González, 201620 | Castilla-La Mancha(2003-2009) | N=17.415 casos de hospitalización por GEA | Retrospectivo basado en el CMBD.Selección de casos con diagnóstico al alta de GEA. Identificación de códigos diagnósticos correspondiente a complicaciones (deshidratación, acidosis, hipoglucemia, convulsiones y rehidratación intravenosa) y de comorbilidad.Evaluación de la relación mediante modelo de regresión logística | 10% de casos de GEA codificados como GEA-RV. El 18% de las GEA-RV presenta coninfecciónAsociación de las hospitalizaciones por RV con el lugar de residencia, edad, estación (p<0,0001), deshidratación (OR 12,44, IC95%: 1,52-40,38), rehidratación intravenosa (OR 1,74, IC95%: 1,29-2,35), acidosis metabólica (OR 1,51, IC95%: 1,24-1,83), infecciones del tracto respiratorio (OR 1,6 IC95%: 1,09-1,98) y GEA concomitante (OR 1,52, IC95%: 1,03-2,25).Deshidratación 4 veces más frecuente en pacientes con RV<5 años (OR 4,36; IC95%: 1,20-12,96) |
| Arístegui, 20166 | Cataluña, Andalucía y País Vasco.(diciembre 2013-abril 2014) | Niños ≤3 años que acuden a la consulta con GEA.N=1.087 casos de GEA y 376 casos de GEA por RV | Prospectivo en 31 consultas de pediatría de atención primaria y 2 servicios de urgencias hospitalarios. Identificación de RV en heces mediante inmunocromatografía (VIKIA Rota-Adeno). Recogida de variables demográficas, clínicas y ambientales mediante Cuaderno de Recogida de Datos (investigadores) y Diario de paciente (padres) | Los niños con GEA por RV presentaron, en el momento del diagnóstico, mayor frecuencia de deshidratación (20,3% vs. 7,6%, p<0,001) y mayor gravedad de esta.Durante el episodio de GEA los niños con infección por RV presentaron con más frecuencia fiebre (60,1% vs. 49,8%, p=0,03) y vómitos (65,0% vs. 48,0%, p=0,001) y requirieron mayor número de vistas a urgencias (41,5% vs. 25,0%, p<0,001) y hospitalización (6,3% vs. 33,3%, p=0,007) que los niños con GEA por otras causas |
CMBD: Conjunto Mínimo Básico de Datos, base de datos nacional de registro de altas hospitalarias.
En 2006, debido a la introducción de las vacunas, se estableció en Europa la red EuroRotaNet para la vigilancia de la circulación de genotipos de RV en los países participantes (http://www.eurorota.net). España ha participado en esta red aportando alrededor de 700 muestras anuales.
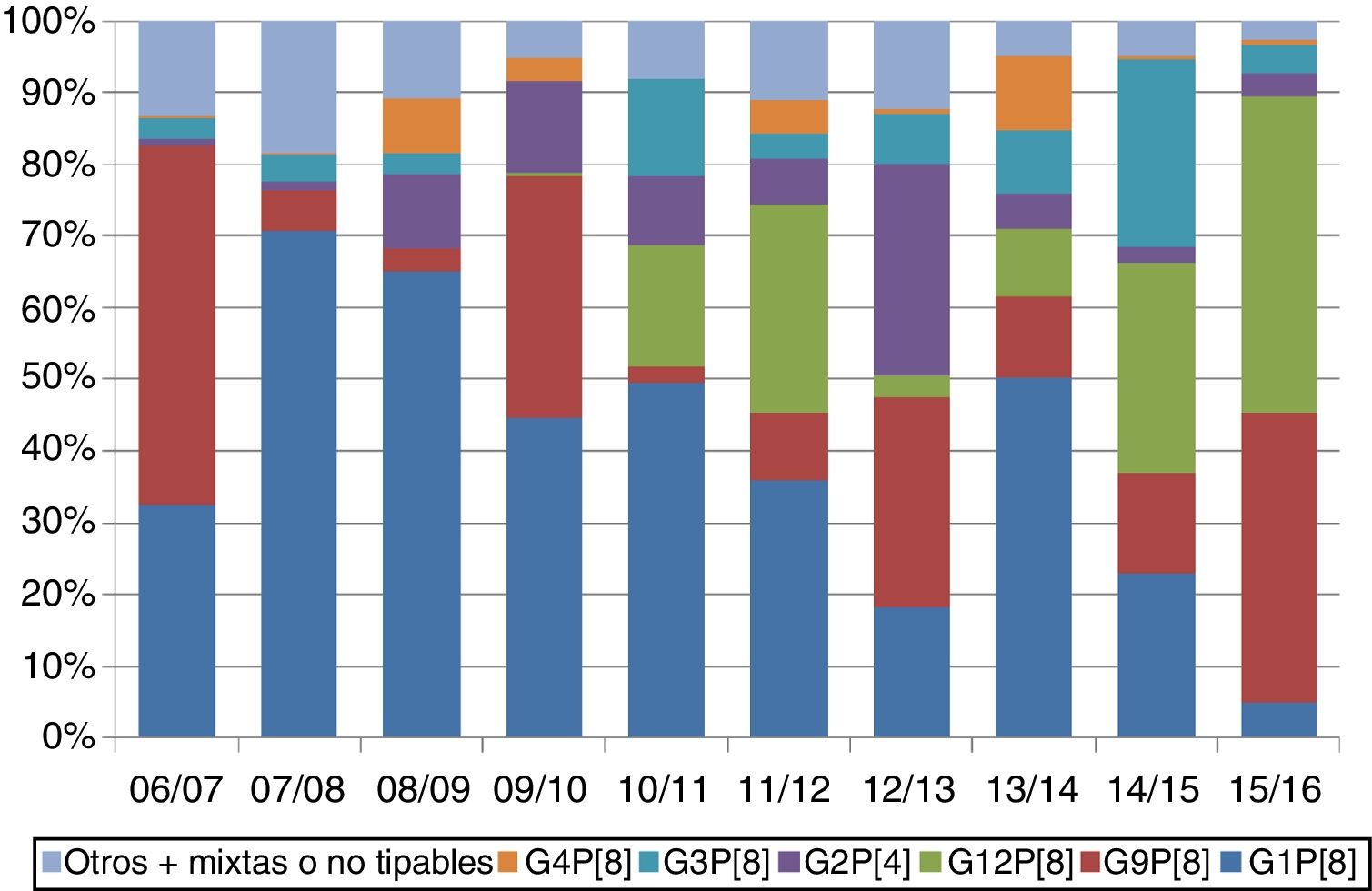
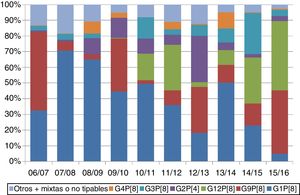
Globalmente, los genotipos G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] y G12P[8] circularon con una frecuencia ≥1%. En España, estos 6 genotipos suponen el 98% de las muestras con un único tipo identificado. Existen fluctuaciones en la distribución de genotipos de una temporada a otra (fig. 1). Esta variabilidad se describe de manera similar en estudios españoles13,21–24.
Según los informes del EuroRotaNet, no existe evidencia hasta la fecha de que los programas de vacunación frente a RV estén teniendo un impacto en la emergencia de nuevos genotipos que escapen a la protección conferida por las vacunas. Estos cambios deben interpretarse en el contexto de las fluctuaciones naturales observadas también en países sin vacunación o las que ocurrían antes de su introducción.
Repercusión económica y familiarDos estudios evaluaron la repercusión económica de la GEA-RV en las familias (tabla 4). Los resultados no son comparables ya que se realizaron en diferentes periodos con respecto a la introducción de las vacunas.
Impacto económico y familiar de la infección por rotavirus en España
| Estudio | Zona geográfica(periodo evaluado) | Población estudiada | Metodología | Variables/resultados |
|---|---|---|---|---|
| Martinón-Torres, 200825 | Galicia(Hospital Clínico Santiago de Compostela)(diciembre 2005-abril 2006) | Niños<2 años.N=88 con GEA (60,5% RV+) | Prospectivo.Recogida de costes no médicos incurridos antes, durante y después del diagnóstico mediante entrevista a los padres y contacto telefónicos | Costes indirectos por RV 2,6 veces superiores que en otras etiologías (427€ vs. 163€). Gastos de transporte y derivados de las comidas superiores |
| Bouzón-Alejandro, 2011a26 | Asturias y Galicia(octubre 2008-junio 2009) | Niños<5 años.N=682 con GEA (30,4% RV+) | Prospectivo en centros de atención primaria, urgencias y hospitales (red Regalip).Recogida de datos de costes no médicos a través de entrevista con los padres y cuestionario web | Costes por RV 1,74 veces superiores que otras GEA (192,7€ vs. 111,6€), principalmente asociado al absentismo laboral de los padres |
| Giménez-Sánchez, 200828 | España(febrero-marzo 2006) | Niños<2 años.N=1.087 casos de GEA (1.006 hospitalarios y 81 de centros de salud) | Transversal en 25 hospitales y 5 centros de atención primaria.Gravedad evaluada mediante escala de Clark.Recogida de información mediante cuestionario cumplimentado por los padres | Mayor porcentaje de casos graves en casos RV+(30% vs. 11,9%).Infección por RV asociado a más preocupación de los padres, mayor frecuencia para levantarse por la noche, más cansancio, más prisas y más tensión |
| Díez-Domingo, 201229 | 3 países europeos incluido España(noviembre 2005 - mayo 2007) | Niños<5 años.N=213 RV+atendidos en centros de atención primaria | Prospectivo en 15 centros de atención primaria.Gravedad evaluada mediante escala de Vesikari.Evaluación de calidad de vida mediante cuestionario validado | GEA-RV asociado a más preocupación, angustia y afectación en las actividades cotidianas de los padres.La mayor gravedad se asocia a mayor preocupación y estrés |
| Arístegui, 20166 | Cataluña, País Vasco, Andalucía(octubre 2013-abril 2014) | Niños ≤3 años.N=1.087 casos de GEA y 376 casos de GEA por RV | Prospectivo en 64 consultas de pediatría de atención primaria y 2 servicios de urgencias hospitalarios.Recogida de variables relacionadas con impacto familiar a través de un diario de paciente (padres) | Los niños con RV+están significativamente más cansados, llorosos e irritables comparado con niños con otras GEA. Los padres están más preocupados y sufren más alteraciones en el ritmo de trabajo.Costes familiares significativamente superiores en GEA-RV (47,3€ vs. 36,7€, p=0,011).En casos de GEA-RV la frecuencia de convivientes infectados es también mayor |
RV+: casos de GEA con resultado positivo a prueba de detección de rotavirus.
Según una revisión sobre el impacto económico y psicosocial de la infección por RV en Europa que incluye estudios españoles, el coste estimado por episodios de GEA-RV hospitalarios, atendidos en urgencias o atención primaria fue de 1.000-1.700€, 409€ y 166€, respectivamente, dando lugar a un coste global para el Sistema Sanitario de 28 millones de euros anuales. Se calculó que el 68% de los padres de niños hospitalizados por RV faltaban al trabajo, una media de aproximadamente 4 días. El coste estimado de la enfermedad desde la perspectiva social sería de aproximadamente 50 millones de euros27.
La infección por RV también tiene un impacto psicosocial considerable, causando estrés en los padres, que ven afectada su calidad de vida27 (tabla 4). En enfermedades prevalentes tienen una importante relevancia, como medida de resultado, las variables relacionadas con la calidad de vida, especialmente, en la interferencia en las actividades cotidianas de la vida familiar en el caso de enfermedades pediátricas28. Este impacto emocional y social, aunque se trate de un coste intangible y con limitaciones en su estandarización y cuantificación, debería ser considerado al evaluar la calidad de vida relacionada con la salud de los pacientes y los cuidadores afectados por la enfermedad28.
Se observa impacto familiar y emocional tanto en los padres de niños hospitalizados por GEA-RV38 como en los atendidos en atención primaria, siendo este impacto mayor que el observado cuando la GEA se debe a otras causas6,29.
Vacunación frente a rotavirusEfectividadEn los estudios revisados se observa un alto nivel de efectividad de las vacunas frente a RV para prevenir episodios y hospitalizaciones por GEA-RV, con resultados consistentes con los de eficacia obtenidos en los ensayos clínicos32 (tabla 5).
Estudios realizados en España en los que se ha evaluado la efectividad de la vacuna frente a rotavirus
| Estudio | Zona geográfica (periodo evaluado) | Metodología | Efectividad de la vacuna frente a rotavirus | |
|---|---|---|---|---|
| Reducción de episodios de GEA-RV (%)(IC 95%) | Reducción de hospitalizaciones por GEA-RV(%)(IC 95%) | |||
| Martinón-Torres, 201130 | Asturias y Galicia.(octubre 2008 –junio 2009) | Prospectivo en centros de atención primaria y hospitales. Análisis de casos y controles.Niños<2 años | 91,5%(83,7-95,6%) | 95,6%(85,6-98,6%) |
| Castilla, 201231 | Navarra (2008-2011) | Caso-control a partir de historias clínicas electrónicas y registro de vacunaciones.Niños<5 años | 78%(68-85%) | 83%(65-93%)96% (85-99%) en el periodo enero 2010 a junio 2011 |
| Bellido-Blasco, 201232 | Castellón (Hospital General)(2009) | Caso-control a partir de resultados del laboratorio de microbiología del hospital y del Registro de Vacunación Regional.Niños<3 años | 87,7%(45,5-99,7%) | 93,5% (30,7-99,3%) |
| Pérez-Vilar, 201533 | Comunidad Valenciana.(enero 2007-junio 2012) | Cohorte retrospectiva a partir de bases de datos sanitarias (CMBD y Registro de Vacunación) | - | 84% (75-90%) para RV191% (84-95%) para RV5(efectividad ajustada frente a casos confirmados de hospitalización por RV) |
| Giménez-Sánchez, 201534 | Almería(Hospital Torrecárdenas) y El Ejido (Hospital del Poniente)(2005-2013) | Prospectivo de casos y controles apareados | - | 86% (59-95%) vs. grupo control A (hospitalizaciones por GEA negativa a RV)88% (68-95%) vs. grupo control B (hospitalizaciones por patología no gastrointestinal) |
La efectividad frente a hospitalizaciones por RV oscila entre un 83% y 96%, posiblemente debido a las diferentes metodologías, poblaciones, periodos posvacunación evaluados, protocolos hospitalarios de ingreso por GEA, y a las diferentes pruebas de determinación etiológica utilizadas, cuya sensibilidad puede variar de manera significativa.
En Europa, se observan resultados de efectividad de la vacunación similares, con reducciones de los casos de GEA-RV atendidos en Atención Primaria u hospitalizados entre el 68% y el 98% dependiendo del grupo control utilizado35.
Impacto clínico y económico de la vacunaciónEl impacto de las vacunas frente a RV se evaluó estimando la reducción en las tasas de hospitalización usando, fundamentalmente, bases de datos o historias clínicas hospitalarias (tabla 6). A la hora de realizar comparaciones es importante tener en cuenta las diferencias en el diseño, periodo de estudio, áreas geográficas, coberturas de vacunación y cómo se han estimado, así como las potenciales diferencias en las prácticas asistenciales de los diferentes hospitales.
Impacto clínico y económico de la vacuna frente a rotavirus en España
| Estudio | Zona geográfica(periodo evaluado) | Población estudiada | Metodología | Variables/resultados |
|---|---|---|---|---|
| Martinón-Torres, 201236 | Galicia.(julio 2003-junio 2010) | Niños<5 años.N=3.564 casos de GEA y 1.989 de GEA-RV | Retrospectivo basado en el CMBD.Comparación de incidencia de hospitalización por GEA-RV antes (2003-2007) y después (2008-2010) de la introducción de la vacunación.Cobertura estimada de vacunación (en base a dosis distribuidas): 43% en julio 2007-junio 2008, 51% en julio 2008-junio 2009 y 46% en julio 2009-junio 2010 | Reducción en las tasas de hospitalización por RV del 44,5% en el periodo julio 2009-junio 2010, en comparación con el periodo prevacunación (julio 2003-julio 2007) y del 57,3% en niños<12 meses.Reducción de las tasas de hospitalización de GEA por cualquier causa del 49,0% en el periodo julio 2009-junio 2010 y del 58,7% en niños<12 meses |
| Gil-Pietro, 201337 | España.(enero 2005-diciembre 2009) | Niños<5 años.N=111.738 ingresos por GEA y 26.500 ingresos por GEA-RV | Retrospectivo basado en el CMBD. Comparación de la incidencia de hospitalización por GEA-RV antes (2005-2006) y después (2008-2009) de la introducción de la vacunación.Cobertura estimada de vacunación (en base a dosis distribuidas): 17% en 2017, 35% en 2008 y 38% en 2009 | Reducción de las tasas de hospitalización de GEA por cualquier causa, diarrea de etiología no determinada y GEA-RV de, 35%, 37% y 36%, respectivamente.En niños<12 meses las respectivas reducciones fueron del 42%, 43% y 42% |
| Redondo, 201538 | Castilla La-Mancha(enero 2003-diciembre 2009) | Niños<5 años.N=6.593 casos de hospitalización por GEA y 1.640 casos de GEA por RV | Retrospectivo basado en el CMBD. Evaluación de la incidencia y estacionalidad antes (2003-2005) y después (2007-2009) de la introducción de la vacunación.Cobertura estimada de vacunación (en base a dosis distribuidas): 18% en 2007, 39% en 2008 y 44% en 2009) | Disminución del 28% en las tasas de hospitalización por RV en los 3 años posteriores al inicio de la vacunación. En niños<2 años reducción del 37%.Reducción del 22% en los ingresos por GEA de etiología desconocida |
| Giménez Sánchez, 201634 | Almería (Hospital Torrecárdenas y El Ejido (Hospital del Poniente).(enero 2006-diciembre 2013) | Niños<2 años.N=1.298 hospitalizaciones por GEA | Retrospectivo mediante revisión de historias clínicas de hospitales en áreas con diferentes coberturas de vacunación (77,1% en Almería y 44,8% en el Ejido en 2009; en base a dosis distribuidas).Comparación de tasas de hospitalización del periodo previo (2005-2006) y posterior (2007-2013) a la introducción de la vacunación | Disminución de las tasas de hospitalización por RV del 23% y del 30,4% las GEA por cualquier causa. Reducciones dependientes de las coberturas vacunales: mayores en Almería (H. Torrecárdenas) que en El Ejido (RR de1,67 vs. 1,23) |
| Orrico-Sánchez, 20171 | Comunidad Valenciana.(enero 2002-septiembre 2015) | Niños<5 años nacidos a partir del 1 de enero de 2002 hasta el 31 de diciembre | Retrospectivo ecológico mediante el uso de bases de datos (SIP; CMBD; sistema de registro de vacunas regional-SIV).Análisis del riesgo de hospitalización por GEA y GEA-RV en función de la cobertura de vacunación (estimada a partir del SIV) y del impacto en las hospitalizaciones por GEA en el periodo pre (2003-2006) vs. posvacunación (2008-2014) | Disminución en tasa hospitalización por RV del 67, 71 y 68% en niños de 0, 1 y 4 años, respectivamente, para coberturas de vacunación del 40-42%.Disminución de hospitalizaciones por GEA por cualquier causa de entre el 32% y 39% en niños de 0 y 3 años. Reducción del coste de hospitalización de 6 millones/100.000 niños a lo largo de 7 años |
CMBD: Conjunto Mínimo Básico de Datos, base de datos nacional de registro de altas hospitalarias.
En este sentido, en el estudio de Orrico et al. se estimó la cobertura de vacunación en base al registro regional de vacunaciones de la Comunidad Valenciana, a diferencia de otros estudios en los que se estimaba a partir de las dosis de vacunas distribuidas en la provincia correspondiente, lo que podría sesgar la estimación. En este estudio se utilizó, además, un modelo para controlar los factores que podían modificar el resultado (p. ej., los cambios en las políticas de admisión) y se calculó la reducción de las tasas de hospitalización en función de la cobertura de vacunación, estableciéndose la dependencia existente entre estas, de manera que para coberturas<20% la reducción del riesgo de hospitalización por RV era de 37% y 45% para niños de 1 y 2 años, mientras que para coberturas ≥40% era de casi un 70% para los niños de esa misma edad1. Esto sugiere un posible efecto comunitario de la vacunación con coberturas intermedias. La reducción estimada en costes sanitarios asociados a las hospitalizaciones por GEA fue de 6 millones de euros por 100.000 niños<5 años en un periodo de 7 años1.
Al no ser la infección por RV de declaración en España y como su diagnóstico no influye en el tratamiento de la GEA, los hospitales podrían no realizar pruebas microbiológicas de manera sistemática. Además, la introducción de las vacunas puede haber influido también en el uso más frecuente de las pruebas de detección de RV, lo que habría dado lugar a un aumento de los ingresos por GEA-RV detectado, influyendo de manera negativa en la evaluación de las reducciones en las tasas de hospitalización. Es importante, por tanto, evaluar el impacto de la vacunación no solo en los ingresos por GEA-RV sino también en GEA por cualquier causa. En el estudio de Redondo et al.38, se estimó que el 66% de los ingresos por GEA se codificaban como GEA no tipificada. En estos casos, la distribución por edad y estacionalidad sugería que una importante proporción podría ser GEA-RV. En los estudios resumidos en la tabla 6 se observa una reducción significativa no solo de las GEA-RV sino también en las hospitalizaciones por GEA por cualquier causa.
Los resultados de un modelo de cohorte para evaluar el impacto económico de vacunación universal con la vacuna pentavalente frente al RV, indicaban que los costes asociados a la enfermedad por RV se reducirían en un 76%, de manera similar a lo observado en otros países europeos8. Esta reducción supondría un ahorro anual para el sistema sanitario de 22 millones de euros y de 38 millones de euros desde una perspectiva social. Hay que destacar que, al tratarse de un modelo, los resultados se deben interpretar con cautela.
A pesar la importante carga económica estimada para la GEA-RV y del impacto de la vacunación, los análisis de coste-efectividad realizados en España39,40 no muestran que la vacunación sea eficiente, a diferencia de lo observado en otros países41. Algunos autores atribuyen estás diferencias a que el diseño de cohortes utilizado en los modelos en España infraestima el potencial impacto indirecto de la vacunación, ya que no tiene en cuenta la protección de grupo ni los casos de infección por RV no diagnosticados. En Australia, al reevaluar el coste-efectividad de la vacunación incluyendo datos de protección de grupo y de reducción de hospitalizaciones por GEA no especificada observados tras la implementación de la vacunación universal, se obtuvo un ahorro de costes sustancialmente mayor al estimado en los modelos previos a la introducción de la vacunación42. Por otro lado, en estos estudios no se consideran los cambios en el coste de la vacuna, que es una de las variables que más impacto tiene en este tipo de estudios27.
Seguridad de las vacunasLas vacunas frente a RV han demostrado ser seguras y bien toleradas43. Las fichas técnicas describen un riesgo de invaginación intestinal observado poscomercialización, estimado en hasta 6 casos adicionales por 100.000 niños en los 7 días tras la vacunación, fundamentalmente, tras la primera dosis de vacuna. El riesgo parece estar asociado a la edad de administración de esta, por lo que la Sociedad Europea de Enfermedades Infecciosas Pediátricas recomienda la administración de la primera dosis entre las 6 y las 12-15 semanas de edad, preferiblemente a las 6-8 semanas43.
En un estudio realizado en Valencia, de 136 casos confirmados de hospitalización por invaginación intestinal, 35 (26%) ocurrieron en niños vacunados y, de estos, 3 casos fueron entre 1 y 7 días tras la primera dosis, dando lugar a una razón de tasas de incidencia ajustada de 4,7 (IC95%: 0,3-74,1)44. Los autores concluyen que los pocos casos de invaginación intestinal observados a pesar del amplio periodo (5 años) evaluado en un país en el que, según los estudios anteriores, podría presentar una tasa de invaginación intestinal basal amplia, son favorables. Además, se observa que la incidencia de hospitalización por invaginación intestinal está disminuyendo en España durante el periodo posterior a la introducción de las vacunas frente a RV44.
Otras líneas de investigaciónOtros aspectos relacionados con la infección por RV y su vacunación que se han estudiado en España, incluyen:
- -
El potencial impacto de la vacunación en la microbiota: comparando la composición de esta en niños de 12-15 meses vacunados con 3 dosis de RV5 frente a no vacunados no se observaron diferencias a largo plazo45.
- -
El impacto de la vacunación frente a RV en hospitalizaciones por convulsiones; los estudios realizados en España presentan resultados discrepantes46,47 por los que es un campo que requiere continuar investigándose a través de estudios de calidad con diseños apropiados para la evaluación del efecto.
- -
Fiabilidad diagnóstica para la detección de RV; un estudio estimó una tasa de hasta un 51% de resultados falsos positivos en niños vacunados cuando se utiliza inmunocromatografía para el diagnóstico en condiciones de baja prevalencia de la enfermedad, por la disminución del valor predictivo positivo. Si estos resultados, falsos positivos, se interpretan como fallos vacunales podrían generar una pérdida de confianza en la vacuna y, en consecuencia, una disminución de las coberturas de vacunación48. Además, también puede tener un impacto a la hora de analizar la efectividad de la vacuna, ya que la disminuiría de manera artificial.
Los estudios realizados en España sobre la GEA-RV y su vacunación proporcionan datos epidemiológicos precisos que refrendan su importante carga de enfermedad y permiten responder a incertidumbres que existían sobre las vacunas en el momento de su autorización en el año 2006 (tabla 7).
Información disponible (2006 vs. 2018) y conclusiones
| Información disponible | 2006 (Recomendaciones de la vacunación frente a rotavirus. Ministerio de Sanidad. Sept 2006; https://www.msssi.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/Rotavirus.htm) | 2018 |
|---|---|---|
| Carga de enfermedad asociada a rotavirus | Información fundamentalmente obtenida a partir de centros hospitalarios o sistemas de vigilancia como el CMBD o el SIM | La información sobre la carga de la enfermedad, tanto adquirida en la comunidad como nosocomial, se ha ampliado considerablemente a partir de estudios en diferentes ámbitos asistenciales, incluyendo estudios de búsqueda activa de casos. Se han realizado estudios que han puesto de manifiesto la mayor gravedad de las GEA-RV con respecto a GEA por otras causas, y el impacto que la enfermedad tiene en las familias y la sociedad.Se concluye que la carga de enfermedad en España es muy importante con un impacto clínico, económico y social que es mayor de lo que se esperaba antes de disponer de las vacunas |
| Efectividad e impacto de las vacunas | Datos de eficacia de las vacunas disponibles procedentes de los ensayos clínicos, pero no de resultados en vida real | Diversos estudios han demostrado que la efectividad de la vacunación frente a RV en España es muy elevada y próxima a los resultados de eficacia de los ensayos clínicos. La efectividad se ha demostrado en la reducción de episodios de GEA-RV de cualquier gravedad y de hospitalizaciones por GEA-RV.Varios estudios han demostrado un impacto significativo de la vacunación en las hospitalizaciones por GEA-RV y en las de GEA por cualquier causa incluso con coberturas intermedias de vacunación |
| Impacto económico de la vacunación | Sin datos en España | En base a la nueva información epidemiológica disponible, se ha estimado el impacto económico de la vacunación que implica importantes ahorros tanto a nivel del sistema sanitario como de la sociedad.Los análisis de coste-efectividad de la vacunación no tienen en cuenta los efectos indirectos de la vacunación, los casos de GEA-RV no diagnosticados ni las variaciones en el coste de las vacunas |
| Protección de las vacunas frente a diferentes genotipos | Los datos de eficacia específica de genotipos de las vacunas estaban limitados por un menor número de casos atribuibles a genotipos diferentes al G1 durante los periodos en los que se realizaron los ensayos clínicos | Aunque en España los estudios realizados no han evaluado la efectividad para los diferentes genotipos, se observa que tanto la efectividad como el impacto son significativos y mantenidos en el tiempo, independientemente de la fluctuación de los tipos circulantes descrita en los estudios de distribución de tipos y de la red de vigilancia EuroRotaNet |
| Reemplazamiento de genotipos causantes de enfermedad como consecuencia de la presión vacunal | La variabilidad de genotipos que producen enfermedad en humanos planteaba la posibilidad de que, como consecuencia de la vacunación, los tipos circulantes más frecuentemente fuesen sustituidos por otros para los que las vacunas no ofreciesen protección | Estudios sobre circulación de genotipos en España y, especialmente la red de vigilancia EuroRotaNet, muestran que a pesar de la variabilidad de genotipos existente, en los últimos 10 años, 6 genotipos han sido los más frecuentes en Europa y España, sin que se observe un impacto de los programas de vacunación en la aparición de nuevos genotipos que escapen a la protección conferida por las vacunas |
Los próximos años darán respuesta a algunos de los aspectos pendientes de resolver en relación con las manifestaciones extraintestinales del RV y los potenciales beneficios inesperados de la vacunación gracias a las líneas de investigación abiertas. Mientras tanto, el cuerpo de evidencia específicamente acumulado en nuestro país en la última década, en línea con la literatura internacional, debería someter a reconsideración la eventual inclusión de la vacuna frente al rotavirus en el calendario vacunal sistemático, siguiendo las recomendaciones de los principales organismos de expertos y el ejemplo de los países de nuestro entorno.
FinanciaciónLa redacción de este artículo ha sido apoyada en parte a través de una beca de MSD España.
Conflicto de interesesMGS ha realizado actividad docente para GSK, Pfizer, Sanofi-Pasteur-MSD, MSD y participa o ha participado como investigadora en ensayos clínicos con GSK, Pfizer, Sanofi-Pasteur-MSD, Wyeth, Medimmune.
FGS ha recibido honorarios como ponente en conferencias y como consultor para GSK y MSD.
JCR declara no tener ningún conflicto de interés.
FMT ha recibido becas de investigación y/o honorarios como consultor/asesor y/o ponente así como en calidad de investigador en el desarrollo de ensayos clínicos en vacunas de Abbot, GlaxoSmithKline, Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer, Novartis, Novavax, Regeneron, Roche, Seqirus y MedImmune Inc.
JDD es investigador principal de ensayos clínicos de GSK, MSD, ABBOT, PFIZER y SANOFI-PASTEUR. Ha recibido honorarios por ponencias y consultor/asesor de Pfizer, MSD, SP y GSK. FISABIO ha recibido becas de investigación de GSK, MSD y SP.
Los autores agradecen a Syntax for Science, S.L. su participación en la elaboración técnica y tramitación de este manuscrito.