La enfermedad meningocócica es una infección grave causada por Neisseria meningitidis, cuyo serogrupo predominante actualmente es el B, para el que ha sido complejo crear vacunas efectivas y, por tanto, difícil modificar o reducir su morbimortalidad. El objetivo de este trabajo ha sido revisar los datos existentes sobre la nueva vacuna 4CMenB y sus posibles aportaciones en la prevención de esta infección.
MétodosSe realizó una búsqueda de autor dirigida por 12 especialistas relacionados con la pediatría, vacunología y salud pública, que priorizó 74 publicaciones, para preparar un documento de revisión sobre la vacuna. El documento se trabajó en una reunión presencial y validó posteriormente mediante correo electrónico.
ResultadosLa vacuna 4CMenB, basada en 4 componentes (NadA, fHbp, NHBA y OMVnz), se ha diseñado mediante vacunología inversa. El Meningococcal Antigen Typing System (MATS) muestra una potencial cobertura del 70-80% de las cepas circulantes en Europa. Los ensayos clínicos demuestran que la vacuna es inmunógena y segura en lactantes, niños, adolescentes y adultos, e induce memoria inmunológica. La incidencia de fiebre es similar a las de vacunas sistémicas administrada sola, pero mayor cuando se coadministra con ellas, aunque el patrón de fiebre es predecible y autolimitado. Es compatible con las demás vacunas incluidas en el calendario sistemático español, pudiendo administrarse simultáneamente con las vacunas hexavalente y pentavalentes actualmente disponibles, así como con la vacuna antineumocócica conjugada heptavalente.
ConclusionesLa vacuna 4CMenB, por el momento, es la única estrategia disponible para prevenir la enfermedad meningocócica por el serogrupo B.
Meningococcal disease is an infection caused by Neisseria meningitidis, and those of serogroup B are currently the most predominant. It has been difficult to create effective vaccines for this serogroup in order to modify or reduce its morbidity. The aim of this study was to review existing data on the new vaccine 4CMenB and its potential contribution to the prevention of this infection.
MethodsA panel of 12 experts (from Pediatrics, Public Health and Vaccinology) conducted a literature search and prioritized 74 publications. A review of the vaccine was then prepared, which was discussed in a meeting and subsequently validated by e-mail.
Results4CMenB vaccine, based on four components (NadA, fHbp, NHBA and OMVnz), was designed by reverse vaccinology. The Meningococcal Antigen Typing System (MATS) shows a potential of 70-80% coverage of the strains in Europe. Clinical trials show that the vaccine is safe and immunogenic in infants, children, adolescents, and adults, and induces an anamnestic response. The incidence of fever is similar to systemic vaccines administered alone, but higher when co-administered with them, although the fever pattern is predictable and self-limited. It is compatible with the Spanish routine vaccines, and can be administered simultaneously with the currently available hexavalent and pentavalent vaccines, as well as the pneumococcal conjugate vaccine.
ConclusionsThe 4CMenB vaccine is the only strategy currently available to prevent meningococcal disease caused by serogroup B.
La enfermedad meningocócica es una infección grave causada por Neisseria meningitidis (N. meningitidis) que incluye diversas formas clínicas, como meningitis y sepsis.
Se han identificado 12 serogrupos de N. meningitidis, 6 de los cuales (A, B, C, W135, X e Y) pueden afectar al ser humano, aunque actualmente existe un cierto nivel de controversia en la nomenclatura. La mayoría de ellos son endémicos. Sus datos epidemiológicos y la circulación de serogrupos varían según las áreas geográficas, y todos ellos pueden producir epidemias1.
Las cepas del serogrupo B que causan enfermedad invasiva son más diversas genéticamente que las de otros serogrupos. La infección por meningococo B es la principal causa de enfermedad invasiva en países desarrollados, en los que lactantes y adolescentes son las poblaciones más vulnerables a presentar las formas más graves de la enfermedad2.
Epidemiología y carga de la enfermedadDistribución geográfica y estacionalLa mayor parte de los casos de enfermedad meningocócica suceden durante el invierno y el inicio de la primavera2–7. La epidemiología de la enfermedad varía según el área geográfica y el serogrupo8,9. El serogrupo A es responsable de las grandes epidemias en África, mientras que los grupos B y C predominan en países industrializados, siendo los responsables de la mayoría de los casos en Europa y el continente americano. El serogrupo W135 provoca epidemias como la de Arabia Saudí y, a finales del 2012, ha sido motivo de un número importante de casos en países del cinturón africano y en Argentina y Chile10. El serogrupo Y es la causa más común de enfermedad meningocócica en Estados Unidos y Colombia, y es muy frecuente en Canadá e Israel. El serogrupo Y ha producido epidemias en Ghana y algún otro país africano2.
La razón de la distinta distribución de los serogrupos a nivel mundial es desconocida, aunque las diferencias inmunitarias en la población y los factores ambientales desempeñan un papel fundamental.
Situación de la enfermedad meningocócica en EuropaSegún datos del European Centre for Disease Prevention and Control (ECDC), la incidencia de la enfermedad meningocócica en Europa oscila entre 0,13 y 3,37 casos por 100.000 habitantes (año 2009)9. Los serogrupos que han predominado en la última década del siglo XX en Europa han sido el B y el C9. No obstante, en la última década, la incidencia de enfermedad meningocócica invasiva ha mostrado una reducción importante, debido a la incorporación de las vacunas antimeningocócicas conjugadas C en el calendario de vacunación infantil sistemática en muchos países4 (de 1,9 por 100.000 habitantes a 0,92 por 100.000 habitantes). Por ello, el serogrupo B es el que actualmente predomina en Europa. Este serogrupo suele causar ondas epidémicas de ciclo largo.
La incidencia de la enfermedad meningocócica varía con la edad, con las tasas más altas en lactantes, seguidos de los adolescentes y los adultos jóvenes. Según datos del 2009, en Europa la incidencia en lactantes fue de 15,9 casos por 100.000 habitantes, seguida por la de los niños entre 1 y 4 años (5,4 por 100.000 habitantes) y los adolescentes de 15-19 años (2,0 por 100.000 habitantes)2–4.
El serogrupo B es el causante de la mayor parte de los casos de esta enfermedad en Europa. De los casos notificados de 2009 de los que se disponía del grupo capsular (en total el 88%), el 71% fue producido por el serogrupo B (particularmente en aquellos países que introdujeron vacunas conjugadas para el serogrupo C), el 13% por el serogrupo C y el 4% por el serogrupo Y. Entre 1993 y 1996 el serogrupo B ya había sido causante del 68% de los casos declarados en Europa2–4,11.
En cuanto a la distribución por serogrupos según la edad, gran parte de los casos producidos por el serogrupo B afectan a niños pequeños. El análisis de 4.435 casos de enfermedad meningocócica invasiva comunicados en Inglaterra y Gales durante 4 años (2006-2010) mostró que el 58% de los casos producidos por el serogrupo B ocurrían en niños menores de 5 años y que, en este grupo de edad, el serogrupo B era claramente mayoritario, siendo el responsable del 94% de los casos4.
Situación de la enfermedad meningocócica en EspañaEn nuestro país, la enfermedad meningocócica es de declaración obligatoria, urgente e individual, y se registra por la Red Nacional de Vigilancia Epidemiológica mediante la notificación al Sistema de Enfermedades de Declaración Obligatoria (EDO)12.
Según datos publicados en los boletines epidemiológicos semanales, durante el periodo de 2006-2007 la tasa de incidencia de casos declarados (casos confirmados y sospechosos no confirmados) fue de 1,37 por 100.000 habitantes, y descendió a 1,21 por 100.000 habitantes en 201012,13. Sin embargo, aunque se han observado importantes reducciones en las tasas de hospitalización y mortalidad por esta enfermedad durante los últimos años, su morbimortalidad continúa siendo importante en menores de 5 años14.
Existen diferencias entre las tasas de incidencia en las distintas comunidades autónomas. Durante el periodo 2006-2007, algunas comunidades registraron tasas de incidencia de hasta 4,19 por 100.000 habitantes, y en 2009-2010 algunas alcanzaron tasas de hasta 3,33 por 100.000 habitantes12,13. En la tabla 1, se pueden observar datos de incidencia correspondientes al año 201012.
Incidencia de enfermedad meningocócica por CC. AA. (casos declarados) (año 2010)
| Tasas de incidencia de enfermedad meningocócica por CC. AA. (casos declarados) por 100.000 habitantes. España, 2010 | |
| Andalucía | 1,53 |
| Aragón | 0,70 |
| Asturias | 1,05 |
| Baleares | 1,12 |
| Canarias | 0,77 |
| Cantabria | 3,33 |
| Castilla-La Mancha | 1,31 |
| Castilla y León | 0,82 |
| Cataluña | 1,45 |
| C. Valenciana | 0,84 |
| Extremadura | 1,67 |
| Galicia | 1,85 |
| Madrid | 0,65 |
| Murcia | 0,63 |
| Navarra | 2,12 |
| P. Vasco | 1,51 |
| La Rioja | 0,95 |
| Ceuta | 2,91 |
| Melilla | 0 |
| Total España | 1,21 |
Tomada de Servicio de Vigilancia Epidemiológica. Centro Nacional de Epidemiología. Instituto Carlos III12.
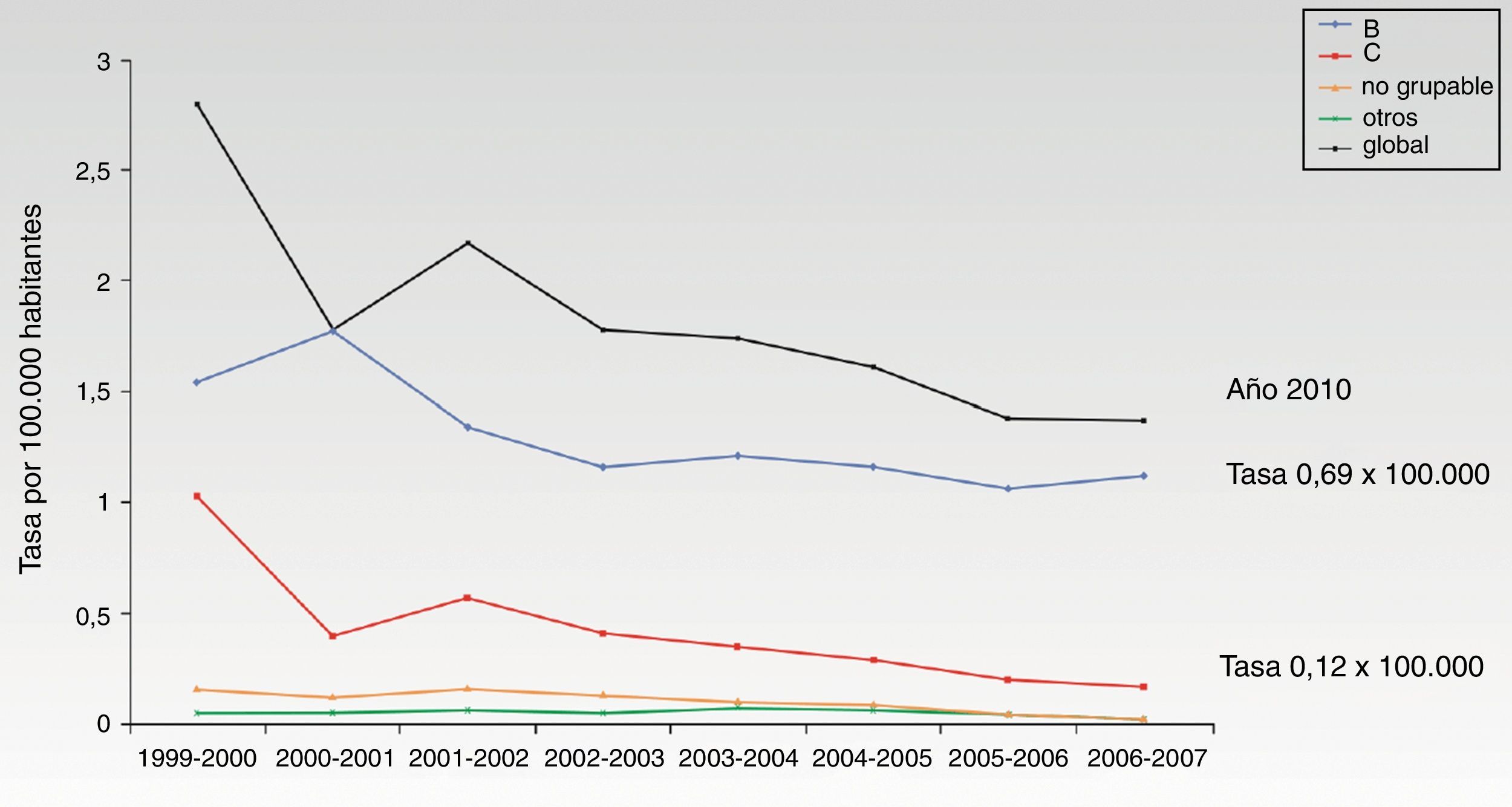
La introducción de la vacuna frente al serogrupo C en el año 2000 ha determinado un cambio importante en la epidemiología de la enfermedad meningocócica en nuestro país, dejando al serogrupo B como el principal responsable de la enfermedad invasiva. Sin embargo, en ausencia de una vacuna efectiva contra el serogrupo B, es difícil modificar o reducir la morbimortalidad por esta enfermedad en nuestro medio. Las tasas de incidencia de casos confirmados durante los últimos años (aproximadamente desde 2006 hasta 2010) han oscilado de 0,17 a 0,12 para el serogrupo C y de 1,12 a 0,69 para el serogrupo B. El descenso del número de casos del serogrupo B que se ha observado, particularmente en el año 2010, es similar al descenso que se ha observado en otros países europeos9. Puede tener su origen en la naturaleza cíclica de la enfermedad2-6 y estar determinado por diversos factores ambientales y conductas asociadas a riesgo2. Esta naturaleza cíclica obliga a mantener una vigilancia estricta que permita generar datos para utilización potencial de vacunas basadas en formulaciones diferentes, así como monitorizar el impacto de las intervenciones con dichas vacunas. Por ejemplo, en la década de 1975-1985 la enfermedad meningocócica en Galicia alcanzó tasas de 30 casos por 100.000 habitantes15. Del resto de serogrupos (A, W135 e Y) se notifican solo de 10 a 30 casos en toda España, según la temporada (incidencias del 0,02 al 0,06 por 100.000 habitantes)12,13.
Consecuencias de la enfermedad meningocócicaSe estima que entre el 10 y el 14% de los casos de enfermedad meningocócica son letales, y entre un 8 y un 20% de los que sobreviven tienen secuelas neurológicas a largo plazo16. Entre las secuelas asociadas a la meningitis bacteriana y septicemia meningocócica se encuentran: pérdida auditiva, amputaciones, complicaciones cutáneas, problemas psicosociales, hidrocefalia, problemas neurológicos y de desarrollo e insuficiencia renal16–19.
Es importante considerar el impacto económico y la carga de hospitalización generada por la enfermedad meningocócica en nuestro país. Un estudio sobre las hospitalizaciones y los fallecimientos relativos a la enfermedad meningocócica, basado en los datos de CMBD entre 1997 y 2008, mostró una incidencia anual de hospitalización de 2,33 por 100.000 habitantes14, con un coste anual asociado de más de 5 millones de euros.
Mecanismo de transmisión y manifestaciones clínicasEstado de portador y transmisión del meningococoLa especie humana es el único reservorio conocido de N. meningitidis, siendo el tracto respiratorio superior la principal fuente de infección. La presencia del meningococo en el tracto respiratorio superior puede ser transitoria, producir colonización y, por lo tanto, crear un estado de portador o desarrollar una enfermedad invasiva16.
La transmisión del meningococo se produce de persona a persona, ya sea a partir de portadores asintomáticos o de enfermos, a través de las secreciones del tracto respiratorio superior16,20. El periodo de incubación es habitualmente de 3 o 4 días, pero puede variar entre 2 y 7 días. Las personas que no desarrollan la enfermedad en los 7 días posteriores a la colonización pueden permanecer como portadores asintomáticos21. Aunque la mayor parte de los estudios de portación asintomática son estudios trasversales, algún estudio con muestras secuenciales de nasofaringe llega a la conclusión de que puede llegar a ser crónica, durar meses, ser intermitente (cepas diferentes colonizando consecutivamente) o simplemente transitoria, durante unos días/semanas22.
La prevalencia de portadores en la población general es muy variable y oscila entre el 0,6 y el 34,4% según varios estudios23–27. La tasa de portadores es superior entre aquellos que viven en áreas confinadas, como guarderías, escuelas, universidades, dormitorios o barracones militares; en las personas expuestas al humo del tabaco de forma activa o pasiva, y en aquellas con enfermedades del tracto respiratorio superior16.
Manifestaciones clínicasEn general, la sepsis y la meningitis son las formas clínicas habituales de la enfermedad meningocócica. Pueden aparecer de forma aislada o presentarse las 2 a la vez en el mismo paciente. La sepsis meningocócica se presenta con fiebre, petequias y erupción maculopapular28. La mayoría de las veces, estas lesiones cutáneas aparecen en las primeras 24 h del inicio de la fiebre28. Un 10-20% de los pacientes puede presentar una sepsis fulminante con púrpura, hipotensión, disfunción miocárdica y, finalmente, fallo multiorgánico en pocas horas, con una elevada mortalidad28.
La meningitis sin sepsis suele presentarse con vómitos, fotofobia, cefalea, rigidez de nuca, alteración variable del nivel de consciencia (desde obnubilación a coma) y, en lactantes, fontanela abombada o rechazo del alimento. En la meningitis aislada no suelen aparecer lesiones cutáneas29.
Es preciso tener presente que, en ocasiones, la sintomatología de la enfermedad meningocócica, tanto la sepsis como la meningitis, es inespecífica en las primeras horas y puede confundirse con un proceso infeccioso de etiología viral17,30.
Excepcionalmente, el meningococo puede ocasionar otras formas clínicas, como artritis, neumonía, endocarditis o pericarditis29.
DiagnósticoEl diagnóstico temprano de la meningococemia es particularmente difícil y requiere un elevado grado de sospecha clínica y una confirmación microbiológica por el laboratorio16,31.
La prueba diagnóstica más sensible es la reacción en cadena de la polimerasa (PCR), cuyo resultado no se ve afectado por tratamiento antibiótico previo. Se utiliza también para la identificación definitiva de genogrupos (serogrupos) y genosubtipos (serosubtipos), siendo la PCR en tiempo real la más usada.
No obstante, el cultivo de la bacteria de un fluido corporal normalmente estéril, como la sangre o el líquido cefalorraquídeo (LCR), o la tinción de Gram del LCR, aún continúan siendo los métodos más ampliamente utilizados en el medio hospitalario, aunque es importante reseñar que la sensibilidad disminuye ostensiblemente si la muestra se obtiene tras haber iniciado tratamiento antibiótico3,16.
Los métodos que no incluyen cultivos, como el uso de kits comerciales para la detección de antígenos polisacáridos en el LCR, se han desarrollado para facilitar y mejorar el diagnóstico del laboratorio. Estos métodos son rápidos y específicos, y pueden proporcionar un diagnóstico preciso del grupo, pero pueden producir con facilidad falsos negativos y presentan reactividad cruzada con otros serogrupos, especialmente en la enfermedad por el serogrupo B3. Por ello, estos métodos no se incluyen generalmente entre los aceptados para confirmar un caso.
El aislamiento de la bacteria en los frotis nasofaríngeos exclusivamente no tiene valor diagnóstico, tan solo indica una colonización, por lo que no se recomienda su utilización para el diagnóstico de la enfermedad invasiva16.
TratamientoLa enfermedad meningocócica es una enfermedad potencialmente fatal y debería ser siempre contemplada como una urgencia médica32. El tratamiento antibiótico precoz es uno de los factores más importantes en el pronóstico de la enfermedad; por tanto, se debe empezar el tratamiento en la misma consulta del centro de salud, antes de derivar al paciente al hospital.
La cefotaxima o la ceftriaxona son los antibióticos de elección hasta disponer del resultado del antibiograma16,32.
Durante la hospitalización tan solo está indicado adoptar precauciones para evitar el contacto directo con las secreciones respiratorias (aislamiento de gotas) que pudieran expelerse durante las primeras 24h del inicio del tratamiento antibiótico.
PrevenciónQuimioprofilaxisExisten 2 tipos de foco de transmisión de la infección: el portador asintomático y el paciente sintomático. Para evitar casos secundarios, se deberá actuar eliminando el estado de portador en aquellos sujetos susceptibles de estar colonizados en su tracto respiratorio superior, como los compañeros de guardería, colegio o domicilio de un afectado31.
El riesgo de contraer la enfermedad a partir de los contactos con un paciente es más alto durante los primeros días de la enfermedad (desde una semana antes del inicio de los síntomas hasta 24 h después de que el afectado haya iniciado el tratamiento antibiótico adecuado)3,16. La tasa de ataque de la enfermedad meningocócica en las personas en contacto estrecho con pacientes se ha calculado entre 400 a 800 veces mayor que la de la población general. En estos casos, el cultivo faríngeo no es útil para decidir quién debe recibir quimioprofilaxis, por lo que no se recomienda33.
La quimioprofilaxis tiene como objetivo reducir el riesgo de adquirir la enfermedad invasiva erradicando el estado de portador en el grupo de contactos. Esta quimioprofilaxis reduce el riesgo de enfermar en los contactos en más de un 80%. Los antibióticos administrados como quimioprofilaxis tienen el objetivo de eliminar el estado de portador nasofaríngeo y deben administrarse lo antes posible, ya que si han pasado más de 14 días desde el inicio de la enfermedad en el caso índice, es posible que la quimioprofilaxis tenga poco o ningún efecto beneficioso3,16.
Entre los antibióticos recomendados y más utilizados en la práctica clínica destacan la rifampicina y el ciprofloxacino. También han mostrado eficacia el ofloxacino, la azitromicina (aunque está en discusión su utilidad por las resistencias observadas) y la ceftriaxona16,31.
Dado que los casos secundarios pueden aparecer varias semanas después del contacto con el caso índice, la vacunación antimeningocócica puede ser un gran apoyo a la quimioprofilaxis cuando un brote es causado por un serogrupo del que se dispone de vacuna33. Sin embargo, no se recomiendan los programas de quimioprofilaxis masiva para el control de grandes brotes de la enfermedad. Diversos factores hacen esta medida poco viable y con pocas probabilidades de éxito, como son las múltiples fuentes de exposición, el prolongado riesgo de exposición, los problemas logísticos y su elevado coste3.
VacunaciónLa estrategia de prevención más efectiva para el control de la enfermedad meningocócica es la vacunación3,34. Para conseguir un óptimo impacto en la prevención de esta enfermedad se requiere incorporar estas vacunas de forma temprana a los calendarios de vacunación infantil4.
Tipos de vacunas meningocócicasVacunas polisacarídicas no conjugadasLas primeras vacunas meningocócicas efectivas basadas en el polisacárido capsular purificado de la bacteria se desarrollaron en los años sesenta frente a los serogrupos A y C, seguidas por vacunas similares para los serogrupos Y y W135 en los años ochenta. Estas vacunas han desempeñado un papel destacado en la prevención de la enfermedad durante décadas, pero tienen limitaciones importantes35: no son inmunógenas en lactantes, no inducen memoria inmunológica y no generan protección de mucosas ni, por tanto, inmunidad de grupo34,36. El desarrollo de vacunas conjugadas frente a estos serogrupos ha representado un paso fundamental para consolidar la protección a largo plazo. Sin embargo, disponer de una vacuna protectora para el serotipo B no ha sido posible siguiendo las estrategias basadas en su polisacárido capsular.
Vacunas conjugadasEn los años noventa se desarrollaron vacunas glucoconjugadas contra el serogrupo C y a partir de 1999 se introdujeron en muchos países europeos (primero Inglaterra y España, y luego progresivamente en el resto), Australia, EE. UU. y Canadá. La conjugación permitió superar las limitaciones de las vacunas polisacarídicas. Las formulaciones glucoconjugadas multivalentes siguieron a las monovalentes del serogrupo C, y en 2005 se aprobó en EE. UU. la primera vacuna glucoconjugada contra los serogrupos A, C, Y y W135. Actualmente, existen 3 vacunas conjugadas tetravalentes para los serogrupos A, C, Y y W135, que se diferencian en la proteína transportadora34,37, si bien en España, por el momento solo 2 de ellas están disponibles, como de prescripción médica y uso hospitalario.
Desde diciembre del 2010 se dispone de una vacuna glucoconjugada monovalente para el serogrupo A, desarrollada para controlar la enfermedad por este serogrupo, que tiene una elevada incidencia en el cinturón africano de la meningitis34,37. Esta vacuna surge de una experiencia novedosa que ha sabido aunar el esfuerzo de organismos internacionales, como la Organización Mundial de la Salud, y la empresa privada, dando como fruto una vacuna que ayudaría a controlar esta enfermedad en una zona donde la escasez y la limitación de recursos dificultan, en gran medida, la solución de grandes problemas de salud, como es el caso de la meningitis por meningococo A.
El uso de vacunas antimeningocócicas conjugadas ha significado un paso decisivo para la prevención de la enfermedad. Quedaría pendiente por el momento el control de la meningitis por el serogrupo B.
Efectividad de las estrategias vacunalesA lo largo del tiempo, diferentes estrategias vacunales han mostrado una buena efectividad para el control de la infección por meningococo. A mediados de los noventa, en Europa hubo un incremento de la incidencia de enfermedad invasiva por el serogrupo C. Tras la introducción de las vacunas conjugadas para este subgrupo en los programas de inmunización sistemática de muchos países europeos, la enfermedad por el serogrupo C se redujo drásticamente y se demostró además su capacidad para producir una inmunidad de grupo. Esta reducción postvacunal del serogrupo C ha sido la causa del predominio actual del serogrupo B9,36,38.
Datos concretos de países europeos, como el Reino Unido, Holanda o España, demuestran este hecho. En el Reino Unido, el uso de la vacuna conjugada contra el meningococo C (introducida en su calendario de vacunación sistemática infantil en 1999 y con catch up [vacunación de rescate] hasta los 18 años) se asoció a una reducción significativa y mantenida de la enfermedad meningocócica invasiva por este serogrupo, con tasas en 2008-2009 de solo 0,02 por 100.000 habitantes (reducción de 955 casos a 13)36,38.
En Holanda, la vacuna conjugada contra el meningococo C se introdujo en el programa de inmunización sistemática en un esquema de una dosis única a la edad de 14 meses en 2002. Además, se realizó una campaña nacional de catch-up en niños de 1-18 años (cobertura de aproximadamente un 94%) con la misma vacuna39.
En el año 2000 se introdujo en los calendarios vacunales de España a los 2, 4 y 6 meses de edad, juntamente con un programa de catch-up en menores de 6 años, ampliado posteriormente a los 18 años, aunque de manera muy heterogénea según las comunidades autónomas y el año de introducción. En lactantes y niños de hasta 9 años de edad, la incidencia de la enfermedad se redujo de 7,04 por 100.000 habitantes (1999-2000) a 1,08 por 100.00036. La efectividad del programa ha sido del 95,2% para lactantes y de un 97,8% para el de catch-up de los menores de 6 años40. La protección de la población ha sido menos pronunciada que en otros países, puesto que la campaña de catch-up se dirigió inicialmente a niños menores de 6 años, no incluyendo a los adolescentes, el grupo de edad en el que las tasas de portadores son más altas40. A los 4 años de la introducción de la vacuna conjugada en España en el calendario vacunal, si bien se observó una efectividad del 94%, se detectó también una pérdida de efectividad de la vacuna en aquellos niños vacunados pero que no recibieron una dosis de refuerzo a los 12 meses de vida40. Este hecho llevó a la modificación de la pauta vacunal inicial, retrasando la administración de la tercera dosis a partir del segundo año de vida40.
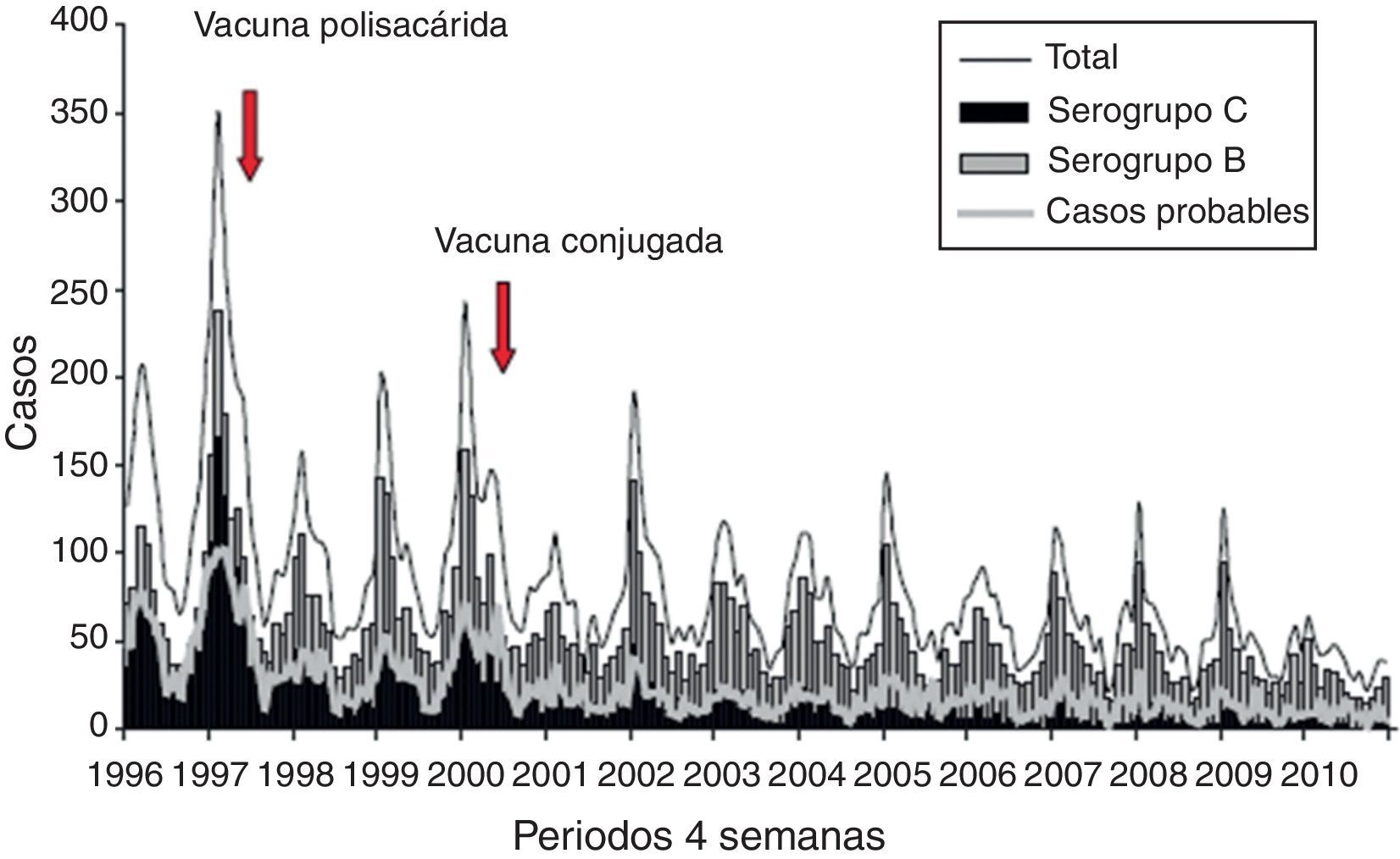
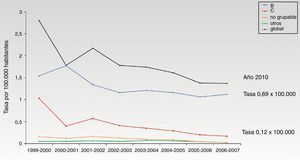
Evolución de los casos de meningitis por serogrupos en España tras la vacunación sistemática frente al serogrupo CTras la introducción de la vacuna conjugada (año 2000) se observa que la infección por el serogrupo C ha disminuido significativamente, mientras que la enfermedad por el serogrupo B no se ha modificado y es actualmente la más frecuente (fig. 1)41. En un periodo de 10 años, se ha producido un descenso del 88% en la tasa de incidencia de la meningitis C (temporada 1999-2000 respecto a 2009-2010)12. Asimismo sucede con datos relativos a hospitalización y muerte, habiéndose producido una reducción muy importante de estas tasas14. No obstante, la reducción global en el número de casos es inferior a la que se observa en el Reino Unido u Holanda9, probablemente a causa de unas bajas coberturas de las campañas de catch-up en adolescentes en algunas comunidades autónomas.
Evolución de los casos de meningitis B y C durante 8 años en España. Adaptada de Cano et al.42.
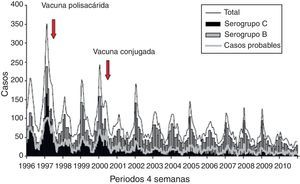
La figura 2 muestra también que la introducción de la vacuna conjugada ha reducido los casos producidos por el serogrupo C, mientras que la enfermedad por el serogrupo B ha presentado cambios menores12.
Enfermedad meningocócica. Casos totales y principales serogrupos. Temporadas 1996-1997 a 2008-2010. Tomada de Servicio de Vigilancia Epidemiológica. Centro Nacional de Epidemiología. Instituto Carlos III12.
El polisacárido capsular del serogrupo B tiene una elevada similitud antigénica con sacáridos del tejido neuronal humano y es poco inmunógeno en humanos. La utilización de polisacáridos del meningococo del serogrupo B para la fabricación de vacunas está limitada por el riesgo teórico de que estas vacunas vencieran la tolerancia inmunológica e indujeran autoinmunidad. Por ello, las estrategias para desarrollar vacunas para el serogrupo B se han centrado principalmente en antígenos no capsulares3,43.
Vacunas de vesículas de membrana externa (tipo outer membrane vesicle)Los primeros intentos de preparar una vacuna contra el serotipo B de N. meningitidis se hicieron con las vesículas de membrana externa Outer Membrane Vehicle (OMV), que contienen varios antígenos inmunogénicos, incluido un lipooligosacárido y la porina A (PorA). Sin embargo, el lipooligosacárido es una endotoxina para el huésped y, aunque se ha tratado de eliminar mediante detergentes, no se consigue del todo, lo que genera mayor reactogenicidad, por lo que ha sido desechado en la composición de estas vacunas. Así, el principal antígeno de este tipo de vacunas es la PorA44.
Aunque las vacunas basadas en OMV evocan una respuesta inmunológica robusta, la PorA es altamente variable en las cepas del serogrupo B45. Por este motivo, las vacunas basadas en este componente producen una respuesta inmunológica específica de la cepa. Además, en el lactante no es suficientemente inmunógena34,44,46.
Las vacunas tipo OMV son las únicas vacunas actualmente disponibles para controlar las epidemias causadas por una cepa hipervirulenta concreta de meningococo B (MenB) y solo proporcionan una protección a corto plazo. Estas vacunas solo son efectivas en epidemias debidas a una cepa que exprese específicamente la PorA contenida en la vacuna. Se han desarrollado vacunas OMV contra el MenB y se han usado en Cuba (de forma sistemática durante 20 años), en Noruega (en ensayos clínicos controlados), en Nueva Zelanda (en una epidemia)47, recientemente en Normandía (Francia)48 y hace años en Brasil49. Este hecho limita su uso en regiones como Norteamérica o Europa, donde la enfermedad por el serogrupo B se debe a una amplia variedad de serosubtipos36,37,44,45,50,51.
Los estudios con vacunas basadas en OMV muestran que una vacuna con múltiples antígenos probablemente cubrirá un mayor número de cepas de N. meningitidis, facilitando una repuesta inmunológica frente a un mayor número de cepas distintas y, por tanto, una mayor protección contra la enfermedad meningocócica44.
En la tabla 2 se muestra un resumen de los estudios realizados con vacunas de tipo OMV52.
Resumen de los estudios realizados con vacunas de tipo OMV
| Lugar | Periodo de estudio | Grupo de edad | Inmunogenicidad de la vacuna (% de individuos con aumento de los anticuerpos bactericidas en suero de 4 veces) |
| Cuba | 1987-1989 | 10-14 años | 83 |
| 1987-1989 | 5 meses-24 años | 83-94 | |
| Chile | 1987-1989 | 1-21 años | 51 |
| Noruega | 1988-1991 | 13-21 años | 57,2 |
| Brasil | 1989-1990 | 3 meses-6 años | 47-74 |
| 1990-1991 | 3 meses-6 años | 0-74 | |
| Chile | 1994 | < 12 meses | Cepa homóloga > 90Cepa heteróloga 0 |
| 2-4 años | Cepa homóloga > 67Cepa heteróloga 31-35 | ||
| 7-30 años | Cepa homóloga > 67Cepa heteróloga 37-60 | ||
| Holanda | 1996 | 2–8 años | 16-100 |
| Nueva Zelanda | 2001-2006 | 6 meses-20 años | 73 |
| 2004-2006 | 6 meses-5años | 80 | |
| 6 meses-3 años | 84,8 | ||
| Francia | 2006-2009 | 2 meses-19 años | Tras 2 dosis 37Tras 2 + dosis en la 6.a semana 88Tras 2 + 1 dosis a los 15 meses 56 |
| Reino Unido | 2009 | Adultos | 8-31 |
| EE. UU. | 2011 | Adultos | 41-81 |
Adaptada de Panatto et al.52.
La considerable diversidad de las proteínas externas de la membrana que causan la enfermedad del serogrupo B, así como variaciones geográficas y posibles variaciones temporales, podrían limitar la utilidad de vacunas no capsulares3. Como se ha visto previamente, el desarrollo de una vacuna frente al subgrupo B se ha basado en diferentes antígenos candidatos, pero, por el momento, con pocos resultados34.
Vacuna rLP2086En la actualidad, se están estudiando vacunas basadas en la proteína de unión al Factor H (Factor H binding protein [fHbp]), de la que hay 2 familias: A y B. Por tanto, según la composición de las vacunas (conteniendo una o las 2 familias de la proteína), estas podrán ser mono o bivalentes. Se ha observado que la vacuna bivalente (en desarrollo por laboratorios Pfizer)53, compuesta por los 2 tipos de fHBP, generó mayor actividad bactericida contra las cepas de MenB que expresaban estos tipos de fHBP que las vacunas monovalentes. El suero inmune de esta vacuna bivalente obtenido de conejos fue testado mediante el ensayo de la actividad bactericida del suero, o serum bactericidal activity (SBA), frente a diversas cepas de MenB, y se neutralizaron 87 de las 100 cepas testadas. El ensayo realizado con suero inmune humano neutralizó 36 de los 45 aislados. El mejor factor predictivo para la neutralización mediante el test de SBA fue el nivel de expresión de fHBP en la superficie in vitro34,54. La vacuna bivalente se encuentra en ensayos clínicos de fase iii.
Vacuna 4 CMenBNovartis Vaccines and Diagnostics ha desarrollado una nueva vacuna contra el serogrupo B, basada en 4 componentes que, por su carácter novedoso y próxima disponibilidad, es objeto de un apartado específico.
Vacuna de 4 componentes frente al meningococo B: nuevo desarrollo vacunal contra el meningococo del serogrupo BVacunología inversaTradicionalmente, las vacunas se han basado en el cultivo de un microorganismo en el laboratorio y en el aislamiento y posible manipulación de sus componentes. Luego se analiza la capacidad que tiene cada antígeno para inducir una respuesta inmunológica. Este método, además de requerir mucho tiempo para la identificación de antígenos válidos para vacunas, no sirve para vacunas contra patógenos que no tienen antígenos inmunodominantes, como los capsulares o las toxinas.
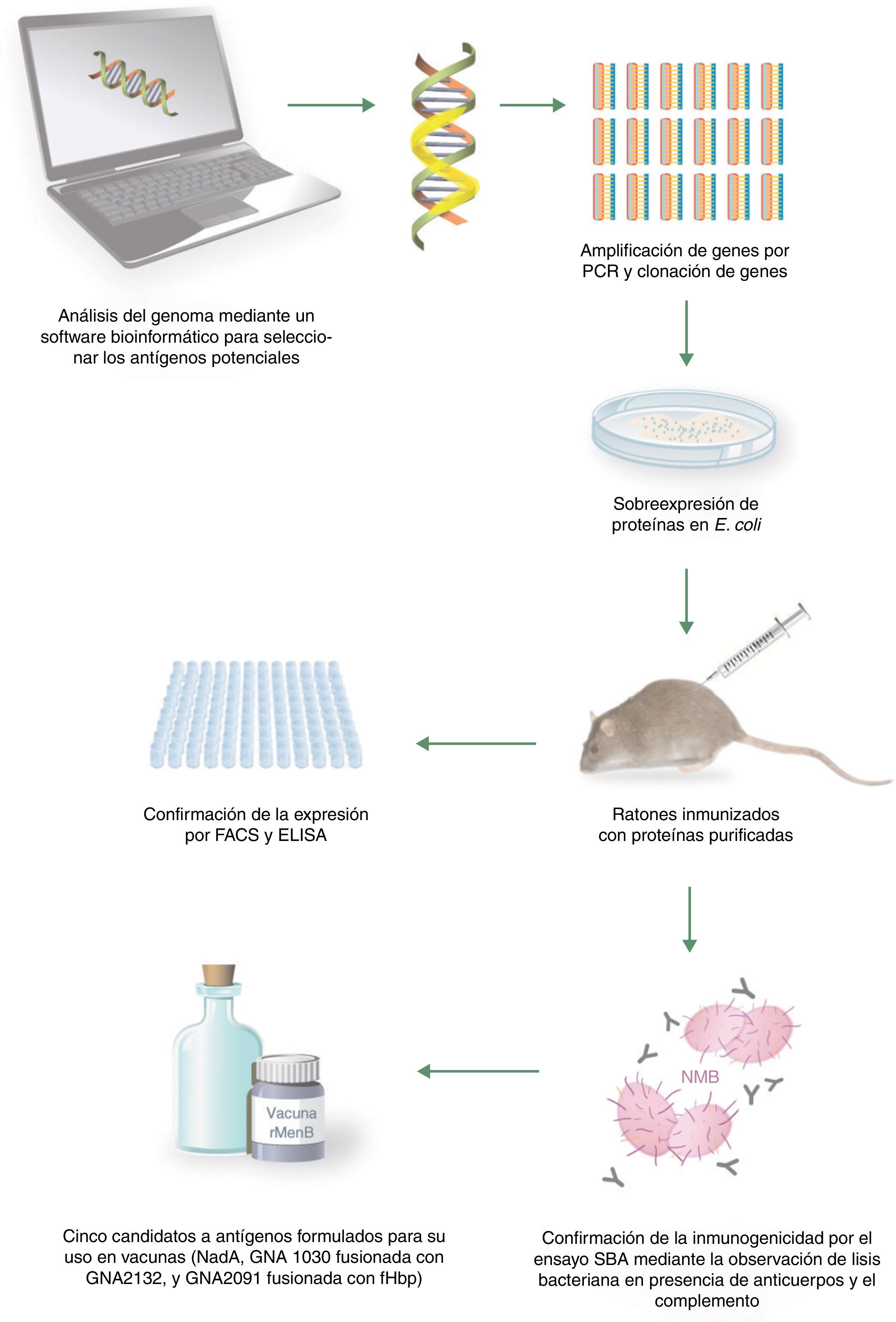
La vacunología inversa parte de la secuencia genómica del microorganismo. Esta secuencia es estudiada mediante un software bioinformático específico que analiza marcos abiertos de lectura (Open Reading Frames [ORF]), es decir, genes conocidos y fragmentos de ADN que potencialmente pueden codificar diferentes tipos de proteínas de expresión de la superficie de la bacteria (aun sin conocer su función, regulación, etc.), estableciendo aquellas regiones que pueden tener ciertas funciones. Así, se consigue predecir los antígenos que tienen más probabilidades de ser candidatos para una vacuna. Tras la selección de estos antígenos, se preparan las vacunas con ellos y se testan en modelos animales, para desarrollar posteriormente la vacuna final55,56.
La técnica de la vacunología inversa tiene la ventaja de que el genoma del microorganismo representa, virtualmente, un listado de todas las proteínas que el patógeno puede expresar en cualquier momento, independientemente de si se expresan in vivo o in vitro. De esta forma, es posible escoger las proteínas que potencialmente se expresan en la superficie, partiendo del genoma en vez del microorganismo55. No obstante, aun con algunas limitaciones (no permite detectar antígenos no proteicos, como los polisacáridos o glucolípidos56,57), ha supuesto un hito de gran impacto en el desarrollo de vacunas proteicas frente a microorganismos complejos.
Diseño de la vacuna de 4 componentes frente al meningococo B mediante vacunología inversaEl meningococo del serogrupo B representa el primer ejemplo de un desarrollo de vacunas exitoso mediante la vacunología inversa56,57. Para preparar la vacuna, primero se realizó un cribado inicial del genoma de una cepa de MenB, que identificó alrededor de 600 ORF. Todos los ORF se amplificaron por PCR y se clonaron en Escherichia coli. En total, se expresaron un total de 350 proteínas recombinantes, que se purificaron y se usaron para inmunizar ratones34,55,58,59.
Tras la inmunización de ratones con estas proteínas, se obtuvo suero que fue analizado mediante diferentes ensayos como el Western blot, para la confirmación de la expresión de las proteínas in vivo y su localización en la membrana externa, y las técnicas enzyme-linked immunosorbent assay (ELISA) y fluorescence-activated cell sorter, para verificar su localización en la superficie. Posteriormente, se analizó la actividad bactericida del suero, para conocer la correlación con la protección en humanos. El análisis de inmunogenicidad identificó 28 antígenos proteicos con capacidad de producir anticuerpos bactericidas en suero34,55,58,59.
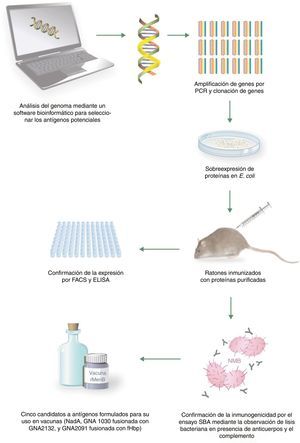
De estos 28 antígenos, algunos estaban muy conservados en un grupo de cepas de MenB y eran reconocidos por el suero de pacientes convalecientes de enfermedad meningocócica. Para priorizar entre los antígenos seleccionados se consideró la capacidad de inducir una amplia protección a través del SBA o la observada por protección pasiva en los ensayos realizados con crías de ratas y ratones. Los 3 antígenos que cumplieron estos criterios fueron antígeno de Neisseria de unión a heparina (Neisserial heparin-binding antigen [NHBA]), o genomme-derived neisserial antigens (GNA2132), GNA1870 o fHbp (proteína de unión al Factor H, Factor H binding protein) y GNA1994 o adhesina A de Neisseria (Neisserial adhesin A [NadA]). Además, también se incluyeron los antígenos GNA1030 y GNA2091 porque indujeron inmunidad protectora en algunos ensayos y se fusionaron con NHBA y fHbp, respectivamente. Sin embargo, ninguno de ellos produjo suficiente respuesta protectora para cubrir todas las cepas probadas. Debido a que la combinación de varios antígenos en una vacuna confiere mejor protección, se combinaron los antígenos principales en una vacuna multicomponente60. La figura 3 (adaptada de Tan et al.7) muestra el proceso de obtención de la vacuna.
Proceso de obtención de la vacuna 4CMenB mediante vacunología inversa. Adaptada de Tan et al.7.
Inicialmente, la vacuna se formuló con 3 componentes y se llamó vacuna recombinante (rMenB), e incluía los antígenos fHbp, NadA y NHBA. Posteriormente, se añadió la OMV de una cepa de Noruega (OMVnw) y se realizaron algunos ensayos con esta combinación (rMenB + OMVnw). Finalmente, se sustituyó la OMVnw por la cepa de Nueva Zelanda, que proporciona más cobertura, dando lugar a la rMenB + OMVnz o también 4CMenB, por sus 4 componentes34.
La vacuna se administra por vía intramuscular con una dosis de 0,5ml. Contiene34,50,61:
- –
50μg de proteína recombinante de fusión NHBA de Neisseria meningitidis B.
- –
50μg de proteína recombinante NadA de Neisseria meningitidis B.
- –
50μg de proteína recombinante de fusión fHbp de Neisseria meningitidis B.
- –
25μg de vesículas de membrana (OMV) de Neisseria meningitidis B cepa NZ98/254, medidas como la cantidad de proteína que contiene el PorA P1.4.
Los componentes NadA, GNA2091-fHbp y NHBA-GNA1030 están absorbidos en 1,5mg de hidróxido de aluminio, 3,25mg de NaCl y 10mM de histidina.
Los antígenos incluidos en la vacuna tienen las siguientes funciones en la bacteria34:
- –
NadA: existen 5 variantes conocidas (Nad1-Nad5). Su función es promover la adhesión e invasión de las células epiteliales del huésped, por lo que puede tener un papel importante en los portadores de la enfermedad. Además, se une a las células dendríticas derivadas de los monocitos y a los macrófagos, lo que puede mejorar la respuesta inmunológica del NadA tras su ingestión y presentación a los linfocitos. Así, la creación de anticuerpos específicos contra esta proteína podría interferir en la colonización y, por tanto, prevenir el estado de portador, aunque se desconoce todavía el impacto real sobre la condición de portador.
- –
fHbp: es una lipoproteína de superficie de N. meningitidis y se clasifica según unos autores en 3 variantes (1-3) y, según otros, en 2 subfamilias (A para las variantes 2 y 3, y B para la variante 1). Esta lipoproteína se une al inhibidor de la vía alternativa al complemento del huésped (Factor H), evadiendo así la acción del complemento y aumentando la supervivencia de la bacteria. In vitro se ha visto que se une también a la enterobactina siderófora de la bacteria. Bloquear esta lipoproteína mejoraría la capacidad de nuestro sistema inmunológico para eliminar el microorganismo.
- –
NHBA: es una lipoproteína de superficie de N. meningitidis, objetivo de proteasas humanas y meningocócicas que, in vitro, se une a la heparina. En ausencia de la cápsula bacteriana, su unión a la heparina mejora la supervivencia de la bacteria en el suero humano y podría facilitar su unión a tejidos del huésped. No obstante, este antígeno es aún poco conocido.
- –
OMVnz: las vesículas OMV proceden de una cepa epidémica de Nueva Zelanda, NZ 98/254 (B:4:P1.7-2,4) y fueron utilizadas para la creación de vacunas para hacer frente a una epidemia en ese país62. Sin embargo, su protección es muy específica, ya que se debe principalmente a su antígeno inmunodominante PorA, que es muy variable. Su inclusión en la vacuna 4CMenB incrementa su inmunogenicidad, además de ofrecer protección para las cepas que expresan el serosubtipo de PorA P1.4.
Para evaluar la inmunogenicidad de cada uno de los componentes proteicos de la vacuna 4CMenB en los estudios clínicos, se utilizan cepas específicas que expresan exclusivamente uno de los antígenos y no los demás contenidos en la vacuna, con el objetivo de analizar de forma independiente la respuesta a cada uno de los 4 componentes. En los ensayos clínicos, las cepas utilizadas son 44/76-SL (respuesta fHbp), NZ98/254 (respuesta PorA), 5/99 (respuesta NadA) y M10713 (respuesta NHBA), aunque esta cepa se identificó más tarde y se analizó solo en los estudios más recientes.
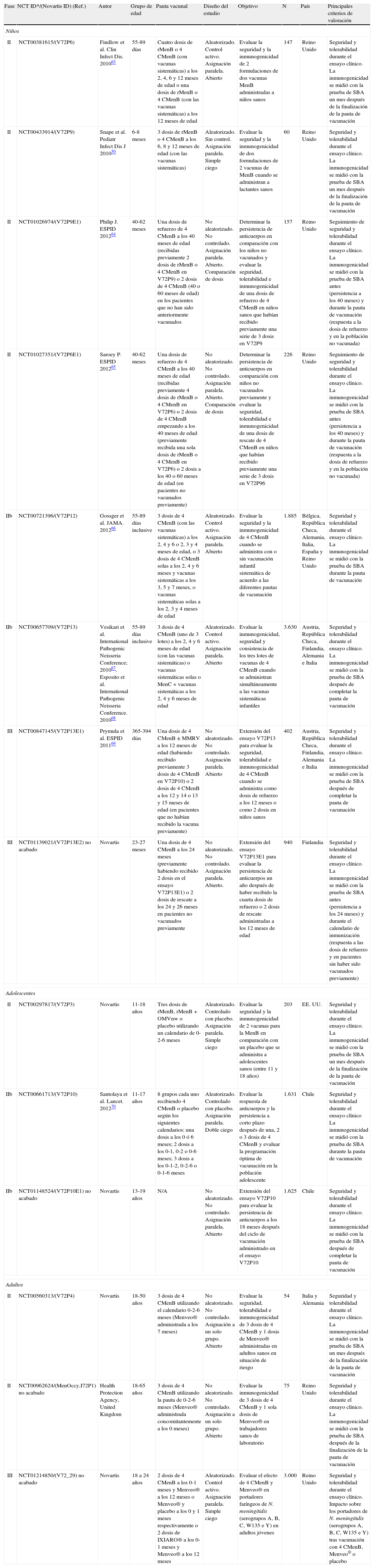
Desarrollo clínico y compatibilidad con otras vacunasA continuación, se muestran 2 tablas (tablas 3 y 4) con la información disponible de los ensayos clínicos realizados con la vacuna 4CMenB y sus principales resultados34.
Resumen general del diseño de los estudios realizados con la vacuna 4CMenB
| Fase | NCT ID*/(Novartis ID) (Ref.) | Autor | Grupo de edad | Pauta vacunal | Diseño del estudio | Objetivo | N | País | Principales criterios de valoración |
| Niños | |||||||||
| II | NCT00381615/(V72P6) | Findlow et al. Clin Infect Dis. 201063 | 55-89 días | Cuatro dosis de rMenB o 4CMenB (con vacunas sistemáticas) a los 2, 4, 6 y 12 meses de edad o una dosis de rMenB o 4CMenB (con las vacunas sistemáticas) a los 12 meses de edad | Aleatorizado. Control activo. Asignación paralela. Abierto | Evaluar la seguridad y la inmunogenicidad de 2 formulaciones de dos vacunas MenB administradas a niños sanos | 147 | Reino Unido | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA un mes después de la finalización de la pauta de vacunación |
| II | NCT00433914/(V72P9) | Snape et al. Pediatr Infect Dis J 201050 | 6-8 meses | 3 dosis de rMenB o 4CMenB a los 6, 8 y 12 meses de edad (con las vacunas sistemáticas) | Aleatorizado. Sin control. Asignación paralela. Simple ciego | Evaluar la seguridad y la inmunogenicidad de dos formulaciones de 2 vacunas de MenB cuando se administran a lactantes sanos | 60 | Reino Unido | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA un mes después de la finalización de la pauta de vacunación |
| II | NCT01026974/(V72P9E1) | Philip J. ESPID 201264 | 40-62 meses | Una dosis de refuerzo de 4CMenB a los 40 meses de edad (recibidas previamente 2 dosis de rMenB o 4CMenB en V72P9) o 2 dosis de 4CMenB (40 o 60 meses de edad) en los pacientes que no han sido anteriormente vacunados | No aleatorizado. No controlado. Asignación paralela. Abierto. Comparación de dosis | Determinar la persistencia de anticuerpos en comparación con los niños no vacunados y evaluar la seguridad, tolerabilidad e inmunogenicidad de una dosis de refuerzo de 4CMenB en niños sanos que habían recibido previamente una serie de 3 dosis en V72P9 | 157 | Reino Unido | Seguimiento de seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA antes (persistencia a los 40 meses) y durante la pauta de vacunación (respuesta a la dosis de refuerzo y en la población no vacunada) |
| II | NCT01027351/(V72P6E1) | Saroey P. ESPID 201265 | 40-62 meses | Una dosis de refuerzo de 4CMenB a los 40 meses de edad (recibidas previamente 4 dosis de rMenB o 4CMenB en V72P6) o 2 dosis de 4CMenB empezando a los 40 meses de edad (previamente recibida una sola dosis de rMenB o 4CMenB en V72P6) o 2 dosis a los 40 o 60 meses de edad (en pacientes no vacunados previamente) | No aleatorizado. No controlado. Asignación paralela. Abierto. Comparación de dosis | Determinar la persistencia de anticuerpos en comparación con niños no vacunados previamente y evaluar la seguridad, tolerabilidad e inmunogenicidad de una dosis de rescate de 4CMenB en niños que habían recibido previamente una serie de 3 dosis en V72P96 | 226 | Reino Unido | Seguimiento de seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA antes (persistencia a los 40 meses) y durante la pauta de vacunación (respuesta a la dosis de refuerzo y en la población no vacunada) |
| IIb | NCT00721396/(V72P12) | Gossger et al. JAMA. 201266 | 55-89 días inclusive | 3 dosis de 4CMenB (con las vacunas sistemáticas) a los 2, 4 y 6 o 2, 3 y 4 meses de edad, o 3 dosis de 4CMenB solas a los 2, 4 y 6 meses y vacunas sistemáticas a los 3, 5 y 7 meses, o vacunas sistemáticas solas a los 2, 3 y 4 meses de edad | Aleatorizado. Control activo. Asignación paralela. Abierto | Evaluar la seguridad y la inmunogenicidad de 4CMenB cuando se administra con o sin vacunación infantil sistemática de acuerdo a las diferentes pautas de vacunación | 1.885 | Bélgica, República Checa, Alemania, Italia, España y Reino Unido | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA durante la pauta de vacunación |
| IIb | NCT00657709/(V72P13) | Vesikari et al. International Pathogenic Neisseria Conference; 201067. Esposito et al. International Pathogenic Neisseria Conference. 201068 | 55-89 días inclusive | 3 dosis de 4CMenB (uno de 3 lotes) a los 2, 4 y 6 meses de edad (con las vacunas sistemáticas) o vacunas sistemáticas solas o MenC + vacunas sistemáticas a los 2, 4 y 6 meses de edad | Aleatorizado. Control activo. Asignación paralela. Abierto | Evaluar la inmunogenicidad, seguridad y consistencia de los tres lotes de vacunas de 4CMenB cuando se administran simultáneamente a las vacunas sistemáticas infantiles | 3.630 | Austria, República Checa, Finlandia, Alemania e Italia | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA después de completar la pauta de vacunación |
| III | NCT00847145/(V72P13E1) | Prymula et al. ESPID 201169 | 365-394 días | Una dosis de 4CMenB ± MMRV a los 12 meses de edad (habiendo recibido previamente 3 dosis de 4CMenB en V72P10) o 2 dosis de 4CMenB a los 12 y 14 o 13 y 15 meses de edad (en pacientes que no habían recibido la vacuna previamente) | No aleatorizado. No controlado. Asignación paralela. Abierto | Extensión del ensayo V72P13 para evaluar la seguridad, tolerabilidad e inmunogenicidad de 4CMenB cuando se administra como dosis de refuerzo a los 12 meses o como 2 dosis en niños sanos | 402 | Austria, República Checa, Finlandia, Alemania e Italia | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA después de completar la pauta de vacunación |
| III | NCT01139021/(V72P13E2) no acabado | Novartis | 23-27 meses | Una dosis de 4CMenB a los 24 meses (previamente habiendo recibido 2 dosis en el ensayo V72P13E1) o 2 dosis de rescate a los 24 y 26 meses en pacientes no vacunados previamente | No aleatorizado. No controlado. Asignación paralela. Abierto. | Extensión del ensayo V72P13E1 para evaluar la persistencia de anticuerpos un año después de haber recibido la cuarta dosis de refuerzo o 2 dosis de rescate administradas a los 12 meses de edad | 940 | Finlandia | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA antes (persistencia a los 24 meses) y durante el calendario de inmunización (respuesta a las dosis de refuerzo y en pacientes sin haber sido vacunados previamente) |
| Adolescentes | |||||||||
| II | NCT00297817/(V72P3) | Novartis | 11-18 años | Tres dosis de rMenB, rMenB + OMVnw o placebo utilizando un calendario de 0-2-6 meses | Aleatorizado. Controlado con placebo. Asignación paralela. Simple ciego | Evaluar la seguridad y la inmunogenicidad de 2 vacunas para la MenB en comparación con un placebo que se administra a adolescentes sanos (entre 11 y 18 años) | 203 | EE. UU. | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA un mes después de la finalización de la pauta de vacunación |
| IIb | NCT00661713/(V72P10) | Santolaya et al. Lancet. 201270 | 11-17 años | 8 grupos cada uno recibiendo 4CMenB o placebo según los siguientes calendarios: una dosis a los 0 ó 6 meses; 2 dosis a los 0-1, 0-2 o 0-6 meses; 3 dosis a los 0-1-2, 0-2-6 o 0-1-6 meses | Aleatorizado. Controlado con placebo. Asignación paralela. Doble ciego | Evaluar la respuesta de anticuerpos y la persistencia a corto plazo después de una, 2 o 3 dosis de 4CMenB y evaluar la programación óptima de vacunación en la población adolescente | 1.631 | Chile | Seguridad y tolerabilidad durante el ensayo clínico La inmunogenicidad se midió con la prueba de SBA durante la pauta de vacunación |
| IIb | NCT01148524/(V72P10E1) no acabado | Novartis | 13-19 años | N/A | No aleatorizado. No controlado. Asignación paralela. Abierto | Extensión del ensayo V72P10 para evaluar la persistencia de anticuerpos a los 18 meses después del ciclo de vacunación administrado en el ensayo V72P10 | 1.625 | Chile | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA después de completar la pauta de vacunación |
| Adultos | |||||||||
| II | NCT00560313/(V72P4) | Novartis | 18-50 años | 3 dosis de 4CMenB utilizando el calendario 0-2-6 meses (Menveo® administrada a los 7 meses) | No aleatorizado. No controlado. Asignación a un solo grupo. Abierto | Evaluar la seguridad, tolerabilidad e inmunogenicidad de 3 dosis de 4CMenB y 1 dosis de Menveo® administradas en adultos sanos en situación de riesgo | 54 | Italia y Alemania | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA un mes después de la finalización de la pauta de vacunación |
| II | NCT00962624/(MenOccy,I72P1) no acabado | Health Protection Agency, United Kingdom | 18-65 años | 3 dosis de 4CMenB utilizando la pauta de 0-2-6 meses (Menveo® administrada concomitantemente a los 0 meses) | No aleatorizado. No controlado. Asignación a un solo grupo. Abierto | Evaluar la inmunogenicidad de 3 dosis de 4CMenB y 1 sola dosis de Menveo® en trabajadores sanos de laboratorio | 75 | Reino Unido | Seguridad y tolerabilidad durante el ensayo clínico. La inmunogenicidad se midió con la prueba de SBA después de la finalización de la pauta de vacunación |
| III | NCT01214850/(V72_29) no acabado | Novartis | 18 a 24 años | 2 dosis de 4CMenB a los 0-1 meses y Menveo® a los 12 meses o Menveo® y placebo a los 0 y 1 meses respectivamente o 2 dosis de IXIARO® a los 0-1 meses y Menveo® a los 12 meses | Aleatorizado. Control activo. Asignación paralela. Simple ciego | Evaluar el efecto de 4CMenB y Menveo® en portadores faríngeos de N. meningitidis (serogrupos A, B, C, W135 e Y) en adultos jóvenes | 3.000 | Reino Unido | Seguridad y tolerabilidad durante el ensayo clínico. Impacto sobre los portadores de N. meningitidis (serogrupos A, B, C, W135 e Y) tras vacunación con 4CMenB, Menveo® o placebo |
Adaptada de Bai et al.34.
Resultados más relevantes de inmunogenicidad y seguridad
| Fase | NCT ID*/(Novartis ID) (Ref.) | Autor (si existe publicación) | Inmunogenicidad | Seguridad | Otros datos |
| Niños | |||||
| II | NCT00381615/(V72P6) | Findlow et al. Clin Infect Dis. 201063 | La vacuna 4CMenB demostró inmunogenicidad frente a un grupo de cepas de MenB cuando se administraba a lactantes sanos a los 2, 4 y 6 meses, siendo superior a la producida por rMenB. La dosis de refuerzo administrada a los 12 meses produjo respuesta memoria. Estos datos muestran que la protección de esta vacuna es superior a la de las vacunas monovalentes en lactantes | Las vacunas rMenB y 4CMenB fueron generalmente bien toleradas, con un perfil de reactogenicidad similar, aunque 4CMenB se asoció a un mayor número de reacciones locales con induración y dolor y reacciones locales más importantes. Las reacciones sistémicas fueron comparables entre las 2 vacunas estudiadas. Hubo una minoría de participantes con fiebre, siendo más común en el grupo de 4CMenB. En general, la reactogenicidad de las vacunas del estudio fue similar a la de las vacunas sistemáticas | |
| II | NCT00433914/(V72P9) | Snape et al. Pediatr Infect Dis J. 201050 | La vacuna 4CMenB induce respuesta inmunológica en lactantes frente a 6 cepas de MenB, por lo que tiene potencial para ofrecer una más amplia protección frente a MenB que las vacunas monovalentes OMV existentes | Ambas vacunas fueron bien toleradas y las tasas de reacciones fueron comparables en los 2 grupos. Aunque se produjo algún caso de reacciones adversas severas, no se relacionó con las vacunas en estudio | |
| II | NCT01026974/(V72P9E1) | Philip. ESPID 201264 | Se produce una disminución de anticuerpos bactericidas a lo largo del tiempo después de la primovacunación con rMenB o 4CMenB, pero con memoria inmunológica tras la dosis de refuerzo. La dosis de refuerzo de 4CMenB puede ser necesaria para mantener la protección inmunológica durante la infancia y adolescencia | No estudiada | |
| II | NCT01027351/(V72P6E1) | Saroey. ESPID 201265 | Se produce una reducción de anticuerpos bactericidas después de la vacunación infantil con rMenB o 4CMenB, pero con memoria inmunológica tras la dosis de refuerzo. Las dosis de refuerzo de 4CMenB pueden ser necesarias para mantener la protección inmunológica durante la infancia y adolescencia | No estudiada | |
| IIb | NCT00721396/(V72P12) | Gossger et al. JAMA. 201266 | La vacuna 4CMenB es inmunogénica frente a 3 cepas de referencia cuando se administra con las vacunas sistemáticas (vacuna combinada de difteria, tétanos, hepatitis B, pertussis, polio inactivada, Haemophilus influenzae tipo b, vacuna heptavalente conjugada neumocócica) a los 2, 4 y 6 meses o a los 2, 3 y 4 meses de edad, produciendo una mínima interferencia con la respuesta de las vacunas sistemáticas | La vacuna 4CMenB tiene un perfil reactogénico comparable a las vacunas sistemáticas (vacuna combinada de difteria, tétanos, hepatitis B, pertussis, polio inactivada, Haemophilus influenzae tipo b, vacuna heptavalente conjugada neumocócica) cuando se administra sola. Aun así, los participantes que recibieron 4CMenB y las vacunas sistemáticas mostraron una reactogenicidad algo incrementada en comparación con los que recibieron las vacunas sistemáticas solas. La mayoría de los niños del estudio tuvieron fiebre tras la primera y segunda dosis de 4CMenB concomitante con las vacunas sistemáticas. Cuando 4CMenB se administra sola, la tasa y magnitud de la fiebre es comparable a la de otras vacunas pediátricas | La administración de 4CMenB concomitantemente a las vacunas sistemáticas (vacuna combinada de difteria, tétanos, hepatitis B, pertussis, polio inactivada, Haemophilus influenzae tipo b, vacuna heptavalente conjugada neumocócica) no afecta a la inmunogenicidad de estas vacunas |
| IIb | NCT00657709/(V72P13) | Vesikari et al. International Pathogenic Neisseria Conference; 201067. Esposito et al. International Pathogenic Neisseria Conference. 201068 | La administración de 4CMenB junto a las vacunas sistemáticas (vacuna combinada de difteria, tétanos, pertusis acelular, polio inactivada, hepatitis B y Haemophilus influenzae tipo B, vacuna heptavalente conjugada neumocócica), a los 2,4 y 6 meses proporcionó una buena respuesta inmunogénica para las 3 cepas de MenB utilizadas, y no afectó a la respuesta inmunológica de las otras vacunas (con excepción de la polio 2 | Los 3 lotes de 4CMenB estudiados tuvieron un perfil de seguridad aceptable cuando fueron administrados junto a la vacunación sistemática. El perfil de reactogenicidad tiene un patrón típico con un pico a las 6 h y una reducción marcada en el día 2 posvacunación. La mayor parte de reacciones fueron transitorias y mayoritariamente de leves a moderadas, tanto de forma local como sistémicas, y muy pocos sujetos (≤ 1%) abandonaron el estudio por estas causas. Los participantes que recibieron 4CMenB y las vacunas sistemáticas mostraron evidencia de una reactogenicidad incrementada comparado con los que recibieron las vacunas sistemáticas solas o los que recibieron MenC y vacunas sistemáticas | Se obtuvo consistencia entre los 3 lotes de 4CMenB estudiados |
| III | NCT00847145/(V72P13E1) | Prymula et al. ESPID 201169 | En este estudio se demostró que dos dosis de 4CMenB administradas con 2 meses de diferencia proporcionaban respuesta inmunológica suficiente contra 3 cepas de referencia, independientemente de la administración concomitante a las otras vacunas sistemáticas | El impacto en la reactogenicidad fue mínimo, lo que facilitó la vacunación con 4CMenB en niños junto a las pautas de vacunación vigentes | La administración de la vacuna del sarampión, parotiditis, rubéola y varicela juntamente con 4CMenB, cuando esta se administra en 2 dosis separadas 2 meses, no afecta a la respuesta inmunológica de 4CMenB |
| Adolescentes | |||||
| IIb | NCT00661713/(V72P10) | Santolaya et al. Lancet. 201270 | Tras una dosis de 4CMenB, se produjeron títulos de hSBA protectores en más de un 90% de vacunados, alcanzando casi un 100% tras 2 dosis (separadas 1, 2 o 6 meses). La tercera dosis no produjo un beneficio inmunológico adicional | La reactogenicidad fue mayor después de la administración de 4CMenB que en placebo, con reacciones locales y sistémicas leves o moderadas. La reactogenicidad fue similar después de cada inyección de 4CMenB y no aumentó con las dosis posteriores. La reacción más descrita fue el dolor en el lugar de la inyección, de tipo transitorio. La tasa de fiebre superior a 38°C fue baja y raramente superior a 39°C. No se registró ningún acontecimiento adverso grave relacionado con la vacuna y no se identificaron problemas importantes de seguridad | |
Adaptada de Bai et al.34.
El desarrollo clínico de la vacuna muestra que es segura e inmunógena tanto en niños como en adultos, genera memoria inmunológica y es compatible con las vacunas de uso sistemático. Con respecto a la seguridad, en lactantes y niños menores de 2 años, las reacciones adversas locales y sistémicas más comúnmente observadas fueron el dolor agudo a la presión y eritema en el lugar de inyección, fiebre e irritabilidad. En los estudios clínicos en lactantes, la fiebre aparecía más frecuentemente cuando 4CMenB se coadministraba con las vacunas sistemáticas que cuando se administraba sola. Cuando 4CMenB se administró sola la frecuencia de aparición de fiebre fue similar a la asociada con las vacunas sistemáticas administradas durante los ensayos clínicos. Cuando apareció la fiebre, normalmente siguió un patrón predecible y autolimitado (inicio a las 6 h, pico al segundo día, cese al tercer día), clínicamente poco significativo, y se puede prevenir con la administración profiláctica de paracetamol.
Cobertura vacunal (Meningococcal Antigen Typing System)Para evaluar el impacto potencial de la vacuna 4CMenB es necesario:
- –
Demostrar su inmunogenicidad mediante el ensayo de SBA con el complemento humano (hSBA) y calcular la tasa de protección a partir de los marcadores de protección subrogada aceptados.
- –
Calcular la cobertura de las cepas (proporción de cepas circulantes causantes de enfermedad en una región o país que son lisadas potencialmente por un suero inmune producido por la vacuna). El potencial de una vacuna frente al serogrupo B radica en este cálculo.
Hasta ahora, la eficacia de las vacunas frente a una enfermedad como esta, de baja incidencia, que impide realizar ensayos clínicos de eficacia por la necesidad de un gran número de participantes, ha sido asumida a través de parámetros subrogados de protección y, en el caso de la enfermedad meningocócica, a través de los resultados obtenidos en ensayos de SBA. Sin embargo, los ensayos de SBA han sido utilizados para demostrar la inmunogenicidad de esta nueva vacuna frente al serogrupo B, enfrentando los sueros de individuos inmunizados con las 4 cepas de las que se habían obtenido los diferentes antígenos incluidos en la formulación vacunal60. Ahora bien, la realización de ensayos clínicos para medir la eficacia protectora en general, tal y como se ha hecho con vacunas de polisacárido conjugado, no es viable. En el caso de la evaluación de vacunas de polisacárido, el antígeno es común a todas las cepas de ese serogrupo, por lo que los sueros son enfrentados a una única cepa que expresa ese antígeno. En el caso de la vacuna de 4 componentes frente al serogrupo B, habría que enfrentar cada suero a cientos de cepas que expresaran todas o la gran mayoría de variantes antigénicas posibles, lo que, sin duda, es inviable.
El Meningococcal Antigen Typing System (MATS) es un método estandarizado y reproducible, que se ha desarrollado para evaluar la cobertura potencial de la vacuna 4CMenB contra cepas individuales de meningococo, por el que se obtiene el porcentaje de muestras de meningococo que son susceptibles de ser neutralizadas por los anticuerpos inducidos por la vacuna71, aunque podría utilizarse para otras vacunas.
El MATS combina un enzimoinmunoensayo (ELISA) específico frente a cada uno de los antígenos vacunales, detectando diferencias cualitativas y cuantitativas en la expresión de dichos antígenos; se mide, pues, tanto la reactividad cruzada inmunológica como la cantidad de antígenos NHBA, NadA y fHbp expresados. Adicionalmente, se incluye la información del subtipo de PorA para incluir la cobertura potencial también con este antígeno. Los resultados obtenidos con el ELISA se han correlacionado con la lisis de las cepas en el ensayo de SBA, y se ha observado que los aislados que superan un valor de umbral (Positive Bacteridal Treshold en inglés [PBT]) en la prueba ELISA para cualquiera de los 3 antígenos de la vacuna tienen ≥ 80% de probabilidad de ser neutralizados por el suero inmune en el ensayo de SBA. Aquellas cepas que resultan positivas para 2 o más antígenos tienen una mayor probabilidad (96%) de ser lisadas en presencia de sueros de individuos inmunizados. El ensayo de MATS permite analizar grandes paneles de cepas y predecir la cobertura potencial de la vacuna.
Así pues, la cobertura vacunal de cepas se define como la proporción de las cepas circulantes que superan el PBT para, al menos, un antígeno de la vacuna (NadA, NHBA o fHbp) en el MATS o que se corresponden con el serosubtipo de la PorA del componente OMV de la vacuna (P1.4).
El MATS permite monitorizar posibles cambios de la población de MenB endémica en el tiempo, monitorizar la distribución de los antígenos vacunales entre aislados de MenB de portadores o enfermos tras la introducción de la vacuna y detectar la posible emergencia de variantes resistentes a la vacuna71,72. En un estudio realizado con un panel de 1.052 cepas de MenB de 5 países europeos (EU5: Alemania, Francia, Inglaterra y Gales, Italia y Noruega), el MATS ha permitido predecir que un 73-87% serían cubiertas por 4 CMenB73. Los datos obtenidos en un estudio similar en España74 muestran una cobertura potencial del 69%, solo ligeramente inferior a la observada en el estudio EU5. Esta diferencia puede estar relacionada con una distribución diferente de las líneas clonales de meningococo asociadas a casos clínicos en España.
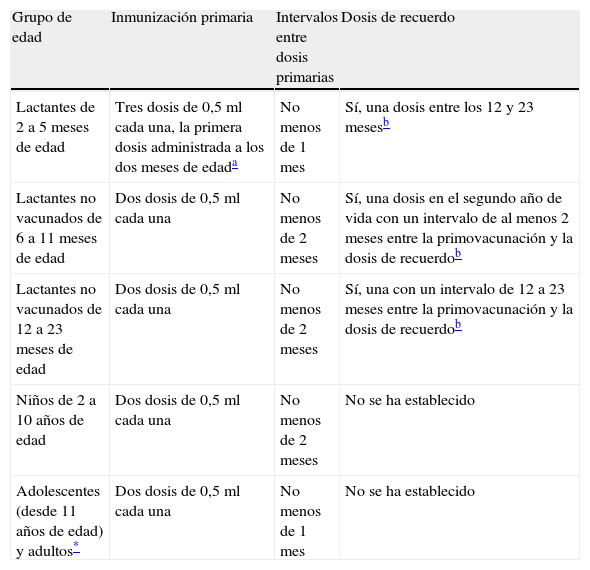
Estrategia de vacunación recomendada: indicaciones propuestas a la Agencia Europea del MedicamentoLa tabla 5 recoge las indicaciones propuestas a la Agencia Europea del Medicamento.
Indicaciones
| Grupo de edad | Inmunización primaria | Intervalos entre dosis primarias | Dosis de recuerdo |
| Lactantes de 2 a 5 meses de edad | Tres dosis de 0,5 ml cada una, la primera dosis administrada a los dos meses de edada | No menos de 1 mes | Sí, una dosis entre los 12 y 23 mesesb |
| Lactantes no vacunados de 6 a 11 meses de edad | Dos dosis de 0,5 ml cada una | No menos de 2 meses | Sí, una dosis en el segundo año de vida con un intervalo de al menos 2 meses entre la primovacunación y la dosis de recuerdob |
| Lactantes no vacunados de 12 a 23 meses de edad | Dos dosis de 0,5 ml cada una | No menos de 2 meses | Sí, una con un intervalo de 12 a 23 meses entre la primovacunación y la dosis de recuerdob |
| Niños de 2 a 10 años de edad | Dos dosis de 0,5 ml cada una | No menos de 2 meses | No se ha establecido |
| Adolescentes (desde 11 años de edad) y adultos* | Dos dosis de 0,5 ml cada una | No menos de 1 mes | No se ha establecido |
Las principales conclusiones del grupo de trabajo sobre la vacuna 4CMenB del documento de consenso son las siguientes:
- –
La vacuna 4CMenB es inmunógena y segura en lactantes, niños, adolescentes y adultos, e induce memoria inmunológica.
- –
La vacuna 4CMenB tiene una reactogenicidad sistémica (incidencia de fiebre) mayor que las vacunas sistemáticas cuando se coadministra con ellas (aunque similar a las vacunas sistemáticas cuando se administra sola) y el patrón de fiebre es predecible y autolimitado.
- –
La vacuna 4CMenB es compatible con las demás vacunas incluidas en el calendario sistemático español, pudiendo administrarse simultáneamente con las vacunas hexavalente y pentavalente actualmente disponibles, así como con la vacuna antineumocócica conjugada heptavalente.
- –
La cobertura potencial de la nueva vacuna 4CMenB se estima que está entre el 70-80% de las cepas circulantes en Europa.
- –
La vacuna 4CMenB, en el momento actual, es la única estrategia disponible para prevenir la enfermedad meningocócica por el serogrupo B.
Barranco D y Gorrotxategi Gorrotxategi P declaran no tener ningún conflicto de intereses.
Gil A declara haber participado en proyectos docentes y de investigación financiados por los laboratorios Sanofi, Pfizer, Crucell, GSK y Novartis.
Batalla J ha recibido honorarios del laboratorio Novaris por participar como docente en una sesión de meningitis B.
Bayas JM ha recibido honorarios profesionales por conferencias, asesoramiento y participación en grupos de trabajo financiados por GSK, Sanofi Pasteur MSD, Esteve, Novartis y Pfizer. Además, ha sido investigador principal en ensayos clínicos promovidos por GSK y Sanofi Pasteur MSD.
Campins M declara haber participado en proyectos docentes y de investigación financiados por los laboratorios Sanofi, Pfizer, Crucell, GSK y Novartis.
Lluch J declara haber participado en proyectos docentes y de investigación financiados por los laboratorios Sanofi, Pfizer, Crucell, GSK y Novartis.
Martinon-Torres F desarrolla su actividad investigadora gracias a la financiación del Instituto de Salud Carlos III (Intensificación de la actividad investigadora y FIS PI1000540) del plan nacional de I+D+I y fondos FEDER.
Mellado MJ ha recibido financiación para la realización de Cursos de actualización en Vacunas de GSK en 2006-2007, para la realización Curso de Vacunas de la Asociación Española de Pediatría financiado por Sanofi Pasteur MSD y para la participación en el Foro de vacunación Pediátrico de Rotavirus y varicela 2011.
Moreno-Pérez D ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de ClaxoSmithKline y como consultor en Advisory Board de Pfizer y Astra-Zeneca.
Uriel B ha participado en asesorías para Novartis.
Vázquez JA declara que el laboratorio que dirige ha recibido y recibe fondos y ayuda para investigación de Baxter, Novartis, Pfizer, Sanofi-Pasteur, GSK y Laboratorios Esteve a través de diferentes Convenios de colaboración.
ColaboraciónEl presente trabajo ha sido realizado con la colaboración del laboratorio Novartis Vaccines and Diagnostics.
Este documento está avalado por las siguientes sociedades científicas: Asociación Española de Pediatría (AEP), Asociación Española de Pediatría de Atención Primaria (AEPap), Sociedad Española de Infectología pediátrica (SEIP) y Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH).