En 2009, 2 casos de convulsiones en adolescentes tras la administración de la vacuna tetravalente frente al virus del papiloma humano (VPH) generaron impacto mediático y afectaron negativamente la confianza del público en esta vacuna.
Nuestros objetivos fueron describir las sospechas de reacciones adversas (SRA) notificadas al Centro Autonómico de Farmacovigilancia de la Comunidad Valenciana (CAFCV) tras la administración de la vacuna frente al VPH y comparar la tasa de notificación de síncope y convulsiones de esta vacuna con la de otras vacunas administradas en adolescentes.
Material y métodosEstudio descriptivo de las notificaciones de SRA relacionadas con esta vacuna recibidas por el CAFCV entre 2007 y 2011.
ResultadosLas manifestaciones clínicas más comunicadas fueron mareos, cefalea y síncope.
Las tasas de notificación de síncope o pérdida de conciencia y convulsiones con la vacuna frente al VPH fueron de 17 y 3,2 por 100.000 dosis administradas, respectivamente, y de 15 y 1,6 para síncope o pérdida de conciencia y convulsiones sincopales ocurridas el día de la vacunación. Las tasas de notificación de síncope o pérdida de conciencia y convulsiones fueron de 6,4 y 0,4 para otras vacunas.
ConclusionesLas tasas de notificación de síncope o pérdida de conciencia y convulsiones fueron mayores para la vacuna frente al VPH que para otras vacunas administradas en adolescentes; esto es consistente con la atención mediática originada por la vacuna y con hallazgos de estudios previos. No obstante, la información obtenida sobre las SRA a la vacuna sugiere un buen perfil de seguridad.
In 2009, two cases of seizures in adolescents following quadrivalent human papillomavirus vaccine (qHPV) administration, generated important media attention, and adversely affected public trust in this vaccine. Our objectives were to describe suspected adverse reactions (SARs) reported to the Pharmacovigilance Centre in the Valencian Community (PCVC) after administration of HPV vaccine, and to compare reporting rates of syncope and seizures following this vaccine with those of other vaccines administered to girls aged 13-15years.
Material and methodsDescriptive study of SARs reported following this vaccine to the PCVC between 2007 and 2011.
ResultsThe clinical symptoms most frequently reported were dizziness, headache, and syncope.
Reporting rates of syncope or loss of consciousness and seizures with qHPV vaccine were 17 and 3.2 per 100,000 doses administered, respectively, and 15 and 1.6 for syncope or loss of consciousness and syncopal seizures occurred on the day of vaccination. The reporting rates of syncope or loss of consciousness and seizures were 6.4 and 0.4, for the other vaccines.
ConclusionsConsistent with the media attention generated, and with results from other studies, the reporting rates of syncope or loss of consciousness and seizures were higher for the HPV vaccine than for other vaccines given in adolescence. Nevertheless, the overall information obtained on SARs following the qHPV vaccine suggests a good safety profile.
La vacuna frente al virus del papiloma humano (VPH) está indicada para la prevención de cáncer cervical y otras lesiones precancerosas del tracto genital de la mujer1. Existen 2 vacunas autorizadas: Cervarix®, vacuna bivalente que incluye los genotipos VPH16 y 18, y Gardasil®, vacuna tetravalente con los genotipos VPH6, 11, 16 y 182. En los ensayos clínicos previos a su autorización ambas vacunas demostraron su eficacia en la prevención de lesiones precancerosas y también su seguridad, y los efectos adversos más frecuentemente descritos fueron dolor, enrojecimiento e inflamación en el sitio de la inyección, cefalea, mialgia y cansancio3–6. Tras la administración de aproximadamente 56 millones de dosis, el sistema de vigilancia pasiva de Estados Unidos, Vaccine Adverse Events Reporting System (VAERS), recibió un total de 21.194 notificaciones relacionadas con la vacuna tetravalente frente al VPH, siendo los episodios adversos más comunicados síncope, mareo, náuseas, cefalea, fiebre, urticaria y reacciones locales en el sitio de la inmunización (dolor, enrojecimiento e hinchazón)7. La administración de la vacuna tetravalente ha sido también relacionada con una respuesta psicógena masiva en adolescentes8, como ocurre con otras vacunas9, cuyos síntomas incluyen mareo, síncope y molestias neurológicas en los que no ha sido determinada ninguna etiología orgánica como posible explicación.
Con respecto a la vacuna bivalente, tras la administración de 558.226 dosis se notificaron 647 episodios adversos al National Institute for Public Health and the Environment (RIVM) en los Países Bajos, y los episodios adversos notificados con mayor frecuencia fueron reacciones locales, síntomas generales en la piel, síncope y presíncope10.
Ambas vacunas comenzaron a comercializarse en España en septiembre de 200711. En la Comunidad Valenciana fue incluida en el calendario oficial de vacunación en octubre de 2008 para su administración en niñas de 14años12, en colegios o en centros de salud. En febrero de 2009, la notificación de cuadros convulsivos tras la administración de la segunda dosis de la vacuna tetravalente en 2niñas con una proximidad geográfica y temporal muy estrecha estuvo acompañada de un gran impacto mediático13. Como consecuencia inmediata a los cuadros convulsivos, en España se suspendió temporalmente la administración del lote de la vacuna relacionada con los episodios, y en la Comunidad Valenciana estas vacunas pasaron a administrarse exclusivamente en centros de salud14,15. Tanto la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) como la Agencia Europea del Medicamento (EMA) evaluaron ambos casos y determinaron que no tenían relación causal con la vacuna15,16. La EMA además concluyó que los beneficios de la vacuna seguían siendo superiores a los riesgos y aconsejó reforzar la información relacionada con la posible aparición de síncopes acompañados en ocasiones de movimientos tónico-clónicos que semejan convulsiones como efecto secundario inmediato a la vacunación16. Por otra parte, en un estudio realizado por el Centro para la Prevención y Control de Enfermedades de Estados Unidos (CDC) se determinó que no existía incremento en el riesgo de síncope tras la administración de la vacuna tetravalente frente al VPH cuando se comparaba con el riesgo de síncopes tras otras vacunas que se administran en la adolescencia17.
A pesar del esfuerzo informativo realizado por las autoridades sanitarias, la cobertura de vacunación sigue siendo menor de la esperada. En España en el año 2011 la cobertura de la vacuna fue del 65%, siendo del 58% en la Comunidad Valenciana18, aunque esta cobertura se ha recuperado en parte para la cohorte de niñas nacidas en 1995, 1996 y 1997 que fueron vacunadas en los años 2009, 2010 y 201114.
La vigilancia pasiva en España se realiza a través del Programa de notificación espontánea de sospecha de reacciones adversas (SRA) a medicamentos incluido en el Sistema Español de Farmacovigilancia (SEFV). Estas sospechas son comunicadas por los profesionales sanitarios a través del formulario conocido como «tarjeta amarilla». Además, la Comunidad Valenciana cuenta con el Registro Nominal de Vacunas (RVN)19, un sistema de información en el que se registran los actos vacunales realizados en los centros públicos, y en parte de los privados, que también permite notificar de manera telemática las SRA a vacunas al Centro Autonómico de Farmacovigilancia de la Comunidad Valenciana (CAFCV).
Los objetivos de este estudio han sido describir las SRA notificadas al CAFCV relacionadas con la vacuna frente al VPH y comparar la tasa de notificación de síncopes y convulsiones para esta vacuna con la tasa de notificación para el resto de vacunas que se administran en niñas de entre 13 y 15años.
Material y métodosEstudio descriptivo y retrospectivo realizado a partir de las notificaciones de SRA relacionadas con la administración de la vacuna frente al VPH, realizadas por profesionales sanitarios al CAFCV entre septiembre de 2007 y diciembre de 2011.
Fueron incluidas en el estudio las notificaciones en niñas de entre 13 y 15años de edad que contenían la información mínima para poder ser procesadas de acuerdo con los criterios del SEFV20.
Las tasas de notificación de síncope, presíncope y convulsiones para la vacuna frente al VPH y para el resto de vacunas administradas en niñas de entre 13 y 15años de edad (vacuna conjugada frente a meningococoC, toxoide tetánico, varicela o tétano difteria [Td]) se calcularon dividiendo el número de notificaciones de cada manifestación clínica entre el número de dosis registradas en el RVN; los intervalos de confianza al 95% (IC95%) se calcularon por el método exacto.
Tras agrupar las notificaciones de SRA por manifestaciones clínicas, se realizó un análisis descriptivo de las variables utilizando el paquete estadístico SPSS 19.0.
ResultadosEl CAFCV recibió un total de 200 notificaciones de SRA, todas relacionadas con la vacuna tetravalente frente al VPH, que era la que se administraba en esta comunidad autónoma durante el periodo de estudio. De estas, fueron incluidas en el estudio 194 notificaciones, ya que 6 (3%) carecían de la fecha de administración de la vacuna, información imprescindible para establecer una relación temporal con las manifestaciones clínicas notificadas. Durante el mismo periodo fueron registradas como administradas en el RVN 187.385 dosis de vacuna tetravalente, por lo que estas 194 notificaciones representaron una tasa de notificación de 103 (IC95%: 89-118) por 100.000 dosis administradas.
Descripción de las notificaciones analizadasDe las 194 notificaciones incluidas, 4 (2%) correspondían a niñas de 13años, 158 (81%) a niñas de 14años y 32 (16,5%) a niñas de 15años.
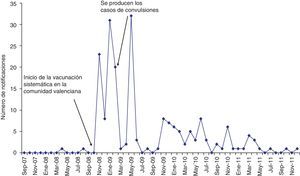
Fueron notificadas 33 (17%) en 2008, 106 (55%) en 2009, 42 (21,6%) en 2010 y 13 (6,7%) en 2011. En el año 2007 (septiembre-diciembre) no fue notificada ninguna sospecha. El número de notificaciones por mes se incrementó tras el inicio de la vacunación sistemática, pasando de ninguna en octubre de 2008 a 23 el mes siguiente. Los otros 2 picos en el número de notificaciones coincidieron con la administración de la segunda y tercera dosis de la primera cohorte de niñas vacunadas (fig. 1).
Del total de notificaciones, 149 (77%) referían únicamente manifestaciones clínicas sistémicas y 22 (11%) únicamente locales. En las 23 (12%) restantes se describían ambos tipos de manifestaciones. El 32% de las notificaciones fueron clasificadas como graves por el personal del CAFCV siguiendo el criterio utilizado por el SEFV20.
Las 194 notificaciones incluían 433 reacciones adversas, con un promedio de 2,2 manifestaciones por notificación y un rango de 1 a 14. Las manifestaciones clínicas comunicadas con mayor frecuencia fueron mareos (n=52; 27%), cefalea (n=44; 23%), síncope o pérdida de conciencia (n=38; 20%) y fiebre (n=32; 17%). Aunque con menos frecuencia, también fueron notificados dolor en el lugar de la inyección (n=19; 10%), arcadas (n=15; 8%), vómitos, palidez, malestar general (n=12; n=11 y n=11, respectivamente; 6%), somnolencia (n=10; 5%), presíncope (n=8; 4%) y convulsiones (n=6; 3%).
El síncope o pérdida de conciencia fue comunicado en 38 de las notificaciones (20%). En 6casos iba acompañado de convulsiones, por lo que fueron descritas por separado. En las 32 restantes, 14 comunicaban únicamente síncope o pérdida de conciencia, y en las otras 18, las manifestaciones clínicas más comunicadas fueron: mareo9, palidez5, hipotensión4 y vómitos4. También se notificó un síncope conjuntamente con una contusión, y otro comunicaba simultáneamente síncope y espasmos musculares. El episodio se produjo el mismo día de la vacunación en 28 de las 32 notificaciones; en las 4 restantes el periodo de latencia fue de 2 a 10días, con una mediana de aparición de 2,5días. La tasa de notificación de síncope o pérdida de conciencia fue de 17 (IC95%: 11,1-23) por 100.000 dosis administradas, siendo la tasa de 15 (IC95%: 9,4-20,4) por 100.000 dosis administradas para episodios ocurridos el día de la vacunación.
El presíncope fue descrito en 8 de las notificaciones (4%): en 2 conjuntamente con síncope, en 2 se notificaba exclusivamente presíncope, y en las 4 restantes, una estaba asociada a dolor, otra a mareo y 2 comunicaban malestar general. Por lo tanto, de los 6 casos de presíncope notificados (excluyendo los que comunicaban simultáneamente síncope), todos tenían como fecha de inicio el día de la vacunación. La tasa de notificación de presíncope fue de 3,2 (IC95%: 0,6-5,7) por 100.000 dosis administradas.
Seis de las notificaciones comunicaron convulsiones (3%). Cuatro estaban asociadas a síncope; en 2 de ellas se notificaban únicamente estas 2 manifestaciones clínicas (una de las cuales especificaba que la convulsión era de gran mal), otra comunicaba adicionalmente rigidez muscular, y la otra, trastornos del movimiento (mioclono e hipertonía). De las 6 notificaciones de convulsiones, 5 tenían como fecha de inicio de la manifestación clínica el día de la administración de la vacuna, y solo una —la convulsión de gran mal— se presentó 50días después del día de vacunación. La tasa de notificación de convulsiones fue de 3,2 (IC95%: 0,6-5,7) por 100.000 dosis administradas, siendo la tasa de notificación de convulsiones sincopales de 2,1 (IC95%: 0,04-4,2) y las tasa de notificación de convulsiones sincopales ocurridas el día de la vacunación de 1,6 (IC95%: –0,2-3,4).
En la Comunidad Valenciana fueron administradas un total de 248.677 dosis de otras vacunas distintas a la del VPH en niñas de 13 a 15años durante el periodo de estudio, que generaron un total de 27notificaciones. De éstas, 16 describían síncope o pérdida de conciencia; 6, presíncope, y una, convulsión. Las tasas de notificación para estas manifestaciones clínicas fueron 6,4 (IC95%: 3,2-9,5), 2,4 (IC95%: 0,4-4,3) y 0,4 (IC 95%: –0,3-1,1) por 100.000 dosis administradas, respectivamente (tabla 1).
Tasas de notificación observadas en la Comunidad Valenciana con la vacuna tetravalente frente al VPH, tasas de notificación publicadas en otros estudios postautorización con la vacuna frente al VPH y tasas de notificación observadas en la Comunidad Valenciana para otras vacunas
| Manifestación clínica | Tasa de notificación observada: vacuna tetravalente VPHa (IC95%) | Tasa de notificación esperada: otros estudios vacuna VPHb | Tasa de notificación observada: otras vacunasa (IC95%) |
| Síncope o pérdida de conciencia | 17 (11,1-23) | 7,827/8,221 | 6,4 (3,2-9,5), |
| Síncope o pérdida de conciencia el día de la vacunación | 15 (9,4-20,4) | – | – |
| Presíncope | 3,2c (0,6-5,7) | – | 2,4 (0,4-4,3) |
| Convulsiones | 3,2 (0,6-5,7) | 0,3d,21 | 0,4 (-0,3-1,1) |
| Convulsiones sincopales | 2,1 (0,04-4,2) | – | – |
| Convulsiones sincopales el día de la vacunación | 1,6 (–0,2-3,4) | 2,627 | – |
| Total | 103 (89-118) | 53,921/116e,10 | 10,8 (6,7-14,9) |
VPH: vacuna frente al virus del papiloma humano.
Las manifestaciones clínicas notificadas al CAFCV coinciden con las manifestaciones clínicas descritas en la ficha técnica4 y las comunicadas tras la autorización de las vacunas por los sistemas de vigilancia pasiva10,21.
La tasa de notificación de SRA relacionadas con la vacuna tetravalente frente al VPH en la Comunidad Valenciana es superior a la descrita por VAERS en Estados Unidos con la misma vacuna21 (tabla 1). En los Países Bajos, los investigadores consideraron que el hecho de que la vacuna fuera cuestionada en los medios de comunicación influyó en la tasa de notificación10. Es posible que, también en la Comunidad Valenciana, el impacto mediático que rodeó a la inclusión de la vacuna en el calendario de vacunaciones y a las sospechas de episodios convulsivos asociados a la vacuna en 2009, incrementaran la notificación de reacciones adversas. Se trataría de un efecto conocido que ocurre cuando un medicamento es objeto de exposición a los medios, bien porque se trata de una asociación conocida o bien porque las autoridades reguladoras han emitido alguna advertencia22. No obstante, debe considerarse que las notificaciones al CAFCV en nuestro periodo de estudio proceden únicamente de profesionales sanitarios, a diferencia de VAERS y RIVM, donde los ciudadanos también pueden notificar10,23. Por otra parte, además el RIVM utiliza un sistema de vigilancia estimulado24.
Adicionalmente, la tasa de notificación de SRA relacionadas con la vacuna tetravalente frente al VPH también fue superior a la observada para las vacunas que se administran desde hace varios años en adolescentes en la Comunidad Valenciana (tabla 1). Esto podría explicarse por el efecto Weber, que refiere que los sistemas de vigilancia pasiva reciben un mayor número de notificaciones los primeros años tras el inicio de la comercialización de un fármaco25,26. Esta hipótesis podría verse reforzada con lo observado en la figura 1, donde se aprecia un mayor número de notificaciones coincidente con la administración de las 3dosis de la vacuna en el primer año de la campaña14, con un descenso en el segundo año.
Las tasas de notificación tanto para la vacuna frente al VPH como para el resto de las vacunas fueron obtenidas sin considerar la posible administración concomitante con otras vacunas, por lo que las tasas atribuibles a la vacuna frente al VPH podrían ser inferiores a las calculadas. Además, las tasas de notificación publicadas en otros estudios21,27, a diferencia de las obtenidas en este estudio, no fueron calculadas para un grupo específico de edad y utilizaron el número de dosis distribuidas, en lugar del número de dosis administradas, como en nuestro caso.
El síncope o la pérdida de conciencia fueron las manifestaciones clínicas más notificadas al CAFCV, coincidiendo también con lo notificado en VAERS y RIVM10,21. Sin embargo, la frecuencia de notificación, tanto para los síncopes o pérdidas de conciencia comunicados el día de la vacunación como para la totalidad de estas manifestaciones clínicas notificados, es mayor que lo descrito por otros sistemas de vigilancia pasiva21,27. Fue asimismo mayor que en un estudio postautorización17 y también mayor que con el resto de vacunas que se administran en adolescentes en la Comunidad Valenciana (tabla 1). Esto también podría explicarse por los efectos anteriormente descritos, ya que al impacto mediático de los casos le siguió la sugerencia de las autoridades sanitarias de reforzar la información relacionada con la administración de esta vacuna y la aparición de síncopes acompañados en ocasiones de movimientos tónico-clónicos que semejan convulsiones, lo que pudo estimular la mayor notificación de estas manifestaciones clínicas. Además, hay que considerar que los síncopes subsecuentes a la vacunación suelen presentarse con mayor frecuencia hasta 15min después de la administración de la vacuna28. Sin embargo, por no disponer de información detallada respecto al intervalo transcurrido, las tasas de síncope o pérdida de conciencia fueron calculadas incluyendo todos los ocurridos el día de la vacunación, por lo que podrían estar sobreestimadas.
Solamente una contusión fue notificada conjuntamente con un síncope. En otros estudios hubo una mayor notificación de lesiones secundarias como consecuencia de las caídas que siguieron al síncope21,28. Esto podría deberse a la infranotificación inherente a los sistemas de vigilancia pasiva, aunque por lo general las lesiones producidas por la aparición de un síncope suelen ser consideradas graves y, por tanto, deberían ser notificadas, o a un adecuado manejo del periodo posvacunación. En la Comunidad Valenciana, tras los casos de convulsiones notificados en 2009, esta vacuna pasó a administrarse exclusivamente en centros de salud, donde es más probable evitar la ocurrencia de este tipo de episodios.
La tasa de notificación de presíncope con la vacuna tetravalente frente al VPH es mayor a la notificada para otras vacunas que se administran en adolescentes; sin embargo, no hemos encontrado estudios que hayan estimado la tasa de notificación de esta manifestación clínica. Esto podría ser consecuencia de la falta de notificación de manifestaciones clínicas leves, sobre todo en medicamentos que no son de comercialización reciente26.
La tasa de notificación de convulsiones es superior a la notificada por VAERS21 y superior a la observada para otras vacunas que se administran en la adolescencia (tabla 1). Este efecto podría también explicarse por el impacto mediático de las sospechas de convulsiones asociadas a la vacuna en Valencia y por el efecto Weber. Fueron clasificadas como convulsiones sincopales todas las notificaciones que comunicaban conjuntamente convulsiones y síncope, por no disponer de acceso a la revisión de historias clínicas. La tasa de notificación de convulsiones sincopales ocurridas el día de la vacunación así calculada fue inferior a la publicada en un estudio previo27, aunque dicho estudio utilizó un sistema de vigilancia estimulada.
La farmacovigilancia utiliza diferentes métodos cuantitativos para valorar la asociación entre medicamentos y sus posibles efectos adversos basados en buscar en las bases de datos desproporcionalidades estadísticas para evaluar si una reacción es comunicada con mayor frecuencia para un medicamento que para otros. Uno de estos métodos es el reported odds-ratio (ROR), que se plantea como un estudio de casos y controles en el cual actúan como controles las notificaciones de reacciones adversas diferentes de la estudiada y a las que se denomina no-casos29. En este estudio no fue de utilidad calcular el ROR para síncope, presíncope y convulsiones porque el número de no-casos era muy pequeño, ya que casi todas las manifestaciones clínicas notificadas en niñas entre 13 y 15años estaban asociadas a la vacuna frente al VPH (27 notificaciones de otras vacunas frente a 194 notificaciones relacionadas con la vacuna frente al VPH).
Como limitaciones del estudio podemos mencionar que en cualquier sistema de vigilancia pasiva hay una mayor notificación en medicamentos de autorización reciente (efecto Weber), y existe asimismo una tendencia a la infranotificación de reacciones adversas conocidas y de medicamentos que están comercializados durante mayor tiempo. Por otra parte, estos sistemas son muy sensibles al efecto de la exposición a los medios. Además, la información incompleta en las notificaciones, y la falta de acceso a las historias clínicas, dificultaron la confirmación de los casos notificados. La relación temporal entre la administración de un medicamento y la notificación de una reacción adversa no implica necesariamente una relación de causalidad26.
Aun así, los resultados confirman que no han sido notificadas manifestaciones clínicas distintas a las descritas en la ficha técnica y en otro sistema de vigilancia pasiva4,21. Asimismo proporciona información sobre los síncopes y convulsiones que tanta repercusión han tenido en la opinión pública, planteando la posible correspondencia entre el ruido mediático y las tasas de notificación.
Conflicto de InteresesLos autores declaran no tener ningún conflicto de intereses.