El diagnóstico precoz de inmunodeficiencias primarias, como la inmunodeficiencia combinada grave (IDCG) y la agammaglobulinemia ligada al cromosoma X (ALX), mejora el pronóstico de los niños afectados. La medida de los T-cell receptor excision circles (TRECS) y kappa-deleting recombination excision circles (KRECS) puede identificar neonatos con linfopenias T y/o B graves.
ObjetivoCuantificar los niveles de TRECS y de KRECS de manera prospectiva a partir de muestras de sangre seca de talón para identificar de manera correcta linfopenias T y/o B.
Materiales y métodosDeterminación de TRECS y de KRECS mediante reacción en cadena de polimerasa multiplex en neonatos nacidos entre febrero y mayo del 2014. Los puntos de corte empleados fueron: TRECS < 15 copias/μl, KRECS < 10 copias/μl, ACTB (β-actina) > 1.000 copias/μl. Se incluyeron controles internos (ALX, ataxia) y externos (IDCG).
ResultadosFueron analizadas 1.068 muestras de las 1.088 recogidas (edad gestacional media: 39 semanas [38-40]; peso al nacer medio 3.238g [2.930-3.520]). La media (mediana, min/máx) copias/μl obtenidas fueron las siguientes; TRECS 145 (132, 8/503), KRECS 82 (71, 7/381) y ACTB 2838 (2763, 284/7710). Veinte muestras (1,87%) fueron insuficientes para el análisis. El re-test fue necesario en un neonato (0,09%), confirmándose resultados normales posteriormente. Empleando puntos de corte inferiores (TREC < 8 y KREC < 4 copias/μl), todas las muestras resultaron normales y se identificaron los controles internos y externos correctamente.
ConclusiónEs el primer estudio prospectivo realizado en España usando el ensayo TREC/KREC/ACTB para identificar linfopenias graves. Es necesario establecer puntos de corte adecuados para nuestra población, mejorar la toma de muestras, su almacenamiento y la preparación de las mismas.
Early diagnosis of primary immunodeficiency such as severe combined immunodeficiency (SCID) and X-linked agammaglobulinemia (XLA) improves outcome of affected infants/children. The measurement of T-cell receptor excision circles (TRECS) and kappa-deleting recombination excision circles (KRECS) can identify neonates with severe T or B-cell lymphopenia.
ObjectivesTo determine TRECS and KRECS levels from prospectively collected dried blood spot samples (DBS) and to correctly identify severe T and B-cell lymphopenia.
Material and methodsDetermination of TRECS and KRECS by multiplex PCR from neonates born in two tertiary hospitals in Seville between February 2014 and May 2014. PCR cut-off levels: TRECS<15 copies/μl, KRECS<10copies/μl, ACTB (β-actin)>1000 copies/μl. Internal (XLA, ataxia telangiectasia) and external (SCID) controls were included.
ResultsA total of 1068 out of 1088 neonates (mean GA 39 weeks (38-40) and BW 3238g (2930-3520) were enrolled in the study. Mean (median, min/max) copies/μl, were as follows: TRECS 145 (132, 8/503), KRECS 82 (71, 7/381), and ACTB 2838 (2763, 284/7710). Twenty samples (1.87%) were insufficient. Resampling was needed in one neonate (0.09%), subsequently giving a normal result. When using lower cut-offs (TRECS<8 and KRECS<4 copies/μl), all the samples tested were normal and the internal and external controls were correctly identified.
ConclusionThis is the first prospective pilot study in Spain using TRECS/KRECS/ACTB-assay, describing the experience and applicability of this method to identify severe lymphopenias. The ideal cut-off remains to be established in our population. Quality of sampling, storage and preparation need to be further improved.
El grupo de las inmunodeficiencias primarias (IDP) es un grupo heterogéneo y abarca más de 240 patologías diferentes, con una incidencia aproximada de 1:500 neonatos vivos. Defectos congénitos del sistema inmunitario, como las inmunodeficiencias combinadas graves (IDCG) y agammaglobulinemias ligadas al cromosoma X (ALX), son menos frecuentes, aunque mantienen una incidencia considerable de 1:70.000-100.000 neonatos vivos1,2. La gran mayoría de neonatos con linfopenias T y/o B graves, incluidos los afectados de los IDP graves, no tienen antecedentes familiares y son asintomáticos durante las primeras semanas de vida3. Debido a estas características, la demora diagnóstica es común y se asocia a una importante morbimortalidad por la aparición posterior de cuadros clínicos graves2-4. Existen medidas terapéuticas altamente eficaces para las IDP más graves, como la sustitución de inmunoglobulinas para las agammaglobulinemias y, en el caso de las IDCG, tratamientos curativos, como el trasplante de progenitores hematopoyéticos o la terapia génica5,6. El diagnóstico precoz, seguido de la instauración de medidas preventivas y terapéuticas, ha demostrado reducir la tasa de secuelas, mejorar la calidad de vida de los pacientes y aumentar la supervivencia de forma impactante7,8. Del mismo modo, la identificación precoz de pacientes con IDCG permitiría evitar lesiones iatrogénicas graves, como la administración de vacunaciones vivas (p. ej., rotavirus), actualmente recomendada a partir de los 2 meses de vida, momento en el que la mayoría de los pacientes aún no han presentado síntomas indicativos9.
En los últimos años, se ha desarrollado la metodología necesaria para detectar IDP en el periodo neonatal de forma sistemática. En EE. UU. una PCR a tiempo real identifica a pacientes con IDCG cuantificando T-cell receptor excision circles (TRECS) en muestras de sangre seca10-12. Recientemente, se ha implementado, como proyecto piloto en Suecia y Alemania, un método que permite detectar tanto linfopenias T (a través de números bajos de TRECS), típicamente relacionadas con IDCG, como linfopenias B (a través de número bajo de kappa-deleting recombination excision circles [KRECS]) relacionados con otras IDP graves tipo ALX o ataxia telangiectasia (AT)13-16. Los TRECS y KRECS son fragmentos de ADN episomales que resultan del reordenamiento génico durante la maduración de los linfocitos T y B. Los excision circles no son replicados en la mitosis celular y siguen, por lo tanto, un patrón de dilución que permite estimar de forma cuantitativa la replicación celular12,16. Pacientes afectados de IDP graves que cursan con linfopenias T y/o B muestran, por lo tanto, concentraciones de TRECS y KRECS muy bajas, independientemente de la causa genética de la IDP, siendo esto muy beneficioso ante la heterogeneidad genética de estas enfermedades10,13,16.
En España, no existe un cribado neonatal para enfermedades del sistema inmunitario potencialmente letales, aunque se ha demostrado que estas patologías cumplen con los requisitos adaptados de Wilson y Jungner, que determinan la adecuación de incluir patologías en un cribado poblacional: alta morbimortalidad, intervalo asintomático inicial, disponibilidad de una metodología accesible y poco invasiva, beneficio de diagnóstico precoz, existencia de tratamientos curativos o eficaces y, finalmente, un análisis coste-beneficio favorable17-19.
Debido a la ausencia de estudios previos y siendo incompletos los registros nacionales, se desconoce en la actualidad la prevalencia verdadera de IDP graves en España. Los resultados del cribado neonatal para IDP en California han cambiado nuestros conocimientos sobre la prevalencia de las IDCG, ya que se hallaron cifras de 1:70.000 neonatos vivos en comparación con previas estimaciones 1:100.000-1:150.00020.
El presente trabajo recoge los datos iniciales de un estudio piloto con el objetivo de: a) aflorar la magnitud de un problema no reconocido, y b) producir datos sobre factibilidad y rendimiento de una metodología novedosa, usando muestras recogidas en el programa de cribado neonatal ya establecido.
En una segunda etapa, aumentando el tamaño muestral se pretende: a) disponer de información fidedigna sobre la epidemiología de las linfopenias T y/o B en nuestro medio; b) conocer la etiología de linfopenias T y/o B y, por último, c) identificar neonatos con linfopenias susceptibles a intervenciones terapéuticas precoces, mejorando así el pronóstico de pacientes afectados de IDP.
Materiales y métodosDiseño, ámbito de estudio y poblaciónEstudio observacional, descriptivo y longitudinal de los niveles de TREC y KREC en muestras de sangre seca obtenidas de los neonatos nacidos en los Hospitales Universitarios Virgen del Rocío (HUVR) y el Hospital de Especialidades Virgen del Valme durante el periodo del estudio (febrero-mayo del 2014). Criterios de exclusión: no disponer del consentimiento informado de los tutores legales.
Recogida de datos y muestrasMuestras recogidas de sangre de talón en papel de filtro Schuell & Schleicher 912 (3.er-5.° día de vida) siguiendo el proceso establecido para el cribado neonatal poblacional habitual. Se obtuvieron 2 discos de 3,2mm mediante «punch» que fueron almacenados a 4°C hasta su procesamiento. Se recogieron datos demográficos-clínicos maternos y neonatales relevantes: sexo, edad gestacional, peso al nacer y resultados patológicos en el cribado neonatal habitual.
Procesamiento de muestras y reacción en cadena de polimerasa multiplex a tiempo real (ensayo TRECS/KRECS/ACTB)Se realizó la purificación (DNA Purification Solution, Qiagen, Maryland, EE. UU.) de las muestras y extracción de ADN (DNA Elution Solution, Qiagen, Maryland, EE. UU.) como se ha detallado previamente13. La cuantificación absoluta de TRECS, KRECS y ACTB en muestras de sangre seca se realizó tal y como se ha descrito previamente13. El valor de ACTB (β-actina) refleja la eficacia de extracción de ADN de la sangre seca.
Controles de calidadSe incluyeron controles internos (diseñados mediante clonación en plásmido) y controles externos proporcionados en el ámbito del Newborn Screening Quality Assurance Program, T-Cell Receptor Excision Circles (Centers for Disease Control and Prevention [CDC], Chamblee, EE. UU.; IDCG, n=2, sanos, n=2). Adicionalmente, se incluyeron muestras de pacientes con diagnóstico establecido: IDCG (n=1), ALX (n=2) y AT (n=2).
Definición e interpretación de resultadosCon un límite inferior de detección del ensayo de 1 copia/μl de TRECS y KRECS, y basado en los resultados de estudios previos, se establecieron los siguientes puntos de corte: TRECS < 15/μl, KRECS < 10/μl con valores de ACTB > 1.000/μl, estimando una sensibilidad del 99,8% de detectar linfopenias T y/o B graves13.
En función de los resultados del ensayo, se definieron 3 categorías (tabla 1).
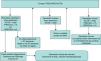
La actuación ante un resultado patológico, dudoso y normal se resume en la figura 1.
En caso de hallar un resultado dudoso o patológico, en el ensayo se repite la PCR usando un nuevo «punch» del mismo papel secante (= retest). Si se mantiene un resultado dudoso o patológico, se solicita una nueva prueba de talón con envío de material (= recall). Si se confirma el resultado con la nueva muestra, se avisa a los tutores legales para valorar al paciente en las consultas especializadas.
Adicionalmente, los resultados fueron analizados usando puntos de corte adaptados (TRECS < 8/μl, KRECS < 4/μl, ACTB > 1.000/μl) a los resultados preliminares obtenidos en este estudio. Esta adaptación coincide con la experiencia de otros grupos empleando este ensayo (Borte et al. Datos no publicados).
Análisis de datosSe realizó un análisis descriptivo con frecuencias absolutas y porcentajes en caso de las variables cualitativas. Las variables cuantitativas, según sigan o no una distribución normal (aplicación del test de Kolmogorov-Smirnov o Shapiro-Wilk, n < 50), fueron resumidas mediante media ± desviación estándar y mediana, rango intercuartílico, respectivamente, o reflejados como valor mínimo y máximo de la prueba.
Se calcularon las tasas de resultados patológicos, dudosos y normales del ensayo TRECS/KRECS/ACTB con intervalos de confianza del 95%. Para analizar la fiabilidad del ensayo se calculó la fracción de falsos positivos. El análisis de las causas/variables asociadas o relacionadas con la presencia de linfopenias T y B, se realizó mediante el test de la chi al cuadrado de Pearson o test exacto de Fisher, en caso de variables cualitativas. Para variables cuantitativas se empleó la t de Student para muestras independientes o la U de Mann-Whitney (según siguieran o no una distribución normal).
El nivel de significación estadística fue asumido en p<0,05. El análisis estadístico se realiza con el paquete IBM SPSS Statistics 20.
ResultadosCaracterísticas demográficas y clínicas de la muestraSe analizaron 1.068 muestras obtenidas de 1.088 neonatos nacidos en los 2 centros participantes, 20 muestras (1,87%) no pudieron ser analizadas por no contener volumen de sangre suficiente en el papel secante. La mayoría de las muestras fueron enviadas desde los centros de salud pertenecientes al área sanitaria del HUVR (76%); el 48% de los neonatos incluidos eran varones y el 67,5% eran neonatos a término. La media de la edad gestacional fue de 39 semanas (P25 38 semanas-P75 40 semanas), siendo la media del peso al nacer de 3.238g (P25 2.930g-P75 3.520g). La mayoría de las muestras correspondían a recién nacidos con un peso mayor de 2.500g (79,1%). Se recibieron muestras válidas y consentimientos informados correctamente rellenados, sin disponer de información sobre la edad gestacional (19,9%) y peso al nacer (15,5%).
Resultados del ensayo TRECS/KRECS/ACTBLos resultados del ensayo TRECS/KRECS/ACTB obtenidos para los 2 subgrupos de edad gestacional y peso se muestran en la tabla 2 y la figura 2. La media y mediana para los 3 parámetros (TRECS, KRECS y ACTB) son equiparables en los subgrupos analizados.
Resultados del ensayo TRECS/KRECS/ACTB en la población general y en relación con las variables edad gestacional y peso al nacer
| TRECS (copias/μl) | KRECS (copias/μl) | ACTB (copias/μl) | ||||||||||||
| N | (%) | Media | Mediana | Min | Máx | media | mediana | min | max | media | mediana | min | max | |
| EG ≤ 37 | 135 | (12,6) | 150 | 140 | 18 | 503 | 75 | 71 | 15 | 274 | 2853 | 2744 | 352 | 5894 |
| EG > 37 | 721 | (67,5) | 149 | 136 | 8 | 503 | 84 | 71 | 7 | 381 | 2017 | 2746 | 284 | 7710 |
| EG desconocido | 212 | (19,9) | 129 | 119 | 20 | 378 | 77 | 67 | 7 | 324 | 2902 | 2016 | 866 | 6528 |
| Total | 1.068 | (100) | 145 | 132 | 8 | 503 | 82 | 71 | 7 | 381 | 2838 | 2763 | 284 | 7710 |
| Peso ≤ 2.500 g | 57 | (5,4) | 138 | 123 | 25 | 315 | 71 | 67 | 15 | 222 | 2920 | 2911 | 352 | 5894 |
| Peso > 2.500 g | 845 | (79,1) | 150 | 137 | 8 | 503 | 82 | 71 | 7 | 381 | 2823 | 2746 | 502 | 7709 |
| Peso desconocido | 166 | (15,5) | 123 | 116 | 18 | 415 | 79 | 66 | 11 | 324 | 2887 | 2789 | 284 | 2628 |
| Total | 1.068 | (100) | 145 | 132 | 8 | 503 | 82 | 71 | 7 | 381 | 2838 | 2763 | 284 | 7710 |
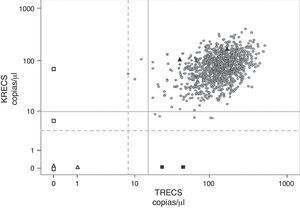
Valores de TRECS y KRECS obtenidos de sangre de talón (n=1.068).
Círculos: neonatos cribados; triángulos blancos: controles IDCS tipo T-B- (CDC); triángulo negros: controles sanos (CDC); cuadrados blancos: controles IDCS tipo T-B+ y AT (internos); cuadrados negros: controles ALX (internos); línea gris continua: TRECS < 15 y KRECS < 10 copias/μl; línea gris de puntos: TRECS < 8 y KRECS <4 copias/μl.
Con la aplicación de los puntos de corte TRECS<15/μl y KRECS<10/μl, 8 muestras (0,75%) mostraron un resultado patológico. Siguiendo el algoritmo establecido, se repitieron dichas muestras sobre el mismo papel seco, hallando en todas, menos una, un resultado normal. Solamente en un neonato (0,09%) se indicó la nueva preparación de papel seco con necesidad de extracción de sangre por presentar resultados patológicos de KRECS (2 copias/μl) tras repetición de la muestra inicial. En el segundo papel secante se encontraron resultados normales para KRECS (167 copias/μl).
Para comprobar la aplicabilidad de otros puntos de corte en la muestra, se emplearon TRECS<8/μl y KRECS < 4/μl, sin encontrar ningún resultado patológico en la población general. Sin embargo, se identificaron todos los controles patológicos de forma fiable.
Prematuridad y peso al nacerAl comparar los valores obtenidos de TRECS y KRECS de neonatos prematuros (ninguno de ellos < 28 semanas de gestación) con neonatos nacidos a término no se hallaron diferencias significativas. Del mismo modo, no se observaron niveles diferentes entre neonatos con un peso al nacer ≤ 2.500g y neonatos con un peso > 2.500g (tabla 2).
Controles internos y externosSe analizaron 9 controles en total (tabla 3): una muestra de un paciente recientemente diagnosticado de una IDCS (tipo T negativo, B positivo), 2 muestras de pacientes, de 3 y 17 años de edad, previamente diagnosticados de ALX fueron identificados de forma fiable con el ensayo (KRECS=0 copias/μl), y 2 pacientes, de 1 y 17 años de edad, diagnosticados de AT y linfopenia grave.
Resultados del análisis de los controles internos y externos
| Patología | TREC(copias/μl) | KREC(copias/μl) | ACTB(copias/μl) | |
| 1 | ALX (paciente) | 23 | 0 | 3.229 |
| 2 | ALX (paciente) | 42 | 0 | 3.009 |
| 3 | AT (paciente) | 0 | 7 | 805 |
| 4 | AT (paciente) | 0 | 0 | 1.979 |
| 5 | IDCS (paciente) | 0 | 78 | 932 |
| 6 | IDCS (CDC) | 0 | 1 | 954 |
| 7 | IDCS (CDC) | 0 | 0 | 87a |
| 8 | SANO (CDC) | 97 | 157 | 2.927 |
| 9 | SANO (CDC) | 244 | 187 | 3.770 |
ALX: agammaglobulinemia ligada al cromosoma X; AT: ataxia telangiectasia; CDC: Centers for Disease Control and Prevention; IDCS: inmunodeficiencia combinada severa.
Adicionalmente, se incluyeron 4 muestras enviadas por parte del CDC, de las que 2 fueron clasificadas como T negativo y B negativo (una de ellas con baja copia de ACTB) y 2 mostraron resultados normales.
DiscusiónLos pacientes con IDP graves se benefician de un diagnóstico precoz, ya que permite instaurar medidas preventivas, de soporte y terapéuticas, mejorando el pronóstico global y, en caso de las IDCG, la supervivencia a través de un trasplante de progenitores hematopoyeticos5-8.
Los estudios previos documentan la fiabilidad de la metodología basada en la determinación de los TRECS en muestras de sangre de talón para identificar a pacientes afectados de linfopenia T grave13,20. Ante esta experiencia, los expertos europeos en el campo de las IDP han declarado claramente su apoyo para la introducción del cribado también en Europa21. Recientemente, el grupo de Modell presentó datos coste-beneficio muy favorables para la implementación del cribado neonatal para IDCG y propuso un modelo para estimar su impacto socioeconómico para diferentes poblaciones18. Su cálculo, basado en los datos del cribado en EE. UU., reveló que el gasto total de un paciente con diagnóstico tardío era de 6.000.000 $; sin embargo, los costes, incluyendo un cribado general, y el tratamiento y el seguimiento de un paciente diagnosticado tras el cribado, era de 1.385.000 $18. Es importante mencionar que el coste de cribado de TRECS y KRECS por neonato en nuestro estudio es de 1,46 € y, por lo tanto, muy por debajo de los costes en EE. UU. (4,25 $/neonato) y Reino Unido (8,30 £/neonato), que solo incluyen el análisis de TRECS.
El potencial de los KRECS como marcador de trastornos del desarrollo de los linfocitos B en el ámbito del cribado neonatal sistemático ha sido comunicado previamente13,22. Al determinar TRECS y KRECS simultáneamente en la misma muestra, se aumenta la capacidad diagnóstica de la prueba. Mediante la PCR multiplex (ensayo TRECS/KRECS/ACTB) se identifican, aparte de los déficits congénitos de los linfocitos T clásicos (IDCG), también otros trastornos inmunitarios en neonatos asintomáticos, como por ejemplo las agammaglobulinemias, inmunodeficiencias combinadas y la AT14,21. Además, tiene capacidad de detectar a aquellos pacientes con IDCG con un fenotipo menos típico que, ocasionalmente, no son identificados a través de ensayos con determinación aislada de TREC23.
Este estudio piloto ha analizado 1.088 muestras de 1.068 neonatos nacidos en el sur de España con el objetivo de conocer los valores de TRECS y KRECS de esta población, buscar los puntos de corte adecuados y, en general, valorar la aplicabilidad del ensayo TRECS/KRECS/ACTB en nuestro medio.
Publicaciones recientes provenientes de estudios predominantemente retrospectivos del Reino Unido, Francia e Israel documentan el interés de añadir el cribado para las IDCG al cribado neonatal habitual22,24,25. Es importante destacar que nuestro trabajo, con su diseño prospectivo, no solamente es el primer estudio de este tipo en la población hispana, sino uno de los primeros en Europa.
Los valores de TRECS y KRECS observados son comparables con los previamente descritos en otras poblaciones usando la misma técnica13. Inicialmente, se emplearon puntos de corte conservadores con TRECS<15/μl, KRECS<10/μl. Con estos límites, el 0,75% de las muestras testadas resultaron patológicas en nuestra población. Otros grupos han comunicado cifras de 0,08-4,1%, dependiendo del punto de corte usado13,20,21. Estudios poblaciones con un número elevado de muestras patológicas serían inviables, puesto que para nuestra área de salud (25.000 partos/año) esta tasa se traduciría en la necesidad de repetir el ensayo a 188 muestras al año. Tres motivos pueden contribuir a encontrar esta elevada tasa re-test: a) la baja calidad de muestras de sangre seca pre-análisis; b) la curva de aprendizaje de metodología y el uso apropiado de la infraestructura establecida, y finalmente, c) puntos de corte conservadores. Al repetir las muestras patológicas, todas menos una presentaron valores por encima de los puntos de corte iniciales (0,09%). Esta tasa re-call es considerada adecuada para este tipo de estudio19.
Considerando unos puntos de corte más restrictivos (TRECS<8/μl y KRECS<4/μl), se observó que todas las muestras mostraban resultados normales (no patológico). Datos recientes publicados por el grupo británico de Gaspar et al. y el grupo de Borte et al. (comunicación personal) son similares e indican la necesidad de determinar el punto de corte específico para cada laboratorio y población20,26.
El objetivo final tiene que ser la disminución de la tasa de re-test. Para ello es importante cuidar y mejorar la calidad de las muestras y hallar el punto de corte adecuado para la población española. Esto implica una comunicación estrecha con los centros de salud asociados. Así se reducen tanto gastos como ansiedad familiar innecesarios y, en casos aislados, evita la necesidad de extraer una nueva muestra en el recién nacido (re-call).
Neonatos prematuros pueden presentar con mayor frecuencia resultados falsos positivos en el ensayo y requieren, por lo tanto, un manejo diferente, tal como se detalla en la figura 1. En nuestro estudio piloto, no se hallaron diferencias significativas entre los 2 subgrupos: peso al nacer (< 2.500g vs. ≥ 2.500g) y edad gestacional (< 37 semanas vs. ≥ 37 semanas), aunque es importante considerar que en nuestra población no se hallaron muestras procedentes de prematuros extremos (peso al nacer < 1.000g o edad gestacional < 28 semanas). De momento, y ante una controversia en la literatura, parece prudente mantener una actitud conservadora con resultados positivos en prematuros y neonatos que precisan cuidados intensivos13,22,23.
Dentro de los 4 controles proporcionados por parte de los CDC, se identificaron correctamente 2 muestras normales y 2 muestras patológicas compatibles con un fenotipo IDCG T-B-, una de ellas con baja copias de ACTB, confirmando la capacidad diagnóstica del ensayo.
Además, se analizaron muestras de pacientes previamente diagnosticados de ALX y AT. En ambas afecciones se hallaron resultados patológicos. Los pacientes con ALX se identificaron con valores muy patológicos de KRECS y ambos pacientes con AT mostraron valores de TRECS y KRECS por debajo de los puntos de corte establecidos, tal y como se ha observado en estudios previos13,15. El hecho de tratarse de muestras no recogidas en el periodo neonatal limita su valor para la validación de los puntos de corte para este tipo de patologías. Aun así, la observación de presentar resultados patológicos en el cribado es destacable, ya que los pacientes con AT (edad: 1 año y 17 años) mostraron linfopenia importante con necesidad de profilaxis frente a Pneumocystis jiroveci y sustitución con inmunoglobulinas.
Finalmente, se analizó una muestra obtenida de un paciente recientemente diagnosticado de IDCG T negativa y B positiva. Es destacable que todos los pacientes presentaron valores de TRECS y/o KRECS claramente patológicos (0-1 copia/μl) y muy por debajo de los puntos de corte establecidos.
En este trabajo, presentamos por primera vez resultados de un estudio piloto prospectivo empleando una metodología novedosa y usando muestras de sangre seca de recién nacidos españoles con el objetivo de detectar neonatos con linfopenias T y B graves. Este estudio proporciona información valiosa sobre su aplicabilidad y capacidad diagnóstica. El reclutamiento prospectivo y continuo de muestras neonatales nos permitirá aumentar la validez de los datos obtenidos, facilitando la implementación del cribado neonatal para IDP graves a nivel regional y, en un futuro, a nivel nacional. La colaboración entre diferentes grupos de profesionales del sistema sanitario (enfermería, neonatólogos, pediatras de Atención Primaria, pediatras especialistas, inmunólogos y expertos en metabolopatías) es fundamental para su implementación exitosa. El objetivo final es poder diagnosticar neonatos asintomáticos afectados de IDP graves en las primeras semanas de vida. Esto nos permitirá iniciar de forma inmediata medidas preventivas, de soporte e incluso curativas, mejorando así la calidad de vida de estos niños y de sus familias.
Financiación- 1.
Fondo de Investigaciones Sanitarias (FIS), Instituto de Salud Carlos III (PI13/01104).
- 2.
Fundación Pública Andaluza para la Gestión de la Investigación en Salud de Sevilla. (FISEVI, «Scott Family Funding»).
- 3.
Ayudas para contratos de formación en Investigación Río Hortega. Instituto de Salud Carlos III.
- 4.
German Federal Ministry of Education and Research (BMBF 1315883).
P. Olbrich y B. de Felipe contribuyeron de forma equitativa en el trabajo presentado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.