Exponemos el caso de una recién nacida a término con peso adecuado. La madre tenía 28 años, era secundigesta (un aborto espontáneo en el primer trimestre), con antecedente de diabetes mellitus de tipo 2, insulinizada, y con artritis reumatoide en tratamiento con factor biológico (certolizumab). Los abuelos maternos eran de Pakistán, consanguíneos (primos hermanos). Dos primos hermanos maternos habían fallecido antes de los 2 años de edad, sin otros antecedentes familiares.
En las ecografías prenatales destacaba un retraso del crecimiento intraútero con flujos Doppler normales, sin otros hallazgos patológicos.
Nació por parto eutócico, con Apgar 9/10/10 y pH de cordón correcto (pH venoso 7,31). A las 18 h de vida se inició un cuadro de hipoactividad, con quejido respiratorio, hipoglucemia de 35mg/dL e hipoxemia mantenida (saturaciones basales 90-92%), por lo que fue ingresada en la unidad neonatal.
En el estudio analítico inicial destacaba una acidosis metabólica grave con hiperlactacidemia (máximo 22 mmol/L a las 21h de vida). Se descartó la causa infecciosa y, ante la sospecha de enfermedad mitocondrial, se inició tratamiento con cofactores: tiamina, biotina, riboflavina, coenzima Q10 y L-carnitina por vía oral.
El perfil de aminoácidos-ácidos orgánicos mostraba acidemia láctica con aumento de alanina y prolina.
El estudio cardiológico evidenció disfunción sistólica grave del ventrículo izquierdo con fracción de eyección del 37%. Se le dio soporte con milrinona y furosemida, con buena respuesta clínica, resolución de la acidosis metabólica y descenso de lactato a < 5 mmol/L. Pudo reducirse la dosis de milrinona hasta suspenderse tras el inicio de carvedilol. Posteriormente se añadió captopril, que se mantuvo hasta el alta hospitalaria.
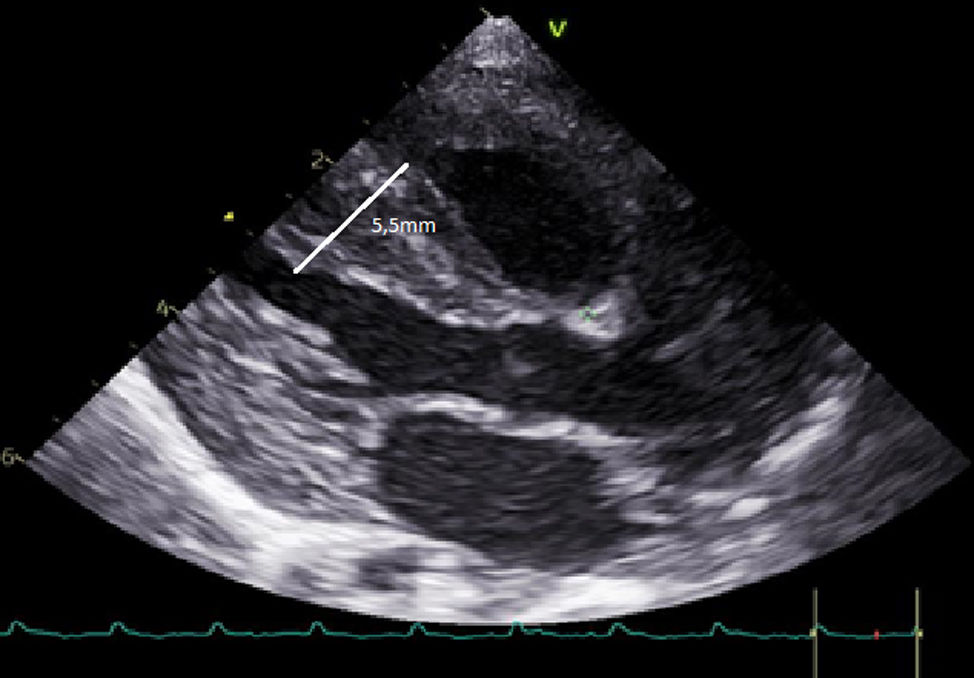
Los controles ecocardiográficos reglados mostraron normalización de la función sistólica biventricular y mejoría estructural, aunque persistía un ventrículo izquierdo engrosado y ventrículo derecho trabeculado (fig. 1).
En el estudio de extensión se objetivaron, además, cataratas puntiformes bilaterales.
Ante la tríada clínica de acidosis láctica, cataratas y miocardiopatía (de probable evolución a hipertrófica por ventrículo izquierdo engrosado), se sospechó el síndrome de Sengers, que se confirmó mediante exoma clínico. Se halló una variante patogénica nonsense en homocigosis en el gen AGK (NM_018238.3: c.632G>A).
La paciente mantuvo una buena curva pondoestatural con lactancia mixta y, dada la buena evolución, fue dada de alta de la unidad neonatal a los 38 días de vida bajo tratamiento con carvedilol, captopril y furosemida. Al alta hospitalaria precisaba de sonda nasogástrica para completar las tomas con el objetivo de evitar la fatiga muscular y la hiperlactacidemia consecuente.
Se mantuvo el seguimiento multidisciplinar con apoyo de la unidad de atención al paciente crónico complejo.
Durante el seguimiento de cardiología pediátrica se objetivó una progresión a miocardiopatía hipertrófica, clínicamente controlada con el tratamiento médico descrito.
La paciente presentaba signos de limitación de la agudeza visual secundaria a cataratas congénitas bilaterales. Dada la estabilidad cardiológica, que hacía pensar en una esperanza de vida más larga de la esperada inicialmente, y con el fin de mejorar su calidad de vida y su relación con el entorno, se decidió, de forma multidisciplinar, realizar cirugía de cataratas a los 6 meses de vida. En el postoperatorio (>24h) falleció por parada cardiorrespiratoria.
El síndrome de Sengers es una enfermedad minoritaria, con unos 40 casos descritos actualmente. Consiste en una enfermedad mitocondrial autosómica recesiva causada por variantes patogénicas bialélicas en el gen AGK, que codifica la enzima acilglicerol cinasa mitocondrial. La proteína codificada es parte de la membrana mitocondrial y del complejo TMEM22. Interviene en funciones de señalización, estabilidad del ADN mitocondrial y del metabolismo energético mitocondrial a través de la cadena respiratoria mitocondrial. Destaca su papel crucial en la síntesis de lípidos, como la cardiolipina. De hecho, un fármaco estabilizador de la estructura del mitocondrio a través de la cardiolipina se ha estudiado como opción terapéutica en este defecto (elamipretida)1-3.
El síndrome se caracteriza por cataratas congénitas, miocardiopatía hipertrófica y acidosis láctica, que puede asociarse a miopatía esquelética. Existen 2formas clínicas: 1) una infantil grave, caracterizada por inicio precoz de miocardiopatía, acidosis láctica y muerte prematura, como el caso descrito; y 2) una más leve, con esperanza de vida de hasta la cuarta década, en la que se desarrolla la miocardiopatía en estadios más avanzados1,2.
Aunque no se ha establecido una correlación genotipo-fenotipo clara, se ha reportado que la presencia de variantes patogénicas nonsense en homocigosis, como en este caso, se asocia con un fenotipo caracterizado por una alta incidencia de mortalidad infantil y una menor esperanza de vida.
El manejo anestésico supone un riesgo elevado de muerte súbita por la inhibición del metabolismo mitocondrial producido por los agentes anestésicos y la disfunción cardíaca subyacente4,5.
La mortalidad alcanza el 50% antes del año de vida, mayoritariamente causada por insuficiencia cardíaca. Es importante sospecharla ante la tríada comentada, dadas las implicaciones pronósticas y de asesoramiento genético.
Presentado en la 26.ª Reunión anual de la Sociedad Catalana de Pediatría. Comunicación oral breve: Hiperlactacidemia en el neonato, ¿en qué debemos pensar? Lérida (Cataluña, España), 10-11 de junio de 2022.