Los neonatos afectos de atresia pulmonar con tabique interventricular íntegro y estenosis pulmonar crítica representan un espectro amplio, incluyendo aquellos con hipoplasia significativa del ventrículo derecho. La presencia de fístulas arteriales coronarias a ventrículo derecho puede ser una contraindicación para la descompresión del ventrículo derecho. El principal objetivo del presente trabajo es analizar los resultados a corto y largo plazo durante 20 años de estos pacientes, e identificar los factores diferenciales entre ambos grupos incluyendo aquellos pacientes afectos por fístulas arteriales coronarias.
Pacientes y métodosEstudio retrospectivo donde se identificaron todos los pacientes diagnosticados de atresia pulmonar con septo interventricular íntegro y estenosis pulmonar crítica entre los meses de enero de 1996 y enero de 2018. Se recogieron y analizaron las características morfológicas del ventrículo derecho, el manejo quirúrgico, la intervención percutánea y la evolución a corto y a largo plazo.
ResultadosFueron incluidos cincuenta y un pacientes. Un total de 9 (17,6%) fallecieron durante el seguimiento. Ninguno de ellos presentaba fístulas arteriales coronarias a ventrículo derecho. La mediana de seguimiento de los restantes 42 supervivientes fue de 8,9 años (rango: 1-16).
La clase funcional según la New York Heart Association en la revisión más reciente fue de 1,2. Los supervivientes del grupo de estenosis pulmonar crítica presentaban una clase funcional de 1,1 y los del grupo de atresia pulmonar con tabique interventricular íntegro de 1,6. No hubo diferencias entre los pacientes que presentaban fístulas arteriales coronarias a ventrículo derecho y los que no.
ConclusionesLa presencia de fístulas arteriales coronarias a ventrículo derecho no es una contraindicación para la vía biventricular. Los pacientes con estenosis pulmonar crítica presentan una mejor evolución que los afectos de atresia pulmonar con tabique interventricular íntegro. La estrategia de apertura agresiva y precoz de la válvula pulmonar tiene una buena supervivencia global correlacionada con una buena clase funcional.
Pulmonary atresia with intact ventricular septum and critical pulmonary stenosis in newborns encompasses a wide spectrum of disease, including cases with significant right ventricular hypoplasia and coronary artery to right ventricle fistulae, which may be considered a contraindication for decompression of the right ventricle. The aim of this study was to review the middle- and long-term outcomes of these patients over 20 years and identify differential factors between both groups, including patients with coronary artery fistulae.
Patients and methodsWe performed a descriptive retrospective study by identifying all patients that received a diagnosis of pulmonary atresia with intact ventricular septum and critical pulmonary stenosis between January 1996 and January 2018. We collected and analysed data regarding right ventricular morphology, surgical management, percutaneous intervention and medium- and long-term outcomes.
Results51 patients were admitted. A total of 9 patients (17.6%) died during the followup. None of the deceased patients had coronary artery to right ventricle fistulae. The median length of follow up in the 42 survivors was 8.9 years (1-16).
The functional class based on the latest revision of the New York Heart Association classification was 1.2 for the overall sample. Survivors of critical pulmonary stenosis had a functional class of 1.1, and survivors of pulmonary atresia with intact ventricular septum a functional class of 1.6. There were no differences based on the presence or absence of coronary artery to right ventricle fistulae.
ConclusionsCoronary artery to right ventricle fistulae may not be a contraindication for biventricular strategy. Patients with critical pulmonary stenosis had better outcomes compared to patients with pulmonary atresia with intact ventricular septum. The aggressive strategy of opening the pulmonary valve early on was associated with a good overall survival and correlated to a good functional class.
La atresia pulmonar con septo interventricular íntegro (APTI) y la estenosis pulmonar crítica (EPC) son formas infrecuentes de cardiopatía congénita cianótica1,2 en las que el flujo pulmonar depende del ductus arterioso. La APTI constituye un amplio espectro clínico3, y los criterios de selección para las vías de corrección univentricular y biventricular continúan siendo objeto de debate. La morfología del ventrículo derecho (VD), la puntuación z inicial de la válvula tricúspide (VT)4 y la presencia de fístulas arteriales coronarias a ventrículo derecho5 y/o circulación coronaria dependiente del VD6 pueden inclinar la balanza a favor de la vía biventricular o la univentricular. No obstante, la EPC difiere de la APTI en que las dimensiones del VD y de la VT se aproximan a la normalidad, lo que posibilita la corrección biventricular. Históricamente, algunos grupos han considerado que la presencia de fístulas arteriales coronarias a VD contraindica la descompresión del VD7,8.
El objetivo principal del tratamiento en el período neonatal es establecer el flujo anterógrado a través del tracto de salida del VD con objeto de mejorar la oxigenación de la circulación sistémica arterial9. La literatura médica describe procedimientos tanto quirúrgicos como percutáneos1,10–15 para mitigar la obstrucción del VD y promover su desarrollo, aumentando así la probabilidad de que se pueda realizar una corrección biventricular en el futuro16,17.
Huelga decir que el enfoque elegido afectará la calidad de vida, la morbilidad y la mortalidad de los pacientes18. Como la APTI y la EPC son cardiopatías congénitas infrecuentes, la mayoría de las series publicadas incluyen menos de 30 pacientes19, lo que hace difícil sacar conclusiones sobre las distintas estrategias terapéuticas.
El objetivo del estudio era analizar los resultados a corto y a largo plazo durante 20 años de los pacientes con APTI y EPC, incluyendo aquellos con fístulas arteriales coronarias, e identificar los factores diferenciales entre ambos grupos.
Material y métodosSe realizó un estudio retrospectivo descriptivo, identificándose a todos los pacientes diagnosticados de APTI o EPC ingresados en la unidad de cuidados neonatales intensivos de nuestro hospital entre enero de 1996 y enero de 2018.
El estudio se llevó a cabo respetando los principios de la Declaración de Helsinki.
Los criterios de inclusión fueron el diagnóstico de APTI o EPC, independientemente del tamaño u otras características del ventrículo derecho.
Se excluyó a pacientes con comunicación interventricular, discordancia auriculoventricular y/o ventriculoarterial u otras malformaciones cardiovasculares importantes.
El estudio incluyó un total de 51 pacientes. Para cada paciente se revisaron las historias clínicas, ecocardiogramas, angiogramas e informes quirúrgicos disponibles. Se recogieron las siguientes variables de los historiales médicos: edad gestacional, peso, sexo, procedimiento inicial ofrecido, complicaciones, necesidad posterior de procedimientos adicionales en supervivientes y tipo de intervención realizada, y manejo adicional de la circulación biventricular o univentricular. También se recogió la causa del fallecimiento y la edad al morir de los pacientes que no sobrevivieron.
Se clasificó a los pacientes en grupos (hipoplasia leve, moderada o grave) en función de la puntuación z de la VT20, la morfología del VD, el diámetro del tracto de salida del VD y la presencia de fístulas arteriales coronarias a VD5,21.
Manejo en el período neonatalUna vez diagnosticada la APTI o la EPC se administró prostaglandina E1 de urgencia por vía intravenosa a los pacientes, con una dosis inicial de entre 0,005 y 0,1ng/kg/min. A continuación la dosis se redujo al máximo posible que garantizase una saturación de oxígeno de aproximadamente el 90%. No se practicó septostomía auricular con balón en ninguno de los pacientes. Cuando los neonatos se habían estabilizado y la resistencia vascular pulmonar había caído por debajo de la presión arterial sistémica fueron transferidos al laboratorio de cateterismo.
En el momento del estudio la actitud terapéutica empleada en neonatos con APTI o EPC consistía en técnicas percutáneas con balón, con o sin perforación con radiofrecuencia de la válvula pulmonar. En aquellos pacientes que requirieron perforación con radiofrecuencia, esta se realizó bajo control fluoroscópico con un cable 2F que suministraba 5W de energía durante uno o 2 segundos. Si la perforación se realizaba con éxito se procedía a dilatar la válvula pulmonar con un balón de 1,2 a 1,4 veces el tamaño del anillo pulmonar. Se consideró que el procedimiento era un éxito si se conseguía un gradiente de presión inferior a 30mmHg a través del tracto de salida del VD.
Tras establecerse el flujo pulmonar anterógrado se mantuvo la infusión de prostaglandina durante unos días más si la saturación de oxígeno seguía por debajo del 92%. Se consideró la realización de otra derivación en casos en los que no era posible retirar la prostaglandina. Si la saturación de oxígeno superaba el 92% se retiraba la infusión de prostaglandina.
La implantación de stent ductal fue la intervención de primera línea en pacientes en los que se consideraba necesaria una derivación adicional. En estos pacientes se mantuvo la infusión de prostaglandina hasta 4-6horas antes de la intervención. El abordaje más frecuente para el procedimiento fue mediante acceso femoral arterial, implantándose un stent de hasta 4mm de diámetro que atravesaba el conducto desde el lado aórtico.
En casos en los que la implantación de un stent ductal no fue posible (neonatos con ductus aneurismático o tortuoso, o recién nacidos de bajo peso) la siguiente opción a considerar era una derivación sistémico-pulmonar. El abordaje utilizado con mayor frecuencia fue la fístula de Blalock-Tausig modificada derecha (FBT). La posición de la fístula se eligió en función de consideraciones anatómicas.
No se descartó la realización de este procedimiento en pacientes con fístulas arteriales coronarias a VD, a los que se trató tal y como se ha descrito. El diagnóstico inicial de fístula arterial coronaria se realizó mediante ecocardiografía y se confirmó posteriormente en el laboratorio de cateterismo. En este grupo de pacientes la válvula pulmonar se dilató progresivamente con balones de distintos tamaños.
Procedimientos adicionalesLa elección de estrategia biventricular, de ventrículo y medio o de paliación univentricular se basó en la función y desarrollo del VD. La reparación biventricular se consideró un éxito cuando el flujo extrapulmonar ya no era necesario tras el cierre de la comunicación interauricular o cuando no hubo evidencia de desaturación sistémica en ausencia de cortocircuito derecha-izquierda interauricular en la ecocardiografía (saturación de oxígeno>92%). La corrección tipo ventrículo y medio consistió en la combinación de flujo anterógrado a través de las válvulas tricúspide y pulmonar con una anastomosis cavopulmonar superior (Glenn) o un shunt bidireccional a través de una comunicación interauricular en pacientes no sometidos a cirugía de Glenn con saturaciones de oxígeno inferiores al 92%. Se definió paliación univentricular como cirugía de Glenn sin flujo anterógrado a través de la válvula pulmonar o comunicación cavopulmonar total (Fontan).
Análisis estadísticoLas características de los pacientes se resumieron mediante estadísticos descriptivos, expresándose las variables continuas como media±desviación estándar si tenían una distribución normal y como mediana y rango en caso de distribución asimétrica, y las variables nominales como frecuencias absolutas y porcentajes. Se evaluaron las diferencias en variables relacionadas con el paciente en función de distintas medidas de resultado de interés mediante las pruebas U de Mann-Whitney, de Mantel-Cox o Chi cuadrado de Pearson según procediese. Se calcularon tasas de supervivencia por el método de Kaplan-Meier. La significación estadística se estableció en p<0,05. Los análisis se realizaron con el paquete estadístico IBM SPSS versión 22.
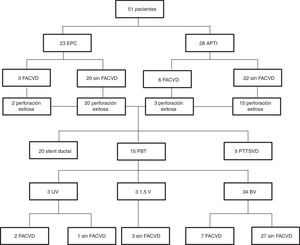
ResultadosUn total de 51 pacientes ingresaron en nuestro hospital con EPC (23 pacientes) o APTI (28 pacientes). De ellos 9 (17,6%) tenían fistulas arteriales coronarias a VD. El diagnóstico fue prenatal en 39 pacientes (76,5%), de los que solo 2 se diagnosticaron prenatalmente de fístulas arteriales coronarias a VD. Veintisiete pacientes (52,9%) eran niñas y 8 (15,7%) nacidos pretérmino (<37 semanas de edad gestacional). La incidencia de anomalías extracardíacas fue superior en pacientes con APTI comparados con los pacientes con EPC (21,4% vs. 4,3%, p=0,037). Las anomalías extracardíacas que se detectaron fueron enfermedad renal poliquística en 2, malrotación intestinal en 2, estenosis pilórica en uno, ventriculomegalia en uno y alteraciones de la sustancia blanca en otro. La tabla 1 compara la morfología del VD y las características de la VT en pacientes con APTI y pacientes con EPC.
Características demográficas y clínicas de los pacientes
| Variable | EPC (n=23) | APTI (n=28) | Valor de p |
|---|---|---|---|
| Sexo femenino | 12 (52,2%) | 15 (53,6%) | NS |
| EG±DE (semanas) | 37,7±3,8 | 38,7±2,0 | NS |
| Prematuridad (EG <37 semanas) | 4 (17,4%) | 4 (14,2%) | NS |
| Peso al nacer±DE (kg) | 2,85±0,80 | 3,11±0,59 | NS |
| RNBP | 3 (13,0%) | 5 (18,5%) | NS |
| Diagnóstico prenatal | 15 (65,2%) | 24 (85,7%) | NS |
| Anomalías extracardíacas | 1 (4,3%) | 6 (21,4%) | <0,05 |
| Morfología del VD | |||
| Tripartito | 19 (82,6%) | 22 (78,6%) | NS |
| Bipartito | 4 (17,4%) | 4 (14,2%) | NS |
| Unipartito | 0 | 2 (7,1%) | <0,05 |
| z-score de VT | –1,8±0,62 | –2,9±0,85 | <0,05 |
| z-score de TSVD | –2,65±1,18 | –3,64±1,63 | <0,05 |
| Anillo de VM (mm) | 13 (12-14) | 13 (12-14) | NS |
| Cociente VT/VM | 0,64 (0,55-0,71) | 0,86 (0,69-0,8) | <0,05 |
| FACVD | 3 (13%) | 6 (21,4%) | NS |
APTI: atresia pulmonar con tabique interventricular íntegro; DE: desviación estándar; EG: edad gestacional; EPC: estenosis pulmonar crítica; FACVD: fístula arterial coronaria a ventrículo derecho; NS: valor no significativo; RNBP: recién nacido de bajo peso (peso al nacer<p10); TSVD: tracto de salida del ventrículo derecho; VM: válvula mitral; VT: válvula tricúspide.
Los valores estadísticamente significativos se presentan en negrita.
La edad mediana de los pacientes en el momento de la primera intervención fue de 8 días (rango: 2-20) y el peso mediano 3,1kg (rango: 2,6-3,5). La edad mediana en el momento del primer procedimiento realizado en el laboratorio de cateterismo fue de 6 días (rango: 2-18), con una mediana de 12 días al realizarse el stent ductal (rango: 7-24 días) y de 10 días al realizarse la FBT (rango: 6-17 días). La tabla 1 compara las características principales de los 2 grupos.
La tabla 2 resume los procedimientos realizados en el período neonatal. En cuanto a la enfermedad, los pacientes con APTI necesitaron ventilación mecánica por un período más prolongado que los pacientes con EPC (3 días [1-56] vs. un día [1-7]; p<0,05). No encontramos diferencias adicionales en la evolución posquirúrgica al tener en cuenta la presencia de fístulas arteriales coronarias a VD.
Procedimientos empleados en el manejo neonatal y sus resultados
| Variable | EPC (n=23) | APTI (n=28) | Valor de p |
|---|---|---|---|
| Valvuloplastia con balón | 22 (95,7%) | 18 (64,2%) | NS |
| Radiofrecuencia+valvuloplastia con balón | 0 (0%) | 16 (57,1%) | <0,05 |
| Stent ductal | 5 (21,7%) | 15 (53,6%) | <0,05 |
| FBT modificada | 3 (13,1%) | 12 (46,4%) | <0,05 |
| PTTSVD | 4 (17,3%) | 1 (3,5%) | <0,05 |
| Duración MV post-op., días (rango) | 1 (1-7) | 3 (1-56) | <0,05 |
| Estancia hospitalaria, días (rango) | 27 (7-130) | 25 (8-83) | <0,05 |
| Mortalidad | 1 (4,3%) | 8 (28,6%) | <0,05 |
APTI: atresia pulmonar con tabique interventricular íntegro; EPC: estenosis pulmonar crítica; FBT: fístula Blalock-Taussig; PTTSVD: parche transanular en el tracto de salida del ventrículo derecho; VM: ventilación mecánica.
Los valores estadísticamente significativos se presentan en negrita.
Dos pacientes (2,8%) fallecieron durante el manejo neonatal. Uno estaba diagnosticado de APTI y el otro de EPC. Ninguno de ellos tenía una fístula arterial coronaria a VD. Un paciente desarrolló síndrome de bajo gasto cardíaco tras la implantación del stent ductal a raíz de un «shunt circular» producido por la regurgitación pulmonar y tricúspide y la disfunción del ventrículo derecho. El paciente no respondió a la ligadura quirúrgica urgente del ductus arterioso y desarrolló daño neurológico grave. Otro paciente, con diagnóstico asociado de síndrome CHARGE, experimentó una parada cardiorrespiratoria secundaria a fibrilación ventricular durante la cateterización.
Ninguno de los pacientes en los que se realizó apertura percutánea de la válvula pulmonar sufrió perforación del tracto de salida del VD. No se practicó septostomía auricular en ninguno de los pacientes durante el período neonatal.
Evolución a largo plazoLa duración mediana del seguimiento desde el ingreso en la muestra total fue de 8,9 años (rango: 1-16). Un total de 7 pacientes (13,7%) fallecieron durante el seguimiento. Hasta el momento se ha conseguido una circulación biventricular en 34 pacientes (85%), 3 (7,5%) fueron sometidos con éxito a corrección de tipo ventrículo y medio y 3 (7,5%) a paliación univentricular. En el subgrupo de la vía biventricular 10 pacientes requirieron cierre percutáneo de la comunicación interauricular. En 2 pacientes del grupo de supervivientes de APTI se ha realizado el procedimiento de derivación cavopulmonar bidireccional, pero aún no se ha programado la cirugía tipo Fontan. La tabla 3 presenta un resumen de estos resultados.
Estado final en supervivientes intervenidos en función de la presencia o ausencia de fístulas arteriales coronarias a ventrículo derecho
| FACVD (n=9) | Sin FACVD (n=31) | Valor de p | |
|---|---|---|---|
| Univentricular | 2 (22,2%) | 1 (3,2%) | <0,05 |
| Ventrículo y medio | 0 (0%) | 3 (9,6%) | <0,05 |
| Biventricular | 7 (77,8%) | 27 (87,1%) | NS |
FACVD: fístula arterial coronaria a ventrículo derecho; NS: valor no significativo.
Actualmente, de los pacientes con fístulas arteriales coronarias a VD, 7 tienen una circulación biventricular y 2 circulación univentricular. No hubo fallecimientos en este grupo. La figura 1 presenta un diagrama de flujo de estos resultados. En 8 pacientes se consiguió una circulación biventricular a pesar del fracaso inicial de la apertura percutánea del tracto de salida del VD. La clase funcional según la New York Heart Association fue de 1,2 en pacientes con reparación biventricular, 1,3 en pacientes con corrección tipo ventrículo y medio y 2,0 en los pacientes con paliación univentricular. No se encontraron diferencias entre grupos al tenerse en cuenta la presencia o ausencia de fístulas arteriales coronarias a VD.
Diagrama de flujo de los pacientes en función de la presencia o ausencia de circulación coronaria dependiente del ventrículo derecho.
APTI: atresia pulmonar con tabique interventricular íntegro; BV: biventricular; EPC: estenosis pulmonar crítica; FACVD: fístula arterial coronaria a ventrículo derecho; FBT: fistula Blalock-Taussig; PTTSVD: parche transanular en el tracto de salida del ventrículo derecho; UV: univentricular; 1,5V: ventrículo y medio.
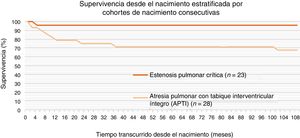
En nuestra muestra la supervivencia estimada a uno, 5 y 10 años del primer ingreso fue del 95% en todos los puntos en el grupo con EPC y del 80%, 70% y 68%, respectivamente, en el grupo con APTI, incluyendo a los pacientes con fístulas arteriales coronarias (fig. 2).
Por último, ninguno de los pacientes en la muestra sufrió complicaciones tales como rotura del VD durante el procedimiento de cateterización, ni requirió una septostomía auricular con balón.
DiscusiónLos resultados fueron más favorables en los pacientes con EPC comparados con los pacientes con APTI. Hasta la fecha casi todos los estudios publicados han incluido a pacientes con EPC o con APTI en la misma categoría22,23, pero los datos disponibles son suficientes para considerar estas cardiopatías entidades diferentes. La estrategia de apertura agresiva y precoz de la válvula pulmonar se asocia a una clase funcional mejor, lo que a su vez permite una corrección definitiva biventricular o de ventrículo y medio.
La supervivencia en nuestra población fue similar a la referida en estudios previos23,24. Al estratificar el análisis por tipo de cardiopatía congénita encontramos que la supervivencia a un año fue del 95,7% en el grupo con EPC y del 80% en el grupo con APTI a la misma edad. Como ya comentamos, casi todos los estudios en la literatura incluyen a pacientes con EPC y a pacientes con APTI en el mismo grupo, y consideramos que esto podría explicar las considerables diferencias en mortalidad entre distintos estudios6. No encontramos diferencias en la supervivencia en función de la presencia de fístulas arteriales coronarias a VD.
Algunos grupos consideran la presencia de fístulas arteriales coronarias a VD una contraindicación absoluta a la descompresión del VD. Teniendo en cuenta nuestros resultados, creemos que esto debería reevaluarse escrupulosamente. Si la descompresión no se realiza, la patofisiología de la enfermedad permanece inalterada. Esto implica que el suministro de oxígeno al miocardio dependerá de la presión de perfusión y la saturación de oxígeno en el VD, 2 parámetros que no mejorarán si no se realiza la descompresión. En primer lugar, si no se descomprime el VD continuará existiendo un cortocircuito derecha-izquierda a nivel auricular, lo que mantendrá la saturación de oxígeno en el VD en niveles bajos. En segundo lugar, las altas presiones en el VD producirán isquemia subendocárdica crónica y finalmente fallo del VD y una presión de perfusión baja. Esta situación conduce inevitablemente a la isquemia crónica y al empeoramiento de la función sistólica y diastólica del miocardio. Si no se realiza descompresión precoz del VD en el período neonatal, el lactante no tardará en requerir una intervención para excluir al VD de la circulación, lo que con el tiempo resulta en alteraciones hemodinámicas en el corazón que colocan al paciente en la vía univentricular. En nuestra serie se consiguió una circulación biventricular en casi el 80% de los pacientes con fístulas arteriales coronarias a VD tras practicarse descompresión del VD en el período neonatal.
A nuestro parecer es fundamental esperar a que la resistencia vascular pulmonar haya caído por debajo de la presión arterial para descomprimir el VD, normalmente tras la primera semana de vida. Con este objeto se debe administrar al paciente la menor cantidad posible de prostaglandina E1 que garantice el flujo pulmonar con una saturación de oxígeno de aproximadamente el 90%. Esta actitud también reporta beneficios tras la descompresión del VD, pues el ductus arterioso tendrá un tamaño menor y no contribuirá a la disfunción del VD al crearse un shunt circular. En casos como estos, con persistencia del ductus arterioso, si es de gran tamaño hay un riesgo considerable de shunt circular tras la descompresión del VD. Este estado es de difícil manejo en estos pacientes. En un estudio previo nuestro grupo demostró la utilidad del banding del ductus arterioso para el manejo favorable de esta situación25.
La derivación auricular es de rigor en estos pacientes cardíacos. La septostomía auricular con balón raramente es necesaria durante el período neonatal. Estudios previos han referido su realización de rutina. Nuestro grupo no realizó septostomías auriculares con balón en ninguno de los pacientes para evitar el posible desarrollo de un shunt circular, ya que el manejo de este fenómeno en el período neonatal es muy difícil. Además, un aumento del cortocircuito derecha-izquierda a este nivel contribuiría producir cianosis y disminuiría la probabilidad de desarrollo del VD y el árbol vascular pulmonar.
Una de las razones fundamentales para elegir la estrategia del stent ductal es reducir la mortalidad asociada a la FBT, de aproximadamente el 7%26. Cabe subrayar que en nuestra muestra no hubo fallecimientos en el grupo tratado con FBT (0/16), mientras que 2 pacientes en el grupo de stent ductal sí murieron (2/20). Pensamos que esto podría deberse a la estrategia neonatal de retrasar la apertura del tracto de salida del VD hasta que empieza a decrecer la resistencia arterial pulmonar. En contraposición a lo descrito por otros autores15, una vez abierto el VD, nuestro equipo no procedió a implantar el stent ductal o a practicar la FBT en la misma operación, sino que esperó a que el VD se adaptara a la presencia de flujo anterógrado con ayuda de la infusión de prostaglandina, de manera que la edad mediana fue de 12 días en el momento de colocarse el stent ductal y de 8 días en el momento de practicarse la FBT. Es posible que esto facilitara una transición de la circulación fetal a la neonatal balanceada, permitiendo el estrechamiento del ductus arterioso y previniendo el fenómeno de sobrecirculación asociado al gasto cardíaco bajo y al hiperflujo pulmonar que pueden desarrollarse con la colocación prematura del stent ductal o la FBT. En consecuencia, consideramos que en estos pacientes es crucial esperar al momento adecuado, que se determinará de manera individualizada.
Pocos estudios han descrito la evolución clínica de pacientes sometidos a corrección tipo ventrículo y medio27–29. En nuestra reducida muestra no encontramos diferencias en la clase funcional entre los pacientes con corrección tipo ventrículo y medio y los pacientes con corrección biventricular. En los 3 pacientes que acabaron con una fisiología de ventrículo y medio se cerró la comunicación interauricular y el VD exhibió un desarrollo adecuado con la función diastólica preservada tras la intervención quirúrgica. Dado que el reto principal en pacientes con VD borderline es la determinación de la vía a seguir en el manejo neonatal (biventricular o univentricular), consideramos que la estrategia inicial de apertura del tracto de salida del VD y la contribución de una fuente adicional de flujo pulmonar puede promover la adaptación del VD, rescatando así a pacientes que de otra manera hubieran acabado en la vía univentricular. En nuestra muestra se logró establecer una circulación biventricular en el 85% de los supervivientes, lo que supera la proporción reportada en casi todas las series publicadas15,30.
En consonancia con estudios previos30,31, la VT fue un determinante importante en la consecución de una circulación biventricular balanceada en nuestro estudio. El anillo tricúspide era mayor en pacientes con EPC en comparación con pacientes con APTI, lo que podría explicar la mayor morbilidad en el grupo con APTI.
Al contrario que en otras series7, en nuestro estudio ni los pacientes con EPC ni los pacientes con APTI sufrieron complicaciones asociadas a la cateterización, tales como perforación del miocardio o taponamiento cardíaco, lo que probablemente se debe a la considerable experiencia de nuestro equipo de cardiología.
Cabe señalar algunas de las limitaciones del presente estudio. Su diseño era unicéntrico y retrospectivo y la muestra reducida, lo que dificultó la comparación de resultados con otros estudios al incluir tan solo 9 pacientes con fístulas arteriales coronarias a VD.
Aunque continúa resultando difícil predecir la vía circulatoria que se acabará estableciendo en pacientes con APTI y EPC, nuestro grupo propugna la apertura precoz del VD en el período neonatal con objeto de aumentar las posibilidades de corrección biventricular. El manejo neonatal de estos pacientes ha de individualizarse, y es necesario diferenciar entre la EPC y la APTI, dado que su evolución es muy diferente. Además, consideramos que la apertura del VD combinada con un stent ductal o la FBT son intervenciones seguras y efectivas siempre y cuando se seleccione correctamente a los pacientes. También es importante realizar la intervención en el momento adecuado, cuando la resistencia vascular pulmonar comienza a disminuir, con objeto de facilitar el acoplamiento del VD y el flujo anterógrado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentaciones previas: el presente estudio se presentó en el 6.° Congreso de la European Academy of Paediatric Societies (EAPS), octubre 2016, Ginebra, Suiza; y en el 7.° World Congress of Pediatric Cardiology and Cardiac Surgery (WCPCCS), julio 2017, Barcelona, España.