Los beneficios de la leche donada frente a la fórmula artificial están demostrados, sin embargo no se conoce la influencia de la apertura de un banco de leche en la práctica clínica habitual. El objetivo de este estudio fue medir el impacto en la práctica clínica de la disponibilidad de leche donada para la nutrición de los prematuros ≤32semanas de edad gestacional.
MétodosEstudio antes-después de la apertura de un banco de leche. Se incluyeron los ≤32semanas nacidos en el Hospital 12 de Octubre de julio-diciembre de 2005 y de enero-junio de 2008 (6 primeros meses tras la apertura del banco de leche).
ResultadosLa apertura del banco de leche permitió empezar 31h antes (p<0,001) la alimentación enteral, se alcanzaron 59,5h antes los 100ml/kg/día (p<0,001) y 52h antes los 150ml/kg/día (p=0,002), permitiendo retirar 72h antes la nutrición parenteral. En ningún prematuro se inició la alimentación enteral con fórmula artificial, la exposición a la misma en los primeros 15días de vida bajó del 50 al 16,6% y su consumo durante los primeros 28días fue significativamente menor. La cantidad consumida de leche de la propia madre fue mayor, al igual que la tasa de lactancia materna exclusiva al alta (54 vs. 40%).
ConclusionesDisponer de leche donada ha permitido avanzar más rápidamente con la nutrición enteral y retirar antes la nutrición parenteral. La exposición a fórmula artificial ha sido menor y mayor el consumo de leche de madre propia y la lactancia materna al alta.
The benefits of donor human milk compared with artificial formulas have been well demonstrated; nevertheless the impact in the clinical practice of opening a human milk bank within a neonatal unit has not yet been studied. The main aim of this study was to analyze the impact on the clinical practice of opening a human milk bank in a neonatal unit to provide donor human milk for preterm infants≤32weeks of gestational age.
MethodsA before and after study was designed, with the intervention being the opening a human milk bank. Preterm infants ≤32weeks of gestational age born in the Hospital 12 Octubre from July to December 2005 and January to June 2008 (firsts 6 months after opening the human milk bank) were included.
ResultsAfter opening the human milk bank, enteral feedings were started 31h before (P<.001), 100ml/kg/day were achieved 59.5h before (P<.001) and 150ml/kg/day 52h before (P=.002). Enteral feedings were never started LM with artificial formula, the exposure to formula in the first 15 days of life was reduced from 50% to 16.6%, and it's consumption during the first 28 days of life was significantly reduced. There was a higher consumption of own mother's milk during the hospital stay, and a higher rate of exclusive breastfeeding at hospital discharge (54% vs 40%).
ConclusionsThe availability of donor human milk has led to quicker progression with enteral feedings and earlier withdrawal of parenteral nutrition. It has reduced the exposure to artificial formulas, and has also increased the intake of own mother's milk during the hospital stay and the rate of exclusive breastfeeding at hospital discharge.
La nutrición constituye uno de los pilares básicos de los cuidados de los recién nacidos hospitalizados, especialmente de los recién nacidos prematuros. Tal y como reconoce la Organización Mundial de la Salud, el alimento de elección es la leche de madre propia (LM), cuyos beneficios están demostrados sobre las fórmulas artificiales, tanto en los niños sanos como en los enfermos. En caso de que no se disponga de LM la siguiente alternativa recomendada para los prematuros de muy bajo peso es la leche materna donada y pasteurizada (LD) de donantes sanas seleccionadas1, siempre que se disponga de este recurso.
La alimentación enteral con fórmula artificial se ha relacionado con un aumento del riesgo de enterocolitis necrosante (ECN) en los recién nacidos de riesgo, especialmente los prematuros de muy bajo peso, si se compara con la alimentación con LM2–8. Ya en el año 1990 Lucas demostró que la ECN era de 6 a 10 veces más frecuente en los pacientes alimentados con fórmula artificial exclusiva, comparados con los que eran alimentados exclusivamente con LM y 3 veces más frecuente en los que tomaron lactancia mixta9. Con una evidencia científica menos sólida, también se ha demostrado que la LM confiere protección frente a la infección nosocomial, reduciendo el número de eventos infecciosos4. A largo plazo se han encontrado otros beneficios, como un mejor desarrollo psicomotor8,10,11 y la disminución de los factores de riesgo cardiovascular8,12,13.
Sin embargo, se han publicado hasta ahora pocos estudios que analicen qué otros posibles efectos beneficiosos podría tener la disponibilidad de LD en una unidad neonatal. Ante la inminencia de la apertura de un banco de leche en nuestro servicio se planteó la necesidad de realizar un estudio sobre el impacto clínico inmediato de la disponibilidad de LD, sobre todo en relación con la duración de la nutrición parenteral, el tiempo de retirada de las vías centrales y el impacto sobre la lactancia materna. Sabiendo los efectos beneficiosos de la LM, parecía poco ético realizar un ensayo aleatorizado y no administrar LD a todos los receptores posibles una vez estuviese disponible.
El banco de leche de nuestro centro se inauguró en diciembre de 2007. El objetivo de este estudio fue medir el impacto en la práctica clínica de la disponibilidad de LD para la nutrición de los prematuros nacidos con 32 semanas o menos.
MétodosDiseñoEstudio cuasiexperimental, prospectivo, de intervención con medida antes y después. Se considera intervención la disponibilidad de LD tras la apertura de un banco de leche en el Servicio de Neonatología suficiente para cubrir las necesidades de la población estudiada.
Consentimiento de los padresPara poder administrar LD a los pacientes, uno de los padres o tutores legales firmó un consentimiento informado, tras recibir información verbal y escrita. La LD se administró siempre bajo prescripción médica, durante todo el tiempo que el médico responsable del paciente lo consideró necesario. Solo se administró LD cuando no se dispuso de LM.
Grupos de estudioGrupo I: nacidos de julio a diciembre de 2005; grupo II: nacidos de enero a junio de 2008 (los 6 primeros meses de funcionamiento operativo del banco de leche).
Población de estudioSe incluyeron todos los recién nacidos prematuros de 32 o menos semanas de edad gestacional nacidos en nuestra maternidad, excluyendo a los portadores de cromosomopatías, enfermedades genéticas, malformaciones mayores y los que fallecieron en los primeros 7 días de vida.
Variables de estudioVariables principales: horas de vida a las que se inicia la alimentación enteral; horas de vida en que se alcanzan los 24ml/kg/día, los 100ml/kg/día y los 150ml/kg/día de alimentación enteral; horas con alimentación parenteral en los primeros 28 días de vida; horas con vías centrales en los primeros 28 días de vida; volumen de alimentación enteral administrado. Variables secundarias: número de episodios de sepsis confirmada; días de tratamiento con antibióticos o antifúngicos en los primeros 28 días de vida; número de episodios de ECN (grado ii de Bell o superior) y tratamiento quirúrgico de la ECN; displasia broncopulmonar a las 36 semanas de edad corregida; ductus arterioso persistente; puntuación de z de peso semanal y al alta.
Los datos se recogieron de las historias clínicas de los pacientes en el momento del alta hospitalaria por los autores del estudio.
Análisis de resultadosLas variables cuantitativas se definieron con la media y la mediana y parámetros de dispersión (desviación estándar o valores extremos). Las variables cualitativas se definieron en porcentajes. Para la comprobación de la normalidad de la distribución se utilizó el test de Kolmogorov-Smirnov. Las comparaciones de variables cuantitativas se realizaron con la t de Student para variables con distribución normal y la prueba no paramétrica de Mann-Whitney en el resto. Las variables cualitativas se analizaron con chi cuadrado, cuando la proporción de un resultado fue inferior a 5% se utilizó el test de Fisher. Se consideró significativo un error alfa inferior a 0,05.
El estudio fue aprobado por el Comité de Ética de Investigación Clínica del centro.
ResultadosEn el primer periodo de estudio nacieron 54 pacientes que cumplían los criterios de inclusión, 6 fallecieron en la primera semana de vida por lo que fueron excluidos del estudio, con lo que el grupo i quedó formado por 48 pacientes, de los que ninguno falleció durante la hospitalización. En el segundo periodo nacieron 52 pacientes que cumplían los criterios de inclusión de los que fallecieron 4. Así pues el grupo II quedó formado por 48 recién nacidos, de los cuales 2 fallecieron durante el ingreso después de la primera semana de vida. Las características demográficas de ambos grupos se resumen en la tabla 1.
Características demográficas de los 2 grupos de estudio
| Grupo I (n=48) | Grupo II II (n=48) | p | |
| Edad gestacional (semanas). Media (DE) | 29,2 (1,7) | 28,8 (1,9) | 0,29 |
| Peso al nacimiento (g). Media (DE) | 1.220 (317) | 1.187 (318) | 0,63 |
| Sexo, varón. N (%) | 23 (48) | 27 (56) | 0,41 |
| Gemelos. N (%) | 21 (44) | 15 (31) | 0,21 |
| Edad materna (años). Media (DE) | 31,9 (5,5) | 30,9 (6,1) | 0,37 |
| Cesárea. N (%) | 40 (83) | 34 (71) | 0,15 |
| Días de ingreso. Media (DE) | 55,9 (24) | 56,9 (2,7) | 0,8 5 |
| Edad corregida al alta. Media (DE) | 36,9 (2,6) | 36,9 (2,7) | 1 |
En el grupo ii se inició la alimentación enteral a una edad mediana de 21h (valores extremos 3 y 148h) y en al grupo i a las 52h (valores extremos 15 y 356h). Esta diferencia es significativa (p<0,001). También se alcanzaron antes los 24ml/kg/día de alimentación enteral (mediana grupo ii: 61h con valores extremos 26 y 278h; mediana del grupo i 120h con valores extremos 48 y 480h; p<0,001), los 100ml/kg/día (mediana grupo ii: 156,5h con valores extremos 73 y 556h; mediana del grupo i: 216horas con valores extremos 120 y 1.200h; p<0,001) y los 150ml/kg/día (mediana grupo ii: 248h con valores extremos 139 y 855horas; mediana del grupo i: 300h con valores extremos 216 y 1.296horas; p=0,002).
En el grupo ii no se inició la alimentación enteral con fórmula de prematuro (FP) en ningún caso. En un 42% (20/48) de los casos se inició con LM, en otro 42% (20/48) con LD y en el 16% (8/48) restante con una combinación de ambas. En el grupo i se inició la alimentación con LM en un 64% (31/48) de los niños, con FP en un 21% (10/48) y en el 15% restante (7/48) con una combinación de ambas. Se consideró «inicio de alimentación» el periodo de 24h tras la primera ingesta por vía enteral.
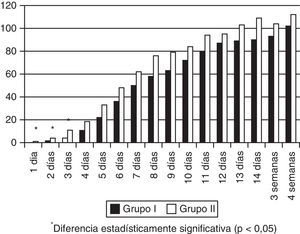
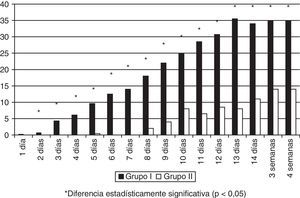
El consumo de LM fue mayor en el grupo ii en los 3 primeros días de vida, pero no hubo diferencias significativas durante el resto del tiempo de hospitalización (fig. 1). El 16,6% (8/48) de los niños en el grupo ii y el 50% (24/48) del grupo i se expusieron a fórmula artificial en los primeros 14días de vida (p=0,0005). En el grupo ii ningún niño consumió FP durante los primeros 4días de vida y el máximo consumo durante la primera semana de vida fue de 0,3ml/kg/día. El consumo de fórmula artificial fue muy significativamente menor en el grupo ii desde las 24h durante las primeras 4 semanas de vida (fig. 2).
Los pacientes del grupo ii precisaron nutrición parenteral una media de 193±157h y los del grupo i 265±221h (p=0,071). Las vías centrales se mantuvieron durante 172±120h en el grupo ii y durante 200±180h en el grupo i (p=0,38).
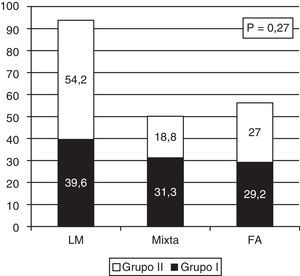
Las proporciones de lactancia materna exclusiva o mixta al alta en ambos grupos se presentan en la figura 3. Aunque las diferencias no tienen significación estadística, hubo una mayor tasa de lactancia materna exclusiva al alta en el grupo ii; 54% (26/48) por 39% (19/48) en el grupo I.
Con respecto a la morbilidad durante el ingreso, no se encontraron diferencias significativas en el número de episodios de sepsis por paciente confirmadas por hemocultivo (0,29 grupo ii vs. 0,31 grupo i; p=0,7) ni en la proporción de pacientes infectados (27% en el grupo ii vs. 31% en el grupo i; p=0,65). Tampoco se encontraron diferencias significativas en el número de días con tratamiento antibiótico (mediana del grupo ii: 5 días; mediana del grupo i: 7,5 días; p=0,079). Sin embargo el grupo ii recibió menos antifúngicos (5,2±7,6 días vs. 2,4±5; p=0,04).
La frecuencia de ECN fue menor en el grupo ii (2%) que en el grupo i (8,3%; p=0,3) pero sin significación estadística. La combinación de ECN o perforación intestinal aislada (grupo ii: 2%; grupo i: 12,5%; p=0,049) sí fue significativamente menor. No se encontraron diferencias en las frecuencias de ductus arterioso persistente con tratamiento médico o quirúrgico ni en la prevalencia de displasia broncopulmonar al alta (tabla 2).
Morbilidad durante el ingreso hospitalario en ambos periodos
| Variable | Grupo I | Grupo II | p |
| DAP+indometacina | 20/48 (41,7) | 16/48 (33,3) | 0,4 |
| DAP+cirugía | 5/48 (10,4) | 2/48 (4,2) | 0,44 |
| ECN | 4/48 (8,3) | 1/48 (2) | 0,3 |
| ECN+perforación | 6/48 (12,5) | 1/48 (2) | 0,049 |
| DBP 36 s | 6/48 (12,5) | 8/46 (17,4)a | 0,5 |
DAP: ductus arterioso persistente; DBP 36 s: displasia broncopulmonar a las 36 semanas de edad corregida; ECN: enterocolitis necrosante.
Los datos están expresados en número (porcentaje).
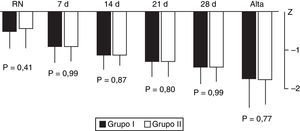
No se encontraron diferencias significativas en la ganancia ponderal durante el ingreso en ambos grupos, calculando la puntuación z del peso semanalmente desde el nacimiento hasta el alta (fig. 4).
Tampoco se modificó significativamente el tiempo de estancia hospitalaria (mediana grupo ii: 57 días, valores extremos 16 y 144; mediana grupo i: 51 días, valores extremos 25 y 165; p=0,8). La edad corregida media al alta fue la misma en ambos grupos: 36,9 semanas.
DiscusiónLa apertura del banco de leche en la unidad neonatal ha permitido iniciar antes la alimentación enteral de los recién nacidos prematuros, en una unidad que ya procuraba iniciar alimentación precozmente con LM. Al no tener que esperar a disponer de LM, se adelantó el inicio de la alimentación enteral 31h si consideramos la mediana y 36h si consideramos la media. Esta es una de las ventajas de disponer de LM desde el nacimiento14. Como además la tolerancia digestiva es mejor con LM que con fórmula artificial y no se depende de la disponibilidad de leche materna, se pudo avanzar más rápidamente con los aportes enterales; de tal forma que se alcanzaron mucho antes los 100ml/kg/día (59,5h antes si consideramos la mediana y 105h si consideramos la media) y los 150ml/kg/día (52h antes si consideramos la mediana y 101h si consideramos la media). Estos hallazgos coinciden con los descritos en un estudio previo, que encontró que los pacientes que consumían fundamentalmente LM alcanzaban los 150ml/kg/día 5 días antes que los que tomaban poca15.
Al alcanzarse antes la nutrición enteral completa, se puede suspender antes la nutrición parenteral y se pueden retirar antes las vías centrales. En nuestro estudio no se encontraron diferencias significativas, pero la tendencia es clara y sería probablemente significativa en una muestra mayor.
Se dispone de fuerte evidencia que demuestra que la alimentación con fórmulas artificiales en esta población incrementa el riesgo de ECN y varios estudios encuentran asociación con otros riesgos a corto y a largo plazo2–8. Se han descrito unos periodos en los que la exposición es especialmente crítica16. El primero es el inicio de la alimentación, cuando cumple sus funciones el calostro. Aunque parte de este efecto beneficioso se pierde cuando la alimentación se inicia con leche madura pasteurizada, al menos se evita la exposición a la fórmula artificial. La disponibilidad de LD no ha retrasado la extracción de leche por parte de las madres; de hecho, la cantidad de LM consumida durante los 3 primeros días de vida fue mayor que antes, con una diferencia estadísticamente significativa.
La restricción del uso precoz de las fórmulas artificiales es importante en esta población. Se ha encontrado una relación dosis-respuesta entre la cantidad de LM ingerida en las primeras 4 semanas y la disminución de patologías propias de los prematuros como la intolerancia digestiva, la infección nosocomial, la ECN, la retinopatía de la prematuridad y la displasia broncopulmonar14–17. Visto desde el lado opuesto, a mayor exposición a fórmulas artificiales, mayor riesgo. El consumo de fórmula artificial ha disminuido significativamente durante las 4 primeras semanas de vida, siendo prácticamente nulo en la primera semana (ver figs. 1 y 2). El aumento de consumo de LM que se ha producido no es significativo, pero sí suficiente para desmentir uno de los argumentos de los detractores de los bancos de leche: disponer de LD no tiene por qué conducir a una relajación de las prácticas de fomento de la lactancia materna en las unidades. Se puede considerar exitosa una tasa de lactancia exclusiva al alta del 54% y lactancia parcial de un 19% adicional. En un estudio multicéntrico realizado en 8 regiones europeas encontraron una tasa de lactancia materna exclusiva al alta que variaba entre el 29% en Trento (Italia) y el 9% en Polonia18. En otro19 se analizaron 12 unidades neonatales de nivel iii en Italia, encontrando una tasa de lactancia materna exclusiva al alta que oscilaba entre el 0 y el 69%. En Italia se hizo también un estudio comparando la tasa de lactancia materna al alta en unidades neonatales con banco de leche y unidades neonatales que no lo tenían20, observándose una mayor tasa de lactancia materna exclusiva al alta en las unidades que sí tenían banco de leche (29,6 vs. 16%). En otro trabajo realizado en 99 unidades de cuidados intensivos californianas21 encontraron una tasa media del 62,5% de lactancia materna exclusiva al alta.
No se encontraron diferencias en la frecuencia de sepsis ni en la exposición a antibióticos. La reducción que se ha observado en la utilización de antifúngicos probablemente sea debida a cambios en las políticas de trabajo en la unidad, en relación con la disminución de las infecciones invasivas por Candida en los últimos años.
Algunos autores han encontrado que los niños alimentados con LM durante su ingreso se van antes de alta, incluso aunque la ganancia ponderal sea menor22, posiblemente en relación con una menor gravedad de la patología durante su ingreso. También se ha comunicado una menor ganancia ponderal en los prematuros alimentados con LD pasteurizada comparados con los alimentados con leche cruda de su madre23. En el presente estudio no se encontraron diferencias entre los grupos.
La menor frecuencia de enterocolitis o perforación intestinal encontrada puede estar condicionada por el hecho de que en el primer periodo de estudio hubo varios casos asociados a infección por rotavirus, lo que no ocurrió en el segundo periodo. La tasa del 12,5% no es la habitual de la unidad, pero sí lo es actualmente una tasa de enterocolitis entre el 2 y el 3% en esta población.
Este estudio tiene varias limitaciones. La primera es no haber aleatorizado la intervención por los condicionantes expuestos previamente. Otra limitación es que se han comparado 2 grupos de pacientes en periodos de tiempo relativamente alejados entre sí, por lo que no podemos excluir que los resultados que se han observado estén relacionados con otros cambios en la práctica clínica en la unidad. El motivo de esta separación es que el estudio fue diseñado en el año 2005 previendo la apertura del banco con financiación en el año 2006. Al retrasarse la financiación, la muestra del grupo ii se obtuvo 3 años más tarde, en el primer semestre de funcionamiento del banco de leche.
A pesar de sus limitaciones, nuestro estudio aporta datos adicionales a la escasa información que existe sobre el impacto en la práctica clínica de la apertura de un banco de leche en una unidad neonatal24. Para poder generalizar estos resultados sería deseable contar con datos de otros bancos y otras unidades neonatales. De todas formas parece claro que la disponibilidad de LD hace que el número de niños que se exponen a la fórmula en un periodo crítico de su desarrollo disminuya significativamente y que se les pueda alimentar por vía enteral más precozmente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado en: Ponencia en el: 1st International Congress of the European Milk Bank Association (EMBA). Lisboa (Portugal), 5-6 de octubre de 2012. Una comunicación oral en el VI Congreso Español de Lactancia Materna y 3.a Reunión de Bancos de Leche Humana. Ávila, 7-9 de abril de 2011. Dos comunicaciones orales en el XXII Congreso de Neonatología y Medicina Perinatal de la Sociedad Española de Neonatología. Valencia, 14-16 de octubre de 2009.