Se ha descrito la regeneración del timo tras la quimioterapia en niños con linfoma y, para evitar diagnosticar incorrectamente estos casos como recurrencias, los facultativos han de familiarizarse con la hiperplasia tímica de rebote (HTR) y tener en consideración su posible ocurrencia. Nuestro objetivo fue estimar la prevalencia de HTR en niños con linfoma tras la quimioterapia y evaluar las características clínicas, evolución y hallazgos de las pruebas de imagen mediante tomografía computarizada (TC) y la gammagrafía con galio 67 (GA-67).
Pacientes y métodosEstudio retrospectivo transversal, mediante la revisión de las historias clínicas de niños diagnosticados de linfoma, realizado en la Clínica Ambulatoria de Oncología Infantil del Centro de Oncología de Yeda, Arabia Saudita.
ResultadosSe detectó HTR en el 51,9% de los pacientes con linfoma (14/27 pacientes). La HTR ocurrió una mediana de 2,5 meses tras finalizarse el tratamiento (rango: 2,0-4,25 meses). Los pacientes con HTR recibieron tratamientos significativamente más cortos, y no se observaron diferencias entre pacientes con y sin HTR en cuanto al sexo, la edad al diagnóstico, el tipo de linfoma o el tipo de tratamiento recibido. Todos los pacientes con HTR se encontraban asintomáticos y las pruebas rutinarias de laboratorio no evidenciaron alteraciones. La TC y la GA-67 fueron altamente sugestivas de HTR. Ninguno de los pacientes con HTR tuvieron recurrencias y la HTR se resolvió espontáneamente en una mediana de 6 meses (rango: 4,0-11,0 meses).
ConclusiónSe detectó HTR en alrededor del 50% de los niños con linfoma tras completarse el tratamiento. La evaluación clínica, pruebas de laboratorio, TC y gammagrafía con GA-67 resultan útiles para identificar la HTR y descartar otras lesiones en otras localizaciones.
Thymic regrowth after chemotherapy treatment has been reported in children with lymphoma, and in order to avoid misdiagnosing these cases as relapses, physicians should become familiar with rebound (reactive) thymic hyperplasia (RTH) and remain aware of its possible occurrence. We aimed to estimate the prevalence of RTH in children with lymphoma after completion of chemotherapy and to evaluate the clinical characteristics, outcomes, and the findings of computed tomography (CT) and gallium-67 (GA-67) scans in these patients.
Patients and methodsWe conducted a retrospective cross-sectional study by reviewing the health records of children with a lymphoma diagnosis managed at an outpatient paediatric oncology clinic in Jeddah, Saudi Arabia.
ResultsRebound thymic hyperplasia was detected in 51.9% of the lymphoma patients (14/27). It developed a median of 2.5 months after completion of chemotherapy (range, 2.0-4.25 months). Patients with RTH had significantly shorter treatment durations, and we found no significant differences between patients with and without RTH in sex, age at diagnosis, type of lymphoma or type of treatment received. All patients with RTH were asymptomatic, and routine laboratory tests did not detect any abnormalities in them. The findings of CT and GA-67 scans were highly suggestive of RTH. None of the patients with RTH had a recurrence, and RTH resolved spontaneously within a median of 6 months (range, 4.0-11.0).
ConclusionRTH was detected in ∼50% of children with lymphoma after completion of chemotherapy. A clinical evaluation and laboratory tests combined with imaging by CT and GA-67 can help identify RTH and rule out other lesions elsewhere.
El timo es un órgano sensible que responde con cambios atróficos a factores de estrés tales como la fiebre, la malnutrición, la quimioterapia, la radioterapia y la corticoterapia. Tras la atrofia inicial, puede recuperar su tamaño original o incluso mostrar un efecto rebote, alcanzando un tamaño aún mayor que el anterior1,2. La regeneración tras la quimioterapia se ha observado más frecuentemente en niños y adolescentes que en adultos3-6. Se han descrito casos de hiperplasia tímica en niños afectos de linfoma7-9. Esta regeneración fisiológica del timo tras la quimioterapia, o rebote tímico, induce involución10.
Los médicos han de familiarizarse con la hiperplasia tímica de rebote (HTR) y tenerla en cuenta en su práctica, pues la malinterpretación de este fenómeno puede dar lugar a la prolongación de tratamientos tóxicos e innecesarios de quimioterapia o a una exposición excesiva a radiación ionizante, así como a las intervenciones de riesgo asociadas, como la biopsia, la aspiración con aguja o la timectomía11-13. Aunque puede suponer un reto, es de vital importancia diferenciar entre la HTR y la recurrencia o metástasis de un tumor mediastínico. Si la HTR se diagnostica erróneamente como un tumor maligno o recurrente, el resultado es la administración de tratamiento innecesario; y por el contrario, si un tumor mediastínico maligno se diagnostica incorrectamente como HTR, pueden retrasarse tratamientos cruciales para salvar vidas7. En caso de sospecha de masa mediastínica, el patrón oro para el diagnóstico continúa siendo el análisis patológico de una biopsia quirúrgica, pero esto conlleva los riesgos asociados a la anestesia general y la cirugía. Por lo tanto, se considera importante agotar todas las posibles medidas no invasivas, tales como la evaluación clínica, la analítica y las pruebas de imagen, para diagnosticar correctamente posibles casos de HTR en pacientes con linfoma tras completarse la quimioterapia7.
Muchos errores médicos y de diagnóstico se pueden evitar mediante el uso de técnicas de imagen, y la tomografía computarizada (TC), la tomografía por emisión de positrones (PET) y la gammagrafía con galio 67 (GA-67) proveen datos inestimables para guiar la crucial diferenciación entre la HTR y los tumores mediastínicos7-9. Son escasos los estudios que han evaluado a niños afectos de HTR mediante TC8, PET7 y GA-679.
El objetivo del estudio era estimar la prevalencia de la HTR en supervivientes pediátricos de linfoma tras la conclusión del tratamiento y también documentar y analizar la presentación clínica y los resultados de laboratorio y de imagen mediante TC y GA-67 de casos de HTR. También consideramos relevante analizar los factores de riesgo asociados y la evolución de la HTR.
Pacientes y métodosTras obtenerse la aprobación del Comité de Revisión Institucional de King Abdullah Medical City (KAMC), se realizó un estudio retrospectivo transversal, recogiéndose datos de las historias clínicas de niños supervivientes de linfoma durante el período 2008-2013. Los pacientes continuaban bajo seguimiento a mes de febrero de 2018 en el Centro de Oncología del KAMC en la ciudad de Yeda, Arabia Saudita. Todos los pacientes pediátricos incluidos en el seguimiento a largo plazo tenían edades de entre 1 y 18 años, habían completado la quimioterapia y tenían diagnósticos de linfoma de varios tipos, incluyendo Hodgkin y no Hodgkin. Se analizaron las historias clínicas de todos los pacientes que desarrollaron HTR, recogiendo datos clínicos tales como la edad al diagnóstico, el sexo, el tipo de linfoma, el tratamiento prescrito y su duración, y resultados de pruebas de laboratorio tras la detección de HTR, que proporcionaron información relevante, incluyendo los valores del hemograma y los niveles séricos de proteína C reactiva (PCR), lactato deshidrogenasa (LDH) y ferritina.
La HTR se identificó con base en un aumento en el tamaño del timo en relación con una prueba de TC previa tras completarse la quimioterapia. Los resultados de la GA-67 también se analizaron al detectarse la HTR. No se pudieron realizar estudios mediante PET, ya que la técnica no estaba disponible en nuestro ámbito y su coste se consideró excesivo.
Análisis estadísticoEl análisis estadístico se realizó con el paquete SPSS versión 18.0 para Windows (SPSS Inc.; Chicago, EE.UU.). Se expresaron los datos categóricos mediante frecuencias absolutas y porcentajes, y los datos cuantitativos mediante la media±desviación estándar (DE). La comparación de variables categóricas se realizó con el test t de Student o la prueba de la χ2. La significación estadística se estableció en p<0,05.
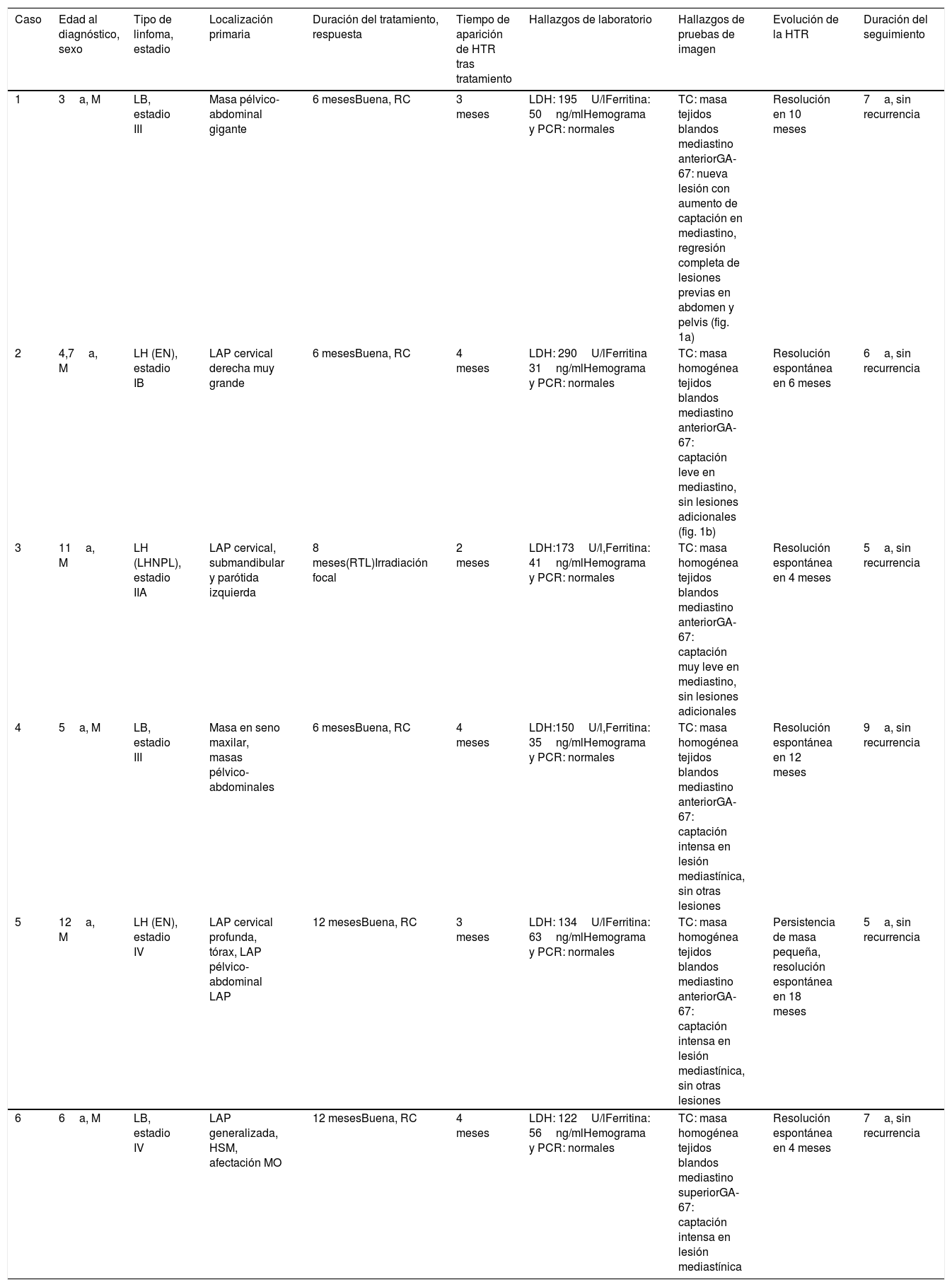
ResultadosDe los 35 pacientes con linfoma elegibles, solo se incluyeron 27 para los que se obtuvieron datos completos. La tabla 1 presenta las características de los pacientes en la muestra final. Catorce pacientes desarrollaron HTR tras la quimioterapia. La HTR apareció una mediana de 2,5 meses después de completarse el tratamiento (rango: 2,0-4,25 meses), durando entre 4,0 y 11,0 meses, con una duración mediana de 6 meses (tabla 2).
Características de los pacientes
| Muestra total27 pacientes(100%) | Pacientes con HTR14 pacientes(51,9%) | Pacientes sin HTR13 pacientes(48,1%) | p | ||
|---|---|---|---|---|---|
| Sexo | |||||
| Masculino: Femenino | 15 (58%): 12 (42%) | 4 (28,6%): 10 (71,4%) | 8 (61,5%): 5 (38,5%) | 0,09 | |
| Edad al diagnóstico (años) | |||||
| Media±DE | 6,93±3,02 | 7,0±3,35 | 6,8±2,75 | 0,84 | |
| Mediana (RIC) | 6,0 (4,0-9,0) | 6,0 (4,5-11,0) | 7 (4,0-9,0) | ||
| [Mínimo-máximo] | [3,0-12,0] | [3,0-11,0] | [3,0-12,0] | ||
| Tipo de linfoma | |||||
| Hodgkin | 9 (33,3%) | 4 (28,6%) | 5 (38,5%) | 0,44 | |
| No Hodgkin | 18 (66,7%) | 10 (64,3%) | 8 (61,5%) | ||
| Estadio | |||||
| I-II | 7 (25,9%) | 3 (21,4%) | 4 (31,6%) | 0,75 | |
| III-IV | 20 (74,1%) | 11 (78,6%) | 9 (68,4%) | ||
| Recurrencia | |||||
| Sí | 2 (7,4%) | 0 | 2 (15,4%) | 0,12 | |
| No | 25 (92,6%) | 14 (100%) | 11 (84,6%) | ||
| Corticoterapia | |||||
| Sí | 22 (81,5%) | 12 (85,7%) | 10 (76,9%) | 0,64 | |
| No | 5 (18,5%) | 2 (14,3%) | 3 (23,1%) | ||
| Radioterapia | |||||
| Sí | 7 (25,9%) | 2 (14,3%) | 5 (61,5%) | 0,20 | |
| No | 20 (74,1%) | 12 (85,7%) | 8 (38,5%) | ||
| Duración de tratamiento (meses) | |||||
| Media±DE | 9,74±2,66 | 8,71±2,78 | 10,84±2,11 | 0,035* | |
| Mediana (RIC) | 10,0 (8,0-12,0) | 8,0 (6,0-12,0) | 12 (8,5-12,5) | ||
DE: desviación estándar; HTR: hiperplasia tímica de rebote; RIC: rango intercuartílico.
Características clínicas, analíticas y de imagen de los pacientes con hiperplasia tímica de rebote
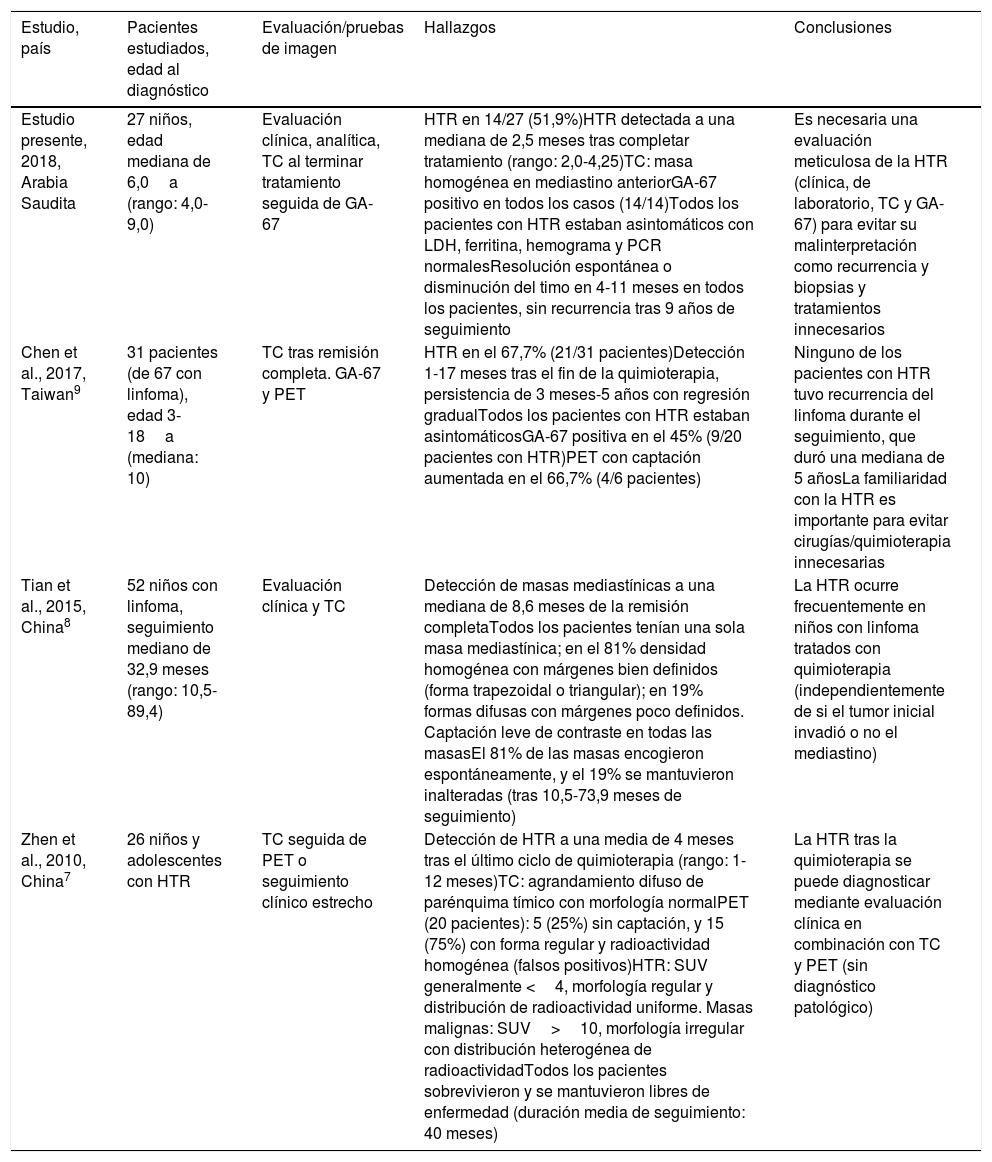
| Caso | Edad al diagnóstico, sexo | Tipo de linfoma, estadio | Localización primaria | Duración del tratamiento, respuesta | Tiempo de aparición de HTR tras tratamiento | Hallazgos de laboratorio | Hallazgos de pruebas de imagen | Evolución de la HTR | Duración del seguimiento |
|---|---|---|---|---|---|---|---|---|---|
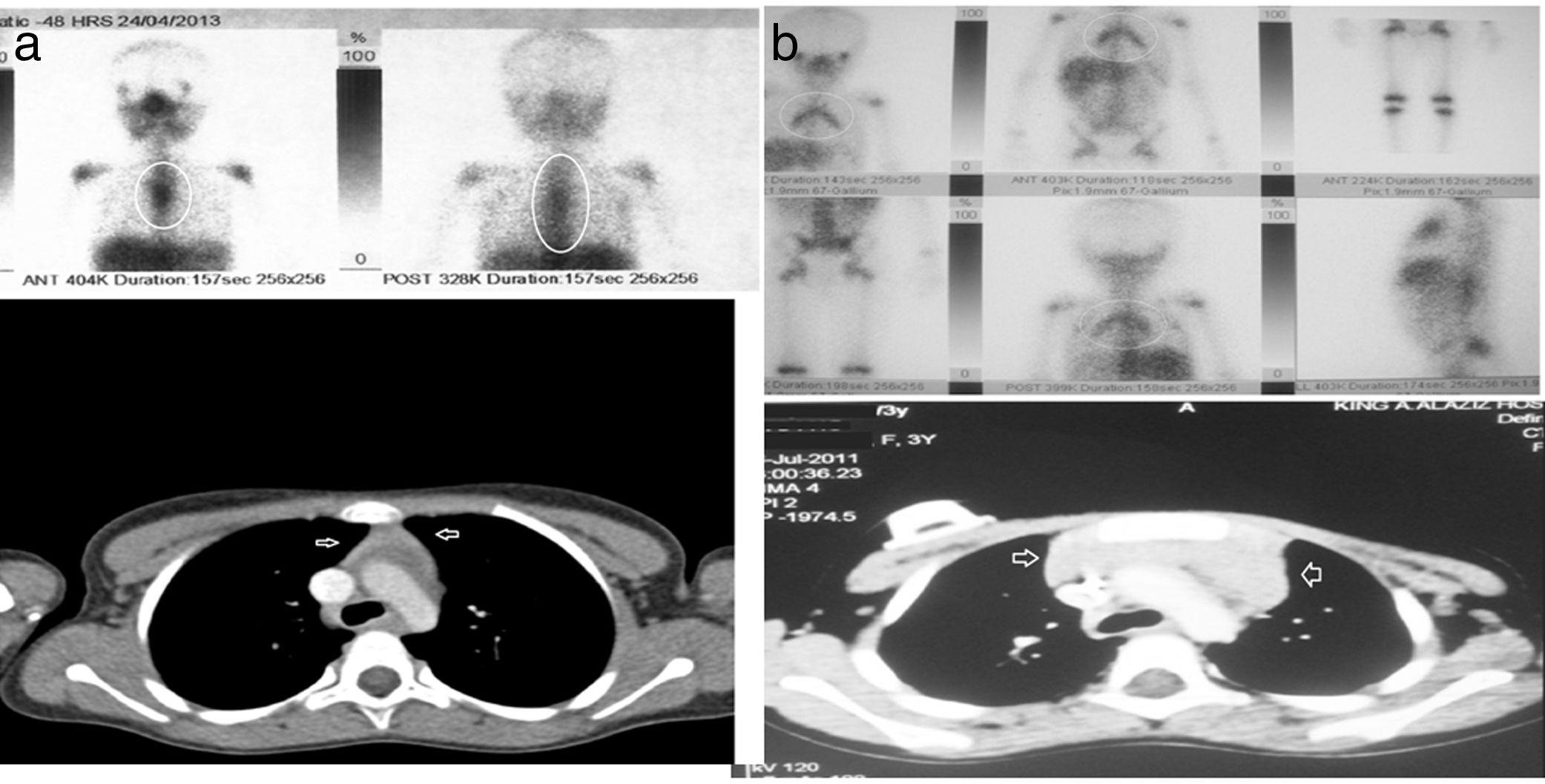
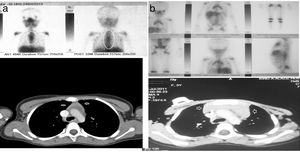
| 1 | 3a, M | LB, estadio III | Masa pélvico-abdominal gigante | 6 mesesBuena, RC | 3 meses | LDH: 195U/lFerritina: 50ng/mlHemograma y PCR: normales | TC: masa tejidos blandos mediastino anteriorGA-67: nueva lesión con aumento de captación en mediastino, regresión completa de lesiones previas en abdomen y pelvis (fig. 1a) | Resolución en 10 meses | 7a, sin recurrencia |
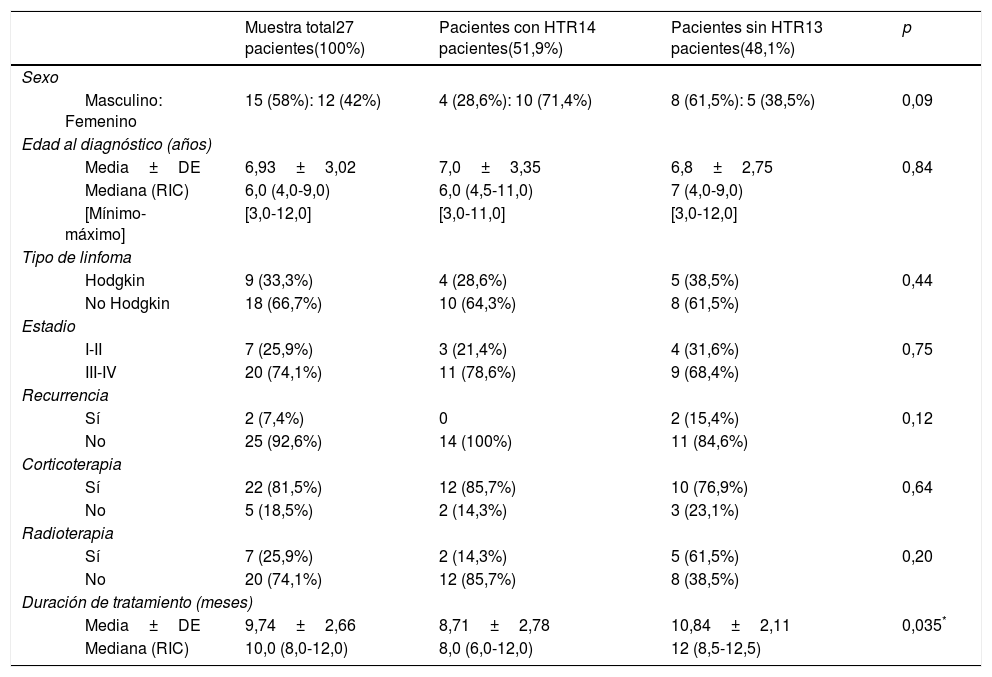
| 2 | 4,7a, M | LH (EN), estadio IB | LAP cervical derecha muy grande | 6 mesesBuena, RC | 4 meses | LDH: 290U/lFerritina 31ng/mlHemograma y PCR: normales | TC: masa homogénea tejidos blandos mediastino anteriorGA-67: captación leve en mediastino, sin lesiones adicionales (fig. 1b) | Resolución espontánea en 6 meses | 6a, sin recurrencia |
| 3 | 11a, M | LH (LHNPL), estadio IIA | LAP cervical, submandibular y parótida izquierda | 8 meses(RTL)Irradiación focal | 2 meses | LDH:173U/l,Ferritina: 41ng/mlHemograma y PCR: normales | TC: masa homogénea tejidos blandos mediastino anteriorGA-67: captación muy leve en mediastino, sin lesiones adicionales | Resolución espontánea en 4 meses | 5a, sin recurrencia |
| 4 | 5a, M | LB, estadio III | Masa en seno maxilar, masas pélvico-abdominales | 6 mesesBuena, RC | 4 meses | LDH:150U/l,Ferritina: 35ng/mlHemograma y PCR: normales | TC: masa homogénea tejidos blandos mediastino anteriorGA-67: captación intensa en lesión mediastínica, sin otras lesiones | Resolución espontánea en 12 meses | 9a, sin recurrencia |
| 5 | 12a, M | LH (EN), estadio IV | LAP cervical profunda, tórax, LAP pélvico-abdominal LAP | 12 mesesBuena, RC | 3 meses | LDH: 134U/lFerritina: 63ng/mlHemograma y PCR: normales | TC: masa homogénea tejidos blandos mediastino anteriorGA-67: captación intensa en lesión mediastínica, sin otras lesiones | Persistencia de masa pequeña, resolución espontánea en 18 meses | 5a, sin recurrencia |
| 6 | 6a, M | LB, estadio IV | LAP generalizada, HSM, afectación MO | 12 mesesBuena, RC | 4 meses | LDH: 122U/lFerritina: 56ng/mlHemograma y PCR: normales | TC: masa homogénea tejidos blandos mediastino superiorGA-67: captación intensa en lesión mediastínica | Resolución espontánea en 4 meses | 7a, sin recurrencia |
| 7 | 13a, V | LNH, LDCBG, estadio IIIB | LAP cervical bilateral, amígdala izquierda muy agrandada | 8 mesesBuena, RC | 14 meses | Neutropenia recurrente, celulitis, infecciones respiratorias fúngicas y viralesLDH: 534U/lFerritina: 663ng/mlHemograma normal, PCR: 35mg/l, CD4/CD8 disminuido, Ig normal | TC: agrandamiento mediastínico anteriorGA-67: captación intensa en lesión mediastínica | Desconocida | 1a, pérdida en seguimiento ¿inmunodeficiencia? |
| 8 | 4a, M | LB, estadio III | Masa y obstrucción intestinal | 6 mesesBuena, RC | 2 meses | LDH: 140U/lFerritina: 45ng/mlHemograma y PCR: normales | TC: masa homogénea tejidos blandos mediastino anteriorGA-67: captación leve en lesión mediastínica, sin otras lesiones | Resolución en 12 meses | 11a, sin recurrencia |
| 9 | 11a, V | LH (EN), estadio IIA | LAP cervical bilateral | 6 mesesRadiación a dosis baja (RTCA) | 2 meses | LDH: 102U/lFerritina: 36ng/mlHemograma y PCR: normales | TC: masa tejidos blandos mediastino anteriorGA-67: captación intensa en lesión mediastínica, sin otras lesiones | Resolución en 9 meses | 9a, sin recurrencia |
| 10 | 8a, M | LNH, LDCBG, estadio III | LAP cervical bilateral, afectación amigdalar y mediastínica, HSM | 6 mesesBuena, RC | 2 meses | LDH: 175U/lFerritina: 56ng/mlHemograma y PCR: normales | TC: masa tejidos blandos mediastino anteriorGA-67: captación intensa en lesión mediastínica, sin otras lesiones | Resolución espontánea en 6 meses | 7a, sin recurrencia |
| 11 | 5a, V | LB, estadio IV | LAP generalizada | 12 mesesBuena, RC | 2 meses | LDH: 166U/lFerritina: 34ng/mlHemograma y PCR: normales | TC: forma oval, mediastino agrandadoGA-67: captación en forma oval (punto caliente), sin otras lesiones | Resolución en 4 meses | 7a, sin recurrencia |
| 12 | 6,5a, M | LNH, LACG, estadio IV | Fiebre, dolores de huesos, lesiones en pelvis ósea | 10 mesesBuena, RC | 1,5 meses | LDH: 188U/lFerritina: 25ng/mlHemograma y PCR: normales | TC: masa tejidos blandos mediastino anteriorGA-67: captación levemente aumentada en mediastino, sin otras lesiones | Resolución en 3 meses | 9a, sin recurrencia |
| 13 | 3,5a, M | LB, estadio IV | Masa y obstrucción intestinal | 12 mesesBuena, RC | 2 meses | LDH: 210U/lFerritina: 49ng/mlHemograma y PCR: normales | TC: masa tejidos blandos mediastino anteriorGA-67: captación levemente aumentada en mediastino, sin otras lesiones | Resolución en 4 meses | 10a, sin recurrencia |
| 14 | 6a, V | LB, estadio IV | Masa epigástrica, LAP generalizada | 12 mesesBuena, RC | 2 meses | LDH: 193U/lFerritina: 28ng/mlHemograma y PCR: normales | TC: masa tejidos blandos mediastino anteriorGA-67: captación leve en mediastino, sin otras lesiones | Resolución en 6 meses | 4a, sin recurrencia |
a: año; EN: esclerosis nodular; GA-67: gammagrafía con galio 67; HSM: hepatoesplenomegalia; HTR: hiperplasia tímica de rebote; Ig: inmunoglobulinas; LAP: linfadenopatía; LDH: lactato deshidrogenasa; M: mujer; LACG: linfoma anaplásico de células grandes; LB: linfoma de Burkitt; LDCBG: linfoma difuso de células B grandes; LH: linfoma de Hodgkin; LHNPL: linfoma de Hodgkin nodular de predominio linfocítico; LNH: linfoma no Hodgkin; MO: médula ósea; PCR: proteína C reactiva; RC: respuesta completa; RTCA: radioterapia en campo afecto; RTL: respuesta temprana lenta; TC: tomografía computarizada; V: varón.
La duración de la quimioterapia fue menor en los pacientes con HTR en comparación con aquellos sin HTR. No se encontraron diferencias significativas entre los pacientes con y sin HTR en otras variables incluyendo el sexo, la edad al diagnóstico, el tipo o el estadio de linfoma y la radioterapia o la corticoterapia. Tampoco hubo diferencias significativas en el tiempo transcurrido entre la quimioterapia y el desarrollo de la HTR o la duración de esta última. Todos los pacientes con HTR estaban asintomáticos y no presentaron fiebre, pérdida de peso, hiperhidrosis ni síntomas torácicos tales como distrés respiratorio, tos, disnea o dolor o sensación de presión en el tórax. La evaluación clínica y el examen físico del tórax fueron normales en todos los pacientes con HTR. Tampoco se evidenció adenopatía o masas u organomegalias abdominales a la palpación.
En el momento de detectarse la HTR, todos los hallazgos de laboratorio fueron normales, incluyendo el hemograma, el recuento linfocitario y los niveles séricos de PCR, LDH y ferritina. Tan solo un paciente (el paciente 7 en la tabla 2) exhibió neutropenia recurrente e infecciones virales/fúngicas durante un período largo, sospechándose inmunodeficiencia, pero desafortunadamente el paciente abandonó el seguimiento, por lo que no conocemos su evolución. No se requirieron procedimientos invasivos para diagnosticar la HTR en ninguno de los pacientes. En pacientes con HTR, la TC reveló un aumento de tamaño homogéneo en el mediastino anterior a nivel del timo en la forma característica de este último —masa oval o triangular, aunque en un único paciente se evidenció un timo bilobulado— en ausencia de masas adicionales o inflamación ganglionar a otros niveles. La GA-67 reveló un patrón homogéneo de aumento de captación en el mediastino anterior, sin captación en ganglios u otras lesiones, como se puede observar en la figura 1a y b, correspondiente a los pacientes 1 y 2 de la tabla 2. En todos los pacientes, la GA-67 mostró aumento de captación en el timo, que desapareció en las imágenes de seguimiento. Lo esencial es que la ausencia de captación en los ganglios u otras regiones en la TC y la GA-67 era altamente indicativa de HTR, lo que se confirmó con la regresión del timo agrandado en pruebas de imagen sucesivas. La HTR regresó y se resolvió en un tiempo que osciló entre los 4 y 11 meses, con una mediana de 6 meses. Ninguno de los pacientes con HTR presentó recurrencia durante el seguimiento a largo plazo, de 5 a 9 años de duración.
a y b) Imágenes de TC y GA-67 de dos pacientes con hiperplasia tímica de rebote (pacientes 1 y 2 en la tabla 2).
La hiperplasia tímica auténtica es un fenómeno de rebote caracterizado por un aumento de peso y tamaño de la masa del timo en respuesta a una situación de estrés, como la corticoterapia, la quimioterapia, la radiación, quemaduras y/o cirugía14. El timo puede mantener su forma bilobulada característica o, más frecuentemente, aparecer como una masa oval15,16. Cuando el cuerpo sufre estrés, y dependiendo de su duración e intensidad, el timo puede encoger hasta aproximadamente el 40% de su tamaño original17. Una vez se recupera el cuerpo, el timo suele recuperar su tamaño original en un período de 9 meses, pudiendo incluso aumentar de tamaño (>50%) en el fenómeno conocido como HTR17,18. La HTR es más frecuente en niños pequeños, pero puede desarrollarse en niños y adultos de cualquier edad19.
En nuestro estudio, se detectó HTR tras completarse la quimioterapia en 14 de los pacientes pediátricos con linfomas de distintos tipos (51,9%). La hiperplasia se desarrolló entre 2,0 y 4,25 meses tras el tratamiento, a una mediana de 2,5 meses, y persistió de 4 a 11 meses. Nuestros hallazgos fueron similares a los de estudios previos9, que han descrito el desarrollo de HTR después de la quimioterapia en el 67,7% de los pacientes (21/31) tras transcurrir de 1 a 17 meses, y con una duración de 3 meses a 5 años, con resolución gradual a lo largo del tiempo9. La tabla 3 detalla los estudios pasados más importantes que han analizado la HTR en niños con linfoma.
Principales estudios que han descrito la hiperplasia tímica de rebote en niños con linfoma
| Estudio, país | Pacientes estudiados, edad al diagnóstico | Evaluación/pruebas de imagen | Hallazgos | Conclusiones |
|---|---|---|---|---|
| Estudio presente, 2018, Arabia Saudita | 27 niños, edad mediana de 6,0a (rango: 4,0-9,0) | Evaluación clínica, analítica, TC al terminar tratamiento seguida de GA-67 | HTR en 14/27 (51,9%)HTR detectada a una mediana de 2,5 meses tras completar tratamiento (rango: 2,0-4,25)TC: masa homogénea en mediastino anteriorGA-67 positivo en todos los casos (14/14)Todos los pacientes con HTR estaban asintomáticos con LDH, ferritina, hemograma y PCR normalesResolución espontánea o disminución del timo en 4-11 meses en todos los pacientes, sin recurrencia tras 9 años de seguimiento | Es necesaria una evaluación meticulosa de la HTR (clínica, de laboratorio, TC y GA-67) para evitar su malinterpretación como recurrencia y biopsias y tratamientos innecesarios |
| Chen et al., 2017, Taiwan9 | 31 pacientes (de 67 con linfoma), edad 3-18a (mediana: 10) | TC tras remisión completa. GA-67 y PET | HTR en el 67,7% (21/31 pacientes)Detección 1-17 meses tras el fin de la quimioterapia, persistencia de 3 meses-5 años con regresión gradualTodos los pacientes con HTR estaban asintomáticosGA-67 positiva en el 45% (9/20 pacientes con HTR)PET con captación aumentada en el 66,7% (4/6 pacientes) | Ninguno de los pacientes con HTR tuvo recurrencia del linfoma durante el seguimiento, que duró una mediana de 5 añosLa familiaridad con la HTR es importante para evitar cirugías/quimioterapia innecesarias |
| Tian et al., 2015, China8 | 52 niños con linfoma, seguimiento mediano de 32,9 meses (rango: 10,5-89,4) | Evaluación clínica y TC | Detección de masas mediastínicas a una mediana de 8,6 meses de la remisión completaTodos los pacientes tenían una sola masa mediastínica; en el 81% densidad homogénea con márgenes bien definidos (forma trapezoidal o triangular); en 19% formas difusas con márgenes poco definidos. Captación leve de contraste en todas las masasEl 81% de las masas encogieron espontáneamente, y el 19% se mantuvieron inalteradas (tras 10,5-73,9 meses de seguimiento) | La HTR ocurre frecuentemente en niños con linfoma tratados con quimioterapia (independientemente de si el tumor inicial invadió o no el mediastino) |
| Zhen et al., 2010, China7 | 26 niños y adolescentes con HTR | TC seguida de PET o seguimiento clínico estrecho | Detección de HTR a una media de 4 meses tras el último ciclo de quimioterapia (rango: 1-12 meses)TC: agrandamiento difuso de parénquima tímico con morfología normalPET (20 pacientes): 5 (25%) sin captación, y 15 (75%) con forma regular y radioactividad homogénea (falsos positivos)HTR: SUV generalmente <4, morfología regular y distribución de radioactividad uniforme. Masas malignas: SUV>10, morfología irregular con distribución heterogénea de radioactividadTodos los pacientes sobrevivieron y se mantuvieron libres de enfermedad (duración media de seguimiento: 40 meses) | La HTR tras la quimioterapia se puede diagnosticar mediante evaluación clínica en combinación con TC y PET (sin diagnóstico patológico) |
GA-67: gammagrafía con galio 67; HTR: hiperplasia tímica de rebote; PET: tomografía por emisión de positrones; SUV: actividad de captación estándar; TC: tomografía computarizada.
Encontramos una prevalencia mayor de HTR en mujeres, aunque esta diferencia no fue significativa (p=0,09). Chen et al.9 refirieron que la edad media de los pacientes con HTR fue menor en comparación con pacientes que no la desarrollaron, y que la probabilidad de desarrollar HTR era más alta en mujeres que en sus pares varones.
La duración de la quimioterapia fue significativamente menor en pacientes que desarrollaron HTR, lo que puede explicar su aparición al poco de completarse el tratamiento, entre 2,0 y 4,25 meses después. Una posible hipótesis que explicaría este hallazgo es que los pacientes que reciben tratamientos más prolongados experimentan supresión por más tiempo, lo que impediría que la HTR se desarrollara lo suficientemente temprano para detectarse en las pruebas de imagen realizadas tras el tratamiento.
El tiempo transcurrido entre el fin de la quimioterapia y la detección de la HTR en nuestro estudio osciló entre 2,0 y 4,25 meses. Además, la hiperplasia se mantuvo de 4 a 11 meses y se resolvió gradualmente, lo que fue consistente con lo descrito en estudios anteriores9. Todos nuestros pacientes con HTR estaban asintomáticos, lo que también concordó con la literatura existente9. Tampoco se encontraron alteraciones en las analíticas de los pacientes con HTR, incluyendo el hemograma y los niveles séricos de PCR, LDH y ferritina. Los hallazgos de la TC del timo se interpretaron como benignos, detectándose un aumento homogéneo de textura lisa en ausencia de lesiones en otras localizaciones. La GA-67 confirmó la captación de leve a moderada de trazador en el timo en pacientes con HTR, sin objetivarse lesiones adicionales en otras áreas, lo que es indicativo de HTR.
En nuestro estudio, el aumento del timo generalmente se malinterpretó como linfoma recurrente, pero la ausencia de manifestaciones clínicas y los resultados normales de las pruebas de laboratorio, la TC y la GA-67 sugirieron prontamente que el proceso era benigno. Ninguno de los pacientes con HTR tuvo recurrencia a pesar de la larga duración del seguimiento, de hasta 9 años en algunos pacientes. El diagnóstico de HTR suponía un reto en pacientes con antecedentes conocidos de malignidad, ya que requería diferenciar esta masa de tumores mediastínicos recurrentes o metastásicos. La detección de aumentos de tamaño en una masa mediastínica intensificaría la preocupación existente sobre la probabilidad de una posible recurrencia. La HTR suele presentarse como un aumento difuso con un contorno liso, una masa no lobulada de tejido mixto linfoide y graso de textura fina con vasculatura normal y sin efecto de masa en las estructuras vecinas. En comparación, los tumores tímicos presentan un contorno nodular y en muchos casos contienen focos de hemorragia, necrosis o calcificación18,19.
Ninguno de los pacientes con HTR en nuestra muestra tuvo recurrencia, y no hubo diferencias significativas entre estos pacientes y aquellos sin HTR, lo que fue consistente con los hallazgos de otros autores, incluyendo a Chen et al.9, que encontraron una probabilidad menor de recurrencia en pacientes con HTR por razones que aún se desconocen. En nuestro estudio se observó lo mismo, y no podemos explicar la ausencia de recurrencia en pacientes con HTR, aunque podría deberse o asociarse a la recuperación o actividad de los mecanismos inmunológicos que desencadenan la HTR, fenómeno que merece una investigación más detallada.
No se requirieron procedimientos invasivos para diagnosticar la HTR, ya que los pacientes en la muestra no desarrollaron síntomas y tuvieron resultados normales en la analítica (hemograma y niveles séricos de PCR, LDH y ferritina). La HTR regresó espontáneamente y se resolvió por completo durante el seguimiento a largo plazo.
En nuestro estudio, los niños con linfoma fueron evaluados mediante GA-67 y TC. Desgraciadamente, no se pudo realizar evaluación mediante PET porque la técnica se consideraba excesivamente costosa y no estaba disponible en nuestra región. La GA-67 es muy útil como técnica funcional en la evaluación de linfomas al diagnóstico (estadificación) y para evaluar la respuesta al tratamiento20. No obstante, la GA-67 también tiene algunas limitaciones claras, como el impacto negativo de la localización del linfoma en la sensibilidad y la especificidad, lo que lleva a imprecisiones en la evaluación de la afectación infradiafragmática. Además, esta técnica es menos sensible en linfomas de grado bajo a intermedio. A esto hay que añadir que requiere esperar un intervalo más largo, de 3 días como mínimo, entre la inyección de galio y la prueba para eliminar la actividad de fondo21. La PET es una técnica de imagen funcional que detecta células malignas debido a su mayor actividad glucolítica en comparación con células normales22. En niños con linfoma, se ha demostrado que la PET tiene un rendimiento superior al de la GA-67 porque puede discriminar entre tejido cicatrizado y linfoma residual tras completarse el tratamiento. En comparación con la TC, la resonancia magnética y la GA-67, la PET ha mostrado una sensibilidad y especificidad superiores, que además son excelentes23,24. No obstante, un aumento en la glicólisis causado por estados benignos, tales como la inflamación inducida por cirugía, quimioterapia, radioterapia, infección o enfermedad granulomatosa, puede ocasionar falsos positivos en la PET con captación aumentada, especialmente cuando el examen se realiza en situaciones como las descritas25,26. También hay que tener en cuenta que se ha reportado que la PET no puede diferenciar entre la hiperplasia tímica y la infiltración maligna en el timo27.
La HTR es un fenómeno fisiológico que teóricamente podría ocurrir en cualquier paciente con linfoma al terminar la quimioterapia. Es de vital importancia que los oncólogos sean plenamente conscientes de este fenómeno para evitar malinterpretarlo como una recurrencia, lo que conllevaría la realización de intervenciones quirúrgicas innecesarias, tales como la biopsia, y/o causaría un miedo y aflicción excesivos en pacientes y familiares al anunciarse la sospecha de recurrencia. Nuestra sugerencia es que, en caso de descubrirse un aumento o ensanchamiento en el mediastino en un paciente pediátrico con linfoma tras completarse el tratamiento, el seguimiento de rutina incluya una evaluación clínica y analítica minuciosa y un examen físico para explorar posibles alteraciones sospechosas. La TC y la GA-67 pueden ser útiles para evaluar la naturaleza del aumento del timo a la vez que la posible presencia de otras masas o de afectación ganglionar.
La presencia de un aumento homogéneo del timo sin otras alteraciones asociadas es altamente indicativa de HTR, y de por sí es razón suficiente para realizar un seguimiento y monitorización estrechos. Por el contrario, de observarse aumentos adicionales de los ganglios linfáticos, cambios en la masa tímica o cualquier otra masa en aumento en cualquier localización cercana a esta región, debe realizarse una biopsia de inmediato para descartar la recurrencia del linfoma.
En nuestra práctica, hemos empleado la gammagrafía con GA-67 y la TC en combinación con una evaluación clínica y de laboratorio rigurosa, apoyadas por un seguimiento estrecho de los pacientes. Esta actitud nos parece de gran ayuda y podría resultar más útil a los oncólogos pediátricos en la evaluación de niños con sospecha de HTR, especialmente en países en vías de desarrollo con acceso limitado a técnicas de imagen o intervención quirúrgica.
Limitaciones del estudio: estudio retrospectivo en un único centro, con un número relativamente pequeño de pacientes con linfoma; no se examinó a los pacientes mediante PET.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.