El norovirus es el segundo agente causal de las gastroenteritis agudas víricas en niños después del rotavirus. Su prevalencia está subestimada debido a que no se realiza habitualmente un diagnóstico específico. El estudio de los diagnósticos microbiológicos, realizados antes y después de la fecha de implantación de un test de detección de un microorganismo concreto, permite estimar el porcentaje de casos no diagnosticados con anterioridad (por la no implantación) y los que se dejarían de diagnosticar en caso de su supresión. En este artículo estudiamos la epidemiología de las gastroenteritis agudas por virus antes y después de la implantación del test CerTest Norovirus GI+GII.
Material y métodosEstudio observacional de cohortes retrospectivo realizado en pacientes menores de 15 años con gastroenteritis aguda desde enero de 2013 hasta abril de 2015. Se dividió la muestra en 2 grupos; en el primero la búsqueda se limitó a adenovirus y rotavirus y en el segundo la determinación de norovirus se incorporó al diagnóstico sistemático. Se incluyó a 604 pacientes, 313 en el primer grupo y 291 en el segundo.
ResultadosLas características demográficas fueron similares en ambos grupos. Se identificaron 58/313 (18,5%) virus entéricos en el primer grupo y 97/291 (33,3%) en el segundo. Del segundo grupo 31 muestras fueron positivas para norovirus, siendo 12 (4,1%) positivas exclusivamente para norovirus. No se encontraron diferencias significativas en las características clínicas de los virus intestinales.
ConclusionesSe observó un aumento real del 4,1% en el porcentaje de casos con agente etiológico identificado al implementar la técnica diagnóstica CerTest Norovirus GI+GII. El rotavirus sigue siendo la causa más frecuente de gastroenteritis aguda en nuestro medio, seguido de cerca por el norovirus.
Norovirus is the second cause of acute viral gastroenteritis in infants after rotavirus. However, its prevalence is underestimated because a specific diagnosis is not usually performed. The comparative study of microbiological diagnostics, performed before and after the implementation date of a test for detecting a particular microorganism, allows the estimation of the percentage of cases not properly diagnosed earlier (for non-implementation of the test) and those that would be left to diagnose if the test is removed. In this paper we study the epidemiology of acute gastroenteritis virus before and after the implantation of the Norovirus GI+GII CerTest.
Material and methodsAn observational retrospective cohort study was conducted on patients under 15 years old with acute gastroenteritis, from January 2013 to April 2015. The sample was divided into two groups. In the first group, the search was limited to adenovirus and rotavirus, and in the second one, the determination of norovirus became part of the systematic diagnosis. The study included 604 patients, 313 in the first group and 291 in the second one.
ResultsDemographic characteristics were similar in both groups. In the first group, 58/313 (18.5%) enteric viruses were identified and in the second group, 97/291 (33.3%). In the second group, 31 positive cases for norovirus were identified, but only 12 (4.1%) of them were positive exclusively for this virus. No significant differences were found in clinical features of intestinal viruses.
ConclusionsAn actual increase of 4.1% was observed in the cases with an identified aetiological agent after implementing the Norovirus GI+GII CerTest diagnostic technique. The most common cause of acute gastroenteritis is rotavirus, closely followed by norovirus.
Las infecciones gastrointestinales son la segunda enfermedad infecciosa más común en la población pediátrica, a pesar de las mejoras en las infraestructuras de salud pública en las últimas décadas1.
La OMS define la gastroenteritis aguda (GEA) como la disminución en la consistencia de las deposiciones o un aumento en el número de las mismas (3 o más en 24h), con o sin fiebre o vómitos de menos de 2 semanas de duración. En el lactante la disminución de la consistencia respecto a las heces previas es más indicativo de diarrea2. Constituye la segunda causa más importante de mortalidad en niños menores de 5 años3. La incidencia en Europa en niños sanos es aproximadamente de 0,5-2 episodios/año en menores de 3 años2. En países subdesarrollados esta cifra asciende a 6 episodios al año4. Asimismo, conlleva una gran carga asistencial5.
En cuanto a las gastroenteritis víricas, existen 4 agentes etiológicos principales: rotavirus, adenovirus, norovirus y astrovirus6. El rotavirus es la principal causa de GEA en la infancia, siendo causa de más de medio millón de muertes anuales y más de 2 millones de hospitalizaciones en todo el mundo2,7. Sin embargo, en los países con alta cobertura vacunal para el rotavirus el norovirus se está convirtiendo en la primera causa de gastroenteritis2,8,9.
El norovirus es un agente etiológico emergente cuya prevalencia está subestimada debido a que no se realiza habitualmente un diagnóstico específico. El estudio de los diagnósticos microbiológicos, realizados antes y después de la fecha de implantación de un test de detección de un microorganismo concreto, permite estimar el porcentaje de casos no diagnosticados apropiadamente con anterioridad (por la no implantación) y los que se dejarían de diagnosticar en caso de su supresión, reduciéndose con ello el porcentaje de gastroenteritis agudas idiopáticas. Esto es particularmente relevante en el caso del norovirus ya que, en la actualidad, se está desarrollando una vacuna para el mismo10.
En este artículo estudiamos la epidemiología de las gastroenteritis agudas por virus antes y después de la implantación del test CerTest Norovirus GI+GII, lo que permitirá hacer las comparaciones mencionadas.
Material y métodosEstudio observacional de cohortes retrospectivo realizado en un hospital de tercer nivel y los centros de salud del área sanitaria asociada, en pacientes menores de 15 años con GEA. El periodo de reclutamiento se extendió desde enero de 2013 hasta abril de 2015.
El método de detección de virus sufrió cambios a lo largo del tiempo analizado debido a la aparición de nuevas técnicas y reactivos en el mercado. Se dividió la muestra en 2 grupos. En el primero, la búsqueda se limitó a adenovirus y rotavirus. En el segundo grupo (a partir de abril de 2014, salvo para muestras en las que el reactivo fue insuficiente), la determinación de norovirus se incorporó al diagnóstico sistemático. La detección de rotavirus y adenovirus se realizó mediante el CerTest Rotavirus-Adenovirus (CerTest BIOTEC)11 y la técnica utilizada para la detección de norovirus fue el CerTest Norovirus GI+GII combo card (CerTest BIOTEC).
La recogida de datos se realizó mediante la revisión de las historias clínicas digitales de los pacientes que consultaron por GEA en los centros de atención primaria y el servicio de urgencias, así como los pacientes ingresados en planta de hospitalización, a los que se les recogió muestra de heces para estudio de virus intestinales (adenovirus, rotavirus y/o norovirus). Se excluyeron aquellos pacientes a los que se les solicitó muestra de heces por otros motivos de consulta diferentes a GEA (dolor abdominal, rectorragia, sospecha de alergia a las proteínas de leche de vaca, etc.). Tampoco se incluyeron las muestras de control recogidas tras la resolución del cuadro, ni aquellos a los que se les solicitó estudio fecal sin constar en la historia clínica la sintomatología presentada.
Se estudiaron 604 muestras, el tamaño mínimo necesario para detectar como significativas diferencias de magnitud de un 10% en la detección de virus gastrointestinales, suponiendo un 20% en muestras detectadas con 2 técnicas y un 30% de positivos detectados con las 3 técnicas, con un nivel de confianza del 95% y una potencia del 80% sería de 586 muestras (293 por grupo).
Se realizó un análisis descriptivo de todas las variables incluidas en el estudio, expresando las variables cuantitativas como media±desviación típica, mediana y rango; las variables cualitativas como valor absoluto, porcentaje e intervalo de confianza del 95%. Se estudió la asociación de variables cualitativas con el test Chi-cuadrado o el test de Fisher. Se realizó la comparación de medias con el test de U de Mann-Whitney o Kruskall-Wallis según fuesen 2 o más grupos, tras comprobar la normalidad con el test de Kolmogórov-Smirnov. El análisis estadístico se realizó con el programa SPSS 19.0. Se consideraron estadísticamente significativos los valores de p menores a 0,05. El protocolo de estudio fue aprobado por el comité ético de investigación clínica de referencia.
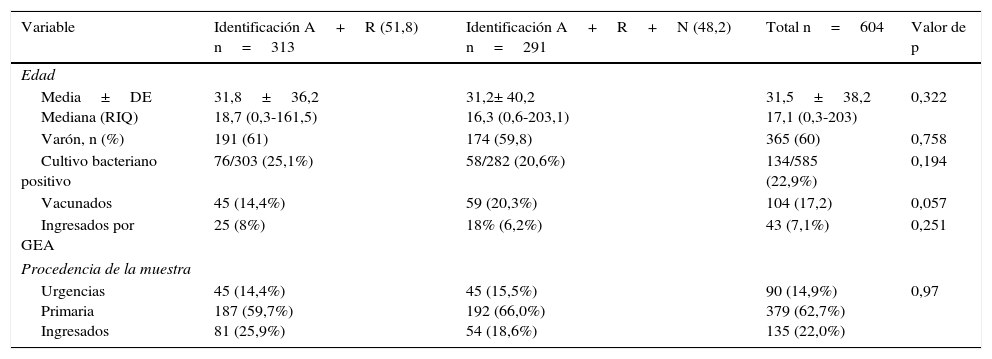
ResultadosSe incluyeron 604 muestras de pacientes que se dividieron en 2 grupos. En el primero de ellos se realizó la técnica diagnóstica para rotavirus y adenovirus, incluyéndose 313 (51,8%, IC 95%: 47,7-55,8%) muestras, mientras que en el segundo grupo (291 muestras (48,2%, IC 95%: 44,1-52,2) se llevó a cabo la técnica para detección de rotavirus, adenovirus y norovirus, siendo ambos grupos comparables tal y como se resume en la tabla 1 (tabla de comparación de ambos grupos).
Características demográficas de ambos grupos
| Variable | Identificación A+R (51,8) n=313 | Identificación A+R+N (48,2) n=291 | Total n=604 | Valor de p |
|---|---|---|---|---|
| Edad | ||||
| Media±DE Mediana (RIQ) | 31,8±36,2 18,7 (0,3-161,5) | 31,2± 40,2 16,3 (0,6-203,1) | 31,5±38,2 17,1 (0,3-203) | 0,322 |
| Varón, n (%) | 191 (61) | 174 (59,8) | 365 (60) | 0,758 |
| Cultivo bacteriano positivo | 76/303 (25,1%) | 58/282 (20,6%) | 134/585 (22,9%) | 0,194 |
| Vacunados | 45 (14,4%) | 59 (20,3%) | 104 (17,2) | 0,057 |
| Ingresados por GEA | 25 (8%) | 18% (6,2%) | 43 (7,1%) | 0,251 |
| Procedencia de la muestra | ||||
| Urgencias Primaria Ingresados | 45 (14,4%) 187 (59,7%) 81 (25,9%) | 45 (15,5%) 192 (66,0%) 54 (18,6%) | 90 (14,9%) 379 (62,7%) 135 (22,0%) | 0,97 |
A: adenovirus; DE: desviación estándar; GEA: gastroenteritis aguda; N: norovirus; R: rotavirus; RIQ: rango intercuartílico.
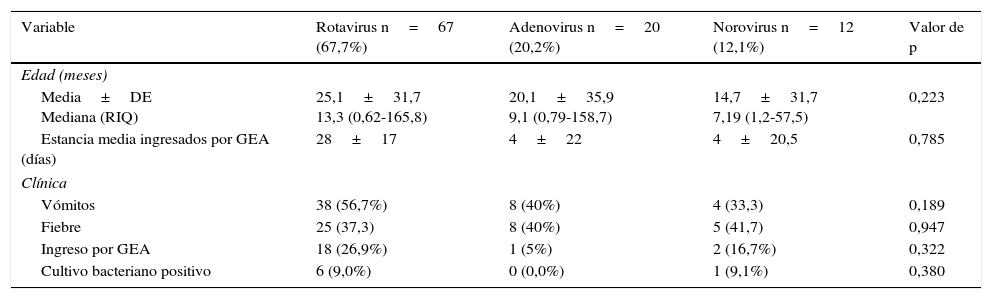
En relación con las muestras pertenecientes al primer grupo, 50 fueron positivas para rotavirus (16,0, IC 95%: 11,8-20,2) y 8 positivas para adenovirus (2,6%, IC 95%: 0,6-4,4). De estas muestras positivas para adenovirus o rotavirus, 3 (1,0%, IC del 95%, 0,2-2,8) fueron positivas para ambos virus. Respecto al segundo grupo en 33 muestras se detectó rotavirus (11,3%, IC 95%: 7,5-15,1); en 33 adenovirus (11,3%, IC 95%: 7,5-15,1) y en 31 norovirus (10,7%, IC 95%: 7,0-14,4). De todos estos casos positivos 19 (2,7%, IC 95%: 0,7-4,8) fueron positivos para más de un virus. En total se identificaron 58/313 (18,5%, IC 95%: 14,1-23,0) virus entéricos en el primer grupo y 97/291 (33,3%, IC 95%: 27,7-38,9) en el segundo. En la tabla 2 se describen las características de las muestras positivas para cada uno de los virus (rotavirus, adenovirus y norovirus), recogen los datos de los casos positivos solo para dicho virus.
Características clínicas de los virus intestinales
| Variable | Rotavirus n=67 (67,7%) | Adenovirus n=20 (20,2%) | Norovirus n=12 (12,1%) | Valor de p |
|---|---|---|---|---|
| Edad (meses) | ||||
| Media±DE Mediana (RIQ) | 25,1±31,7 13,3 (0,62-165,8) | 20,1±35,9 9,1 (0,79-158,7) | 14,7±31,7 7,19 (1,2-57,5) | 0,223 |
| Estancia media ingresados por GEA (días) | 28±17 | 4±22 | 4±20,5 | 0,785 |
| Clínica | ||||
| Vómitos | 38 (56,7%) | 8 (40%) | 4 (33,3) | 0,189 |
| Fiebre | 25 (37,3) | 8 (40%) | 5 (41,7) | 0,947 |
| Ingreso por GEA | 18 (26,9%) | 1 (5%) | 2 (16,7%) | 0,322 |
| Cultivo bacteriano positivo | 6 (9,0%) | 0 (0,0%) | 1 (9,1%) | 0,380 |
DE: desviación estándar; GEA: gastroenteritis aguda; RIQ: rango intercuartílico.
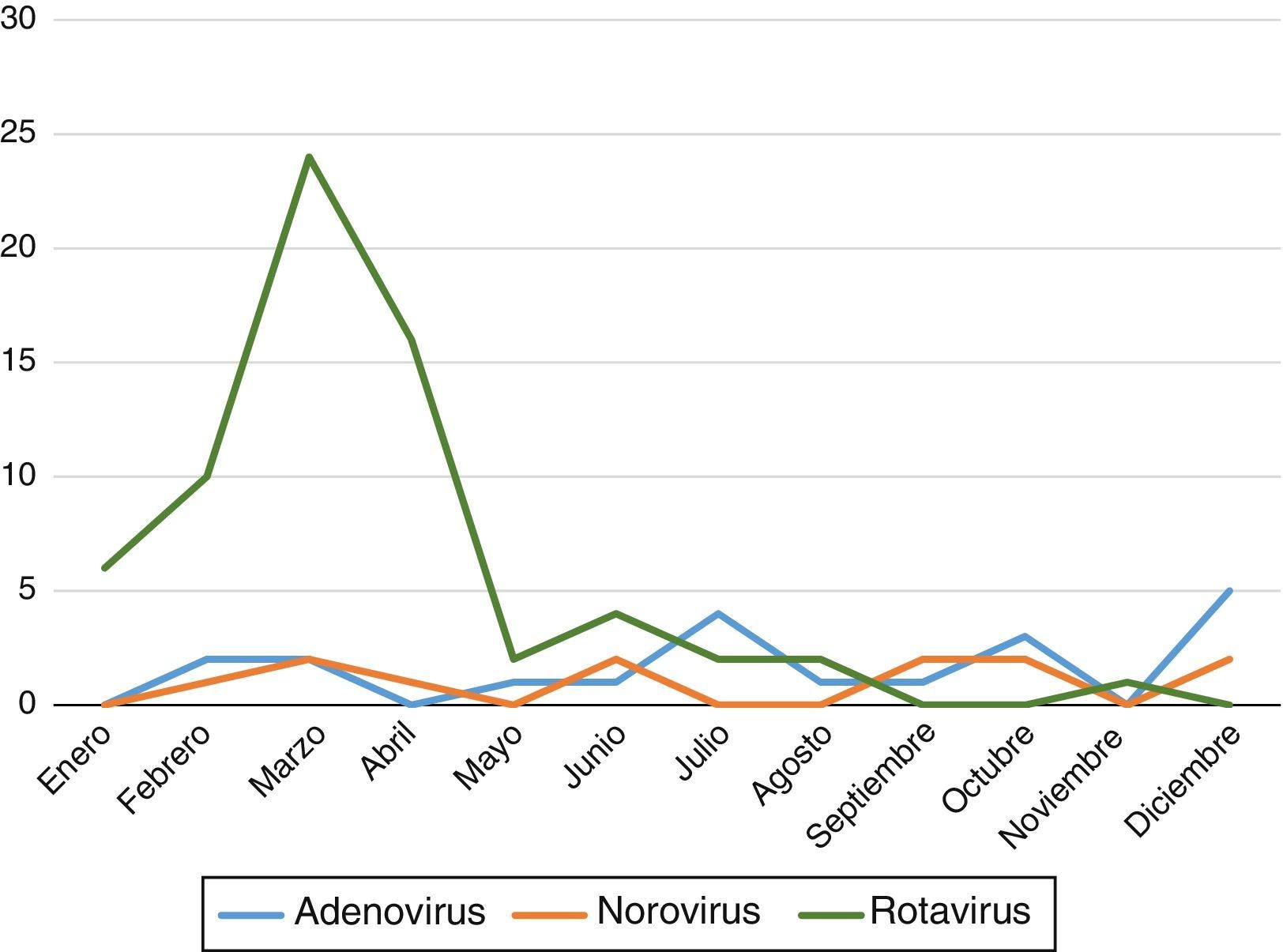
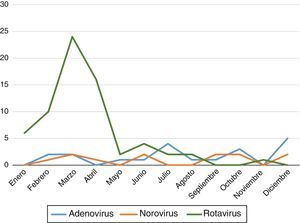
Se objetivó un predominio de GEA con positividad para virus en heces en los primeros meses del año (entre enero y abril) con un repunte en otoño (octubre y noviembre). En la figura 1 se recogen las variaciones a lo largo del año según los diferentes virus.
En relación con las muestras con positividad para norovirus, 8 de ellas (25,8%, IC 95%: 8,8-42,8) fueron además positivas para adenovirus, 3 (9,7%, IC 95%: 2,0-25,7) para rotavirus y 8 (25,8%, IC 95%: 8,8-42,8) para los 3 virus. Solo 12 muestras (4,1% del total de pacientes estudiados en el segundo periodo, IC 95%: 1,7-6,6) fueron positivas exclusivamente para norovirus. Respecto al genotipo de dicho germen, en 24 casos (77,4%, IC 95%: 61,1-93,8) fue el genotipo 1, sin detectarse ningún genotipo 2 exclusivo. En 4 muestras (12,9%, IC 95%: 3,6-29,8) la técnica resultó positiva para los genotipos 1 y 2.
DiscusiónLas gastroenteritis agudas son una de las causas más importantes de mortalidad en niños menores de 5 años3, siendo actualmente la etiología vírica la más importante. El porcentaje de gastroenteritis agudas idiopáticas sigue siendo muy elevado, y solo la identificación del agente etiológico permite reducirlo. En este artículo determinamos el porcentaje de gastroenteritis agudas que la introducción de la técnica CerTest Norovirus GI+GII en el diagnóstico microbiológico de las GEA permitió identificar al norovirus como tal agente causante.
Los datos mostraron un aumento real del 4,1% en el porcentaje de muestras con diagnóstico microbiológico en el segundo grupo, que corresponden a los 12 casos positivos exclusivamente para norovirus.
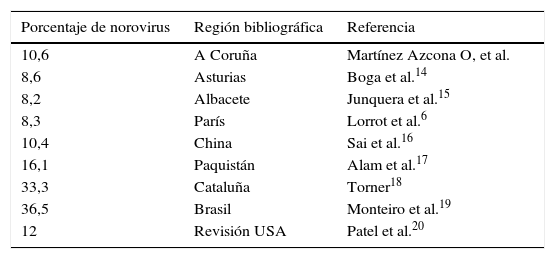
En nuestro medio el rotavirus continúa siendo la causa más frecuente de GEA2,7. Sin embargo, el norovirus adquiere cada vez más importancia, siendo el segundo agente etiológico más frecuente2. Los datos del norovirus de nuestro estudio fueron similares a los de otros autores6,12,13, tal y como se describe en la tabla 3. Solamente en 2 casos se observaron porcentajes de norovirus más elevados18,19. Patel et al.20 realizaron una revisión sistemática de los estudios publicados con anterioridad a 2008, en la que las infecciones debidas a norovirus alcanzaron el 12% de los casos severos, datos concordantes con los aquí presentados.
Porcentajes de norovirus obtenidos por otros autores, referidos a otras localizaciones
| Porcentaje de norovirus | Región bibliográfica | Referencia |
|---|---|---|
| 10,6 | A Coruña | Martínez Azcona O, et al. |
| 8,6 | Asturias | Boga et al.14 |
| 8,2 | Albacete | Junquera et al.15 |
| 8,3 | París | Lorrot et al.6 |
| 10,4 | China | Sai et al.16 |
| 16,1 | Paquistán | Alam et al.17 |
| 33,3 | Cataluña | Torner18 |
| 36,5 | Brasil | Monteiro et al.19 |
| 12 | Revisión USA | Patel et al.20 |
Respecto a la distribución de genotipos de norovirus, el predominante fue el GI, siendo responsable del 77,4% del total de las muestras positivas. No se detectaron cepas pertenecientes al GII, pero sí infección mixta en un 12,9%. Estos resultados contrastan con los publicados por Lorrot et al.6 quienes observaron un predominio claro del genogrupo ii, especialmente del genotipo GGII.4, siendo el segundo en importancia el genotipo GGII.b. Buesa et al.21 describieron el GGII.4 como el genotipo de norovirus más prevalente en casos esporádicos de gastroenteritis en la edad pediátrica. En esa misma línea se enmarcaron los resultados de Kirkwood et al.22 y de Boga et al.14. Sai et al.16 también concluyeron que el genotipo más abundante fue el GII.4, además de GII.3, GII.4 y GII.6. Toda esta diversidad genómica de los norovirus se revisó en el artículo publicado por Hoehne y Schreier23.
La distribución de los casos positivos para norovirus fue similar a lo largo del año. Sin embargo, el relativamente bajo número de casos (=12) exclusivamente positivos para norovirus, impidió un análisis estadístico fiable. Lorrot et al.6 observaron estacionalidad para el norovirus, con un máximo principal en enero y otro menor en septiembre, lo cual fue concomitante con la del rotavirus, mucho más acusada. En cambio, Sai et al.16 describieron la máxima incidencia de norovirus en el periodo septiembre-noviembre y la incidencia máxima del rotavirus como desplazada hacia la época más fría de noviembre-enero.
En nuestro estudio se encontró un papel importante del norovirus como agente coinfectante, con predominio de coinfección entre norovirus y adenovirus (25,8%) y entre los 3 virus estudiados (rotavirus, adenovirus y norovirus) en otro 25,8% de los casos. Asimismo, en un 9,7% se detectó positividad para rotavirus y norovirus. Estos datos coincidieron con publicaciones previas11, aunque en nuestro estudio el porcentaje resultó más elevado (61,3%). En la bibliografía revisada Li et al.24 describen una asociación positiva por un lado entre rotavirus y adenovirus, y por otro entre norovirus GII y Salmonella.
En conclusión, se observó un aumento en el porcentaje de casos con agente etiológico identificado tras implementar la técnica diagnóstica CerTest Norovirus GI+GII.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
María Teresa Seoane Pillado, técnico estadístico de la Unidad de Epidemiología Clínica y Bioestadística del Complejo Hospitalario Universitario de A Coruña.
Amparo Otero Fernández, administrativa de ensayos clínicos de la Unidad de Investigación Clínica y Ensayos Clínicos de A Coruña.
José Vázquez Tato, profesor de química en la Universidad de Santiago de Compostela.