El consumo de medicamentos durante el embarazo se ha incrementado en las últimas décadas.
ObjetivoIdentificar el riesgo de anomalías congénitas (AC) asociado a la utilización de medicamentos en atención ambulatoria en embarazadas residentes en la Comunitat Valenciana.
MétodosEstudio de casos-controles, considerando caso a menores de un año nacidos vivos en 2009-2010 diagnosticados de AC y residentes en la Comunitat Valenciana, obtenidos del registro poblacional de AC. Los controles se seleccionaron del Registro de Metabolopatías y la medicación prescrita y dispensada se obtuvo del módulo Gestión Integral de Prestación Farmacéutica. Se calcularon las odds ratio (OR) y los intervalos de confianza al 95% y las OR ajustadas mediante regresión logística.
ResultadosSe identificaron 1.913 casos y 3.826 controles. Los grupos de medicamentos más frecuentemente prescritos y dispensados fueron: los que actúan sobre los sistemas musculoesquelético, nervioso, respiratorio, sobre la sangre y órganos hematopoyéticos, y antiinfecciosos. Los medicamentos más habituales fueron: ibuprofeno, dexketoprofeno, paracetamol, amoxicilina, sulfato de hierro y una combinación de ácido fólico. Se identificó un aumento del riesgo de anomalías congénitas significativo para los fármacos de acción sobre el sistema musculoesquelético (OR ajustada de 1,14 [intervalo de confianza al 95% 1,02-1,28]). Se observó una disminución del riesgo significativa en el grupo que actúa sobre la sangre y los órganos hematopoyéticos (OR ajustada de 0,87 [intervalo de confianza al 95% 0,78-0,98]).
ConclusionesSe han identificado asociaciones de medicamentos con AC en mujeres embarazadas residentes en la Comunitat Valenciana, tanto para fármacos que actúan como factores de riesgo de AC como para fármacos que actúan como factores protectores de AC.
Despite the potential risks of drug use during pregnancy, consumption has increased in recent decades.
ObjectiveTo identify the risk of congenital anomalies (CA) associated with the use of drugs in primary care in pregnant women residents in the Valencia Region.
MethodsA case-control study, considering a case as a less than one year old live birth in 2009-2010, diagnosed with a CA and resident in the Valencia Region, obtained from the CA population-based registry. Controls were selected from the Metabolic Disease Registry, and the drugs prescribed and dispensed from the Integral Management of Pharmaceutical Services. Crude odds ratio (OR) was calculated with its 95% confidence intervals and adjusted OR was calculated using logistic regression.
ResultsA total of 1,913 cases and 3,826 controls were identified. The most frequently used drug groups were those acting on the musculoskeletal, nervous and respiratory systems, on the blood and blood forming organs, and anti-infection drugs. The most common drugs used were ibuprofen, dexketoprofen, paracetamol, amoxicillin, ferrous sulphate, and a combination of folic acid. A significantly increased risk of CA was identified for drugs acting on the musculoskeletal system (adjusted OR 1.14 [95% confidence interval 1.02-1.28]). A significantly decreased risk was observed for drugs acting on the blood and blood forming organs (adjusted OR 0.87 [95% confidence interval 0.78-0.98]).
ConclusionsAssociations between drugs and CA in pregnant women resident in the Valencia Region have been identified for drugs that act as risk factors of CA, and for drugs that act as protective factors of CA.
El término de anomalía congénita (AC) incluye cualquier tipo de error del desarrollo físico, psíquico, funcional, sensorial o motor, que ocurre durante la vida intrauterina y se detecta durante el embarazo, en el parto o en un momento posterior de la vida. Incluso cabe incluir también las alteraciones moleculares y los errores congénitos del metabolismo1.
Las AC representan un importante problema de salud pública en términos de impacto en la calidad de vida de los pacientes y sus familias, contribución a la mortalidad fetal e infantil, así como en coste emocional de las familias, y costes médicos, sociales y educacionales necesarios para mejorar la calidad de vida tanto de los afectados como de sus familias2.
La etiología de las AC es desconocida, si bien se considera que son el resultado de interacciones entre factores genéticos y ambientales, sin que se haya establecido su interacción y la importancia relativa de cada uno3,4.
Desde el descubrimiento del efecto teratogénico de la talidomida5 se ha avanzado en la investigación de los efectos teratógenos que determinados medicamentos, por diversos mecanismos, pueden tener sobre el feto, principalmente si son consumidos durante el primer trimestre del embarazo. Sin embargo, los resultados obtenidos no son siempre concluyentes6. Así, medicamentos utilizados en el tratamiento del hipertiroidismo, como carbimazol y metimazol, se han asociado a AC como la atresia de coanas y el onfalocele7, aunque no en todos los estudios se evidencia8.
Los antibióticos han sido ampliamente investigados, encontrándose diferencias entre ellos. Penicilinas, eritromicina y cefalosporinas no se han asociado a AC. Fisuras orales y faciales se han encontrado asociadas al consumo de amoxicilina durante los primeros meses del embarazo. Las sulfamidas y las nitrofurantoínas se han asociado a AC graves como la anencefalia y a AC cardíacas, así como a atresia de coanas, fisuras orales y faciales y hernia diafragmática9,10.
Los resultados obtenidos para otros grupos de medicamentos como los antiepilépticos son discordantes11,12, o no se han encontrado evidencias concluyentes sobre la asociación con AC13. Otras veces es difícil diferenciar el posible efecto teratógeno del medicamento y el de la enfermedad de base14,15.
A pesar de los riesgos potenciales del consumo de medicamentos durante el embarazo, especialmente en el primer trimestre, en las últimas décadas este consumo se ha incrementado más del 60%, utilizándose al menos un medicamento en el 50% de las gestaciones16. Además, se prescribe a veces medicación potencialmente teratógena sin el adecuado consejo contraceptivo17. Se estima que el 1% de las mujeres embarazadas están expuestas a medicación potencialmente teratógena, y el 0,6% en el primer trimestre18.
La existencia en la Comunitat Valenciana (CV) del módulo de Gestión Integral de Prestación Farmacéutica (GAIA)19, que forma parte del Sistema de Información de la Asistencia Ambulatoria, hace posible llevar a cabo estudios de utilización de medicamentos, ya que registra la prescripción farmacológica del facultativo en la consulta ambulatoria, permitiendo su posterior explotación.
Además, la reciente creación del registro poblacional de AC de la CV, que recoge los casos de menores de un año residentes en la CV que han sido diagnosticados con alguna AC siguiendo los criterios y controles de calidad de la Red Europea de Registros Poblacionales para la Vigilancia Epidemiológica de Anomalías Congénitas20, permite disponer de datos validados de las AC en la CV. Y la existencia del Registro de Metabolopatías de la CV, que contiene la información de los nacimientos que se producen anualmente en la comunidad mediante el registro de estos al realizarse las pruebas de enfermedades metabólicas en los recién nacidos, permite disponer de información de los nacidos no incluidos en el registro poblacional de AC.
El objetivo es identificar en mujeres embarazadas residentes en la CV el riesgo potencial de AC asociado a la prescripción y dispensación de medicamentos en atención ambulatoria, como indicadores del consumo de medicamentos durante el embarazo.
Materiales y métodosSe realizó un estudio epidemiológico de casos y controles con recogida de información retrospectiva a partir de fuentes secundarias.
Se definieron como casos los menores de un año nacidos vivos en los años 2009-2010, diagnosticados de una AC (definición de la Red Europea de Registros Poblacionales para la Vigilancia Epidemiológica de Anomalías Congénitas20) durante el primer año de vida y residentes en la CV, y como controles, los menores de un año nacidos vivos en los años 2009-2010, no diagnosticados de una AC durante el primer año de vida y residentes en la CV. Se utilizaron 2 controles por caso y la selección de estos se realizó aleatoriamente por frecuencias (asegurando que la distribución de controles y casos fuera la misma para: sexo, mes y año de nacimiento y provincia de residencia).
Del nacido vivo se incluyó: número de tarjeta sanitaria, mes y año de nacimiento, sexo, multiparidad, tipo de parto, peso y edad gestacional al nacimiento, y tipo de AC (casos). De la madre se incluyó: número de tarjeta sanitaria, edad y municipio de residencia en el momento del parto, país de nacimiento, y medicación prescrita y dispensada durante el embarazo.
Las fuentes de información utilizadas fueron: registro poblacional de AC (se seleccionaron los casos y se obtuvieron sus variables de estudio y las de sus madres –excepto la medicación–), Registro de Metabolopatías (se seleccionaron los controles y se obtuvieron sus variables y las de sus madres –excepto la medicación–) y GAIA (se obtuvo para casos y controles la medicación prescrita y dispensada en atención ambulatoria a la madre).
Utilizando el número de tarjeta sanitaria del nacido vivo se ha podido integrar la información de las distintas fuentes y se ha podido identificar a la madre de cada menor. En los datos de medicación de la madre, el número de tarjeta sanitaria estaba encriptado y el número de tarjeta sanitaria de la madre incluido en la base de datos de casos y controles fue encriptado, mediante el mismo algoritmo, para poder integrar la información de medicación. En el análisis no se identificó a los participantes, ya que la base de datos final con la que se realizó el estudio, utilizando el programa Stata 1221, fue anonimizada de manera irreversible.
Se llevó a cabo un estudio descriptivo de los medicamentos prescritos y dispensados a las madres tanto de los casos como de los controles. Para ello, se consideró como periodo de exposición el comprendido entre los 30 días anteriores a la fecha de inicio de la gestación y la fecha de nacimiento del niño. Se incluyeron los 30 días anteriores para asegurar que el periodo de exposición fuera durante el embarazo. La fecha inicial se calculó restando a la fecha de nacimiento del niño las semanas de gestación al nacimiento. Los medicamentos prescritos y dispensados se codificaron y agruparon siguiendo la clasificación Anatómica, Terapéutica y Química22. Se consideraron de manera individualizada tantas exposiciones de la madre como a fármacos diferentes estuvo expuesta. La descripción se realizó por grupos, identificando los medicamentos más frecuentemente prescritos y dispensados, en casos y controles.
Según la residencia de la embarazada se analizaron las posibles diferencias en la prescripción y dispensación por grupos de medicamentos entre los diferentes departamentos de salud. Se identificaron las diferencias significativas con la prueba de Chi-cuadrado de Pearson. El análisis se realizó separadamente para casos y controles.
Se realizó un análisis bivariante exploratorio para detectar asociaciones de cada grupo de medicamentos y los fármacos más frecuentes prescritos y dispensados en casos y controles. Se calcularon las odds ratio (OR) brutas y sus intervalos de confianza al 95% (IC95%). El análisis multivariante se realizó para aquellos medicamentos o grupos de medicamentos para los que se encontraron diferencias significativas.
Se obtuvieron las OR ajustadas utilizando un modelo de regresión logística. Se ajustó teniendo en cuenta las siguientes variables, ya descritas como confusoras en la literatura: la edad de la madre (<20, 20-35,>35 años), el peso al nacimiento (≥2.500g,<2.500g), la edad gestacional (≥37,<37 semanas de gestación), multiparidad (No/Sí), el país de origen de la mujer (nacidas en España/no nacidas en España) y el departamento de salud (1 al 23). Se hicieron pruebas de diagnóstico del modelo comprobando la colinealidad entre las variables de ajuste (utilizando el factor de inflación de la varianza). El análisis se realizó tanto para el conjunto de las AC como para cada grupo de anomalías.
ResultadosDurante los años 2009-2010, se identificaron 1.913 casos nacidos vivos menores de un año diagnosticados de AC durante el primer año de vida y residentes en la CV. Se seleccionaron 3.826 controles nacidos vivos residentes en la CV y sin diagnóstico de AC durante su primer año de vida. En la tabla 1 se presentan las características de los nacidos vivos y de sus madres según el grupo al que pertenecen.
Características de los nacidos vivos y de las madres, según el grupo al que pertenecen los menores
| Controles | Casos | |||
|---|---|---|---|---|
| n | (%) | n | (%) | |
| Nacido vivo | ||||
| Año de nacimiento | ||||
| 2009 | 1.948 | (50,9) | 974 | (50,9) |
| 2010 | 1.878 | (49,1) | 939 | (49,1) |
| Sexo | ||||
| Hombre | 1.957 | (51,2) | 1.058 | (55,3) |
| Desconocido | 0 | (0,0) | 1 | (0,1) |
| Multiparidad | ||||
| Sí | 141 | (3,7) | 126 | (6,6) |
| Madre | ||||
| Edad, años | ||||
| <20 | 106 | (2,8) | 72 | (3,8) |
| 20-35 | 2.872 | (75,1) | 1.304 | (68,2) |
| >35 | 844 | (22,1) | 505 | (26,4) |
| Desconocida | 4 | (0,1) | 32 | (1,7) |
| Provincia | ||||
| Valencia | 1.920 | (50,2) | 862 | (45,1) |
| Alicante | 1.443 | (37,7) | 804 | (42,0) |
| Castellón | 459 | (12,0) | 246 | (12,9) |
| Desconocida | 4 | (0,1) | 1 | (0,1) |
| País | ||||
| España | 2.818 | (73,7) | 1.340 | (70,0) |
| No España | 968 | (25,3) | 524 | (27,4) |
| Desconocido | 40 | (1,0) | 49 | (2,6) |
De las 27.712 recetas prescritas y dispensadas, el 33,2% correspondieron a madres de casos y el 66,8% a madres de controles. El 14,0% de las madres de casos y el 15,1% de las madres de controles tenían datos de medicación.
En casos y controles los grupos de medicamentos más frecuentes fueron los mismos: los que actúan sobre los sistemas respiratorio, nervioso, musculoesquelético, sobre la sangre y órganos hematopoyéticos, y antiinfecciosos.
Se produjo únicamente un cambio en la proporción del grupo de los antiinfecciosos, que pasó de la cuarta posición en la prescripción a la primera en la dispensación. Y los grupos de medicamentos que actúan sobre la sangre y los órganos hematopoyéticos y el sistema musculoesquelético intercambiaron posiciones al comparar casos y controles, identificándose una mayor proporción de los primeros en los controles y una mayor proporción de los segundos en los casos.
Los medicamentos más habituales, coincidiendo también en casos y controles, fueron: ibuprofeno, sulfato ferroso, amoxicilina, la combinación de ácido fólico con ioduro potásico y cianocobalamina, paracetamol y dexketoprofeno.
En los 2 grupos, y tanto en prescripción como en dispensación, el medicamento más frecuente fue el ibuprofeno. Algunos fármacos presentaron una proporción diferente en la prescripción y la dispensación; por ejemplo, en la prescripción el segundo en frecuencia fue el sulfato ferroso (3,0%), y en la dispensación, la amoxicilina (3,0%). No se identificaron diferencias entre casos y controles al comparar separadamente prescripción y dispensación.
Se realizó el análisis de la prescripción y la dispensación por departamentos de salud y solo se encontraron diferencias significativas en los casos: en la prescripción y la dispensación para el grupo de medicamentos que actúan sobre el sistema genitourinario y hormonas sexuales (p=0,008 y p<0,001, respectivamente), y además, en la dispensación para el grupo que actúa sobre el sistema respiratorio (p=0,03).
Se obtuvo la proporción de recetas prescritas y dispensadas por 100.000 habitantes en los diferentes departamentos de salud para casos y controles por separado. Los departamentos con mayor proporción de recetas sobre el total de habitantes fueron los mismos y en el mismo orden en los casos para prescripción y dispensación. Lo mismo ocurrió en los controles, pero con departamentos diferentes.
El riesgo de AC tanto en la prescripción como en la dispensación no fue significativo para el conjunto de todos los medicamentos.
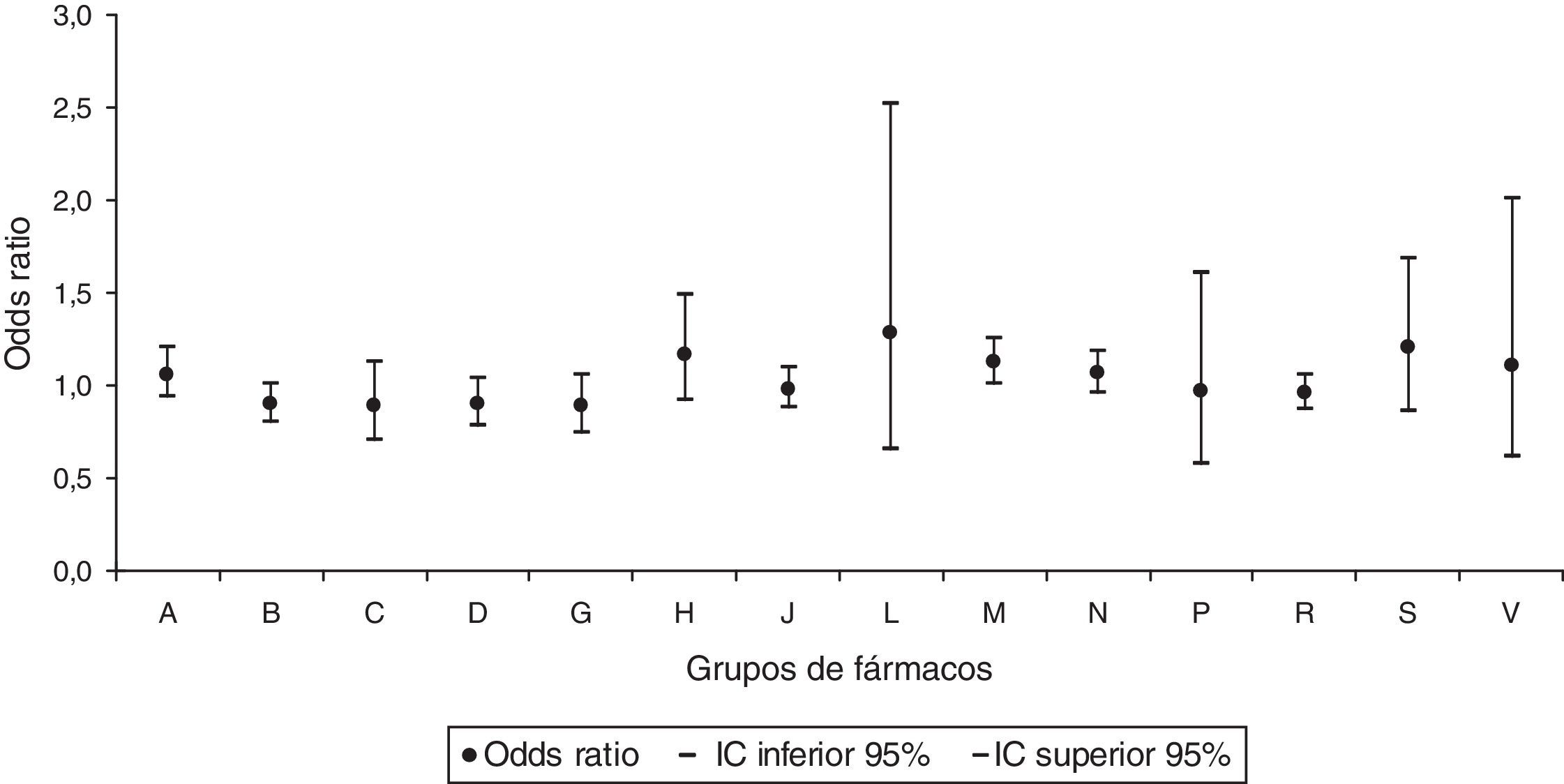
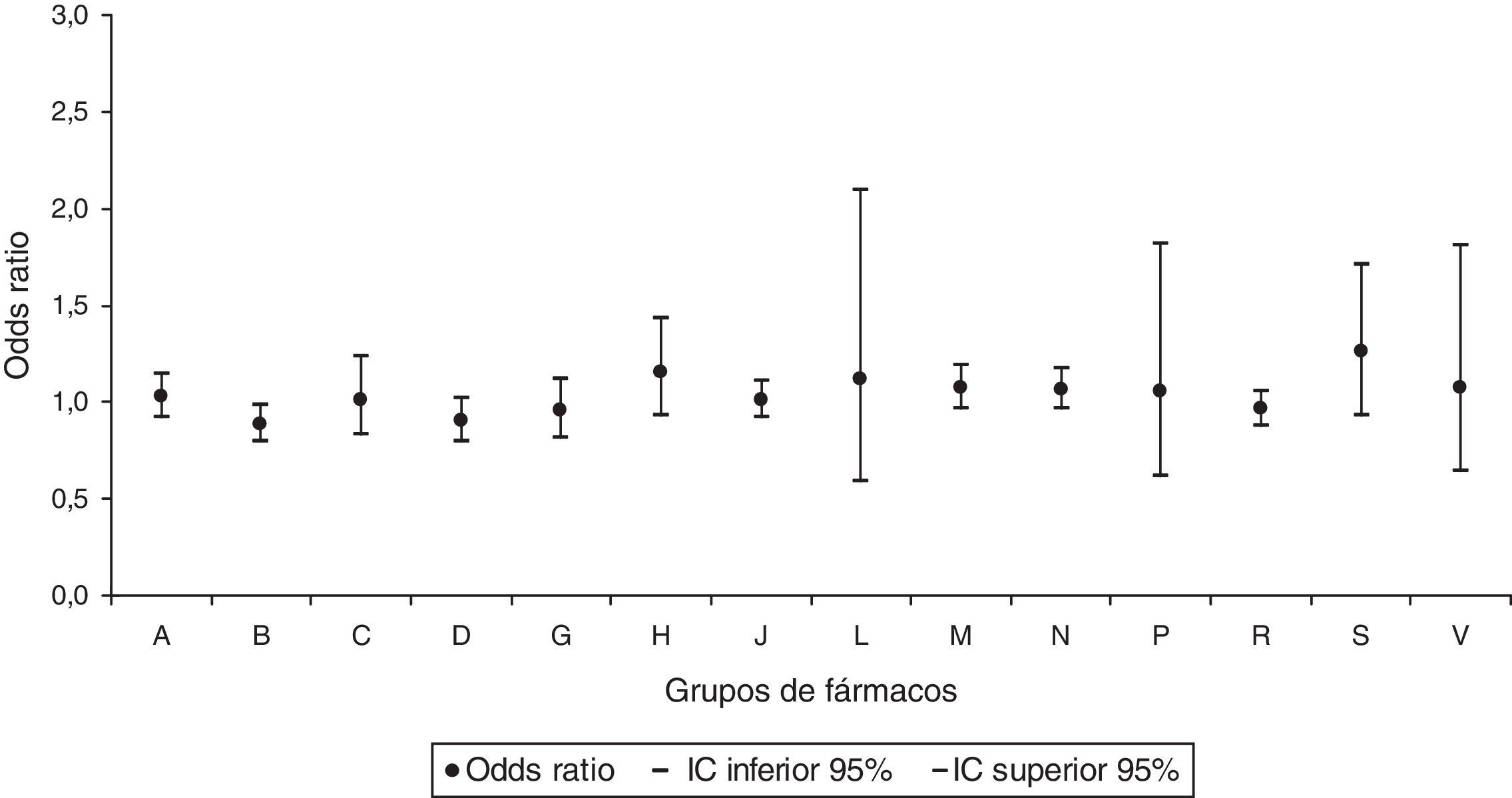
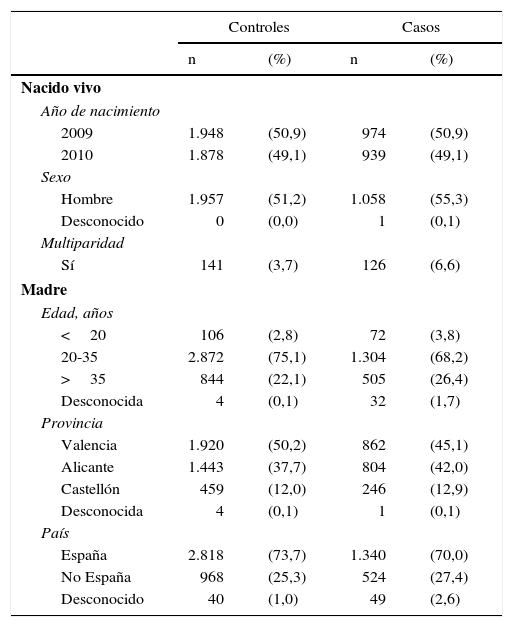
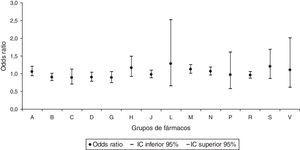
Al realizar el análisis por grupos de medicamentos prescritos, se obtuvo un mayor riesgo de AC estadísticamente significativo para el grupo de fármacos de acción sobre el sistema musculoesquelético, con una OR de 1,13 (IC95% 1,01-1,26) (fig. 1). Se observó un efecto protector de AC para la dispensación del grupo de los fármacos que actúan sobre la sangre y los órganos hematopoyéticos, con una OR de 0,88 (IC95% 0,79-0,99) (fig. 2).
Odds ratios de anomalías congénitas por grupos de fármacos en la prescripción.
A: tracto alimenticio y metabolismo; B: sangre y órganos hematopoyéticos; C: sistema cardiovascular; D: dermatológicos; G: sistema genitourinario y hormonas sexuales; H: preparados hormonales sistémicos; IC: intervalo de confianza al 95%; J: antiinfecciosos de uso sistémico; L: antineoplásicos y agentes inmunomodulares; M: sistema musculoesquelético; N: sistema nervioso; P: productos antiparásitos, insecticidas y repelentes; R: sistema respiratorio; S: sistema sensorial; V: varios.
Odds ratios de anomalías congénitas por grupos de fármacos en la dispensación.
A: tracto alimenticio y metabolismo; B: sangre y órganos hematopoyéticos; C: sistema cardiovascular; D: dermatológicos; G: sistema genitourinario y hormonas sexuales; H: preparados hormonales sistémicos; IC: intervalo de confianza al 95%; J: antiinfecciosos y agentes inmunomodulares; M: sistema musculoesquelético; N: sistema nervioso; P: productos antiparásitos, insecticidas y repelentes; R: sistema respiratorio; S: sistema sensorial; V: varios.
El riesgo de AC tampoco fue significativo para ninguno de los medicamentos más frecuentes, ni en la prescripción ni en la dispensación.
Por último, se realizó el análisis multivariante de los 2 grupos de medicamentos en los que se habían encontrado diferencias significativas para casos y controles. Se ajustó la OR por peso y edad gestacional al nacimiento, multiparidad, y edad, departamento de salud y país de origen de la madre. Al comprobar la colinealidad entre las covariables se obtuvo un factor de inflación de la varianza menor de 3 en todos los casos.
En la prescripción del grupo de fármacos de acción sobre el sistema musculoesquelético se mantuvo el aumento del riesgo de AC significativo, con una OR ajustada de 1,14 (IC95% 1,02-1,28), y también permaneció la disminución significativa del riesgo de AC para la dispensación del grupo de los fármacos que actúan sobre la sangre y los órganos hematopoyéticos, con una OR ajustada de 0,87 (IC95% 0,78-0,98).
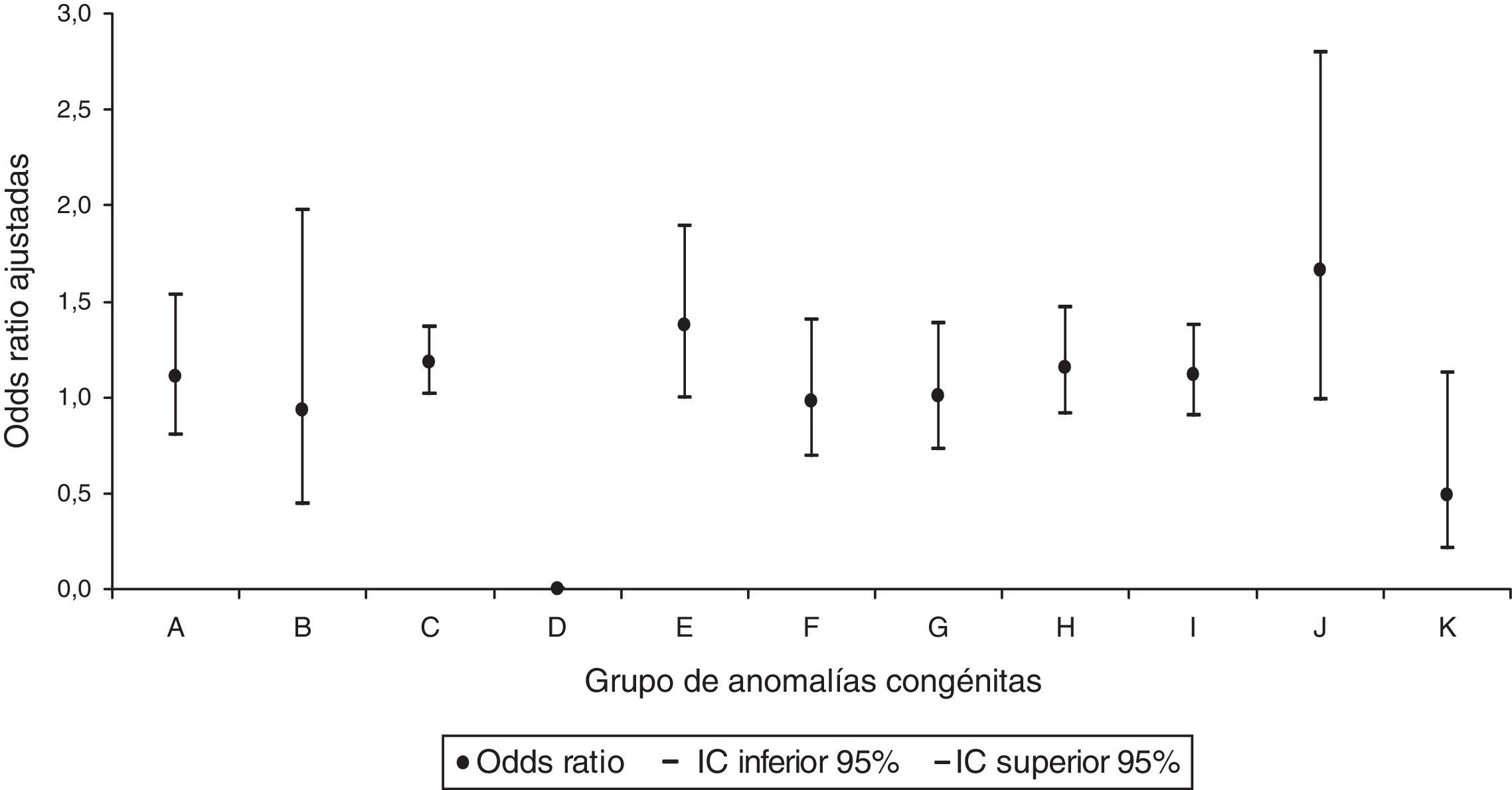
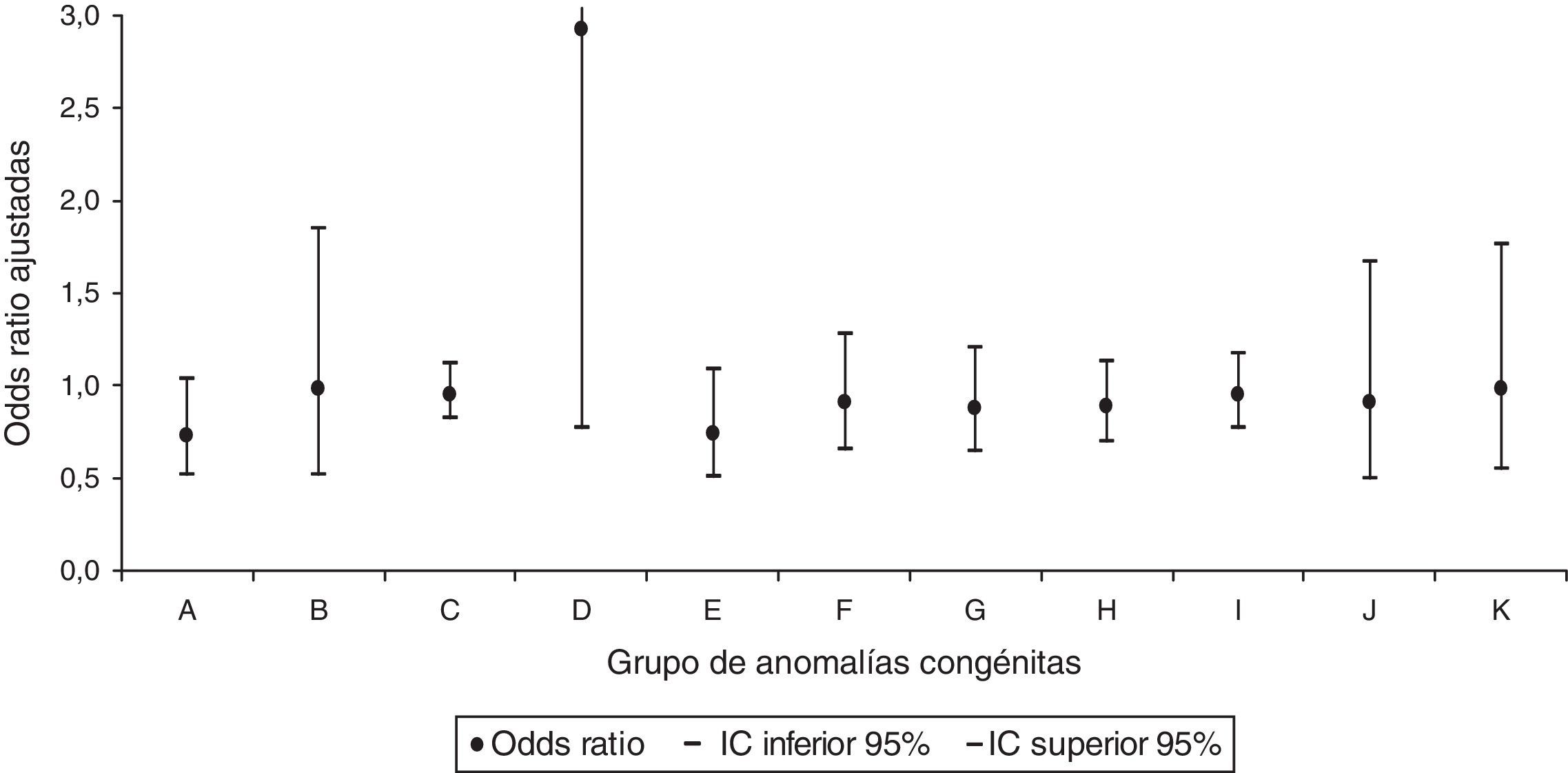
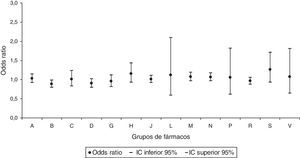
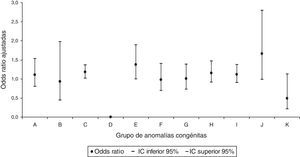
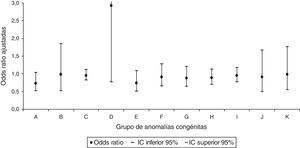
Al realizar el análisis por grupos de AC, únicamente se identificó para las AC del sistema circulatorio un aumento significativo con una OR ajustada de 1,18 (IC95% 1,01-1,37) en la prescripción del grupo de fármacos de acción sobre el sistema musculoesquelético (fig. 3). No se identificó relación significativa en ninguno de los grupos de AC para la dispensación del grupo de los fármacos que actúan sobre la sangre y los órganos hematopoyéticos (fig. 4).
Odds ratios ajustadas de anomalías congénitas por grupos de anomalías congénitas en la prescripción del grupo de fármacos de acción sobre el sistema musculoesquelético.
A: sistema nervioso; B: ojo, oído, cara y cuello; C: sistema circulatorio; D: sistema respiratorio; E: labio leporino y paladar hendido; F: sistema digestivo; G: órganos genitales; H: sistema urinario; I: sistema musculoesquelético; IC: intervalo de confianza al 95%; J: otras malformaciones; K: anomalías cromosómicas.
Odds ratios ajustadas de anomalías congénitas por grupos de anomalías congénitas en la dispensación del grupo de los fármacos que actúan sobre la sangre y los órganos hematopoyéticos.
A: sistema nervioso; B: ojo, oído, cara y cuello; C: sistema circulatorio; D: sistema respiratorio; E: labio leporino y paladar hendido; F: sistema digestivo; G: órganos genitales; H: sistema urinario; I: sistema musculoesquelético; IC: intervalo de confianza al 95%; J: otras malformaciones; K: anomalías cromosómicas.
El consumo de medicación fue mayor en los controles, con un 15% de embarazadas que consumieron fármacos frente a un 14% en los casos. Estos datos son inferiores a los descritos en otros estudios, en los que se identifican consumos muy variados (desde un 37 hasta un 81%)16,23,24.
La frecuente utilización de medicamentos en embarazadas se debe principalmente al hecho de que el consumo no siempre es evitable. Existen casos en los que es necesario, y los beneficios son mayores que el riesgo teratogénico al que se exponen25. Ante esta situación, lo más importante es valorar el balance riesgo/beneficio antes de la prescripción, administrar la mínima dosis eficaz durante el tiempo más corto posible, usar el menor número de fármacos posible y recurrir a fármacos con amplia experiencia clínica. Esta evaluación se tiene que hacer para cada embarazada y se debe evitar la utilización de fármacos en el primer trimestre26.
Los medicamentos más utilizados en este estudio coinciden con los identificados como de uso más frecuente en otros estudios24,27, diferenciándose 2 tipos: aquellos cuya administración se recomienda durante el embarazo y los utilizados para tratar enfermedades que se presentan en la gestación.
Los análisis realizados sobre las posibles diferencias entre departamentos de salud no han permitido establecer ningún patrón geográfico. Es necesario el planteamiento de investigaciones que permitan identificar posibles diferencias geográficas en la utilización de los medicamentos y las causas que las desencadenan, ya que a nivel internacional se ha descrito la existencia de una notable variación28 y, además, en la CV se ha identificado un patrón geográfico en la prevalencia y la distribución de algunas AC29.
La prescripción a embarazadas de fármacos que actúan a nivel musculoesquelético, sobre todo de 2 antiinflamatorios no esteroideos (AINE) (ibuprofeno y dexketoprofeno), aumenta significativamente el riesgo de AC en el hijo (OR ajustada 1,14) y, concretamente, el de AC del sistema circulatorio (OR ajustada 1,18). Esto coincide con otros estudios en los que la OR ajustada del conjunto de AC y de AC cardíacas mostraba una asociación perjudicial con el uso de AINE30, aunque también existen otras investigaciones en las que no se evidencia31.
El mayor riesgo de AC identificado puede deberse a que uno de los principales efectos adversos de los AINE en el feto es el cierre prematuro del ductus arterioso, provocando una sobrecarga del ventrículo derecho con hipertrofia y dilatación de este, a lo que se le asocia una insuficiencia tricuspídea y un cortocircuito auricular de derecha a izquierda32. Además, la disminución del flujo de la arteria renal y del líquido amniótico revierte cuando se suspende el tratamiento con AINE33, y estos pueden provocar hipertensión pulmonar y aumento del sangrado cutáneo e intracraneal en el feto, partos más largos y con mayores pérdidas de sangre y anemias más severas en la madre34.
Otra situación se da en la dispensación a embarazadas de los fármacos que actúan sobre la sangre y los órganos hematopoyéticos (sobre todo sulfato ferroso y la combinación de ácido fólico, ioduro potásico y cianocobalamina), ya que se ha observado una disminución significativa del riesgo de AC en el hijo (OR ajustada 0,87). No se ha identificado un efecto protector para ningún grupo de AC en concreto, pese a ser ampliamente conocida la acción preventiva del ácido fólico, asociado con multivitaminas, en las anomalías congénitas del tubo neural35 y en otros grupos de malformaciones36. Además, el hierro es fundamental para prevenir la anemia, ya que durante la gestación retrasa el crecimiento del feto y aumenta la posibilidad de pérdida del bebé, malformaciones genéticas y del sistema nervioso, bajo peso y frecuencia de partos prematuros37.
Al tratarse de un estudio de casos y controles poblacional con recogida de información retrospectiva a partir de fuentes secundarias, se minimizó el sesgo de selección de un estudio no poblacional y el sesgo de información diferencial entre casos y controles de la recogida de información por encuesta de un estudio no poblacional. También se minimizaron los sesgos derivados de las no respuestas.
Una de las limitaciones del proyecto es la calidad de los datos en las fuentes secundarias. En el caso del registro poblacional de AC, por no constar el número de tarjeta sanitaria del 13,1% de las madres no se pudieron integrar los posibles datos de medicación existentes. Y en el caso de GAIA existe un subregistro, ya descrito en otros estudios38,39, al no incluir recetas de medicamentos no financiados por el Sistema Nacional de Salud, medicamentos que no necesitan receta para su dispensación y recetas prescritas por facultativos privados. Además, con los medicamentos de bajo precio existe la posibilidad de que prefieran comprarlos directamente en lugar de conseguir la receta. Este infrarregistro no es probable en los medicamentos más caros, que requieran ajustes de dosis o necesiten un mayor control médico38. No obstante, esta fuente de información, con sus limitaciones, nos permite realizar una aproximación del consumo de fármacos en la CV que sería infinitamente más costosa utilizando otras técnicas.
Otra limitación es que se ha considerado la prescripción y la dispensación en GAIA como utilización del medicamento por la embarazada y que no ha sido posible diferenciar la exposición en función del trimestre de embarazo. Además, por el tipo de diseño planteado no se pueden identificar los medicamentos como factores etiológicos inequívocos de las AC, pero sí se puede valorar el riesgo asociado a estos. Para ello se tendrían que considerar otros posibles factores causales (ambientales, genéticos, socioeconómicos, etc.).
No obstante, la monitorización de la prescripción y la dispensación de medicamentos durante el embarazo puede ser utilizada como aproximación del consumo de medicamentos por las gestantes. El disponer de la exposición a medicamentos hace posible la identificación de aquellos fármacos potencialmente teratógenos, permitiendo la identificación de sus asociaciones con las AC tanto como factor de riesgo como protector. Además, servirá como base para establecer pautas de actuación clínicas y administrativas que permitan realizar farmacoterapias individualizadas efectivas y seguras en la gestación, y para iniciar la vigilancia sistemática de los riesgos farmacológicos de las AC a partir de las fuentes utilizadas.
FinanciaciónEsta investigación ha sido financiada por el Instituto Médico Valenciano, por el proyecto del Fondo de Investigaciones Sanitarias (FIS PI10/01676) y por la Spanish Rare Diseases Registries Research Network (SpainRDR) con el apoyo del International Rare Diseases Research Consortium (IRDiRC) y del Instituto de Salud Carlos III (PR11/122).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentaciones previas: Conferencia europea Safety of Medication use in Pregnancy, EUROmediCAT, Poznan (Polonia), febrero de 2015, y I Congreso de Biomedicina Predocs de Valencia, Valencia (España), noviembre de 2014.