Describir los factores de riesgo de displasia broncopulmonar en las primeras semanas de vida en grandes prematuros.
Material y métodosEstudio observacional de cohortes, retrospectivo, en recién nacidos ≤ 32 semanas y ≤ 1.500 g. Se realizó un análisis multivariante de regresión logística para identificar factores de riesgo independientes en las primeras semanas de vida.
ResultadosSe incluyeron 202 recién nacidos con una edad gestacional media de 29,5 ± 2,1 semanas. El 61,4% de los pacientes no recibió ventilación mecánica invasiva. El 28,7% fue diagnosticado de displasia broncopulmonar y el 10,4% de displasia broncopulmonar moderada-grave.
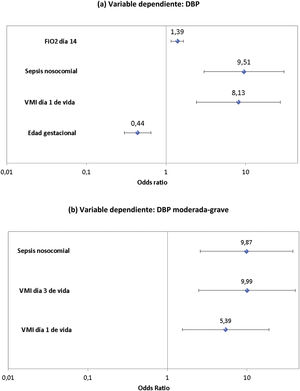
La edad gestacional (p < 0,001; OR = 0,44 [IC 95% = 0,30-0,65]), la ventilación mecánica en el día 1 (p = 0,001; OR = 8,13 [IC 95% = 2,41-27,42]), la sepsis nosocomial (p < 0,001; OR = 9,51 [IC 95% = 2,99-30,28]) y la FiO2 en el día 14 (p < 0,001; OR = 1,39 [IC 95% = 1,16-1,66]) fueron los factores de riesgo independientes de displasia broncopulmonar. La ventilación mecánica el día 1 (p = 0,008; OR = 5,39 [IC 95% = 1,54-18,89]) y 3 de vida (p = 0,001; OR = 9,99 [IC 95% = 2,47-40,44]) y la sepsis nosocomial (p = 0,001; OR = 9,87 [IC 95% = 2,58-37,80]) se asociaron al desarrollo de displasia broncopulmonar moderada-grave.
ConclusionesLa edad gestacional, la ventilación mecánica en los primeros días de vida y la sepsis nosocomial son factores de riesgo precoces de displasia broncopulmonar. El análisis de datos clínicos sencillos y objetivos nos permite seleccionar a un grupo de pacientes con alto riesgo de desarrollar displasia broncopulmonar, en el que podría estar justificado actuar de forma más agresiva y nos muestra áreas de mejora para prevenir su desarrollo o disminuir su gravedad.
To describe risk factors of bronchopulmonary dysplasia in very preterm infants in the first weeks of life.
Material and methodsRetrospective cohort study of preterm infants ≤ 32 weeks of gestational age and birth weight ≤ 1500 g. A multivariate logistic regression analysis was performed to identify independent risk factors for bronchopulmonary dysplasia in the first weeks of life.
ResultsA total of 202 newborns were included in the study (mean gestational age 29.5 ± 2.1 weeks), 61.4% never received invasive mechanical ventilation. The incidence of bronchopulmonary dysplasia was 28.7%, and 10.4% of the patients were diagnosed with moderate–severe bronchopulmonary dysplasia.
Bronchopulmonary dysplasia was independently associated with gestational age at birth (p < 0.001; OR = 0.44 [95% CI = 0.30–0.65]), the need for mechanical ventilation on the first day of life (p = 0.001; OR = 8.13 [95% CI = 2.41–27.42]), nosocomial sepsis (p < 0.001; OR = 9.51 [95% CI = 2.99–30.28]) and FiO2 on day 14 (p < 0.001; OR = 1.39 [95% CI = 1.16–1.66]). Receiving mechanical ventilation at the first day of life (p = 0.008; OR = 5.39 [95% CI = 1.54–18.89]) and at the third day of life (p = 0.001; OR = 9.99 [95% CI = 2.47–40.44]) and nosocomial sepsis (p = 0.001; OR = 9.87 [95% CI = 2.58–37.80]) were independent risk factors for moderate–severe bronchopulmonary dysplasia.
ConclusionsGestational age at birth, mechanical ventilation in the first days of life and nosocomial sepsis are early risk factors for bronchopulmonary dysplasia. The analysis of simple and objective clinical data, allows us to select a group of patients at high risk of bronchopulmonary dysplasia in whom it could be justified to act more aggressively, and shows areas for improvement to prevent its development or reduce its severity.
La displasia broncopulmonar (DBP) es una enfermedad pulmonar crónica que afecta alrededor del 50% de los recién nacidos pretérmino menores de 28 semanas de edad gestacional, y en torno a un 30% de los menores de 32 semanas1,2. Los recién nacidos afectos de DBP tienen una mayor mortalidad3, y los que sobreviven lo hacen a costa de un aumento de morbilidad pulmonar, cardiovascular y sobre el neurodesarrollo, que se asocia con una peor calidad de vida y un mayor consumo de recursos4–6.
La fisiopatología de la DBP es multifactorial y todavía no está claramente establecida7. El eje central es el nacimiento prematuro8, sobre el cual influyen diferentes factores pre y posnatales, que modulan la probabilidad basal de desarrollar la enfermedad9. A pesar de que se han estudiado múltiples terapias para prevenir o tratar la DBP, todavía no disponemos de un tratamiento seguro y eficaz, y cada vez hay más evidencia de que existe una ventana de oportunidad que es muy anterior al diagnóstico clínico de DBP10. Higgins et al.9 proponen que las estrategias encaminadas a prevenir la DBP deben ser intervenciones prenatales o en los primeros días de vida, en torno a la primera semana. Medidas realizadas en este sentido han contribuido a disminuir la mortalidad neonatal y algunas complicaciones asociadas con la prematuridad11,12. Sin embargo, esto no se ha traducido en una reducción significativa de las tasas de DBP. Una mayor supervivencia de los recién nacidos extremadamente prematuros, en los que la enfermedad es más prevalente, justificaría en parte estos resultados, pero también reflejan nuestra incapacidad para prevenir el desarrollo de DBP13,14.
Por tanto, identificar a los neonatos con mayor riesgo de desarrollar DBP es uno de los retos de la neonatología actual y ha sido estudiado en múltiples ocasiones15, con un doble interés. Por un lado, a nivel clínico, al permitirnos determinar a los pacientes en los que los beneficios de las terapias actualmente disponibles pueden superar a los potenciales riesgos16. Por otro lado, a nivel de investigación, al permitirnos seleccionar adecuadamente los candidatos a las nuevas terapias en estudio en el contexto de los ensayos clínicos.
En este estudio, nuestro objetivo fue conocer la incidencia, características clínicas y los factores de riesgo de DBP y DBP moderada-grave en una muestra contemporánea de recién nacidos muy prematuros, analizando variables prenatales y relacionadas con la evolución neonatal en las primeras semanas de vida.
Material y métodosDiseño y población de estudioSe realizó un estudio observacional de cohortes retrospectivo, en una Unidad de Cuidados Intensivos Neonatales (UCIN) de nivel IIIC de un hospital de la red sanitaria pública española. Se incluyeron en el estudio aquellos recién nacidos pretérmino ≤ 32 semanas de edad gestacional y peso al nacimiento ≤ 1.500 g, que nacieron en el hospital del estudio e ingresaron en su UCIN entre el 1 de enero de 2013 y el 30 de agosto de 2020. Se excluyeron aquellos recién nacidos con malformaciones congénitas mayores y los fallecidos antes de los 28 días de vida. Con los criterios de inclusión y exclusión establecidos, se incluyeron en el estudio n = 202 pacientes, tamaño suficiente para estimar la incidencia de DBP con una seguridad del 95% y una precisión de +/-6,5%, así como para detectar como estadísticamente significativos valores de riesgo relativo [RR] ≥ 1,65 asociados con un factor de riesgo presente en el 50% de la población estudiada, con una seguridad del 95% y un poder estadístico del 80%. El protocolo de estudio fue aprobado por el Comité de Ética de la Investigación de referencia previo a su realización.
Variables y definicionesSe recogieron variables demográficas, características prenatales y obstétricas, datos sobre la reanimación en sala de partos y el soporte respiratorio en las primeras dos semanas de vida (días 1, 3, 7 y 14), así como los principales resultados relacionados con la prematuridad. Las variables resultado principales fueron la DBP y la DBP moderada-grave. Se definió la DBP como la necesidad de oxigenoterapia suplementaria a los 28 días de vida (de acuerdo con la base de datos nacional SEN1500) y se clasificó en función de los requerimientos de oxígeno y del soporte respiratorio a las 36 semanas: leve si ya no existía dependencia de oxígeno, moderada si la fracción inspiratoria de oxígeno (FiO2) era < 30% y grave si precisaba FiO2 ≥ 30% o VMI17. Se consideró enterocolitis necrotizante (ECN) al grado ≥ 2, según la clasificación de Bell18. El ductus arterioso persistente (DAP) se diagnosticó mediante ecocardiografía realizada a criterio clínico, y se trató según el protocolo de la unidad. La hemorragia intraventricular (HIV) se definió según los grados de Volpe19. A todos los recién nacidos se les realizó cribado de retinopatía de la prematuridad (ROP) y se clasificó según las guías nacionales20. La restricción al crecimiento intrauterino (RCIU) se definió como un peso al nacimiento < -1,5 z-score, según las gráficas de crecimiento de Fenton21. La sepsis nosocomial se diagnosticó con el resultado positivo de un hemocultivo. Se diagnosticó la enfermedad mineral ósea con base en los niveles de fósforo y fosfatasa alcalina en la tercera semana de vida22.
Pautas de manejo respiratorioNo se realizaron cambios relevantes durante el periodo de estudio en el manejo respiratorio. La reanimación en sala de partos se realizó según las recomendaciones del grupo de reanimación de la Sociedad Española de Neonatología, utilizando soporte no invasivo con continuous positive airway pressure/noninvasive positive pressure ventilation (CPAP/NIPPV) con mascarilla y resucitador en T como terapia inicial23,24. En UCIN, se utilizó la NIPPV como terapia de rescate precoz previo a considerar intubación orotraqueal (IOT) ante una evolución desfavorable de la enfermedad de membrana hialina. Se administró surfactante en las primeras horas de vida cuando los requerimientos de oxígeno fueron superiores al 30% en ventilación mecánica no invasiva (VMNI) o si se precisó IOT. La técnica de elección en neonatos no intubados fue la de intubar-surfactante-extubar (INSURE), manteniendo la VMNI durante el procedimiento, evitando la ventilación con presión positiva intermitente a través del tubo endotraqueal y bajo premedicación con cafeína, fentanilo y atropina. Se administró cafeína de forma profiláctica a todos los recién nacidos < 28 semanas de edad gestacional y a los < 32 semanas si presentaron apneas de la prematuridad. Se consideró administrar una pauta de 22 días de hidrocortisona (dosis total 72,5 mg/kg) en neonatos intubados y con FiO2 > 30% en la tercera semana de vida25. Dos pacientes recibieron terapia experimental con células mesenquimales intravenosas en el contexto de un ensayo clínico.
Análisis estadísticoEl análisis descriptivo se realizó expresando las variables cuantitativas como media ± desviación típica y las variables cualitativas como valor absoluto y porcentaje. Para el análisis univariante se aplicaron los test correspondientes: t de Student o U de Mann-Whitney para las variables cuantitativas y χ2 o prueba exacta de Fisher para las variables cualitativas. Se consideraron como estadísticamente significativos valores de p < 0,05. Se realizó un análisis multivariante mediante regresión logística para identificar factores de riesgo independientes de DBP. Se incluyeron en este análisis las variables previas al diagnóstico de DBP que resultaron estadísticamente significativas en el análisis univariante, así como aquellas que no teniendo asociación estadísticamente significativa, fueron consideradas clínicamente relevantes. Se excluyeron las variables con alta colinealidad. Se calculó en área bajo la curva (ABC) ROC para los modelos finales y se aplicaron a la muestra dos modelos de predicción de DBP previamente descritos26,27 para su comparación. Todos los análisis se realizaron con el programa estadístico SPSS versión 24 (IBM Corp, Armonk, NY).
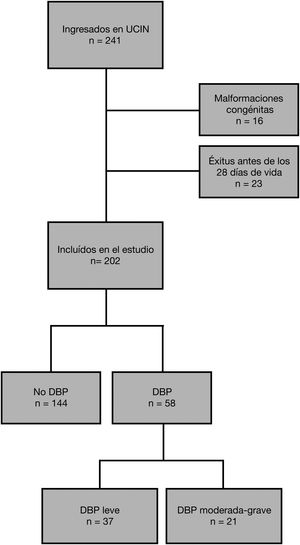
ResultadosDurante el periodo de estudio, ingresaron en la unidad 241 recién nacidos pretérmino ≤ 32 semanas de edad gestacional y peso al nacimiento ≤ 1.500 g. Se excluyeron aquellos con malformaciones congénitas mayores (n = 16) y los pacientes fallecidos antes de los 28 días de vida en los que no se pudo establecer el diagnóstico de DBP (n = 23, de los cuales ocho fueron de causa respiratoria). Finalmente, 202 grandes prematuros (106 mujeres, 52,5%) se incluyeron en el estudio (fig. 1). La edad gestacional media fue de 29,5 ± 2,1 semanas y el peso al nacimiento 1.142,1 ± 255,5 g. Sus principales características perinatales y diagnósticos más relevantes de la evolución neonatal están descritos en la tabla 1.
Análisis descriptivo de la población de estudio
| Características perinatalesX¯ ± DS | Muestra totaln = 202 | EG(1) ≤ 28 n = 77 | EG 29-32 n = 125 |
|---|---|---|---|
| Edad gestacional (semanas) | 29,50 ± 2,1 | 27,3 ± 1,2 | 30,8 ± 1,1 |
| Peso al nacimiento (g) | 1.142,08 ± 255,5 | 956,52 ± 218,5 | 1.250,84 ± 212,8 |
| Peso Z-score (DS) | -0,46 ± 0,8 | -0,01 ± 0,8 | -0,74 ± 0,6 |
| Edad materna (años) | 34,19 ± 6,3 | 33,8 ± 6,6 | 34,4 ± 6,2 |
| n (%) | |||
| HTA(2) materna | 46 (22,8) | 13 (16,9) | 33 (26,4) |
| Corioamnionitis | 32 (15,8) | 21 (27,3) | 11 (8,8) |
| Esteroides prenatales(3) | 198 (98) | 77 (100) | 121 (96,8) |
| Parto múltiple | 77 (38,1) | 22 (28,6) | 55 (44) |
| Parto vaginal | 46 (22,8) | 20 (26) | 26 (20,8) |
| FIV(4) | 51 (25,2) | 15 (19,5) | 36 (28,8) |
| Sexo (mujer) | 106 (52,5) | 44 (57,1) | 62 (49,6) |
| RCIU(5) | 18 (8,9) | 3 (3,9) | 15 (12) |
| Evolución neonatal | |||
| X¯± DS | |||
| Días ingreso UCIN | 26,39 ± 18,9 | 41,29 ± 19,1 | 17,2 ± 11,5 |
| Días ingreso | 61,14 ± 55,6 | 85,8 ± 82,5 | 45,83 ± 14,2 |
| n (%) | |||
| DBP(6) | 58 (28,7) | 50 (64,9) | 8 (6,4) |
| DBP moderada-grave | 21 (10,4) | 17 (22,1) | 4 (3,2) |
| Oxígeno al alta | 8 (4) | 6 (7,8) | 2 (1,6) |
| DAP(7) | 41 (20,3) | 31 (40,3) | 10 (8) |
| Cierre farmacológico DAP | 29 (14,4) | 24 (31,2) | 5 (4) |
| Cierre quirúrgico DAP | 12 (5,9) | 9 (11,7) | 3 (2,4) |
| ECN(8) | 11 (5,4) | 7 (9,1) | 4 (3,2) |
| Grado ROP(9) > II | 22 (10,9) | 20 (26,3) | 14 (11,2) |
| Sepsis nosocominal | 73 (36,1) | 41 (53,2) | 32 (25,6) |
| Grado HIV(10) > II | 12 (5,9) | 11 (14,3) | 1 (0,8) |
| LPV(11) | 13 (6,4) | 10 (13) | 3 (2,4) |
| EMO(12) | 42 (20,8) | 21 (27,3) | 21 (16,8) |
(1) Edad gestacional. (2) Hipertensión arterial. (3) Pacientes que recibieron pauta de maduración pulmonar completa. (4) Fecundación in vitro. (5) Restricción al crecimiento intrauterino. (6) Displasia broncopulmonar. (7) Ductus arterioso persistente. (8) Enterocolitis necrotizante. (9) Retinopatía de la prematuridad. (10) Hemorragia intraventricular. (11) Leucomalia periventricular. (12) Enfermedad mineral ósea.
DS: desviación estándar; IQR: rango intercuartílico; ABC: área bajo la curva; UCIN: Unidad de Cuidados Intensivos Neonatales.
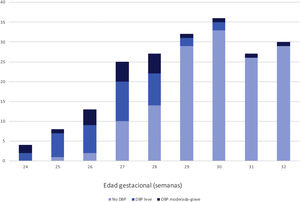
Un total de 58 pacientes (28,7%) fueron diagnosticados de DBP, de los cuales 21 (10,4% del total) fueron clasificados como DBP moderada-grave, su distribución por semanas de edad gestacional [EG] se representa en la figura 2. Un 19,8% (n = 40) requirieron intubación en paritorio y un 50% (n = 101) requirieron surfactante en algún momento. Un 38,6% (n = 78) recibieron VMI a lo largo del ingreso, siendo el resto (n = 124) manejados solo de forma no invasiva. No hubo ningún exitus posterior a los 28 días de vida.
En la tabla 2 se refleja el análisis univariante para DBP. El resultado del análisis de regresión logística en relación con el diagnóstico de DBP demostró como factores de riesgo independientes más relevantes la edad gestacional (p < 0,001, odds ratio [OR] = 0,44 [IC 95% = 0,30-0,65]), la necesidad de VMI durante el primer día de vida (p = 0,001, OR = 8,13 [IC 95% = 2,41-27,42]), la sepsis nosocomial (p < 0,001, OR = 9,51 [IC 95% = 2,99-30,28]) y la FiO2 del día 14 de vida (p < 0,001, OR = 1,39 [IC 95% = 1,16-1,66]) (fig. 3). El ABC ROC para el modelo de DBP fue de 0,967 (IC 95%: 0,944-0,990).
Factores de riesgo de displasia broncopulmonar
| DBP (n = 58) | No DBP (n = 144) | Valor p | ABC | IC 95% | |
|---|---|---|---|---|---|
| Características perinatales | |||||
| X¯± DS | |||||
| Edad gestacional* | 27,5 ± 1,7 | 30,3 ± 1,6 | < 0,001 | 0,888 | 0,77-1 |
| Peso (g)** | 938,7 ± 216,8 | 1.224 ± 222,5 | < 0,001 | 0,790 | 0,62-0,96 |
| Peso Z-score** | -0,2 ± 0,9 | -0,6 ± 0,8 | 0,005 | 0,628 | 0,54-0,72 |
| Edad materna (años) | 34,2 ± 6,9 | 34,2 ± 6,1 | 0,980 | 0,500 | 0,41-0,59 |
| n (%) | RR | IC 95% | |||
| HTA(1) materna | 12 (20,7) | 34 (23,6) | 0,654 | 0,885 | 0,51-1,52 |
| Corioamnionitis | 10 (17,2) | 22 (15,3) | 0,729 | 1.107 | 0,63-1,95 |
| Esteroides prenatales(2) | 57 (98,3) | 141 (97,9) | 0,868 | 1.515 | 0,21-6,37 |
| Parto múltiple | 19 (32,8) | 58 (40,3) | 0,319 | 0,791 | 0,49-1,36 |
| FIV(3) | 12 (20,7) | 39 (27,1) | 0,344 | 0,772 | 0,44-1,34 |
| Parto vaginal | 17 (29,3) | 29 (20,1) | 0,160 | 1.406 | 0,89-2,23 |
| Sexo mujer | 27 (46,6) | 79 (54,8) | 0,285 | 0,789 | 0,51-1,22 |
| RCIU(4) | 3 (5,2) | 15 (10,4) | 0,237 | 0,557 | 0,19-1,60 |
| Reanimación sala de partos | |||||
| n (%) | RR | IC 95% | |||
| Oxígeno** | 55 (94,8) | 114 (79,2) | 0,006 | 3.580 | 1,29-10,76 |
| IOT(5)** | 24 (41,4) | 16 (11,1) | < 0,001 | 2.859 | 1,93-4,23 |
| Masaje cardíaco | 4 (6,9) | 6 (4,2) | 0,418 | 1.422 | 0,64-3,14 |
| Adrenalina | 3 (5,2) | 4 (2,8) | 0,400 | 1.519 | 0,63-3,68 |
| Evolución neonatal | |||||
| X¯± DS | ABC | IC 95% | |||
| FiO2 día 1** | 28,9 ± 13,1 | 23,9 ± 5,5 | 0,007 | 0,661 | 0,58-0,74 |
| FiO2 día 3** | 26 ± 7,5 | 22,3 ± 3,1 | 0,001 | 0,699 | 0,61-0,78 |
| FiO2 día 7** | 25,4 ± 6,2 | 21,7 ± 2,4 | < 0,001 | 0,709 | 0,62-0,80 |
| FiO2 día 14* | 27,8 ± 7,2 | 21,4 ±1,9 | < 0,001 | 0,835 | 0,76-0,91 |
| n (%) | RR | IC 95% | |||
| Surfactante** | 50 (86,2) | 51 (35,4) | < 0,001 | 6.250 | 3,12-12,50 |
| CPAPn | 58 (100) | 137 (95,1) | 0,087 | ------ | -------------- |
| NIPPV** | 57 (98,3) | 53 (36,8) | < 0,001 | 47.673 | 6,73-337,63 |
| VMC(6)** | 50 (86,2) | 28 (19,4) | < 0,001 | 9.936 | 1,98-19,82 |
| VAFO(7)** | 5 (8,6) | 3 (2,1) | 0,031 | 2.288 | 1,28-4,10 |
| VMI(8) día 1 de vida* | 36 (62,1) | 15 (10,4) | < 0,001 | 4.845 | 3,17-7,41 |
| VMI día 3 de vida** | 18 (31) | 3 (2,1) | < 0,001 | 3.878 | 2,80-5,36 |
| VMI día 7 de vida** | 12 (20,7) | 1 (0,7) | < 0,001 | 3.792 | 2,82-5,10 |
| VMI día 14 de vida** | 17 (29,3) | 1 (0,7) | < 0,001 | 4.238 | 3,16-5,68 |
| DAP(9)** | 26 (44,8) | 15 (10,4) | < 0,001 | 3.190 | 2,16-4,70 |
| Cierre farmacológico DAP** | 20 (34,5) | 9 (6,3) | < 0,001 | 3.140 | 2,16-4,55 |
| Cierre quirúrgico DAP** | 9 (15,5) | 3 (2,1) | < 0,001 | 2.908 | 1,94-4,36 |
| Sepsis nosocomial* | 41 (70,7) | 32 (22,2) | < 0,001 | 4.262 | 2,62-6,94 |
(1) Hipertensión arterial. (2) Pacientes que recibieron pauta completa de maduración pulmonar. (3) Fecundación in vitro. (4) Restricción al crecimiento intrauterino. (5) Intubación orotraqueal. (6) Ventilación mecánica convencional. (7) Ventilación de alta frecuencia oscilatoria. (8) Ventilación mecánica invasiva. (9) Ductus arterioso persistente.
DS: desviación estándar; ABC: área bajo la curva; IC 95%: intervalo de confianza del 95%; RR: riesgo relativo; CPAPn: nasal continuous positive airway pressure; NIPPV: noninvasive positive pressure ventilation.
En la tabla 3 se refleja el análisis univariante para la DBP moderada-grave. En el análisis de regresión logística en relación con la DBP moderada-grave, los factores de riesgo que se asociaron de forma independiente son la necesidad de VMI el día 1 (p = 0,008, OR = 5,39 [IC 95% = 1,54-18,89]) y 3 de vida (p = 0,001, OR = 9,99 [IC 95% = 2,47-40,44]) y el diagnóstico de sepsis nosocomial (p = 0,001, OR = 9,87 [IC 95% = 2,58-37,80]) (fig. 3). El ABC para el modelo de DBP moderada-grave fue de 0,891 (IC 95%: 0,812-0,971).
Factores de riesgo de displasia broncopulmonar moderada-grave
| DBP moderada-grave(n = 21) | No DBP moderada-grave(n = 181) | Valor p | ABC | IC 95% | |
|---|---|---|---|---|---|
| Características perinatales | |||||
| X¯± DS | |||||
| Edad gestacional* | 27,78 ± 2 | 29,7 ± 2 | < 0,001 | 0,447 | 0,12-0,79 |
| Peso (g)* | 923,1 ± 268,3 | 1167,5 ± 242,2 | < 0,001 | 0,404 | 0,10-0,70 |
| Peso Z-score | -0,5 ± 0,8 | -0,4 ± 0,8 | 0,604 | 0,649 | 0,30-0,99 |
| Edad materna (años) | 33 ± 6,3 | 34,3 ± 6,3 | 0,365 | 0,429 | 0,30-0,56 |
| n (%) | RR | IC 95% | |||
| HTA(1) materna | 6 (28,6) | 40 (22,1) | 0,503 | 1.356 | 0,56-3,30 |
| Corioamnionitis | 2 (9,5) | 30 (16,6) | 0,402 | 0,559 | 0,14-2,28 |
| Esteroides prenatales(2) | 20 (95,2) | 178 (98,3) | 0,334 | 0,404 | 0,07-2,32 |
| Parto múltiple | 9 (42,9) | 68 (37,6%) | 0,637 | 1.217 | 0,54-2,75 |
| FIV(3) | 4 (19) | 47 (26) | 0,490 | 0,696 | 0,25-1,97 |
| Parto vaginal | 6 (28,6) | 40 (22,1) | 0,552 | 1.356 | 0,56-3,30 |
| Sexo (mujer) | 8 (38,1) | 98 (54,1) | 0,163 | 0,557 | 0,24-1,29 |
| RCIU(4) | 1 (4,8) | 17 (9,4) | 0,481 | 0,511 | 0,07-3,60 |
| Reanimación sala de partos | |||||
| n (%) | RR | IC 95% | |||
| Oxígeno* | 21 (100) | 148 (81,8) | 0,032 | ------ | -------------- |
| IOT(5)** | 8 (38,1) | 32 (17,7) | 0,026 | 2.492 | 1,11-5,60 |
| Masaje cardíaco | 1 (4,8) | 9 (5) | 0,966 | 0,960 | 0,14-6,45 |
| Adrenalina | 0 | 7 (3,9) | 0,359 | ------ | -------------- |
| Evolución neonatal | |||||
| X¯± DS | ABC | IC 95% | |||
| FiO2 día 1* | 32,9 ± 17,2 | 24,5 ± 6,6 | 0,007 | 0,733 | 0,61-0,85 |
| FiO2 día 3* | 27,7 ± 8,2 | 22,9 ± 4,3 | 0,037 | 0,716 | 0,59-0,85 |
| FiO2 día 7* | 26,6 ± 6,6 | 22,3 ± 3,7 | 0,015 | 0,709 | 0,57-0,84 |
| FiO2 día 14* | 29,7 ± 8,1 | 22,5 ± 4 | 0,009 | 0,826 | 0,72-0,93 |
| n (%) | RR | IC 95% | |||
| Surfactante* | 20 (95,2) | 81 (44,8) | < 0,001 | 20.000 | 2,74-146,21 |
| CPAPn | 21 (100) | 174 (96,1) | 0,359 | ------ | -------------- |
| NIPPV* | 21 (100) | 89 (49,2) | 0,010 | ------ | -------------- |
| VMC(6)* | 20 (95,2) | 58 (32) | < 0,001 | 31.795 | 4,35-232,20 |
| VAFO(7)* | 3 (14,3) | 5 (2,8) | 0,010 | 4.042 | 1,49-10,95 |
| VMI(8) día 1 de vida** | 16 (76,2) | 36 (19,9) | < 0,001 | 9.474 | 3,65-24,56 |
| VMI día 3 de vida** | 11 (52,4) | 10 (5,5) | < 0,001 | 9.481 | 4,58-19,62 |
| VMI día 7 de vida* | 6 (28,6) | 7 (3,9) | < 0,001 | 5.815 | 2,71-12,46 |
| VMI día 14 de vida* | 8 (38,1) | 10 (5,5) | < 0,001 | 6.290 | 3,01-13,13 |
| DAP(9)* | 10 (47,6) | 31 (17,1) | 0,001 | 3.570 | 1,63-7,82 |
| Cierre farmacológico DAP* | 7 (33,3) | 22 (12,2) | 0,009 | 2.983 | 1,32-6,76 |
| Cierre quirúrgico DAP* | 5 (23,8) | 7 (3,9) | < 0,001 | 4.948 | 2,18-11,20 |
| Sepsis nosocomial** | 17 (81) | 56 (30,9) | < 0,001 | 7.510 | 2,63-21,48 |
(1) Hipertensión arterial. (2) Pacientes que recibieron pauta completa de maduración pulmonar. (3) Fecundación in vitro. (4) Restricción al crecimiento intrauterino. (5) Intubación orotraqueal. (6) Ventilación mecánica convencional. (7) Ventilación de alta frecuencia oscilatoria. (8) Ventilación mecánica invasiva. (9) Ductus arterioso persistente.
DS: desviación estándar; ABC: área bajo la curva; IC 95: intervalo de confianza del 95%; RR: riesgo relativo; CPAPn: nasal continuous positive airway pressure; NIPPV: noninvasive positive pressure ventilation.
El ABC ROC de los modelos seleccionados previamente descritos fue inferior a nuestro modelo. El modelo de Gursoy et al.27 para predecir DBP demostró ABC de 0,869 (IC 95%: 0,815-0,922) y para DBP moderada-grave ABC de 0,803 (IC 95%: 0,711-0,895). El modelo de Hunt et al.26 para predecir DBP demostró ABC de 0,600 (IC 95%: 0,508-0,692) y para DBP moderada-grave ABC de 0,624 (IC 95%: 0,480-0,767).
DiscusiónEl mejor conocimiento de los factores de riesgo de DBP es un paso fundamental en la prevención y adecuado manejo de esta entidad. En el presente estudio, realizado en una muestra consecutiva de recién nacidos con edad gestacional ≤ 32 semanas y peso al nacimiento ≤ 1.500 g, manejados mayoritariamente de forma no invasiva y con una incidencia de DBP similar a la previamente descrita, hemos demostrado que la menor EG, la necesidad de VMI en los primeros días de vida y la infección nosocomial siguen siendo los principales factores de riesgo precoces de DBP. La capacidad predictiva de estos modelos mejoró a otros previamente descritos26,27.
En nuestros recién nacidos, la incidencia de DBP moderada-grave fue del 10,4%, inferior a la media nacional (15,8%), según los datos de SEN1500 reflejados por la red iNeo11 donde la incidencia global del análisis de todos los países integrantes es significativamente superior (25,5%). Estos resultados también se reflejan en una mayor supervivencia libre de DBP moderada-grave en recién nacidos ≤ 28 semanas, que en nuestra muestra fue del 79,2%, superior a la media nacional (61,4%), pero similar a la de los hospitales de nuestro medio que reportan resultados más favorables (72,5%)28. Probablemente estos datos están influenciados por un menor número de prematuros más extremos en nuestra serie.
La edad gestacional al nacimiento es reconocida como el mejor predictor aislado de DBP7, si bien se trata de un factor habitualmente no modificable. Al nacimiento, el pronóstico respiratorio está muchas veces condicionado por la propia causa que ha desencadenado el parto prematuro y por la interrupción del desarrollo pulmonar que ocurre en relación con el mismo7,9. La edad gestacional, por tanto, es muy determinante en los recién nacidos más inmaduros, que nacen en una fase del desarrollo pulmonar muy precoz7. Con alta probabilidad, estos neonatos serán diagnosticados de DBP independientemente del manejo posnatal9. Sin embargo, existen múltiples factores posnatales que pueden influir en su gravedad y, sobre todo, en neonatos de mayor edad gestacional, condicionar su desarrollo. La activación de la cascada inflamatoria y el estrés oxidativo son las dos vías fisiopatológicas principales que conducen al establecimiento de la enfermedad. En relación con esta base fisiológica, factores como la presión positiva en la vía aérea, el oxígeno suplementario y la sepsis posnatal están clínicamente relacionados con la DBP7, de la misma manera que reflejan nuestros datos.
Diferentes estudios han descrito la existencia de tres patrones de la enfermedad que habitualmente se establecen ya en las primeras semanas de vida29,30. En primer lugar, aquellos pacientes con una enfermedad pulmonar leve al nacimiento y que progresivamente se recuperan. Por otro lado, niños que sufren un deterioro pulmonar progresivo y de forma precoz, que habitualmente requieren soporte respiratorio de forma prolongada desde el nacimiento. En tercer lugar, recién nacidos que, tras experimentar una evolución inicialmente favorable, sufre un deterioro respiratorio posterior7. Esto van más allá de los pacientes en los que Northway describió en 1967 la DBP, como la enfermedad pulmonar que desarrollaban los recién nacidos prematuros sometidos a ventilación mecánica prolongada31. Los prematuros actuales no tienen las mismas características ni están sometidos a los mismos cuidados que la población en la que se definió esta enfermedad. Estrategias encaminadas a mejorar la evolución pulmonar (el uso de modalidades ventilatorias sincronizadas, la estandarización del volumen garantizado, el aumento de la VMNI, la administración de surfactante precoz y los esteroides prenatales) han condicionado que nos encontremos ante unos pacientes diferentes29. Nuestra muestra está compuesta en su totalidad por pacientes sometidos a estos cuidados y recogidos de homogénea durante un periodo consecutivo de la última década. Así, menos de cuatro de cada 10 pacientes recibieron VMI durante su ingreso y menos de dos de cada 10, precisaron IOT al nacimiento. A pesar de ello, como en estudios previos, continúa existiendo un grupo de pacientes en el que no se consigue evitar la IOT y necesidad de VMI.
Si analizamos la relación entre la VMI y la DBP en nuestra muestra, la necesidad de VMI en los primeros días de vida se asoció de forma independiente con el desarrollo de DBP, como ya se ha descrito previamente en la literatura32,33. El 60% de los pacientes que precisaron intubación durante la estabilización en paritorio desarrolló DBP, y este porcentaje aumentó al 70% en los que precisaron VMI durante su primer día de vida. En contraposición, solo el 14% de los pacientes que no estuvieron intubados en el primer día de vida desarrollaron DBP. De igual forma, casi nueve de cada 10 pacientes con VMI en su tercer día de vida desarrolló DBP y más del 50% DBP grave-moderada.
Nuestros resultados muestran otro punto de mejora en la VMNI como soporte respiratorio inicial. Entre nuestros grandes prematuros, ocho de cada 10 reciben soporte respiratorio no invasivo en sala de partos. En el caso de los pacientes que posteriormente desarrollan DBP, el 60% había recibido CPAP/NIPPV al nacimiento. Sin embargo, en las primeras 24 h de vida esta proporción disminuye al 40%. Por tanto, hay un grupo no desdeñable de pacientes en el que ocurre un fracaso de la VMNI en las primeras horas de vida, que terminan desarrollando DBP. Este hallazgo es acorde con algunas series, en las que el fracaso de la CPAP se asoció con un mayor riesgo de morbilidad mayor, incluida la DBP34. Estudiar detalladamente estos pacientes, establecer protocolos de VMNI y mejorar sus estrategias es un paso fundamental que podría ayudar a evitar la VMI en una etapa especialmente significativa en el desarrollo de la enfermedad33,35,36.
La relación entre la sepsis posnatal y el desarrollo de inflamación pulmonar se ha reflejado en múltiples trabajos previos37–39. Algunos sugieren una asociación causal entre la infección posnatal, el DAP y la mayor duración de VMI37,39. Probablemente todos son factores interrelacionados. Sin embargo, en nuestro estudio la sepsis nosocomial persiste como factor de riesgo independiente en el modelo final de regresión logística. De hecho, aumenta más de nueve veces el riesgo de desarrollar DBP y se relaciona de la misma manera con su gravedad. Por lo que, en nuestra población, debería considerarse un factor de riesgo per se. Mejorar las tasas de infección nosocomial, a través de protocolos más estrictos y limitando la invasividad, debería ser otra de las estrategias preventivas que cobre importancia.
Nuestro estudio tiene algunas limitaciones, relacionadas con el carácter retrospectivo y unicéntrico del mismo, y el hecho de estar realizado sobre una muestra relativamente pequeña que incluye pacientes con edad gestacional entre 28 y 32 semanas, donde el riesgo basal de DBP es bajo. La definición de DBP, como la dependencia de oxígeno a los 28 días de vida, tiene sus limitaciones intrínsecas, como la diferencia con lo establecido en el consenso de 2001 (durante 28 días). Esto podría dificultar la comparación de resultados. En cuanto a los valores de ABC ROC de nuestros modelos, deben tomarse con cautela, ya que no se seleccionaron las variables para poder ser aplicables en un momento dado, y no corregimos la sobreestimación que puede dar lugar el testar el modelo, en los mismos pacientes en los que se desarrolla. Las conclusiones obtenidas deben ser analizadas de forma prudente y son solo directamente aplicables a la población de estudio. Sin embargo, se trata de una muestra homogénea, recogida de manera consecutiva en los últimos siete años, donde se han mantenido los mismos protocolos y no existen variaciones significativas en la práctica clínica recibida, similar a la de otros centros de nuestro medio.
En conclusión, el análisis de datos clínicos sencillos, objetivos y disponibles en los primeros días de vida, como son la EG al nacer y la necesidad de VMI en el primer y tercer día de vida, nos permitiría seleccionar a un grupo de pacientes con alto riesgo de desarrollar DBP, en el que podría estar justificado actuar de forma más agresiva. Creemos que nuestros hallazgos pueden ser la base para el desarrollo de modelos predictivos precoces o para comparar la capacidad predictiva de nuevas herramientas con las variables clínicas disponibles a pie de cuna.
FinanciaciónEste estudio carece de financiación externa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.