La ecografía pulmonar es una herramienta útil para el diagnóstico y seguimiento de la patología del paciente crítico neonatal. Su uso está cada vez más extendido gracias a sus ventajas sobre otras pruebas de imagen y el rápido incremento en la evidencia científica a su favor, constituyendo así, un pilar básico de las guías «point of care ultrasound» (POCUS) neonatal. El objetivo de este artículo especial es proporcionar las bases y aplicaciones diagnóstico-terapéuticas establecidas de la ecografía pulmonar, y dar a conocer nuevas aplicaciones.
Métodos y resultadosLa sección de ecografía pulmonar del Grupo de Trabajo de Ecografía Neonatal de la Sociedad Española de Neonatología resume la evidencia científica actual. Se describen los patrones ecográficos de las principales patologías respiratorias, aborda algunas de sus aplicaciones en la asistencia neonatal (predicción de ingreso, necesidad de surfactante, procedimientos ecoguiados, seguimiento del desarrollo pulmonar en el prematuro, entre otros) y propone su incorporación en otros escenarios actualmente menos establecidos como la reanimación o el manejo ventilatorio.
Este artículo reafirma los beneficios de esta herramienta para ayudar en el diagnóstico, toma de decisiones terapéuticas, apoyo en procedimientos y valoración pronóstica.
ConclusionesLa ecografía pulmonar debe establecerse como la prueba diagnóstica de elección en la patología respiratoria neonatal. Por ello, su entrenamiento debería formar parte de la formación de los neonatólogos e incluirse en los protocolos diagnóstico-terapéuticos asistenciales. Se deben seguir desarrollando líneas de investigación con estudios sólidos y multicéntricos que aumenten la calidad de la evidencia científica.
Lung ultrasound is a useful tool for diagnosis and follow-up of diseases in critically ill neonates. Its use is increasingly widespread thanks to its advantages over other imaging tests and the rapidly growing body of evidence to support it, and «point-of-care ultrasound» (POCUS) has become a key component in neonatal guidelines. The objective of this special article is to present the foundations and the established diagnostic and therapeutic applications of lung ultrasonography as well as introducing new applications.
Methods and resultsThe Lung Ultrasound Section of the Neonatal Ultrasonography Working Group of the Spanish Neonatology Society has summarised the current scientific evidence. The article describes the sonographic features of the most common respiratory diseases, discusses some of the applications of ultrasound in neonatal care (such as prediction of admission and need of surfactant, ultrasound-guided procedures or monitoring of lung development in premature infants) and proposes its introduction in other scenarios in which its use is not quite established at present, such as resuscitation or respiratory management. This article reaffirms the usefulness of lung ultrasound in guiding diagnosis, clinical decision-making and prognosis and facilitating procedures.
ConclusionsLung ultrasound should be established as the gold standard for diagnosis of respiratory diseases in neonates. Therefore, training in lung ultrasound should be included in the educational curriculum of neonatologists and in diagnostic and therapeutic care protocols. Research on the subject should continue to be pursued with performance of rigorous multicentre studies to increase the quality of the evidence.
La ecografía pulmonar (EP) realizada e interpretada por el clínico es una herramienta que ha demostrado sus ventajas frente a otras técnicas de imagen (radiografía de tórax). Presenta mayor sensibilidad (S) y especificidad (E), mejor concordancia interobservador y evita el uso de radiaciones ionizantes1. Es una herramienta fácil de aprender con un adecuado entrenamiento, rápida y reproducible. Por todo esto, en los últimos años ha ganado popularidad y ha despertado gran interés en neonatología, convirtiéndose en una de las aplicaciones más atractivas del «point of care ultrasound» (POCUS) neonatal.
Aun así, el uso de la EP permanece limitado en neonatología debido a la falta de protocolos y estándares diagnósticos2. La creación en 2020 del Grupo de Trabajo de Ecografía Neonatal de la «Sociedad Española de Neonatología» (Eco-seNeo) tiene como objetivo promover, difundir, colaborar en la formación y potenciar la investigación en esta herramienta. Así, se ha elaborado este escrito que plasma la evidencia científica actual sobre la EP y sus nuevas aplicaciones. Por un lado, describe los hallazgos ecográficos en las principales patologías respiratorias neonatales3 y por otro, aborda sus aplicaciones funcionales en los diferentes escenarios asistenciales para la toma de decisiones y en la valoración pronostica; reconociendo, que la EP debe ser la técnica de elección en la evaluación respiratoria del recién nacido (RN).
Sistemática para realización de la ecografía pulmonar (EP)3,4- 1.
Consideraciones técnicas: definir un preset en el ecógrafo y establecer una profundidad de acuerdo con la longitud del transductor (4-5 cm) para que la imagen sea proporcionada y no modificarlo para homogeneizar las imágenes. Se recomienda un transductor lineal de alta resolución (12-14 MHz). En su defecto, es válido el transductor convex de alta frecuencia (≥ 8 MHz).
- 2.
Se recomienda aplicar medidas de confort al RN (contención, leche materna, sacarosa, calentar el gel conductor) y son necesarias medidas de higiene del transductor y equipo ecográfico.
- 3.
Sistemática de exploración: se deben explorar todos los campos pulmonares, adaptándose a la situación de cada paciente (pegatinas, sensores, postura, etc.).
3.1. Colocación del transductor en sentido longitudinal y puntualmente trasversal. Perpendicular a la línea pleural con la muesca orientada hacia craneal evitando movimientos oblicuos o de rotación que generan falsas imágenes. (Figura S1)
3.2. Planos de exploración:
- a.
Plano anterior trasversal medio: intermamilar.
- b.
Plano anterior-paraesternal: entre línea medio-clavicular (LMC) y línea axilar anterior (LAA).
- c.
Plano lateral: entre la LAA y línea axilar posterior (LAP).
- d.
Plano posterior: entre LAP y medio-escapular; se puede explorar en decúbito lateral o prono.
Las imágenes no se corresponden con ninguna estructura reconocible, sino que se producen por parte de la reflexión y la reverberación de los ecos sobre las interfases de los tejidos, y se denominan artefactos. Los más importantes son los siguientes:
- 1.
Línea pleural: artefacto hiperecogénico lineal que se produce por el cambio de impedancia acústica entre el tejido celular subcutáneo/musculo (contenido líquido) y el pulmón (contenido aire).
1.1. Deslizamiento pleural «lung sliding»: movimiento de la línea pleural sincronizado con la respiración producido por el cambio de la relación (Video S1) entre la pared torácica (pleura parietal) y la superficie pulmonar (pleura visceral).
- 2.
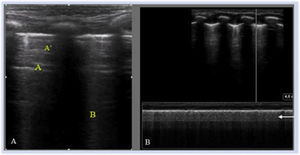
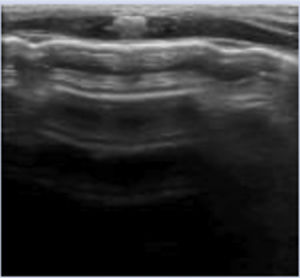
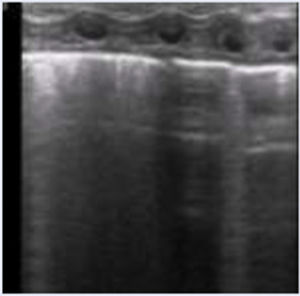
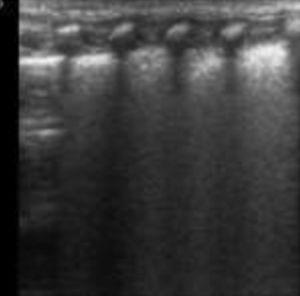
Línea A: artefacto hiperecogénico horizontal, repetición de la línea pleural y paralela a la misma que se repite con equidistancia piel-pleura y de la longitud de la línea pleural. Presentes en número variable y ocasionalmente entre dos líneas A aparecen líneas A’. Su presencia indica aireación pulmonar.
- 3.
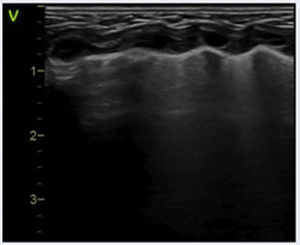
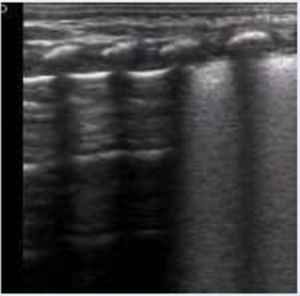
Líneas B: artefacto hiperecogénico vertical que sale de la línea pleural en número variable y ocupa toda la pantalla. Se mueve y borra las líneas A. Indica contenido de líquido en el intersticio y/o alveolo.
En la tabla 1 se describen los principales artefactos y signos en ecografía pulmonar, tanto en condiciones de normalidad como asociados a procesos patológicos. Figura S2.
Patrones ecográficos pulmonares1. (tabla 1)Patrón normalEl patrón normal, propio de un pulmón bien aireado se describe por una línea pleural definida con deslizamiento pleural (o pulmonar), presencia de líneas A y líneas B aisladas, no confluentes3 (Figura S3. Video S2).
Patrones ecográficos pulmonares
| Patrón pulmonar | Signos ecográficos | Figura | Video (enlace) |
|---|---|---|---|
| Patrón normal | Línea pleural definidaDeslizamiento pleuralLíneas A presentesLíneas B aisladasSigno de la arena de playa (modo M) | Video S2 | |
| Patrón intersticial | Líneas B no confluentesLínea pleural definida | Video S3 | |
| Patrón alveolo-intersticial | Líneas B confluentesIrregularidad o engrosamiento de línea pleural | Video S4 | |
| Neumotórax | Ausencia de deslizamiento de línea pleuralAusencia de líneas BPresencia exclusiva de líneas APunto pulmonarSigno de la estratosfera (modo M) | Video S5 | |
| Patrón de consolidación | Ausencia de línea pleuralColapso alveolar con broncogramaPatrón de tisulizaciónSigno de la sierra | Video S6 | |
| Derrame pleural | Imagen anecoica entre pleura parietal y visceralSigno de la medusa (modo 2D) (A)Signo del sinusoide (modo M) (B)Signo del cuadrado (modo 2D) (C) | Video S7 |
Aparecen cuando la relación aire/fluido del pulmón disminuye; se identifican por la presencia de líneas B. Si las líneas B se encuentran separadas entre sí (no confluentes) con línea pleural definida se trata de un síndrome intersticial (Figura S4, Video S3) e indican edema intersticial, y si son confluentes, hablamos de síndrome alveolo-intersticial (AI) e indican una relación aire/fluido menor; bien, por edema alveolar o por disminución de la aireación pulmonar; la línea pleural suele ser irregular, engrosada o mal definida. La presencia de un patrón AI homogéneo (en todo el campo pulmonar) se denomina «pulmón blanco» (Figura S5. Video S4).
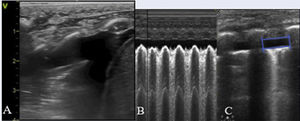
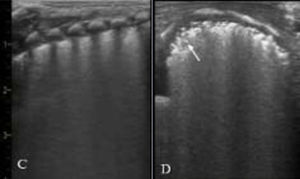
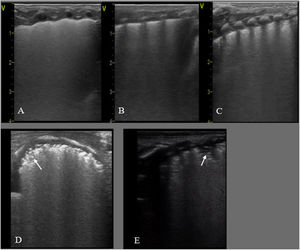
NeumotóraxLos signos ecográficos son: ausencia de deslizamiento de la línea pleural y de líneas B, con presencia exclusiva de líneas A5 y el punto pulmonar (PP), signo ecográfico que corresponde a la zona de transición entre el neumotórax (ausencia de deslizamiento pleural) y cualquier otro patrón pulmonar (deslizamiento pleural) (fig. 1. Video S5).
Neumotórax. A/ Plano longitudional anterior. Ausencia de deslizamiento de la línea pleural, ausencia de líneas B y líneas A muy definidas. B/ Modo M. Ausencia de deslizamiento. Signo de la estratosfera: línea pleural y líneas A equidistantes bien definidas. C/ Plano transversal 4-5° espacio intercostal. Punto pulmonar (PP): signo ecográfico que corresponde a la zona de transición entre el neumotórax (ausencia de deslizamiento pleural) y cualquier otro tipo de patrón pulmonar (deslizamiento pleural). Se considera neumotórax ecográficamente leve-moderado si el PP se localiza en línea medio clavicular o línea axilar anterior y grave, si se localiza a partir de línea axilar media.
Ausencia de línea pleural, presencia de colapso alveolar con broncograma y patrón de tisulización. Aparición del signo de la sierra, artefacto hiperecogénico irregular que se genera por el cambio de interfase que ocurre entre la zona colapsada y el pulmón aireado (Figura S6. Video S6).
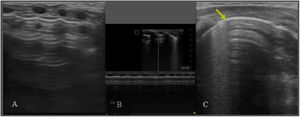
Derrame pleuralImagen real fácilmente reconocible, generalmente anecoica y localizada entre la pleura parietal y visceral2,3 con tendencia acumularse en las zonas declives. En modo 2D podemos identificar el «signo del cuadrado», y en modo M el del «sinusoide». Si el pulmón es comprimido por el derrame genera una consolidación con broncograma estático o incluso de aspecto hepatizado cuyo movimiento crea un efecto de aleteo de la zona colapsada que se conoce como «signo de la medusa»6 (fig. 2. Video S7).
Derrame pleural. A/ signo de la medusa, colapso pulmonar extrínseco por el derrame pleural (contenido anecoico). B/ signo de sinusoide (modo M), se genera por el movimiento de la superficie pulmonar hacia la pleura durante la respiración. C/ Signo del cuadrado (modo 2D): imagen cuadrada donde el derrame pleural es el área anecoica, delimitado por la pleura visceral (abajo) y parietal (arriba) y en los laterales por las sombras costales o el diafragma.
La EP es una herramienta útil para valorar la aireación pulmonar al nacimiento (fig. 3), pudiéndose utilizar para confirmar el deslizamiento pleural y monitorizar el reclutamiento durante las maniobras de ventilación, así como para detectar posibles complicaciones durante la RCP7.
Además, la ecografía es un método de detección de la FC más rápido, con buena correlación con los valores obtenidos mediante el electrocardiograma (ECG) durante la RCP en el recién nacido a término (RNT)8,9 pudiendo ayudar a descartar otras causas de actividad eléctrica sin pulso.
Se ha propuesto su utilización en el diagnóstico etiológico del empeoramiento súbito en el neonato estable en la Unidad de Cuidados Intensivos Neonatales (UCIN) (protocolo Sonographic Assessment of liFe-threatening Emergencies (SAFE)1 y SAFE-R (SAFE-Revised)10.
Valoración ecográfica de la transición y el aclaramiento pulmonarEn cuanto a su utilidad para evaluar el líquido pulmonar se ha estudiado la diferencia en el aclaramiento pulmonar en RNT sanos en función de la vía de parto, apreciando un aclaramiento más lento en las primeras horas en aquellos nacidos mediante cesárea (sin trabajo de parto) frente a los nacidos vía vaginal11. En el RN el grosor de los tabiques interlobulares es mayor, considerándose el patrón intersticial como normal, especialmente en las primeras horas de vida.
Recientemente, en estudios observacionales en RNT y pretérmino (RNP) tardío sin dificultad respiratoria se describe la aireación pulmonar y el aclaramiento parcial desde las primeras respiraciones, observando el aclaramiento completo en las primeras 4 horas tras el nacimiento12.
Patrones predictores de ingresoConocer la expresión ecográfica de la transición pulmonar nos ayuda a entender la patología respiratoria, a evaluar la posible necesidad de ingreso y/o asistencia respiratoria o un tratamiento precoz (surfactante, drenaje torácico, etc.). La EP contribuye, por tanto, a la toma de decisiones desde el nacimiento.
El patrón pulmonar en el RNT o RNP tardío es claramente diferenciable y paralelo al estado respiratorio del RN. Así, la EP realizada entre los 60 y 120 minutos de vida en RNT y RNP tardío tiene una alta fiabilidad para la predicción de ingreso. El «pulmón blanco» presenta una S para predecir el ingreso del 77,7%, una E del 100% y un valor predictivo negativo (VPN) del 97%13.
Resultados similares se han obtenido recientemente en un estudio prospectivo observacional donde se evalúa la capacidad de la EP para predecir ingreso por dificultad respiratoria (síndrome de distrés respiratorio (SDR) y taquipnea transitoria neonatal (TTN) en RNT y RNP tardío nacidos mediante cesárea, confirmando la fiabilidad de la EP precoz (a los 30 minutos) para predecir ingreso, con un valor predictivo positivo (VPP) para el pulmón blanco bilateral del 100% y unilateral del 54%14.
Diagnóstico diferencial de la patología respiratoria neonatal. (tabla 2)Neumotórax/neumomediastinoLa EP permite un diagnóstico rápido y preciso del neumotórax, incluso para aquellos escapes subclínicos y no visibles en la radiografía de tórax7. Sin embargo, la ausencia de deslizamiento pleural puede aparecer también en casos de intubación selectiva o en pulmón hiperinsuflado6. La presencia de líneas A detrás del esternón en el plano transversal medio anterior ha demostrado ser un recurso ecográfico simple, con alta S, E y reproductibilidad para el diagnóstico de neumotórax15 (Figura S7. Video S8). El PP es el signo más específico de neumotórax y evalúa su extensión según su localización en las diferentes líneas anatómicas del tórax5 (fig. 1C).
Diagnóstico diferencial de la patología respiratoria neonatal
| Patología | Patrón ecográfico | Figura | Video (enlace) |
|---|---|---|---|
| Neumotórax | Plano transversal anterior medio:• Líneas A detrás del esternón(Figura S7)Plano longitudinal:• Ausencia deslizamiento pleuralPlano transversal:• Punto pulmonar | Video S8 | |
| Taquipnea transitoria RN | Patrón variable con distinta afectación por zonas, con:• Patrón normal• Patrón intersticial• Patrón alveolo-intersticial• Signo de doble punto pulmonar (50%) (Figura S9)Alteraciones leves de la línea pleural. Derrame pleural leve | Video S9 | |
| Síndrome de distrés respiratorio neonatal | Patrón alveolo-intersticial homogéneo (Figura 4C)Irregularidad o engrosamiento pleuralCondensaciones variables:• Pequeños colapsos subpleurales (Figura 4D) o atelectasiasDerrame pleural no significativo | Video S10 | |
| Dificultad respiratoria transitoria (RN término) | Patrón variable:• Patrón AI parcheado sin condensaciones (video S11)• Patrón normal• Escape aéreo mínimo | Video S11 | |
| Síndrome de aspiración meconial | Patrón parcheado y dinámico con zonas de:• Consolidaciones con broncograma aéreo (bilaterales, tamaño variable). Figura S12.• Patrón AI• Patrón normalDerrame pleuralHallazgos dinámicos | Video S12 | |
| Neumonía congénita | Patrón no específico, según la gravedad:• Patrón intersticial y/o• Alveolointersticial con consolidacionesLínea pleural irregular, engrosadaDerrame pleural no significativo | Video S13 | |
No existe una descripción formal de los signos ecográficos del neumomediastino1. En el plano supraesternal, en función de la gravedad podemos observar grandes artefactos de líneas A (Figura S8) o pequeñas líneas hiperecogénicas en los márgenes del timo o a nivel intratímico16.
Taquipnea Transitoria del RN (TTN)La TTN fisiopatológicamente se caracteriza por la presencia de edema en un pulmón estructuralmente maduro. Los patrones ecográficos son diversos: zonas con aireación normal, patrón intersticial o incluso campos con patrón pulmón blanco3,13. La presencia de un patrón AI con gradiente, es decir, de predominio en zonas declives (bases o campos posteriores) o «signo de doble punto pulmonar» (Figura S9. Video S9) es un signo frecuente presente en cerca del 50% de los casos, pero no específico de TTN17. Pueden asociarse alteraciones de la línea pleural o derrame pleural, sin embargo, la existencia de consolidaciones es infrecuente3,17,18.
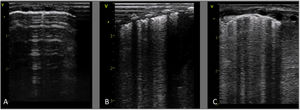
Síndrome de distrés respiratorio neonatal (SDR)El SDR está causado por un déficit primario o secundario de surfactante en RNP o RNT respectivamente, produciendo edema pulmonar y pérdida de volumen (colapso o atelectasia). Ecográficamente se caracteriza por la pérdida de aireación con un patrón AI homogéneo e irregularidad o engrosamiento pleural, originando una imagen de campo pulmonar completamente hiperecogénico («pulmón blanco»)13, con condensaciones que pueden variar desde pequeños colapsos subpleurales a grandes consolidaciones con broncograma (atelectasias), pudiendo asociar derrame pleural no significativo (fig. 4. Video S10). Según la gravedad y evolución de la enfermedad se puede observar distinta afectación por campo o hemitórax1,19.
SDR. A, B y C: RNP de 30+2 s. Cesárea urgente, corticoides no administrados. Ecografía pulmonar al ingreso: A/ Plano anterior: patrón alveolo-intersticial homogéneo, sin zonas de aireación (no líneas A) y pleura irregular, pulmón blanco. B/ Plano lateral, hallazgos similares. C/ Plano posterior: patrón AI con engrosamiento pleural y condensaciones subpleurales en la base. D/ Plano transversal con patrón AI difuso con condensaciones subpleurales (flecha). E/ Plano longitudinal posterior con patrón AI con engrosamiento pleural, condensaciones subpleurales y una condensación con broncograma aéreo (atelectasia) de 2 espacios intercostales (EIC) (flecha).
No existe un patrón ecográfico característico de los cuadros de dificultad respiratoria transitoria del RNT, caracterizados por síntomas leves y rápida resolución con pocas horas de soporte respiratorio. Con frecuencia encontramos un patrón AI parcheado sin consolidaciones y/o un patrón pulmonar normal, incluso a veces, mínimos escapes aéreos3. (Figura S10. Video S11). El patrón AI con gradiente o la aparición de pequeñas condensaciones son menos frecuentes. Esta diversidad puede deberse a los distintos mecanismos fisiopatológicos que ocasionan la dificultad respiratoria. La evolución común es hacia una rápida normalización clínica y ecográfica, en menos de 12-24 horas20.
Síndrome de aspiración meconial (SAM)Los hallazgos ecográficos del SAM son heterogéneos y se correlacionan con la desigual gravedad clínica de la enfermedad. Se describe la presencia de consolidaciones con broncograma aéreo (bilaterales, dispersas y de tamaño variable). También se puede observar patrón AI bilateral, difuso o parcheado21,22, irregularidad de la linea pleural con zonas de aireación normal y derrame pleural (Figura S11. Video S12). Estos hallazgos son dinámicos y pueden cambiar de localización con la evolución del cuadro1.
Estos hallazgos ecográficos son comunes a otros cuadros aspirativos como la aspiración de líquido claro, sangre o leche con evolución ecográfica más favorable.
Neumonía congénitaLa neumonía congénita presenta un patrón intersticial y/o AI con consolidaciones asociadas, con una línea pleural irregular y gruesa, y en ocasiones mínimo derrame pleural23 en el contexto clínico de un RN con factores de riesgo infeccioso junto con dificultad respiratoria y elevación de reactantes de fase aguda. (Figura S12. Video S13).
Utilidad de la EP en los protocolos diagnóstico-terapéuticosEP como herramienta para predecir la administración de surfactanteExisten sistemas de valoración semicuantitativa, que evalúan el patrón ecográfico del SDR y presentan buena correlación con parámetros que valoran la oxigenación del RNP (índice de oxigenación, gradiente alveolo-arterial de oxígeno, cociente entre la saturación de oxígeno y la fracción inspirada de oxígeno (SaFi)), y con la necesidad de tratamiento con surfactante en menores de 34 semanas24 (Tabla S3). El objetivo es adelantarse a los criterios clínicos tradicionales de administración del surfactante y así realizar una terapia más precoz que disminuya el número de complicaciones relacionadas con un diagnóstico tardío.
En esta línea, un estudio de cohortes en menores de 32 semanas utiliza sistemas de puntuación ecográfica pulmonar (Pt-EP) para decidir la administración de surfactante y reporta un aumento significativo de pacientes que reciben surfactante antes de las tres horas de vida, sin registrar un aumento del número de RN que reciben surfactante25. En un ensayo aleatorizado en RNP menores de 32 semanas, a recibir surfactante en función de Pt-EP > 8 o de FiO2 > 0,3, se han encontrado diferencias significativas en el tiempo de administración de surfactante, y valores superiores de SaFi tras surfactante en el grupo de EP; sin diferencias significativas en el porcentaje de administración de surfactante26. Trabajos posteriores han desarrollado un modelo predictivo para la administración de surfactante combinando la Pt-EP y parámetros clínicos (SaFi). La capacidad predictiva encontrada es excelente, desarrollando ambos una calculadora on-line27,28.
En RNP mayores de 34 semanas los estudios son escasos, incluyen pocos pacientes con gran heterogeneidad, por lo que los resultados se deben interpretar con cautela13. De ellos, el estudio de Brat et al.24 encuentra un punto de corte con baja especificidad, lo que limita su aplicabilidad en la práctica clínica. A diferencia del prematuro extremo, la patología respiratoria del prematuro tardío es más diversa y pueden coexistir varias patologías con expresión clínica y ecográfica similares.
En cuanto a la utilidad de la EP para predecir la necesidad de dosis repetidas de surfactante, sólo existen dos estudios en pacientes menores de 32 semanas24 utilizando, además, distinto criterio para la administración de surfactante. A pesar de encontrar una buena precisión, los puntos de corte propuestos muestran baja sensibilidad.
Monitorización y detección de complicaciones en el paciente con asistencia respiratoriaUna de sus principales utilidades es el diagnóstico de las complicaciones asociadas a la ventilación, que como herramienta diagnóstica debe integrarse en el contexto clínico.
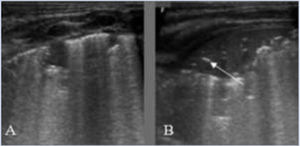
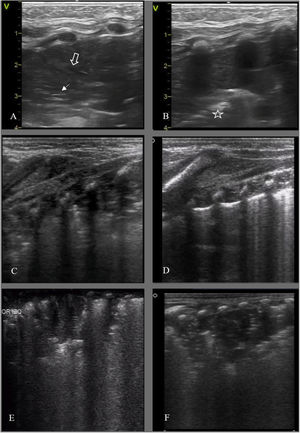
Podemos diagnosticar precozmente condensaciones por malposición del tubo endotraqueal (TET) (fig. 5) (A-B) o por decúbito en pacientes con displasia broncopulmonar (DBP). La EP asociada a la clínica aumenta el VPP para el diagnóstico de neumonía asociada a ventilación (NAV). Se ha propuesto un sistema de valoración semicuantitativo de NAV donde los hallazgos ecográficos más frecuentes encontrados son: condensaciones > 0,5 cm, principalmente bilaterales, predominio en campos posteriores, no translobares y con broncograma (estático el 100% de las NAV y dinámico el 70%); destacando como signo específico de neumonía que la condensación no pueda ser completamente reclutada con maniobras habituales de ventilación29 (fig. 5 C-F).
Detección de complicaciones, imágenes condensativas. A y B: Colapso pulmonar/ atelectasia por malposición tubo endotraqueal (TET). A/ Campo anterior izquierdo, desaparición de la línea pleural con patrón de tisulización y broncograma aéreo (hiperecogénico, flecha blanca) y líquido (anecoico, flecha hueca). B/ Campo lateral: desaparición de la línea pleural y tisulización; signo de la sierra (barrera hiperecogénica, interfase pulmón colapsado/pulmón aireado) (estrella). C/ RNP 25 +3 s. DBP. Condensación/atelectasia en campo posterior, broncograma desestructurado. D/ Mismo paciente, control ecográfico a las 2 horas de cambio postural a prono: desaparición de la condensación. E/ RNP 23+5 s. 50 h de vida, condensación en campo posterior izquierdo en contexto clínico de desreclutamiento. F/ Mismo paciente a los 35 ddv, imagen condensativa de aspecto ecográfico similar en contexto clínico compatible con NAV.
La EP también permite monitorizar la presencia de edema o líquido pulmonar extravascular y optimizar su tratamiento en RN con exceso de líquidos o cardiopatías congénitas (CC) e hiperaflujo pulmonar30. Según la gravedad del edema, el patrón varía de intersticial a AI pudiendo asociar derrame pleural.
Procedimientos ecoguiados/ecoasistidosToracocentesisLa extensión del neumotórax se determina localizando el punto pulmonar. Manteniendo al RN en decúbito supino, se elige el punto de punción, que debe coincidir con la zona en la que el deslizamiento pleural esté ausente. En el caso del derrame pleural, la EP permite cuantificar el derrame pleural31 e igualmente guiar la toracocentesis evacuadora y/o la colocación de un drenaje de una forma más segura.
En ambos casos, la ecografía ofrece la ventaja de poder comprobar inmediatamente la reexpansión pulmonar (Figura S13) y realizar el seguimiento respiratorio hasta su resolución6.
Localización del tubo endotraqueal (TET)Se han descrito distintos abordajes ecográficos para la comprobación de la posición32,33 y la profundidad del TET34 (Figura S14). Pero una forma rápida, aunque indirecta de verificarlo es objetivar el deslizamiento pleural bilateral mediante EP.
EP como herramienta pronósticaMonitorización y seguimiento del desarrollo pulmonar en RNP. Predicción de displasia broncopulmonar (DBP)La EP es una herramienta adecuada para predecir el desarrollo de DBP en RNP menores de 32 semanas: en varios estudios multicéntricos35–37, se demuestra como el uso de un sistema de Pt-EP similar al utilizado para predecir la necesidad de surfactante, tiene una capacidad diagnóstica adecuada para esta entidad incluso desde los tres días de vida, aunque el momento óptimo para su uso sería a la semana del nacimiento.
La evolución pulmonar ecográfica habitual en los nacidos antes de las 32 semanas presenta el patrón característico del SDR al nacimiento, con valores de Pt-EP elevados durante los primeros días de vida, pero que debe presentar una mejoría posterior, paralelo a la resolución de este déficit de surfactante, hasta valores del Pt-EP cercanos a cero en torno a la semana de vida38. Aquellos pacientes en los que no se produce este descenso, o incluso presentan empeoramiento, son los que tienen más riesgo de desarrollar DBP (fig. 6). En cambio, en el prematuro nacido antes de las 28 semanas, este descenso de los valores del Pt-EP se produce más tardíamente, incluso después de haber pasado la fase inicial de déficit de surfactante, y hasta las cuatro semanas de vida39–41Tabla S4.
Progresión ecográfica en la primera semana de vida de prematura de 25 semanas cuya madre desarrolló corioamnionitis, y era portadora de U. parvum en exudado cervical. A/ A las 4 horas de vida presenta un patrón normal. B/ Al tercer día de vida ya hay un patrón alveolo-intersticial con engrosamiento pleural y línea pleural fragmentada solo en campos posteriores. C/ A la semana de vida se evidencian estas mismas alteraciones en todos los campos pulmonares. En este tiempo, la paciente apenas presentó empeoramiento de las necesidades de soporte respiratorio, pero a partir de la segunda semana precisó aumento de los parámetros ventilatorios de forma muy agresiva, desarrollando finalmente una DBP grave.
La EP es una herramienta idónea para valorar la aireación pulmonar, el contenido de líquido y el colapso alveolar, información imprescindible para monitorizar de forma dinámica el estado pulmonar y la respuesta al tratamiento establecido, incluyendo cambios en el soporte respiratorio, ajuste de líquidos, etc.
Existen trabajos en RNP que correlacionan los sistemas de valoración semicuantitativa con la oxigenación24, la predicción de la VNI13 incluso desde el área de partos42 y la necesidad de VMI. Sin embargo, son necesarios estudios enfocados a comprobar si cambios en los parámetros de ventilación no invasiva o invasiva se reflejan en cambios en los Pt-EP.
En la valoración del destete de la VMI, la EP juega un papel fundamental asociado a la valoración clínica, la ecografía diafragmática y los parámetros respiratorios permitiendo descartar complicaciones y valorar el grado de aireación pulmonar, teniendo en cuenta los cambios pulmonares según la enfermedad de base y la EG35,43,44 (fig. 5 C y D).
Otras patologíasAnomalías congénitas pulmonaresEl diagnóstico de sospecha de las anomalías congénitas pulmonares en la mayor parte de las ocasiones se realiza de forma prenatal. La atenuación o desaparición de la imagen en los controles prenatales, la ausencia de clínica o una radiografía de tórax normal al nacimiento, no excluyen su presencia.
La EP realizada de forma precoz al nacimiento, previa a la completa aireación pulmonar, es capaz de demostrar la presencia de la malformación pulmonar. Encontramos patrones condensativos más o menos extensos, con/sin imágenes quísticas hipoecoicas en su interior, con/sin broncograma y en ocasiones la aferencia de vasos provenientes de la circulación sistémica (Figura S15)45,46.
Hernia diafragmática congénita (HDC)La zona afecta presenta un patrón consolidativo formado por órganos sólidos, o imágenes redondeadas con artefactos hiperecogénicos en movimiento en su interior (aire) si se trata del intestino. El escaso parénquima pulmonar circundante, presenta un patrón AI con línea pleural engrosada, característico de la hipoplasia pulmonar. El mediastino se ve desplazado hacia el hemitórax contralateral en el plano transversal y el pulmón no afecto, en general, presenta un patrón normal. (Figura S16)47,48.
Desde el plano subcostal se observa un defecto en la línea hiperecoica que define al diafragma.
Quilotórax congénitoAdemás de los hallazgos descritos del derrame pleural, son características las alteraciones en la línea pleural (engrosada, irregular con colapsos subpleurales) que persisten durante semanas incluso en pacientes en los que el cuadro se resuelve espontáneamente antes de nacer y se atribuyen a la inflamación pleural secundaria a la ocupación prolongada del espacio pleural49.
Utilidad en el postoperatorio de cirugía cardiacaLa EP se ha demostrado útil para la monitorización del edema pulmonar, el diagnóstico y la resolución ecoguiada de atelectasias y la detección de complicaciones postoperatorias (derrame pleural, neumotórax o hematomas)50,51.
El estudio del diafragma mediante ecografía tiene gran importancia dada la prevalencia de parálisis traumáticas y su importancia en la función pulmonar.
Desde el punto de vista funcional, existe correlación de los distintos sistemas de valoración semicuantitativa con la duración de la ventilación mecánica o del ingreso hospitalario, mejorando la capacidad predictiva de los modelos multiparamétricos basados en variables clínicas52.
Por ello, es recomendable incluir la EP en la monitorización no invasiva necesaria en la evaluación diaria del paciente cardiópata; ofreciendo información útil que permite un mejor manejo de estos pacientes.
ConclusionesLa utilización de la EP en las unidades neonatales está creciendo de forma paralela al aumento de la evidencia actual que avala la utilidad de esta herramienta como técnica de elección en el diagnóstico de la patología respiratoria neonatal. Aunque la evidencia científica ya sostiene la necesidad de cambio de paradigma y la inclusión de esta herramienta en los protocolos habituales de manejo de la dificultad respiratoria en el RN, son necesarios más estudios rigurosos y multicéntricos. Esta aplicación se puede extender a la valoración diafragmática, de la vía aérea y otras que deberán ser objeto de nuevas publicaciones. La sección de ecografía pulmonar del Grupo de Ecografía de la seNeo se ha creado con el objetivo de contribuir a difundir la utilización de la EP y favorecer el desarrollo de proyectos de investigación que resultan de interés, entre otros, acerca del pronóstico de RNP que recibe surfactante utilizando criterios ecográficos, de la utilidad de la EP en la monitorización de la VNI/VMI o en el destete de la VMI.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.