La hipoglucemia neonatal ofrece múltiples controversias. El objetivo del estudio es valorar los principales factores y circunstancias ambientales implicadas en el desarrollo de la hipoglucemia neonatal precoz.
MétodosEstudio analítico prospectivo de una cohorte de recién nacidos entre 34 + 1 y 40 + 6 semanas de edad gestacional. Se realizó una determinación de glucemia capilar a las dos, cuatro y ocho horas de vida. Tamaño muestral: 207; 59 neonatos desarrollaron hipoglucemia.
ResultadosPrenatalmente, los factores con mayor influencia fueron la diabetes gestacional con mal control glucémico, gemelaridad y edad gestacional. La presencia de líquido amniótico meconial y el nacimiento por cesárea programada se asociaron a mayor probabilidad de hipoglucemia. Postnatalmente, el contacto precoz piel con piel, la succión al pecho, la iluminación tenue y la normotermia fueron factores protectores. El modelo predictivo que combinó tipo de iluminación, temperatura corporal y cifra de exceso de bases clasificó correctamente al 98% de los casos de hipoglucemia grave, con un R2 de Nagelkerke de 0,645 y especificidad del 99,5%.
ConclusionesLos factores postnatales ambientales parecen estar relacionados de forma directa en el desarrollo de la hipoglucemia precoz, por lo que el apoyo a la unión maternofilial y a la lactancia materna es fundamental. Nuestros resultados permiten una mejor identificación de los neonatos que no son subsidiarios de realizar controles de glucemia por tener poco riesgo de desarrollarla.
Neonatal hypoglycemia offers multiple controversies. The study aims to assess the main factors involved in the development of early hypoglycemia in term and late preterm infants, and the implication of different environmental circumstances.
MethodsA prospective cohort study, in infants born between 34 0/7 weeks and 36 6/7 weeks of gestation. Three capillary blood glucose determinations were performed during the eight first hours after birth. Sample size: 207; 59 neonates developed hypoglycemia.
ResultsPrenatal risk factors include gestational diabetes with poor glycemic control, twin pregnancy and gestational age. The presence of meconium amniotic fluid and planned cesarean delivery are associated with a higher probability of hypoglycemia. After birth, skin to skin contact, breastfeeding, soft lightening, and normothermia are described as protective factors. The predictive model that combines the type of lightening, body temperature and the excess of bases level, correctly classifies 98% of the severe hypoglycemia cases, with a high Nagelkerke R2 value (0.645) and specificity of 99.5%.
ConclusionsPostnatal environmental factors seem to be directly related to early hypoglycemia development, so it is essential to support the maternal–child union and breastfeeding. Our results allow better identification of neonates who are not subsidiary to performing blood glucose determinations because they have little risk of developing it.
La hipoglucemia es una de las alteraciones metabólicas más frecuentes en el neonato1, con gran controversia respecto a la definición, sintomatología, el significado de la hipoglucemia asintomática y su posible efecto en el neurodesarrollo2. Actualmente, existen múltiples protocolos de actuación, con diferencias en el espectro de pacientes considerados en riesgo y en el nivel de glucemia susceptible a tratamiento3,4.
La glucosa es la principal fuente de energía del organismo y, casi en exclusiva, el sustrato energético del sistema nervioso central. Las concentraciones plasmáticas de glucosa en el recién nacido (RN) son variables en virtud de múltiples circunstancias como el tipo de parto, edad gestacional (EG) y peso del RN5. El neonato es capaz de usar fuentes energéticas alternativas a la glucosa durante las primeras horas de vida (hdv), pero la prematuridad y otros factores pueden limitar esta respuesta contrarreguladora natural. En este caso, la inmadurez del cerebro neonatal le hace más susceptible a sufrir efectos adversos derivados de la hipoglucemia6,7.
En este estudio se propone evaluar los principales factores asociados a la hipoglucemia neonatal precoz.
Material y métodosEstudio analítico, longitudinal, en el que se siguió a una cohorte de 207 neonatos, de los cuales, 59 presentaron hipoglucemia en algún momento de las primeras ocho hdv. Abandonaron el estudio 10 neonatos por expreso deseo familiar. Los criterios de inclusión fueron: RN con EG entre 34 + 1 y 41 + 6 semanas, cuyas madres no hubieran recibido perfusiones de suero glucosado durante el parto. Se procedió a la determinación de glucosa con el glucómetro Stat Strip Xpress a las dos, cuatro y ocho hdv. Se definió hipoglucemia global: <45 mg/dL, hipoglucemia moderada-grave (HMG): < 36 mg/dL, hipoglucemia grave (HG): < 18 mg/dL. Posteriormente, se compararon distintas variables entre los pacientes hipoglucémicos y los que no presentaron dicha circunstancia. En los hipoglucémicos, no se realizó intervención, salvo que objetivaran cifras menores a 25 mg/dL o fueran sintomáticos (insistiendo en la succión o administrando leche materna (LM) extraída o leche artificial o glucosa intravenosa [IV]).
Las variables recogidas fueron las siguientes:
- •
Maternas: edad, nivel educativo, tóxicos, enfermedades pregestacionales, peso y talla.
- •
Gestacionales: ganancia ponderal, patología, gemelaridad, cultivo vaginorrectal.
- •
Nacimiento: características del líquido amniótico, amniorrexis, tipo de parto y anestesia.
- •
Perinatales: EG, sexo, peso, necesidad de reanimación, Apgar, contacto precoz maternofilial (piel con piel), succión al pecho (al nacimiento, a las dos, cuatro y ocho hdv), tipo de alimentación.
- •
Valores analíticos: niveles en sangre de arteria umbilical de glucosa, láctico y exceso de bases (EB).
- •
Postnatales: separación de los padres, habitación individual, ruido ambiental (valorado con un sonómetro en una escala de dB: leve <60, moderado: 60 a 80 intenso: >80 dB), intensidad lumínica (1. oscuridad, 2. luz tenue: presencia de un foco lumínico alejado del RN y 3. luz intensa: existencia de dos focos lumínicos o un foco cuyo haz de luz estuviera dirigido directamente hacia el neonato), succión al pecho (en el momento del análisis o en los 30 minutos previos), posición del RN respecto a su madre en el momento de la determinación glucémica. Patología precoz (distrés respiratorio, sepsis, etc.).
El cálculo del tamaño muestral se realizó con el programa Epidat 3.1. (se tuvo en cuenta una posible pérdida del 10%, potencia mínima del 80% e intervalo de confianza [IC] del 95%) y el análisis estadístico, con SPSS, versión 25.0. En la estadística descriptiva, las variables cualitativas se presentaron mediante distribución de frecuencias absolutas y porcentajes. Las cuantitativas, mediante mediana y rango intercuartílico. En el análisis bivariante, se utilizaron pruebas de contraste de hipótesis. En el estudio multivariante, primero, se efectuaron modelos de regresión logística simples, considerando como variable dependiente la hipoglucemia y como variables independientes las que mostraron diferencias estadísticamente significativas en el estudio bivariante. Posteriormente, se calculó el modelo de regresión logística para pronosticar la hipoglucemia (con la selección automática de variables o con la selección manual de estas con diferencia estadísticamente significativa). Se controlaron factores de confusión y otros sesgos. El límite mínimo de significación aceptado fue del 95% (p< 0,05).
Se han tenido en cuenta las normas deontológicas8,9, contando con la aprobación del Comité de Ética Regional. Todos los tutores legales de los participantes aceptaron y firmaron un documento de consentimiento informado.
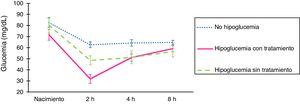
ResultadosLa figura 1 muestra el perfil de glucemia de la muestra estudiada.
Comparación de la evolución de los valores de la glucemia según la existencia de hipoglucemia o no. Al nacimiento, la determinación de glucosa fue extraída a través de muestra arterial (arteria umbilical), las siguientes extracciones, a través de muestra capilar. Mediciones en mg/dL. Las barras de error indican el valor máximo y mínimo del error estándar. El tratamiento, consistente en succión al pecho y/o suplementos de leche artificial y/o glucosa intravenosa se indicó en pacientes sintomáticos, o en los que presentaron glucemias < 25 mg/dL en las primeras 2 horas de vida.
A continuación, se describen resultados en los que se encontraron diferencias estadísticamente significativas.
Evaluación de los factores asociados con hipoglucemia (<45 mg/dL) (tabla 1)En el estudio univariante, en los RN hipoglucémicos, se encontró mayor gemelaridad (p< 0,01) y diabetes gestacional (DG), fundamentalmente del tipo A2 con mal control (p = 0,029). Por cada semana que aumentó la EG, disminuyó un 24% la probabilidad de hipoglucemia (OR: 0,765, IC 95%: 0,64 a 0,91; p = 0,003). El tipo de nacimiento con mayor porcentaje de hipoglucemia fue la cesárea programada, mostrando 3,2 veces más probabilidad de hipoglucemia (OR: 3,2, IC 95%: 1,5 a 7,07; p = 0,003).
Relación entre las variables antenatales con diferencias estadísticamente significativas y postnatales recogidas entre los grupos de estudio (neonatos hipoglucémicos y no hipoglucémicos) a las dos, cuatro y ocho horas de vida
| Variable | Posibles valores | Hipoglucemia a las 2 horas de vida | Hipoglucemia a las 4 horas de vida | Hipoglucemia a las 8 horas de vida | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| No | Sí | p | No | Sí | p | No | Sí | p | ||
| Aumento ponderal madre | 10/5 | 10/8 | 0,593 | 9,3/6 | 12/5 | 0,005 | 10/5 | 14/4 | 0,001 | |
| E. gestacional o embarazo de riesgo | Sobrepeso/obesidad | 35 (23,1) | 18 (30) | <0,01 | 40 (26,4) | 6 (21,4) | 0,555 | 45 (26,8) | 0 (0) | <0,01 |
| Hipotiroidismo | 20 (13,2) | 6 (10) | 19 (12,6) | 4 (14,2) | 24 (14,3) | 0 (0) | ||||
| Otros | 12 (7,9) | 4 (6,7) | 13 (8,6) | 3 (10,7) | 13 (7,7) | 1 (10) | ||||
| Gemelaridad | 0 (0) | 7 (11,6) | 5 (3,3) | 2 (7,1) | 5 (3) | 2 (20) | ||||
| Diabetes gestacional (DG) | DG A1 | 1 (0,7) | 2 (3,6) | 0,029 | 3 (1,8) | 0 (0) | 0,318 | 2 (1,1) | 1 (9,1) | 0,310 |
| DG A2 | 10 (6,6) | 2 (3,6) | 11 (6,5) | 1 (0,6) | 12 (6,4) | 0 (0) | ||||
| DG A2 de mal control | 1 (0,7) | 3 (5,4) | 4 (2,4) | 0 (0) | 4 (2,1) | 0 (0) | ||||
| Semanas de gestación | 40/2 | 39/3 | 0,006 | 39/2 | 39/3 | 0,6 | 39/2 | 38/5 | 0,307 | |
| Sexo masculino | 79 (52,3) | 35 (62,5) | 0,191 | 96 (53,9) | 21 (72,4) | 0,034 | 99 (53,2) | 7 (6,6) | 0,501 | |
| Test de Apgar a los 5 minutos de vida | 5-8 | 8 (5,3) | 2 (3,6) | 0,607 | 5 (3) | 3 (7,8) | 0,008 | 7 (3,8) | 0 (0) | |
| 9-10 | 143 (94,7) | 54 (96,4) | 163 (97) | 26 (92,3) | 179 (96,2) | 11 (100) | ||||
| Test de Apgar a los 10 minutos de vida | 5-8 | 1 (0,7) | 0 (0) | 0,542 | 0 (0) | 1 (3,4) | 0,010 | 1 (0,5) | 0 (0) | |
| 9-10 | 150 (99,3) | 56 (100) | 168 (100) | 28 (96,6) | 185 (99,5) | 11 (100) | ||||
| EB al nacimiento | -4,7/4,1 | -4,3/4,2 | 0,116 | -4,4/3,4 | -6,2/3,8 | 0,016 | -4,6/3,8 | -5,5/7,2 | 0,657 | |
| Peso de RN | 3254 (512) | 3118 (618) | 0,076 | 3220/563 | 3138/498 | 0,374 | 3220/730 | 2940/980 | 0,037 | |
| Piel con piel al nacimiento | 118 (7,1) | 31 (55,4) | 0,022 | 105 (63) | 15 (52) | 0,272 | 114 (61,3) | 6 (54,5) | 0,754 | |
| Temperatura del RN (°C) | 36,5/0,4 | 36,4/0,5 | 0,028 | 36,5/0,5 | 36,5/0,5 | 0,647 | 36,5/0,4 | 36,4/0,6 | 0,984 | |
| Patología aguda del RN | 16 (10,6) | 15 (26,8) | 0,04 | 23 (13,7) | 7 (24,1) | 0,162 | 26 (14) | 3 (27,3) | 0,209 | |
| Glucemia 2 h (mg/dL) | 60/16 | 37,5/10 | <0,001 | 54,5/22 | 49/32 | 0,019 | 53,5/23 | 43/23 | 0,019 | |
| Glucemia 4 h (mg/dL) | 60/17 | 54/16 | 0,002 | 60,5/16 | 40/9 | <0,01 | 58/16 | 41/20 | <0,001 | |
| Glucemia 8 h (mg/dL) | 62/13 | 56/15 | 0,004 | 62/15 | 55/22 | 0,002 | 62/15 | 40/8 | 0,002 | |
| L.A. desde el nacimiento | 5 (3,3) | 9 (16,1) | 0,003 | 9 (5,4) | 5 (17,2) | 0,037 | 12 (6,4) | 2 (18,2) | 0,178 | |
| Succión al pecho* | 103 (68,2) | 24 (42,9) | 0,001 | 105 (62,5) | 11 (37,9) | 0,013 | 129 (69,7) | 3 (27,3) | 0,006 | |
| Tipo de iluminación en la habitación** | Oscuridad | 2 (1,3) | 0 (0) | 0,022 | 9 (5,4) | 1 (3,4) | 0,813 | 17 (9,2) | 2 (18,2) | 0,490 |
| Iluminación tenue | 140 (92,7) | 47 (83,9) | 130 (77,8) | 22 (75,9) | 145 (78,4) | 7 (63,6) | ||||
| Iluminación intensa | 9 (6) | 9 (16,1) | 28 (16,8) | 6 (20,7) | 23 (12,4) | 2 (18,2) | ||||
| Posición del RN respecto su madre | En colecho/brazos | 106 (70,2) | 30 (53,6) | 0,025 | 87 (52,1) | 13 (44,9) | 0,029 | 101 (54,3) | 6 (54,5) | 0,760 |
| En cuna | 0 (0) | 0 (0) | 77 (46,1) | 15 (51,7) | 82 (44,1) | 5 (45,5) | ||||
| Otras | 45 (29,8) | 26 (46,4) | 3 (1,8) | 1 (3,4) | 3 (1,6) | 0 (0) | ||||
| Presencia de acompañante | 147 (88) | 26 (90) | 0,801 | 173 (93) | 9 (82) | 0,174 | ||||
| Habitación compartida | Sí | 13 (7,8) | 4 (13,8) | 0,289 | 18 (9,7) | 1 (9,1) | 0,949 | |||
| Sonido ambiental intenso† | Sí | 20 (12) | 5 (17,2) | 0,433 | 28 (15) | 0 (0) | 0,165 | |||
E: enfermedad; EB: exceso de bases; h: hora; L.A.: lactancia artificial; p: medida de la significación estadística; RN: recién nacido.
Los valores de las variables cuantitativas se expresan mediante el valor mediana/rango intercuartílico (ambos valores se separan con una barra invertida). Las variables cualitativas se expresan mediante el valor absoluto, seguido del porcentaje, respecto al total de cada grupo, entre paréntesis. Se consideró hipoglucemia a los valores < 45 mg/dL. Los valores analíticos recogidos al nacimiento se recogieron en sangre arterial de cordón umbilical. El resto de determinaciones fueron recogidas a través de muestras capilares.
se consideró en este ítem los pacientes que habían realizado succión al pecho en los 30 min previos a la determinación de glucemia.
Se relacionó el resultado del test de Apgar más bajo a los cinco y a los 10 minutos de vida con hipoglucemia (p ≤ 0,010). En los neonatos con menor peso se encontró mayor probabilidad de hipoglucemia (p = 0,037). La realización de contacto precoz («piel con piel») y la normotermia se identificaron como factores protectores (p = 0,022 y p = 0,028). Hubo 2,1 veces más probabilidades de hipoglucemia en los RN que no realizaron piel con piel (OR 2,109, IC 95%: 1,115 a 3,988; p = 0,021). La succión al pecho fue el factor que se relacionó con menor porcentaje de hipoglucemia en los tres puntos de análisis (p< 0,02). Los pacientes que no lactaron en las primeras cuatro horas tuvieron 2,6 veces más riesgo de hipoglucemia (OR: 2,560, IC 95%: 1,408 a 4,645; p = 0,002). Hubo 4,4 veces más probabilidad de hipoglucemia en los RN alimentados con lactancia artificial (OR: 4,394, IC 95%: 1,326 a 14,563; p = 0,009) respecto a los alimentados con lactancia materna a demanda.
Existió 3,1 veces más riesgo de hipoglucemia precoz en los RN con patología (OR 3,075, IC 95%: 1,361 a 6,947; p = 0,005).
La iluminación tenue u oscuridad se asociaron con un porcentaje menor de hipoglucemia (p = 0,022). No se detectaron diferencias en el hecho de compartir habitación o la presencia de un acompañante junto al RN y su madre.
En el estudio multivariante, el modelo formado por gemelaridad, parto eutócico y succión al pecho a las cuatro hdv, clasificó correctamente al 71,4% de los casos (tabla 2).
Estudio de regresión logística de las variables con significación estadística para hipoglucemia (detección a las 2,4 u 8 horas de vida de glucemia capilar <45 mg/dL)
| Variables | β | Wald | p | OR | IC para OR (95%) | ||
|---|---|---|---|---|---|---|---|
| Lím inf | Lím sup | ||||||
| Resultado de la regresión logística (RL) univariante sobre hipoglucemia | Gemelaridad | 2,838 | 7,103 | 0,008 | 17,074 | 2,119 | 137,59 |
| Diabetes gestacional | 1,654 | 2,020 | 0,155 | 5,230 | 0,534 | 51,188 | |
| Semanas de gestación | -0,156 | 3,461 | 0,063 | 0,855 | 0,725 | 1,008 | |
| Ganancia de peso gestacional | 0,042 | 1,802 | 0,179 | 1,042 | 0,981 | 1,107 | |
| Parto eutócico | -1,056 | 7,919 | 0,005 | 0,348 | 0,167 | 0,726 | |
| Lactancia artificial | 1,180 | 4,173 | 0,041 | 3,256 | 1,049 | 10,106 | |
| Piel con piel al nacimiento | -0,524 | 3,208 | 0,073 | 0,592 | 0,334 | 1,051 | |
| Temperatura del RN | -0,439 | 1,517 | 0,218 | 0,645 | 0,321 | 1,296 | |
| Apgar 5 min <9 | -0,124 | 0,035 | 0,851 | 0,883 | 0,241 | 3,233 | |
| Exceso bases al nacimiento | 0,050 | 1,248 | 0,264 | 1,051 | 0,963 | 1,147 | |
| Peso del RN | -0,0003 | 1,060 | 0,303 | 1,000 | 0,999 | 1,001 | |
| Líquido amniótico no meconial | -0,137 | 0,106 | 0,744 | 0,872 | 0,383 | 1,987 | |
| Grande edad gestacional | 0,874 | 2,430 | 0,119 | 2,396 | 0,799 | 7,189 | |
| Succión al pecho a las 2 h | -0,714 | 5,846 | 0,016 | 0,490 | 0,275 | 0,874 | |
| Piel con piel a las 2 h | -0,545 | 2,988 | 0,084 | 0,580 | 0,313 | 1,076 | |
| Tipo de iluminación* | 1,339 | 6,557 | 0,010 | 3,815 | 1,369 | 10,633 | |
| Posición del RN a las 2 h.** | 0,597 | 3,944 | 0,047 | 1,816 | 1,008 | 3,271 | |
| Succión al pecho a las 4 h. | -0,967 | 10,277 | 0,001 | 0,380 | 0,211 | 0,687 | |
| Variables | β | Wald | p | OR | IC para OR (95%) | Características del modelo | ||
|---|---|---|---|---|---|---|---|---|
| Lím inf | Lím sup | |||||||
| Modelo de RL para hipoglucemia realizado con la selección automática de variables | Gemelaridad | 2,688 | 6,234 | 0,013 | 14,698 | 1,782 | 121,22 | R2 = 0,185.S: 31,1%.E: 96,6%. |
| Parto eutócico | -0,987 | 6,237 | 0,013 | 0,373 | 0,172 | 0,809 | ||
| Succión al pecho a las 4 horas | -0,926 | 8,295 | 0,004 | 0,396 | 0,211 | 0,744 | ||
| Constante | 0,731 | 3,469 | 0,063 | |||||
E: especificidad; IC: intervalo de confianza.; Lím: límite; Inf: inferior; OR: Odds Ratio; R2: R2 de Nagelkerke, versión corregida de la R2 de Cox y Snell; S: sensibilidad; Sup: superior.
Se observó mayor frecuencia de HMG en gemelos (p = 0,025), hijos de madre con DG A2 con mal control y en neonatos con menor EG (p = 0,039). Los prematuros tardíos tuvieron 3,7 veces más probabilidad de sufrir HMG (OR: 3,688 IC 95%: 1,295 a 10,505; p = 0,015) (tabla 3).
Comparación de variables entre el grupo que presentó hipoglucemia moderada-grave y el que no lo presentó. Solo se muestran las variables en las que se encontraron diferencias estadísticamente significativas
| Variable | Posibles valores | Hipoglucemia a las 2 horas de vida | Hipoglucemia a las 4 horas de vida | Hipoglucemia a las 8 horas de vida | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| No o leve | Moderada-grave | p | No o leve | Moderada-grave | p | No o leve | Moderada-grave | p | ||
| Embarazo de riesgo | Patología gestacional | 96 (52,4) | 13 (54,2) | 0,025 | ||||||
| Gemelaridad | 4 (2,2) | 3 (12,5) | ||||||||
| Diabetes gestacional | No/DGA1/DGA2 buen control | 181 (97,3) | 22 (91,7) | 0,029 | ||||||
| DG A2 mal control | 5 (2,7) | 2 (8,3) | ||||||||
| Tipo de nacimiento | Eutócico | 91 (49,7) | 10 (43,5) | 0,028 | 93 (49,5) | 4 (44,4) | 0,032 | |||
| Instrumental | 42 (22,9) | 1 (4,3) | 40 (21,3) | 1 (11,2) | ||||||
| Cesárea programada | 28 (15,3) | 8 (34,8) | 31 (16,5) | 4 (44,4) | ||||||
| Cesárea urgente | 22 (12,1) | 4 (17,4) | 24 (12,7) | 0 (0) | ||||||
| Semanas de gestación | 39/2 | 38/3 | 0,039 | |||||||
| Líquido amniótico meconial | 22 (12) | 7 (29,1) | 0,023 | |||||||
| Glucemia al nacimiento (mg/dL) | 79/29 | 70/30 | 0,014 | |||||||
| EB al nacimiento (mmol/L) | -4,5/3,6 | -7,5/2,9 | 0,021 | |||||||
| Grande para la edad gestacional | 10 (5,5) | 4 (16,7) | 0,040 | |||||||
| Piel con piel con madre al nacimiento | 116 (63,4) | 8 (33,3) | 0,005 | |||||||
| Glucemia capilar (mg/dL) | 56/18 | 30,5/14 | <0,001 | 58,5/16 | 31/6 | 0,001 | 62/15 | 31,5/14 | 0,029 | |
| Síntomas de hipoglucemia | 2 (28,6) | 5 (20,8) | 1 (0,5) | 0 (0) | ||||||
| Tratamiento recibido 2/4/8 horas | Lactancia artificial | 23 (12,6) | 13 (54,1) | 18 (9,6) | 6 (66,6) | |||||
| Glucosa IV | 2 (1,1) | 7 (29,1) | 8 (4,2) | 1 (11,1) | ||||||
| Glucemia a las 4 horas (mg/dL) | 59/16 | 52/19 | 0,003 | 58,5/16 | 31/6 | <0,001 | 57/17 | 40,5/1 | 0,029 | |
| Glucemia a las 8 horas (mg/dL) | 62/15 | 56/18 | 0,043 | 62/16 | 52/16 | 0,014 | 62/15 | 31,5/14 | <0,001 | |
| L. A. desde el nacimiento | 8 (4,4) | 6 (25) | 11 (5,8) | 3 (33,3) | 0,002 | |||||
| Succión al pecho a las 2/4/8 horas* | 120 (94,5) | 7 (5,5) | 115 (99,1) | 1 (0,9) | 0,003 | |||||
| Piel con piel a las 2 horas de vida | 139 (76) | 10 (41,7) | <0,001 | |||||||
DG: diabetes gestacional; EB: exceso de bases; IV: intravenosa; LA: lactancia artificial; p: medida de la significación estadística.
El valor de las variables cuantitativas se expresa mediante mediana/rango intercuartílico. Las variables cualitativas mediante valor absoluto y porcentaje entre paréntesis. Se consideró hipoglucemia a los valores < 45 mg/dL, hipoglucemia moderada-grave: < 36 mg/dL, hipoglucemia grave: <18 mg/dL. Los valores analíticos recogidos al nacimiento se obtuvieron de sangre arterial (cordón umbilical). Las cifras posteriores son muestras capilares.
El tipo de nacimiento con mayor porcentaje de HMG fue la cesárea programada, seguida de la cesárea urgente y del parto eutócico (p = 0,032). Se encontró relación entre el líquido meconial y la HMG (p = 0,023). Los neonatos pequeños para la edad gestacional (PEG) presentaron un mayor porcentaje de HMG (11,1% de los RN PEG vs. el 0,5% de los RN con peso adecuado), aunque con diferencias no significativas.
Postnatalmente, la realización de «piel con piel» se asoció con menor porcentaje de HMG (p< 0,001). Los neonatos que no realizaron contacto precoz presentaron cinco veces más probabilidad de HMG (OR: 5,006 IC 95%: 2,038 a 12,296; p< 0,001). Los neonatos que no estaban a las dos horas en brazos o en colecho tuvieron 4,7 veces más probabilidades de presentar HMG (OR: 4,711 IC 95%:1,882 a 11,792; p< 0,001). Los neonatos que no habían lactado al pecho a las dos horas tuvieron 5,2 veces más probabilidad de HMG (OR: 5,211 IC 95%: 2,027 a 13,401; p< 0,001).
En el estudio multivariante, se observó mayor probabilidad de HMG en (tabla 4): hijos de madre con DG A2 de mal control (8,2 veces más probabilidad de HMG), menor EG (por cada semana que disminuyó la EG, aumentó 1,3 veces la probabilidad), los nacidos por cesárea programada (2,8 veces más probabilidad) o con presencia de meconio, los sometidos a iluminación intensa y los que no se mantuvieron en contacto estrecho con su madre (4,6 veces más). Los RN que lactaron a las dos hdv presentaron una reducción hasta el 21% de probabilidad de HMG respecto a los que no lactaron.
Regresión logística univariante sobre la hipoglucemia moderada-grave
| Horas de vida | Variables | β | Wald | p | OR | IC para OR (95%) | ||
|---|---|---|---|---|---|---|---|---|
| L. Inf | L. Sup | |||||||
| Hipoglucemia moderada-grave | 2 h | Gemelaridad | 1,279 | 3,088 | 0,079 | 3,592 | 0,863 | 14,952 |
| Diabetes gestacional* | 2,107 | 4,226 | 0,040 | 8,227 | 1,103 | 61,360 | ||
| Semanas de gestación | -0,268 | 5,461 | 0,019 | 0,765 | 0,611 | 0,958 | ||
| Tipo de parto** | -1,018 | 4,513 | 0,034 | 0,361 | 0,141 | 0,924 | ||
| Piel con piel al nacimiento | -1,242 | 7,310 | 0,007 | 0,289 | 0,117 | 0,711 | ||
| pH cordón | 0,148 | 0,095 | 0,758 | 1,159 | 0,453 | 2,967 | ||
| Coloración líq. amniótico (meconial) | 1,103 | 4,803 | 0,028 | 3,013 | 1,124 | 8,082 | ||
| Temperatura del RN | -0,119 | 0,051 | 0,822 | 0,888 | 0,317 | 2,491 | ||
| Glucosa en sangre de cordón (mg/dL) | -0,031 | 6,706 | 0,010 | 0,970 | 0,947 | 0,993 | ||
| Grande para la edad gestacional | 1,241 | 3,797 | 0,051 | 3,460 | 0,993 | 12,059 | ||
| Succión al pecho a las 2 horas de vida | -1,532 | 10,386 | 0,001 | 0,216 | 0,085 | 0,549 | ||
| Tipo de iluminación† | 1,236 | 4,553 | 0,033 | 3,441 | 1,106 | 10,708 | ||
| Posición a las 2 horas de vida‡ | 1,538 | 11,077 | 0,001 | 4,655 | 1,882 | 11,513 | ||
| 4 h | Temperatura RN | -0,221 | 0,065 | 0,798 | 0,802 | 0,148 | 4,359 | |
| Exceso de bases en sangre de cordón | -0,173 | 3,287 | 0,070 | 0,841 | 0,698 | 1,014 | ||
| Lactancia artificial | 2,085 | 7,288 | 0,007 | 8,045 | 1,771 | 36,559 | ||
| Succión al pecho a las 4 h. | -2,534 | 5,596 | 0,018 | 0,079 | 0,010 | 0,648 | ||
| Piel con piel a las 2 h. | -0,765 | 1,227 | 0,268 | 0,465 | 0,120 | 1,801 | ||
IC: intervalo de confianza; h: horas; L: límite; Inf: inferior; OR: Odds Ratio; RN: recién nacido; Sup: superior.
Las variables que se relacionaron de forma independiente a HMG a las dos horas fueron: líquido amniótico meconial, glucosa al nacimiento en sangre de cordón y posición del RN a las dos horas. El modelo predictivo calculado para HMG explicó un 22,4% de la variabilidad de la variable, clasificando correctamente al 88,7% de los casos. A las cuatro hdv, las variables que se relacionaron de forma independiente al resto fueron: lactancia artificial desde el nacimiento, no administrada como tratamiento (ocho veces más riesgo de hipoglucemia) y la succión al pecho (reduce al 7% la probabilidad de HMG respecto a los que no lactaron). En este modelo, se obtuvo un valor de R2 de Nagelkerke de 0,188, clasificando correctamente al 95,4% de los casos (tabla 5).
Modelo de regresión logística sobre hipoglucemia moderada-grave a las dos y cuatro horas de vida
| Horas de vida | Variables | β | Wald | p | OR | IC para OR (95%) | Características del modelo | |
|---|---|---|---|---|---|---|---|---|
| L. Inf | L. Sup | |||||||
| 2 h | Diabetes gestacional* | 2,168 | 3,668 | 0,055 | 8,740 | 0,950 | 80,366 | R2 = 0,224.S: 8,3%.E: 99,4%. |
| Líquido amniótico meconial | 1,380 | 6,103 | 0,013 | 3,975 | 1,330 | 11,884 | ||
| Glucosa al nacimiento (mg/dL) | -0,030 | 5,712 | 0,017 | 0,970 | 0,946 | 0,995 | ||
| Posición a las 2 hdv† | 1,307 | 7,267 | 0,007 | 3,695 | 1,429 | 9,554 | ||
| Constante | -0,735 | 0,570 | 0,450 | |||||
| 4 h | Lactancia artificial | 1,310 | 2,684 | 0,101 | 3,706 | 0,773 | 17,758 | R2 = 0,188.S: 0%.E: 100%. |
| Succión al pecho a las 4 h. de vida | -2,240 | 4,146 | 0,042 | 0,106 | 0,012 | 0,919 | ||
| Constante | -2,527 | 29,931 | 0,000 | |||||
E: especificidad; IC: intervalo de confianza; h: hora; Inf: inferior; L: límite; OR: Odds Ratio; R2: R2 de Nagelkerke, versión corregida de la R2 de Cox y Snell; S: sensibilidad; Sup: superior.
La puntuación de Apgar a los 10 minutos y la temperatura se relacionaron de forma inversa con los niveles de glucemia (p = 0,003 y p = 0,039). Destaca la ausencia de contacto piel con piel (p = 0,010) y de succión al pecho en las primeras horas (p = 0,008 y p = 0,011) respecto al grupo que no presentó HG. El grupo con HG objetivó niveles de EB mayores (p = 0,003) y sintomatología asociada a la hipoglucemia en mayor proporción (p < 0,001) (tabla 4).
Se comprobó que presentaron mayor probabilidad de HG: hijos de madres con DG A2 de mal control (OR: 16,58, IC 95%: 1,402 a 196,08; p = 0,026), los nacidos por cesárea programada (OR del resto de tipo de nacimiento OR: 0,047, IC 95%: 0,004 a 0,435; p = 0,007), neonatos que fueron sometidos a luz intensa (OR: 53,7 IC 95%: 5,619 a 513,50; p = 0,001) y RN con menor temperatura (cada grado que disminuía, aumentaba 5,74 veces la probabilidad de presentar HG (OR: 0,174 IC 95%: 0,033 a 0,927; p = 0,040) tabla 6.
Variables con diferencias significativas en hipoglucemia grave a las dos horas de vida
| Variable | No hipoglucemia grave | Sí hipoglucemia grave | p |
|---|---|---|---|
| Talla materna (cm) | 163,07/9 | 157,2/10 | 0,043 |
| Apgar a los 10 minutos de vida | 199 (98,5) | 4 (80) | 0,003 |
| Exceso de bases en sangre de cordón (mmol/L) | -4,6/4 | -3,7/4,8 | 0,009 |
| Piel con piel con madre al nacimiento | 124 (60) | 0 (0) | 0,010 |
| Temperatura del recién nacido (°C) | 36,5/0,4 | 36/0,3 | 0,039 |
| Glucemia capilar a las 2 horas de vida (mg/dL) | 53,5/21 | 13/4 | <0,001 |
| Síntomas de hipoglucemia a las 2 horas de vida | 4 (2) | 3 (60) | <0,001 |
| Piel con piel con madre a las 2 horas de vida | 149 (73,8) | 0 (0) | 0,002 |
| Succión al pecho a las 2 horas de vida | 127 (62,9) | 0 (0) | 0,008 |
| Succión al pecho a las 4 horas de vida | 117 (57,9) | 0 (0) | 0,011 |
| Ruido ambiental a las 4 horas de vida* | 21 (10,4) | 4 (80) | 0,001 |
El valor de las variables cuantitativas normales se expresa mediante mediana/rango intercuartílico. Las variables cualitativas mediante valor absoluto y porcentaje entre paréntesis.
En el análisis multivariante, se comprobó el papel protector de la iluminación tenue y la normotermia. La iluminación intensa se relacionó con 3.000 veces más probabilidad de HG (OR iluminación tenue: 0,0003, IC 95%: 0,00 a 0,307). En el neonato, por cada grado centígrado que disminuía su temperatura, aumentaba 1.000 veces la probabilidad de HG (OR: 0,001, IC95%: 0,00 a 0,287). Cada unidad que incrementó la cifra de EB en sangre de cordón, se encontró 1,5 veces más probabilidad de HG (OR: 1,508, IC 95%: 1,005 a 2,261). El modelo resultante explicó un 64,5% de la variabilidad de la HG, clasificando correctamente al 98% de los casos (tabla 7).
Modelo de regresión logística sobre hipoglucemia grave a las dos horas de vida
| Variables | β | Wald | p | OR | IC para OR (95%) | ||
|---|---|---|---|---|---|---|---|
| L. Inf | L. Sup | ||||||
| Resultado de la regresión logística (RL) univariante sobre hipoglucemia grave a las 2 horas de vida | Diabetes gestacional* | 2,808 | 4,966 | 0,026 | 16,583 | 1,402 | 196,08 |
| Tipo de parto** | -3,056 | 7,257 | 0,007 | 0,047 | 0,005 | 0,435 | |
| Tipo de iluminación*** | 3,984 | 11,961 | 0,001 | 53,714 | 5,619 | 513,50 | |
| pH en sangre de cordón | -0,054 | 0,009 | 0,923 | 0,948 | 0,320 | 2,806 | |
| Temperatura del RN (°C) | -1,747 | 4,200 | 0,040 | 0,174 | 0,033 | 0,927 | |
| Exceso de bases nacimiento (mmol/L) | 0,196 | 2,274 | 0,132 | 1,217 | 0,943 | 1,571 | |
| Variables | β | Wald | p | OR | IC para OR (95%) | Características del modelo | ||
|---|---|---|---|---|---|---|---|---|
| L. Inf | L. Sup | |||||||
| Modelo de RL para hipoglucemia grave a las dos horas realizado con variables postnatales y analíticas | Iluminación tenue | -8,106 | 5,262 | 0,022 | 0,0003 | 0,000 | 0,307 | R2 = 0,645.S: 40%.E: 99,5%. |
| Temperatura RN (°C) | -6,810 | 5,757 | 0,016 | 0,001 | 0,000 | 0,287 | ||
| Exceso de bases al nacimiento (mmol/L) | 0,411 | 3,942 | 0,047 | 1,508 | 1,005 | 2,261 | ||
| Constante | 247,614 | 5,728 | 0,017 | |||||
E: especificidad; IC: intervalo de confianza; Inf: inferior; L: límite; OR: Odds Ratio; RN: recién nacido; R2: R2 de Nagelkerke, versión corregida de la R2 de Cox y Snell; S: sensibilidad; Sup: superior. No se realizó modelo de regresión a las 4 y 8 horas al no existir casos suficientes para su realización.
En la literatura, se describe el patrón fisiológico de las concentraciones de glucosa en RN sanos10–12, mostrando un descenso rápido, con valores mínimos a las una o dos horas, y progresivo aumento posterior, hasta estabilizarse a las 12 a 24 hdv5. Recientemente, se apoya la idea de que la hipoglucemia moderada precoz en RN sanos es una situación que no requiere intervención13,14.
La DG es un factor clásico de riesgo de hipoglucemia neonatal. En aquellos neonatos en los que además existe macrosomía o son prematuros, el riesgo es mayor15. En nuestro estudio, se ha encontrado mayor probabilidad de hipoglucemia en los hijos de diabéticas gestacionales tipo A2 de mal control, respecto al resto de gestantes.
Los prematuros son un grupo de riesgo de hipoglucemia. En el presente estudio, se encuentra que, por cada semana que disminuye la EG, aumenta 1,3 veces la probabilidad de hipoglucemia (p = 0,003). En el caso de la HG, no se demuestran diferencias entre prematuros tardíos y RN a término, lo que indica que los recursos homeostáticos a partir de las 34 semanas de EG son suficientes, al menos, para evitar la HG, no así valores moderadamente bajos de glucemia.
Los pacientes con retraso de crecimiento intrauterino (CIR) presentan un riesgo aumentado de morbilidad neonatal, que se ve incrementado si, además, el paciente es prematuro16,17. En nuestra investigación, se encuentra relación entre menor peso al nacimiento e hipoglucemia a las ocho horas (p = 0,037). El motivo de no identificarse como factor de riesgo independiente puede deberse al hecho de no incluir a prematuros con menos de 34 semanas, por lo que la muestra contiene, dentro del grupo de riesgo, al grupo menos vulnerable.
La gemelaridad se relaciona con 13,7 veces más probabilidad de hipoglucemia respecto a los nacimientos únicos. Está descrita la relación entre gemelaridad y mayor morbimortalidad neonatal, incluida la hipoglucemia precoz, pero otros factores asociados, fundamentalmente la prematuridad, seguido del bajo peso y las gestaciones monocoriales pueden ser factores influyentes18. En nuestro estudio, se encuentra como factor asociado de forma directa e independiente al resto de variables.
El nacimiento por cesárea se ha barajado como factor favorecedor de hipoglucemia, con resultados contradictorios17,19–21. En nuestro estudio, el tipo de nacimiento con mayor riesgo es la cesárea programada (2,9 veces más probabilidad, p = 0,004) y 21 veces más probabilidad de HG (p = 0,007), con relación directa e independiente a otros factores estudiados. Quizá el principal mecanismo fisiopatológico implicado es la ausencia de elevación de las hormonas de estrés en contexto del trabajo de parto (adrenalina y cortisol), que son las iniciadoras de la respuesta contrarreguladora y ausencia de contacto precoz postnatal.
En nuestro estudio, el estrés fetal intraparto se valora mediante el test de Apgar, cifras de pH, EB y lactato al nacimiento. Se encuentran diferencias en los valores del test de Apgar a los cinco y 10 minutos en el caso de hipoglucemia leve-moderada y a los 10 minutos en el caso de las graves (p = 0,003). Las cifras de EB, como marcador de hipoglucemia, han sido valoradas en varias publicaciones22,23, aunque con resultados no significativos. En la presente investigación, se encuentra relación entre el descenso de las cifras de EB e hipoglucemia leve-moderada a las ocho horas (p = 0,037). Se observan mayores cifras de EB en los pacientes con HG (p = 0,009), lo que puede indicar que las cifras de EB más fuertemente negativas (también llamado déficit de bases) traduce una mayor fuente de cuerpos cetónicos para su uso como sustrato energético alternativo, por lo que justifica el valor menos negativo encontrado en los pacientes con HG. Quizá en el caso de hipoglucemias leves-moderadas, la existencia de lactato como fuente energética principal inicial, hace que los niveles de EB sean más un marcador de estrés fetal que un indicador de fuente energética.
El contacto precoz se describe como una medida no farmacológica muy eficaz, no solo en la homeostasis glucémica, sino también en la termorregulación y adaptación respiratoria, entre otros beneficios24,25. En nuestro grupo, se vincula con menor riesgo de hipoglucemia, tanto leve, como HMG (p = 0,010) e HG (p = 0,001), con relación independiente al resto de factores asociados.
Está demostrado que la hipotermia descontrolada aumenta la mortalidad neonatal; cada grado que disminuye la temperatura, aumenta un 80% la mortalidad neonatal. La medida preventiva con mayor impacto y más recomendable es la realización de piel con piel de forma inmediata24,26. El presente trabajo apoya los datos encontrados en la literatura, observando que la menor temperatura corporal se asocia de forma directa e independiente al resto de variables con mayor probabilidad de HG.
La iluminación tenue se muestra como un factor protector independiente. La influencia de la iluminación en el bienestar neonatal y pediátrico ha sido ampliamente analizada27–29, pero dichos estudios están más dirigidos al paciente prematuro o grave, de mayor fragilidad y susceptibilidad a factores ambientales adversos. Los resultados obtenidos apoyan el control estricto de los factores ambientales, no solo en prematuros, sino también en el RN sano, ya que, aunque el riesgo de patología grave es menor, disminuir la contaminación lumínica reduce el estrés y beneficia el adecuado desarrollo de su respuesta homeostática.
La lactancia artificial se cuestionó en el pasado como un posible protector de hipoglucemia neonatal precoz30, pero se comprobó posteriormente que la lactancia materna facilita la homeostasis glucémica a través del estímulo de la liberación de sustratos alternativos5. En este estudio, la alimentación con LA se ha relacionado con un riesgo de hipoglucemia 4,4 veces mayor (p = 0,009). La lactancia materna tiene beneficios en una multitud de aspectos materno-filiales31–33. Estos efectos positivos se atribuyen, no solo a la LM, sino también al contacto entre madre e hijo. La succión al pecho es el factor que se relaciona con menor porcentaje de hipoglucemia en las primeras ocho hdv (p < 0,02). Este es un factor de riesgo postnatal modificable y controlable, por lo que su consideración en el control del neonato en las primeras horas es de gran interés.
Los RN que muestran situaciones que afectan al metabolismo oxidativo, como distrés respiratorio o sepsis, tienen mermada su capacidad adaptativa postnatal1,34. El presente trabajo encuentra tres veces más probabilidad de hipoglucemia en estos pacientes (p = 0,004). Aquellos con HG, se muestran sintomáticos en mayor proporción (p < 0,001), hecho que concuerda con la literatura35.
La predicción y control de factores de riesgo de aparición de HG es de gran importancia clínica, por su implicación terapéutica y pronóstica, por lo que se realizó un especial esfuerzo en el diseño de varios modelos predictivos, válidos en nuestro medio. Dichos modelos, que combinan factores pre y postnatales, llegan a presentar un R2 de Nagelkerke alto. Todas las variables son de fácil detección y los modelos creados son sencillos, explicativos y con muy alta especificidad, lo que permite una fácil clasificación de los neonatos que no son subsidiarios a presentar HG, lo que evita controles innecesarios de glucemia, con un ahorro económico acompañante.
Las limitaciones encontradas se fundamentan en los posibles sesgos, que se intentaron minimizar en la mayor medida posible, a través de talleres prácticos de entrenamiento para la adecuada evaluación de los factores ambientales. Se valoró la realización de un control analítico en sangre venosa tras cada determinación capilar, pero esta medida hubiera aumentado el estrés al paciente, por lo que se decidió evitar este procedimiento (el glucómetro utilizado presenta una alta precisión, aun con glucemias bajas). Se restringió el control venoso a los pacientes con glucemia <25 mg/dL o sintomáticos.
ConclusionesFruto de este estudio, se han acotado los factores prenatales que tienen más impacto en el desarrollo de hipoglucemia y se ha evidenciado la importancia de los factores postnatales y ambientales en el desarrollo de hipoglucemia neonatal precoz en el RN de más de 33 semanas de EG.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.