La sospecha de alergia a antibióticos betalactámicos, especialmente penicilina y sobre todo amoxicilina, suponen el motivo de consulta más frecuente en las Unidades de Alergia Infantil. En este documento de consenso se describe la clínica y los criterios diagnósticos de las reacciones alérgicas, así como el tratamiento antibiótico alternativo de las infecciones más habituales en pediatría, para los pacientes con sospecha diagnóstica o confirmación de la alergia.
The suspected allergy to beta-lactam antibiotics, especially penicillin and amoxicillin, is the most frequent reason for consultation in Child Allergy Units. In this consensus document, the clinical and diagnostic criteria of allergic reactions are described, as well as alternative antibiotic treatment for the most common infections diagnosed in paediatrics for patients with known or suspected allergy.
Los antibióticos betalactámicos suponen alrededor del 80% de las consultas por alergia a medicamentos en pediatría especializada. De ellos, las penicilinas son los más frecuentes, y actualmente las aminopenicilinas (amoxicilina) ocupan el primer lugar1-3.
La prevalencia de alergia a betalactámicos autodeclarada en niños oscila entre 1,7 y 5,2%4,5, aunque solo una minoría (<20%) son diagnosticados como verdaderamente alérgicos6. Las reacciones anafilácticas varían entre un 0,01 y un 0,05%, siendo excepcionales y generalmente menos graves en los niños1.
Al metabolizarse la penicilina se liberan determinantes alergénicos como el benzilpeniciloil (95% del total), que constituye el determinante mayor, siendo responsable de la mayor parte de reacciones alérgicas, y determinantes menores, que causan una minoría de las mismas, aunque no por ello menos graves2,3.
Las penicilinas semisintéticas (ampicilina, amoxicilina) también producen determinantes antigénicos únicos localizados en la cadena lateral1,2.
Lo más frecuente es la alergia selectiva a la amoxicilina (a la cadena lateral), sin alergia a la penicilina. Cuando la alergia es al determinante mayor de la penicilina están implicadas todas las penicilinas7.
Sospecha de alergia a betalactámicosLas reacciones alérgicas inmediatas, que se manifiestan con urticaria, angioedema, broncoespasmo o edema laríngeo en la primera hora después de la administración del antibiótico, son fáciles de reconocer. Sin embargo, muchas reacciones pueden ser tardías (horas o días después de la administración) y manifestarse únicamente como exantemas maculopapulares o morbiliformes no pruriginosos1.
La prevalencia de cuadros infecciosos virales que causan exantema es muy alta en el niño, por lo que es importante intentar diferenciar ambas situaciones. Las confusiones más habituales son con el exantema súbito (que puede cursar con erupción maculopapular o urticariforme e incluso con edema palpebral —signo de Berliner—), con la mononucleosis infecciosa (por la frecuente aparición de edema palpebral bilateral y el desarrollo de exantema tras la administración de amoxicilina) y con las urticarias infecciosas. El uso racional de los antibióticos, evitando su utilización en procesos febriles sin foco o en faringoamigdalitis con test rápido estreptocócico negativo, es la mejor estrategia para evitar estas confusiones. No deben encuadrarse como alérgicas las reacciones adversas farmacológicas no inmunológicas, como la aparición de vómitos o diarrea en el curso del tratamiento.
Ante la sospecha de alergia a penicilina/amoxicilina, es prioritaria la realización de una correcta anamnesis, describiendo detalladamente el cuadro clínico y el tiempo transcurrido desde la administración del fármaco, e interrogando sobre la toma previa de ese fármaco u otros de estructura antigénica similar. Debe derivarse el niño (de cualquier edad) a la consulta de alergia.
Mientras dura el estudio se evitará el uso del fármaco sospechoso y de aquellos con los que puede existir reactividad cruzada1-3,7. En la historia clínica del paciente se debe anotar de forma visible la sospecha de alergia al fármaco implicado, retirando la advertencia una vez sea descartada8.
Tipo de reaccionesTanto para la evaluación clínica como para la interpretación del mecanismo responsable, se clasifican actualmente las reacciones en inmediatas y no inmediatas1-3,9-11 (tabla 1).
Clasificación de las reacciones alérgicas a betalactámicos según el momento de aparición
| Tiempo | Ejemplo de reacciones |
|---|---|
| Inmediata | IgE mediadas |
| Usualmente en <1h. IgE mediadas (tipo I) | Urticaria Angioedema Edema laríngeo Broncoespasmo Hipotensión |
| Acelerada | No IgE mediadas (>1h a<72h) |
| >1h y <72h. Generalmente no IgE mediadas, probable tipo IV, o idiopáticas, de aparición precoz (posiblemente por linfocitos T) | Rash morbiliforme Rash maculopapular Urticaria |
| Retardada | |
| ≥72h. Reacciones tipo II, III, IV e idiopáticas | Rash morbiliforme. Rash maculopapular Enfermedad del suero Urticaria tardía (raramente) S. de Stevens-Johnson, NET (necrólisis epidérmica tóxica), DRESS Nefritis intersticial Infiltración pulmonar Anemia hemolítica Neutropenia Trombocitopenia |
Modificado de Lagace Wiens y Rubinstein9.
Reacciones inmediatas: aparecen de forma inmediata tras la toma del fármaco, generalmente dentro de la primera hora. Son IgE mediadas, pueden ser rápidamente progresivas y potencialmente mortales, tendiendo a ser más graves con exposiciones repetidas1. Incluyen urticaria, angioedema y la anafilaxia con sus manifestaciones más severas (edema laríngeo, broncoespasmo, hipotensión).
Reacciones no inmediatas: aparecen después de un período variable de tiempo, desde horas a días. Incluyen las reacciones aceleradas (>1 a <72h) y las tardías (días a semanas), apareciendo urticarias y exantemas en general no IgE mediados y, más raramente, cuadros graves como el síndrome de Stevens-Johnson, la necrólisis epidérmica tóxica (NET) o la reacción a fármacos con eosinofilia y síntomas sistémicos (síndrome DRESS). Otros cuadros asociados son la dermatitis exfoliativa, pustulosis exantemática generalizada aguda, anemia hemolítica, nefritis intersticial, hepatitis y vasculitis.
La mayor parte de las reacciones no inmediatas incluyen el exantema morbiliforme no pruriginoso y las erupciones maculopapulares. Se producen en el 3-7% de los niños que toman amoxicilina1,6,10. Estas reacciones están mediadas habitualmente por células T (tipo IV de hipersensibilidad)10. Algunos de los que desarrollan estas erupciones presentarán reacción al volver a tomar el antibiótico, y estos serán los verdaderamente alérgicos; el resto (la mayoría), lo tolerarán sin problemas.
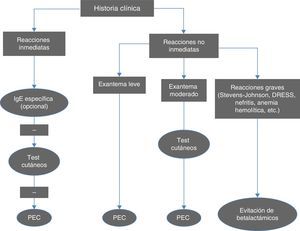
Criterios diagnósticosEl algoritmo diagnóstico en caso de sospecha de alergia a betalactámicos se resume en la figura 1. La historia clínica es fundamental para orientar el estudio a realizar. La IgE específica para amoxicilina, ampicilina, penicilina V y G tiene interés especialmente en reacciones anafilácticas, y debe realizarse antes que los test cutáneos (TC)1. El punto de corte para reacciones positivas es 0,35kU/l y a partir de 0,1 indica sensibilización. No deben realizarse hasta 4-6 semanas después de la reacción y preferentemente no más allá del año, para reducir los posibles falsos negativos. Su sensibilidad es baja (excepto en el shock anafiláctico), aunque la especificidad es elevada. Los niveles declinan con el tiempo y pueden llegar a ser negativos en la mitad de los casos, transcurridos 2-3 años de la reacción.
Algoritmo para el diagnóstico de reacciones inmediatas y no inmediatas a betalactámicos.
PEC: prueba de exposición controlada.
Modificado de Fernández et al.10.
Los TC (prick test e intradermorreacción) tienen una excelente especificidad para el diagnóstico de reacciones inmediatas a betalactámicos, y una aceptable sensibilidad, sumando, entre los determinantes mayores y menores de la penicilina y la amoxicilina, algo más del 80%, siendo positivas con más frecuencia las pruebas intradérmicas que el prick test10. Con el tiempo también se negativizan, aun con alergia persistente. El valor predictivo negativo de los TC a betalactámicos en reacciones inmediatas es alto (94%), y en los casos con resultado de falso negativo, las reacciones en la prueba de provocación no son graves10.
En las reacciones retardadas, más frecuentes en el niño, los TC (reacción tardía de la intradermorreacción y test de parche) son poco rentables y obligan a la prueba de exposición (o provocación) controlada (PEC) para confirmar el diagnóstico. Más del 95% de los niños con reacciones no inmediatas son diagnosticados por medio de la PEC. Estos datos apoyan la posibilidad de proponer protocolos de diagnóstico más rápidos para los casos considerados de bajo riesgo12,13.
La PEC se realiza tras el estudio alergológico negativo, bien para confirmar o descartar el diagnóstico, o bien para confirmar la tolerancia de un fármaco alternativo al causante de la reacción. La experiencia clínica demuestra que es positiva entre el 7 y el 10% de los casos sospechados1,3,6.
En las reacciones tardías graves (anemia hemolítica, nefritis intersticial, NET, síndrome de Stevens-Johnson, DRESS), no está indicado en general el uso de TC ni PEC, debiéndose evitar el uso de betalactámicos indefinidamente en estos pacientes.
Resistencias bacterianas en las principales infecciones pediátricas comunitariasInfección respiratoriaLa faringoamigdalitis bacteriana suele estar ocasionada por Streptococcus pyogenes. Esta bacteria no presenta resistencia a betalactámicos, pero entre un 5-20%14,15 de las cepas en niños son resistentes a macrólidos. A diferencia de Streptococcus pneumoniae, donde la práctica totalidad de las cepas resistentes presentan el fenotipo MLS (con resistencia cruzada a todos los macrólidos y clindamicina), en S. pyogenes, un 60% de los aislamientos resistentes son fenotipo M14 (resistentes a macrólidos de 14 y 15 átomos, pero no a macrólidos de 16 átomos ni a clindamicina), por lo que josamicina, midecamicina o clindamicina son de elección en caso de no poder utilizar betalactámicos.
S. pneumoniae, Haemophilus influenzae no tipificable y Moraxella catarrhalis son los principales patógenos implicados en neumonía, otitis media y sinusitis. La resistencia de S. pneumoniae a los antimicrobianos presenta variaciones geográficas y ecológicas dependiendo de los serotipos circulantes, estando también afectada por la comercialización de las vacunas antineumocócicas15-18.
Mientras que las cefalosporinas parenterales de tercera generación (cefotaxima/ceftriaxona) son activas frente a las 3 bacterias implicadas, el comportamiento de las cefalosporinas orales difiere según el grupo. En las cefalosporinas orales, podemos considerar 2 grandes grupos: las «antiguas» o de primera generación (cefadroxilo, cefalexina) y las denominadas de «generación avanzada», con 3 subgrupos: I (cefaclor, cefuroxima), II (cefixima, ceftibuteno) con actividad frente a enterobacterias pero no frente a estafilococos sensibles a meticilina (SASM) y III (cefpodoxima, cefditoren), útiles frente a patógenos respiratorios y SAMS19. H. influenzae y M. catarrhalis presentan elevada susceptibilidad frente a las cefalosporinas orales. En cambio, en S. pneumoniae, la resistencia a la penicilina (presente en un 25-30% en rango intermedio)20 influye en el comportamiento frente a las cefalosporinas, siendo cefixima, cefaclor y cefuroxima las de menor actividad, y cefpodoxima y cefditoren las más eficaces21,22. En el serotipo 19A, el más prevalente de los neumococos R circulantes actualmente en nuestro medio —aunque podría desparecer o disminuir con la vacunación—, las cepas intermedias a penicilina muestran una sensibilidad de 33,8% a cefuroxima, un 47% a cefpodoxima, 96% a cefotaxima y 100% sensibilidad a cefditoren23. Si bien cefditoren es la más activa de las cefalosporinas orales frente a S. pneumoniae (incluidas las altamente resistentes a penicilina)24, su uso no está autorizado en menores de 12 años.
Los macrólidos (eritromicina, azitromicina, claritromicina) son activos frente a H. influenzae y M. catarrhallis, mientras que en nuestro medio las tasas de resistencia de S. pneumoniae han presentado un descenso progresivo desde un 49 a un 20%25. El porcentaje de neumococos resistentes a levofloxacino permanece estable en España (2,3%)26, y la sensibilidad a levofloxacino de las cepas I-R del serotipo 19A a penicilina es del 99,5 y 100% respectivamente23.
Infecciones cutáneasStaphylococcus aureus y S. pyogenes son las dos bacterias más frecuentemente implicadas en infecciones de piel y tejidos blandos.
Las cepas de S. aureus meticilin-sensibles lo son también a cefalosporinas, salvo al grupo cefixima/ceftibuteno. La resistencia a meticilina (presente en alrededor del 10% de los aislamientos comunitarios) confiere resistencia cruzada a todos los betalactámicos excepto a ceftarolina27. Estas cepas son generalmente susceptibles a clindamicina y trimetoprima-sulfametoxazol27,28. También son activos rifampicina, ácido fusídico y fosfomicina, pero no deben utilizarse como monoterapia por seleccionar con facilidad cepas resistentes.
Infección urinariaEl 85% de infecciones del tracto urinario son debidas a enterobacterias, especialmente a Escherichia coli. El perfil de resistencia de las enterobacterias presenta variaciones debidas a múltiples factores, como el tipo de muestra, de paciente, o procedencia geográfica, por lo que es necesario conocer las tasas de resistencia locales antes de realizar recomendaciones empíricas para las infecciones causadas por estos microorganismos29. La resistencia a cefalosporinas de tercera generación (fundamentalmente mediante betalactamasas de espectro extendido [BLEE]) oscila entre el 5 y el 12%25. La resistencia de E. coli a gentamicina es de un 15%25. Fosfomicina es una buena alternativa para infecciones urinarias de vías bajas de manejo ambulatorio30, con tasas de susceptibilidad mayores del 90% para E. coli, incluso en cepas productoras de BLEE.
Antibioterapia empírica en niños alérgicos a penicilina/amoxicilinaReacción alérgica inmediataSe recomienda evitar el uso de cefalosporinas10,31 aunque el riesgo de reactividad cruzada es inferior al 10% y probablemente cercano al 0,5%32. Sin embargo, dado que las reacciones de hipersensibilidad tipo I pueden ser graves, se considera que este riesgo supera al potencial beneficio de usar una cefalosporina. En infecciones graves en donde no tenemos alternativas terapéuticas adecuadas, pueden realizarse TC, y, si son negativos, realizar PEC con cefalosporinas que no compartan la misma cadena lateral que penicilina/amoxicilina. Si no es posible la realización de TC y la reacción con penicilina no fue grave (anafilaxia), se pueden administrar una cefalosporina de distinta cadena lateral o un carbapenem en provocación gradual controlada10.
En las infecciones respiratorias bacterianas de vías altas sin complicaciones ni factores de riesgo se emplearán macrólidos como tratamiento de primera línea33-35. A pesar de que neumococo puede presentar resistencias, son procesos con una alta tasa de curación espontánea. El uso generalizado de antibióticos de mayor espectro podría conducir a un rápido desarrollo de resistencias en la población, lo que dificultaría el tratamiento de los niños más graves.
En niños con infecciones respiratorias complicadas, factores de riesgo de infección grave o fracaso terapéutico, la mejor opción es levofloxacino, que tiene una actividad frente a neumococo muy superior a ciprofloxacino. Las quinolonas son fármacos seguros y bien tolerados en niños, y es excepcional la aparición de efectos secundarios osteoarticulares36. Los padres pueden preparar la dosis machacando y disolviendo el comprimido de 500mg, aunque también está disponible una fórmula magistral (50mg/ml) de elaboración en farmacias. El uso de levofloxacino es off-label, por lo que debe obtenerse el consentimiento informado de los padres, que debería quedar registrado en la historia. Su uso debe quedar restringido a infecciones graves (valorar consultar con especialista en enfermedades infecciosas).
Para el tratamiento de las infecciones cutáneas37, clindamicina es una buena alternativa terapéutica, con buena actividad frente a las 2 principales bacterias implicadas, S. aureus y S. pyogenes, además de tener un efecto frente a las toxinas producidas por ambos microorganismos.
Las infecciones urinarias pueden tratarse con los fármacos que empleamos habitualmente, de fácil administración, buena actividad y en general bien tolerados: gentamicina en pielonefritis y fosfomicina, nitrofurantoína o trimetoprima-sulfametoxazol en la infección urinaria de vías bajas. Como se ha comentado, si las resistencias a un determinado antibiótico están por encima de un 15% debería valorarse otra opción. Aunque la nitrofurantoina es mal tolerada, causando vómitos, puede ser necesaria en estas ocasiones, sobre todo en niños pequeños.
En las infecciones comunitarias graves emplearemos antibióticos de mayor espectro. La reactividad cruzada con los carbapenémicos (imipenem, meropenem, ertapenem) es muy baja (0,9%)38, por lo que podrían emplearse previa comprobación de TC negativo o en provocación gradual controlada. Pueden emplearse monobactámicos (aztreonam), ya que la reactividad cruzada es excepcional y muy débil, glucopéptidos (vancomicina, teicoplanina) y oxazolidinonas (linezolid). La combinación más empleada en caso de sepsis o meningitis es aztreonam más vancomicina.
Reacción alérgica tardíaEl tratamiento de elección son las cefalosporinas, aunque deben evitarse aquellas con similares o idénticas cadenas laterales a penicilina y ampicilina (cefadroxilo, cefprozil, y cefaclor)10,31. Como excepción, en las reacciones alérgicas tardías graves está contraindicado el uso de betalactámicos, y se actuará como en las reacciones alérgicas inmediatas. En la consulta de alergia se comprobará la tolerancia a la penicilina mediante PEC, previos TC negativos7.
Ante una historia clara de exantemas no graves (no urticariales), que no deje duda respecto a la posibilidad de situaciones de riesgo, especialmente en niños pequeños y en el contexto de cuadros infecciosos víricos, sería factible realizar una PEC con primera dosis completa bajo control directo9,12,13 —previo consentimiento informado y firmado—, seguida de 2h de observación y tratamiento hasta 5 días10, pudiéndose realizar incluso en el ámbito de atención primaria, lo que evitaría restricciones y derivaciones innecesarias.
En general, se empleará cefuroxima en infecciones de manejo ambulatorio causadas por bacterias grampositivas, y cefalosporinas de tercera generación (cefixima, ceftibuteno) en las ocasionadas por gramnegativas. En las infecciones abscesificadas, mediadas por toxinas o con participación de flora anaerobia, clindamicina es una excelente opción. El riesgo de alergia cruzada entre penicilina y amoxicilina con cefalosporinas de primera generación que comparten la misma cadena lateral es de alrededor un 1%39. Sin embargo, un estudio encontró que la reactividad cruzada con cefadroxilo puede llegar a un 27%. Por ello, existe un debate en la literatura y en los expertos de este consenso, que no llegaron a un acuerdo unánime, respecto al uso de cefadroxilo en faringoamigdalitis y también en adenitis e infecciones cutáneas. Se podría considerar una opción adecuada y, desde luego, la de menor espectro posible, siempre que estuviéramos seguros de estar ante una alergia retardada selectiva a penicilinas, con cuadro leve y no IgE mediada. Por ello, parece importante recomendar que ante toda sospecha de alergia se realicen las pruebas diagnósticas oportunas, para poder emplear en cada caso la mejor opción terapéutica. Las infecciones más graves que requieren hospitalización (mastoiditis, celulitis preseptal, neumonías complicadas40, sepsis y meningitis) pueden ser tratadas con una cefalosporina parenteral de tercera generación (cefotaxima o ceftriaxona) en monoterapia o asociada a vancomicina.
En la tabla 2 se resumen las infecciones pediátricas adquiridas en la comunidad más frecuentes y las alternativas terapéuticas según el tipo de hipersensibilidad a penicilina.
Tratamiento de las principales infecciones comunitarias en niños alérgicos a penicilina
| Infección | Principales bacterias | Tratamiento antibiótico Reacción alérgica tardía no grave | Tratamiento antibiótico Reacción alérgica inmediata y tardía grave |
|---|---|---|---|
| Faringoamigdalitis aguda | S. pyogenes | Cefuroxima-axetilo 15mg/kg/día en 2 dosis Cefadroxiloa (ver precauciones en texto) 30mg/kg/día en 2 dosis | Josamicina 30-50mg/kg/día en 2 dosis Midecamicina 30-50mg/kg/día en 2 dosis Clindamicina 20-30mg/kg/día en 3 dosis |
| Absceso periamigdalino | S. pyogenes Anaerobios | Clindamicina 30-40mg/kg/día cada 6h i.v. | Clindamicina 30-40mg/kg/día cada 6h i.v. |
| Adenitis cervical aguda | S. aureus S. pyogenes | Tratamiento ambulatorio: Cefuroxima-axetilo 30mg/kg/día en 2 dosis Cefadroxiloa (ver precauciones en texto) 30mg/kg/día en 2 dosis Tratamiento hospitalario: Cefuroxima 60mg/kg/día cada 8h i.v. Clindamicina 30-40mg/kg/día cada 6h i.v. | Tratamiento ambulatorio: Clindamicina 20-30mg/kg/día en 3 dosis Tratamiento hospitalario: Clindamicina 30-40mg/kg/día cada 6h i.v. |
| Otitis media aguda | S. pneumoniae H. influenzae | Cefuroxima-axetilo 30mg/kg/día en 2 dosis Cefpodoxima 10mg/kg/día en 2 dosisb | Azitromicina 10mg/kg/día en 1 dosis Claritromicina 15mg/kg/día en 2 dosis |
| Mastoiditis aguda | S. pneumoniae H. influenzae S. aureus | Cefotaxima 100mg/kg/día cada 6-8h i.v. | Levofloxacino: 20mg/kg/día en 2 dosis i.v. o v.o. en <5 años; 10mg/kg/día en 1 dosis i.v. o v.o. en ≥5 años |
| Sinusitis aguda | S. pneumoniae H. influenzae | Cefuroxima-axetilo 30mg/kg/día en 2 dosis Cefpodoxima 10mg/kg/día en 2 dosisb | Azitromicina 10mg/kg/día en 1 dosis Claritromicina 15mg/kg/día en 2 dosis |
| Celulitis preseptal | S. pneumoniae H. influenzae S. aureus | Cefotaxima 100mg/kg/día cada 6-8h i.v. | Levofloxacino 20mg/kg/día en 2 dosis i.v. o v.o. en <5 años; 10mg/kg/día en 1 dosis i.v. o v.o. en ≥5 años |
| Neumonía adquirida en la comunidad | S. pneumoniae S. aureus S. pyogenes | Tratamiento ambulatorio: Cefuroxima-axetilo 30mg/kg/día en 2 dosis Tratamiento hospitalario: Cefotaxima 100mg/kg/día cada 6-8h i.v. | Tratamiento ambulatorio: Claritromicina 15mg/kg/día en 2 dosis Azitromicina 10mg/kg/día en 1 dosis Tratamiento hospitalario: Levofloxacino 20mg/kg/día en 2 dosis i.v. o v.o. en <5 años; 10mg/kg/día en 1 dosis i.v. o v.o. en ≥5 años. |
| Pielonefritisc | E. coli Proteus spp Klebsiella spp | Tratamiento ambulatorio: Cefixima 16mg/kg/día en 2 dosis el primer día, luego 8mg/kg/día en 1-2 dosis Ceftibuteno 9mg/kg/día en 1 dosis Tratamiento hospitalario: Gentamicina 5mg/kg/día cada 24h i.v. En caso de elevadas resistencias, valorar amikacina (15mg/kg/día cada 24h i.v.) Cefotaxima 100mg/kg/día cada 8h i.v. | Tratamiento ambulatorio: Gentamicina 5mg/kg/día cada 24h. i.m. Ciprofloxacino 20-30mg/kg/día en 2 dosis Tratamiento hospitalario: Gentamicina 5mg/kg/día cada 24h. i.v. En caso de elevadas resistencias, valorar amikacina (15mg/kg/día cada 24h i.v.) |
| Infección urinaria bajac | E. coli Proteus spp Klebsiella spp | Cefuroxima-axetilo 15mg/kg/día en 2 dosis Nitrofurantoina 5-7mg/kg/día en 4 dosis o Fosfomicina: cálcica 40-80mg/kg/día en 3 dosis (<6 años) o trometamol 2g dosis única (6-12 años) o 3g dosis única (>12 años) | Nitrofurantoina 5-7mg/kg/día en 4 dosis Fosfomicina: cálcica 40-80mg/kg/día en 3 dosis (<6 años) o trometamol 2g dosis única (6-12 años) o 3g dosis única (>12 años) Cotrimoxazol 8-12mg/kg/día en 2 dosis |
| Impétigo/celulitis | S. aureus S. pyogenes | Tratamiento ambulatorio: Cefuroxima-axetilo 30mg/kg/día en 2 dosis Cefadroxiloa (ver precauciones en texto) 30mg/kg/día en 2 dosis Tratamiento hospitalario: Cefuroxima 150mg/kg/día cada 8h i.v. Clindamicina 30-40mg/kg/día cada 6h i.v. | Tratamiento ambulatorio: Clindamicina 20-30mg/kg/día en 3 dosis Tratamiento hospitalario: Clindamicina 30-40mg/kg/día cada 6h i.v. |
| Infección de mordedura | Pasteurella multocida S. aureus Anaerobios | Cefuroxima-axetilo 30mg/kg/día en 2 dosis+clindamicina 20-30mg/kg/día en 3 dosis | Cotrimoxazol 8-12mg/kg/día en 2 dosis+clindamicina 20-30mg/kg/día en 3 dosis |
| Infección osteoarticular | S. aureus Kingella kingae (<5 años) S. pyogenes S. pneumoniae (<2 años) | Cefuroxima-axetilo 60-90mg/kg/día en 3 dosis oral o i.v. | <3 meses: clindamicina (30-40mg/kg/día oral o i.v., cada 6-8h + gentamicina 3 meses-5 años: TMP-SMX (10mg/kg/día cada 12h v.o., cada 6-12h, 15mg/kg/día i.v., cada 6-12h) o ciprofloxacino 30mg/kg/día cada 12h oral, cada 8-12h i.v., (± rifampicina 15-20mg/kg/día oral o i.v., cada 12-24h) >5 años: clindamicina |
| Sepsis | Neisseria meningitidis S. pneumoniae | Cefotaxima 200mg/kg/día cada 6h i.v. Ceftriaxona 100mg/kg/día cada 12h i.v. | Aztreonam 150mg/kg/día cada 8h i.v.+vancomicina 60mg/kg/día cada 6h i.v. |
| Meningitis | N. meningitidis S. pneumoniae | Cefotaxima 300mg/kg/día cada 6h i.v.+vancomicina 60mg/kg/día cada 6h i.v. | Aztreonam 150mg/kg/día cada 8h i.v.+vancomicina 60mg/kg/día cada 6h i.v. |
La duración de los tratamientos es la habitual de las diversas patologías.
Los autores declaran no tener ningún conflicto de intereses.
María Teresa Muñoz Giner (Sociedad Española de Inmunología Clínica y Alergia Pediátricas).
Roi Piñeiro Pérez (Sociedad Española de Infectología Pediátrica).
Fernando Alvez (Sociedad Española de Infectología Pediátrica).
Santiago Alfayate (Sociedad Española de Infectología Pediátrica).
María José Cilleruelo (Sociedad Española de Infectología Pediátrica).
Antonio José Conejo Fernandez (Sociedad Española de Infectología Pediátrica).