El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) publica anualmente el calendario de vacunaciones que estima idóneo para los niños residentes en España, teniendo en cuenta la evidencia disponible sobre vacunas. Se recogen las vacunas sistemáticas de los calendarios oficiales actuales, con las del neumococo y la varicela en la primera infancia, ya incluidas en todos ellos. Además, este comité realiza recomendaciones sobre vacunas no incluidas en los calendarios oficiales (no financiadas), como rotavirus, meningococo B y meningococo tetravalente.
En cuanto a las vacunas financiadas, se sigue recomendando emplear esquemas 2+1 (2, 4 y 11-12 meses) con las vacunas hexavalentes y con la antineumocócica conjugada 13-valente.
Se aconseja un refuerzo a los 6 años, preferentemente con DTPa, junto a una dosis de polio para aquellos que recibieron esquemas 2+1, así como vacunación con Tdpa en adolescentes y durante el embarazo entre las semanas 27 y 32.
Se emplearán esquemas de 2dosis para triple vírica (12 meses y 2-4 años) y varicela (15 meses y 2-4 años).
Se deben incrementar las coberturas frente al papilomavirus en niñas de 12 años con 2dosis (0-6 meses), así como informar a los varones de los beneficios potenciales de la vacunación y valorar la recomendación del preparado tetravalente.
En adolescentes, la opción óptima es la vacuna antimeningocócica tetravalente.
Respecto a las vacunas recomendadas no financiadas, dada su disponibilidad en las farmacias comunitarias, se recomienda la vacuna frente al meningococo B, con esquema 3+1, y se solicita su entrada en el calendario. Es recomendable vacunar a todos los lactantes frente al rotavirus.
The Advisory Committee on Vaccines of the Spanish Association of Paediatrics (CAV- AEP) annually publishes the immunisation schedule which, in our opinion, is considered optimal for children resident in Spain, taking into account the evidence available on current vaccines. Pneumococcal and varicella immunisation in early childhood is already included in all funded vaccines present in the regional immunisation programmes. Furthermore, this committee establishes recommendations on vaccines not included in official calendars (non-funded immunisations), such as rotavirus, meningococcal B, and meningococcal ACWY.
As regards funded immunisations, 2+1 strategy (2, 4, 11-12 months) with hexavalent (DTaP-IPV-Hib-HB) and 13-valent pneumococcal vaccines is recommended.
Administration of the 6-year booster dose with DTaP is recommended, as well as a poliomyelitis dose for children who had received the 2+1 scheme, with the Tdap vaccine for adolescents and pregnant women between 27 and 32 weeks gestation. The two-dose scheme should be used for MMR (12 months and 2-4 years) and varicella (15 months and 2-4 years).
Coverage of human papillomavirus vaccination in girls aged 12 with a two-dose scheme (0, 6 months) should be improved. Information and recommendations for male adolescents about potential beneficial effects of the tetravalent HPV vaccine should also be provided.
ACWY meningococcal vaccine is the optimal choice in adolescents.
For recommended unfunded immunisations, the CAV-AEP recommends the administration of meningococcal B vaccine, due to the current availability in Spanish community pharmacies, with a 3+1 scheme. CAV-AEP requests the incorporation of this vaccine in the funded unified schedule. Vaccination against rotavirus is recommended in all infants.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza anualmente su calendario de vacunaciones teniendo en cuenta la evidencia disponible, para ofrecer las recomendaciones de vacunación que se consideran más adecuadas para los niños residentes en España.
Este año se mantienen los cambios principales en las recomendaciones de este comité realizadas el año pasado, como se puede apreciar en la figura 1, añadiendo ahora solo algunos cambios menores. Se recomienda la lectura de la revisión ampliada de estas recomendaciones en www.vacunasaep.org. Por otro lado, las recomendaciones para situaciones especiales y grupos de riesgo se han eliminado de este documento y pueden consultarse también en la misma web.
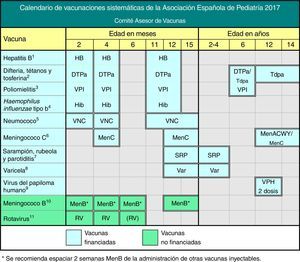
Calendario de vacunaciones sistemáticas de la Asociación Española de Pediatría. Recomendaciones 2017. Este calendario de vacunaciones, diseñado para la infancia y la adolescencia, indica las edades en las que se han de administrar las vacunas consideradas por el CAV-AEP con un perfil de sistemáticas, es decir, las que todos los niños en España deberían recibir de forma universal. Se incluyen las vacunas sistemáticas financiadas oficiales, que son ofrecidas gratuitamente en cada una de las CC. AA. y las sistemáticas no financiadas, que el CAV-AEP considera deseable que todos los niños reciban, pero que por el momento no cuentan con financiación pública. En caso de no llevarse a cabo la vacunación en las edades establecidas, deben aplicarse las recomendaciones de vacunación con las pautas aceleradas o de rescate. Se recomienda consultar el calendario de vacunación de la propia comunidad o ciudad autónoma. Las reacciones adversas se deben notificar a las autoridades sanitarias.
(1) Vacuna antihepatitis B (HB).- 3 dosis, en forma de vacuna hexavalente, a los 2, 4 y 11-12 meses de edad. Los hijos de madres HBsAg positivas recibirán, además, al nacimiento, una dosis de vacuna HB monocomponente, junto con 0,5 ml de inmunoglobulina antihepatitis B (IGHB), todo dentro de las primeras 12 horas de vida. Los hijos de madres de serología desconocida deben recibir la dosis neonatal y se determinará inmediatamente la serología materna; si esta fuera positiva, deberán recibir IGHB cuanto antes, dentro de la 1.ª semana de vida. La administración de 4 dosis de vacuna HB es aceptable en general y recomendable en hijos de madres HBsAg positivas, vacunados al nacimiento y con peso de recién nacido menor de 2000 g, pues la dosis neonatal en estos casos no se ha de contabilizar. A los niños y adolescentes no vacunados se les administrará, a cualquier edad, 3 dosis de vacuna monocomponente o combinada con hepatitis A, según la pauta 0, 1 y 6 meses.
(2) Vacuna frente a difteria, tétanos y tosferina acelular (DTPa/Tdpa).- 5 dosis: primovacunación con 2 dosis, a los 2 y 4 meses, de vacuna DTPa (hexavalente); refuerzo a los 11-12 meses (3.ª dosis) con DTPa (hexavalente); a los 6 años (4.ª dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI) y a los 12-14 años (5.ª dosis) con Tdpa.
(3) Vacuna antipoliomielítica inactivada (VPI).- 4 dosis: primovacunación con 2 dosis, a los 2 y 4 meses, y refuerzos a los 11-12 meses y a los 6 años.
(4) Vacuna conjugada frente al Haemophilus influenzae tipo b (Hib).- 3 dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11-12 meses.
(5) Vacuna conjugada frente al neumococo (VNC).- 3 dosis: las 2 primeras a los 2 y 4 meses con un refuerzo a los 11-12 meses de edad. Si no estuviera aún financiada en el calendario infantil, se mantendría la pauta 3+1: 3 dosis en el primer año (2, 4 y 6 meses) y una 4.ª dosis a los 12 meses de edad. La vacuna actualmente recomendada en España es la VNC13.
(6) Vacuna conjugada frente al meningococo C (MenC).- 3 dosis de vacuna conjugada monovalente con esquema 1(2)+1+1: 1 dosis a los 4 meses, otra a los 12 meses de edad y una dosis final a los 11-12 años. Según el preparado vacunal utilizado puede ser necesaria en la primovacunacion una dosis (4 meses) o dos dosis (2 y 4 meses de edad). Actualmente solo Madrid utiliza la pauta de 2 dosis en el primer año: 2 y 4 meses. La dosis final de los 12 años podría sustituirse óptimamente por 1 dosis de MenACWY, aplicable entre los 12 y 14 años de edad.
(7) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP).- 2 dosis de vacuna sarampión-rubeola-parotiditis (triple vírica). La 1.ª a los 12 meses y la 2.ª a los 2-4 años de edad, preferentemente a los 2 años. En pacientes susceptibles fuera de las edades anteriores, vacunación con 2 dosis con un intervalo de, al menos, 1 mes.
(8) Vacuna frente a la varicela (Var).- 2 dosis: la 1.ª a los 15 meses (también es aceptable a los 12 meses de edad) y la 2.ª a los 2-4 años de edad, preferentemente a los 2 años. En pacientes susceptibles fuera de las edades anteriores, vacunación con 2 dosis con un intervalo de, al menos, 1 mes.
(9) Vacuna frente al virus del papiloma humano (VPH).- Solo para niñas, aunque se debe informar a las familias con hijos varones sobre la posibilidad de administrar esta vacuna, preferiblemente la VPH-4, ya que con VPH-2, aunque ya está autorizada, prácticamente no hay experiencia en varones. Administrar 2 dosis a los 11-12 años. Pautas de vacunación según el preparado vacunal: la vacuna tetravalente con pauta de 2 dosis (0 y 6 meses) para niñas entre 9 y 13 años y pauta de 3 dosis (0, 2 y 6 meses) si 14 años o más y la bivalente con pauta de 2 dosis (0 y 6 meses) para niñas entre 9 y 14 años y pauta de 3 dosis (0, 1 y 6 meses) si 15 años o más. Es posible su coadministración con las vacunas MenC, las de hepatitis A y B, y con Tdpa. No hay datos de coadministración con vacuna de la varicela.
(10) Vacuna frente al meningococo B (MenB).- 4 dosis: las 3 primeras en el primer año (2, 4 y 6 meses) con un refuerzo entre los 12-15 meses de edad, aunque se recomienda una separación de 15 días con las otras vacunas inyectables para minimizar su posible reactogenicidad y evitar la coadministración con MenC (actualmente está autorizada la coadministración con Menjugate® y Meningitec®).
(11) Vacuna frente al rotavirus (RV).- 2 o 3 dosis de vacuna frente al rotavirus: a los 2 y 4 meses (Rotarix®) o a los 2, 4 y 6 meses (RotaTeq®). La pauta ha de iniciarse entre las 6 y las 12 semanas de vida, es muy importante para minimizar riesgos, y debe completarse antes de las 24 semanas (Rotarix®) o de las 32 (RotaTeq®). El intervalo mínimo entre dosis es de 4 semanas. Ambas se pueden coadministrar con cualquier otra vacuna.
La AEP se felicita por la decisión ministerial que supuso la introducción de las vacunas de la varicela y del neumococo en los calendarios de las comunidades autónomas (CC. AA.)1, porque evitará un gran número de casos de estas enfermedades y sus complicaciones. También es importante la disponibilidad de las vacunas de varicela y del meningococo B en las farmacias comunitarias, así como de las 2vacunas de rotavirus comercializadas.
Debido a la escasez de vacunas frente a tosferina y con el fin de optimizar el calendario vacunal, adaptarlo a las condiciones epidemiológicas actuales, incrementar la eficiencia y tender hacia la armonización de los esquemas vacunales europeos, el CAV-AEP mantiene el esquema 2+1 con vacunas hexavalentes.
Sería deseable que las sociedades científicas fueran tenidas en cuenta en la toma de decisiones y también un mayor esfuerzo económico colectivo, por parte de las CC. AA. y del Ministerio, que permitiera la financiación de un calendario sistemático más completo. Se deberían abrir vías alternativas de ayuda a las familias para vacunas no financiadas, igual que se realiza con los medicamentos habituales.
Para evitar la reemergencia de enfermedades inmunoprevenibles es necesario continuar vacunando a todos los niños, realizar esfuerzos para mantener coberturas altas y persuadir a los padres que rechazan la vacunación.
Vacunación frente a hepatitis BRecomendación 2017: se recomienda vacunar a los lactantes con 3 dosis en forma de vacuna hexavalente, con pauta 2, 4 y 11-12 meses de edad. En la inmunización del lactante se admiten pautas de 4 dosis cuando se incluye la vacunación neonatal. En niños mayores y adolescentes no vacunados se aplicarán 3 dosis de vacuna monocomponente o bien combinada con vacuna de hepatitis A, con pauta 0, 1 y 6 meses.
En España, la tasa de incidencia anual de hepatitis B (HB) se mantiene por debajo de 2 casos por 100.000 habitantes (tasa estimada en 2015: 1,47)2.
En 2016, en la mitad de las CC. AA., se administraba la 1.ª dosis de vacuna al nacimiento, esquema que debería mantenerse si se considera que el control obstétrico de la HB es subóptimo. La vacunación neonatal siempre se realizará con vacuna monocomponente y será preceptiva en hijos de madres HBsAg positivas o de serología desconocida. En el primer caso deberán recibir, además, inmunoglobulina antihepatitis B (IGHB), preferiblemente en las primeras 12 horas de vida.
Vacunación frente a difteria, tétanos, tosferina, poliomielitis y Haemophilus influenzae tipo bRecomendación 2017: se recomienda primovacunación de DTPa-VPI-Hib a los 2 y 4 meses con vacuna hexavalente. Se puede adelantar la 1.ª dosis a las 6 semanas de vida. El refuerzo, también con hexavalente, a los 11-12 meses de edad (esquema 2+1), con un refuerzo posterior con DTPa-VPI, preferiblemente, o Tdpa-VPI a los 6 años y con Tdpa a los 12-14 años. Se recomienda vacunar con Tdpa a las embarazadas a partir de la semana 27 de gestación, preferentemente antes de las 32 semanas, y a todo el entorno familiar de los recién nacidos cuando sea posible (especialmente a la madre en el puerperio inmediato, si no se vacunó en el embarazo).
La tosferina ha experimentado un incremento en su incidencia en el mundo. Los lactantes sufren las formas más graves y letales de la enfermedad. Las acciones preventivas deben dirigirse prioritariamente a proteger a este grupo. La vacunación con Tdpa de la embarazada es segura, eficaz3 y la forma más efectiva y eficiente para prevenir la tosferina en lactantes. La vacunación en el segundo trimestre de la gestación produce mayores niveles de anticuerpos en los lactantes e incrementa las oportunidades de vacunación4, por lo que, en países como Reino Unido recomiendan su administración a partir de las 20 semanas5.
El esquema 2+1 es utilizado en muchos países europeos y recomendado por el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) para 20171. Esta pauta, segura e inmunógena, supone optimizar las dosis disponibles.
Para el refuerzo de los 6 años se prefieren los preparados DTPa frente a los de baja carga antigénica (Tdpa) porque confieren una protección más duradera6.
Los lactantes que sigan esquema de primovacunación 2+1 con hexavalentes deberán recibir un refuerzo antipolio a los 6 años, preferiblemente con DTPa-VPI. Provisionalmente, sigue suspendida la dosis de recuerdo de Tdpa de los 6 años, debido a la disponibilidad limitada de vacunas. Dadas las altas coberturas vacunales y que estos niños ya han recibido 4 dosis, no se esperan consecuencias negativas.
Vacunación frente al neumococoRecomendación 2017: se recomienda vacunar frente al neumococo a todos los niños menores de 5 años con una pauta sistemática 2 +1 (2, 4 y 11-15 meses) en lactantes; así como a todos los que padecen inmunodepresión u otras situaciones de riesgo a cualquier edad. El CAV-AEP reafirma que la vacuna antineumocócica conjugada tridecavalente (VNC13) es la adecuada para la vacunación sistemática en España porque es la que mejor cobertura proporciona para los serotipos circulantes en este país y la que mayor impacto puede tener en el control de la enfermedad neumocócica.
Durante el útimo año ha aparecido un considerable volumen de información sobre el impacto de las vacunas antineumocócicas conjugadas, decavalente (VNC10) y tridecavalente (VNC13), frente a la enfermedad neumocócica invasora (ENI). Ambas son muy efectivas frente a los serotipos neumocócicos que contienen7–13 y son capaces de proporcionar protección indirecta (inmunidad de grupo) frente a estos serotipos vacunales en los no vacunados9–13, por lo que su impacto final depende en gran medida de la prevalencia de estos serotipos en el área donde se utiliza. El empleo de la VNC10 podría ser apropiado cuando exista muy baja o nula circulación de serotipos 19A, 6A y 3. En la Comunidad de Madrid, a pesar de que la ENI por serotipo 19A ha desaparecido prácticamente en los niños tras la vacunación sistemática infantil con la VNC13, sigue siendo el tercer serotipo más frecuente en la ENI del adulto (5% de casos), solo por detrás de los serotipos 8 (15,6%) y 3 (8,6%)14. En la Comunidad Valenciana, los serotipos 3 y 19A suponen el 16,8% y el 5% de los casos, respectivamente, de ENI con serotipo identificado (en frecuencia son el primer y tercer serotipo)15.
En general, con ambas vacunas se produce una expansión o emergencia de serotipos no vacunales, lo que puede disminuir parcialmente su impacto final en la ENI10–12.
La evidencia disponible demuestra que la VNC10 no induce inmunidad de grupo frente a los serotipos 19A y 6A. Aunque proporciona un grado significativo de protección cruzada frente a estos serotipos, solo lo hace en los niños vacunados y con una duración que no parece extenderse más de 1-2 años. De hecho, en Finlandia, el aumento de los casos por los serotipos 3 y 19A en personas no vacunadas anula el impacto final de la VNC10 en la carga global de ENI, a pesar de la reducción de casos por serotipos vacunales11.
Ambas vacunas reducen la enfermedad neumocócica no invasora, lo que produce una disminución de hospitalizaciones por neumonía, tanto la neumocócica como la de etiología desconocida16,17.
La efectividad de las VNC frente a la otitis media aguda (OMA) es mayor de la esperable por los estudios de eficacia. Es bien conocido el hecho de que un primer episodio de OMA en lactantes, al alterar los mecanismos locales de defensa, predispone a otros episodios futuros. Un estudio reciente demuestra que la VNC13 reduce no solo las OMA neumocócicas por los serotipos vacunales, sino que también disminuye los episodios de OMA por otras bacterias18.
Vacunación frente al meningococo CRecomendación 2017: se recomiendan 3 o 4 dosis de vacuna conjugada monovalente antimeningocócica C (MenC) (esquema 1+1+1 o 2+1+1). La pauta de administración recomendada es: 4 meses, 12 meses y 12 años. Según la vacuna utilizada, puede ser necesaria la primovacunación con 2dosis: 2 y 4 meses, o una sola dosis a los 4 meses. En la dosis del adolescente, una alternativa idónea es la antimeningocócica tetravalente (ACWY).
La efectividad de la vacuna monovalente frente al MenC ha sido ampliamente demostrada a lo largo de los años19. La tasa de enfermedad meningocócica invasora (EMI) por serogrupo C en España se reduce cada año y sigue muy baja (0,04 casos/100.000 habitantes) en la temporada 2014-201520. En esta temporada se comunicaron 28 casos por serogrupos no B y no C (0,06 casos/100.000 habitantes), de los que 3 se debieron al serogrupo Y y 4 al W. En los primeros 5 meses de 2016, se ha detectado un incremento de aislamientos del serogrupo W, que se ha duplicado respecto a 2015, y que si mantiene esta tendencia podría a final de año multiplicar por 5 el número de aislamientos de años previos21. Las vacunas conjugadas tetravalentes (Menveo® y Nimenrix®)22, reservadas para viajeros a zonas endémicas, constituyen una opción idónea para el refuerzo en adolescentes (12-14 años), dado el aumento de viajes que realizan a partir de esta edad.
En el Reino Unido, en 2016, se ha eliminado la dosis de MenC de los 3 meses de edad, manteniendo las de los 12 meses y 14 años. Esta decisión está fundamentada en el éxito de la campaña de vacunación desde 1999, que ha llevado a la práctica desaparición de los casos infantiles de EMI por MenC. Asumen una protección indirecta de los lactantes con la vacunación universal a los 12 meses y en la adolescencia (a esta edad con tetravalente) y la introducción en el calendario infantil de la vacuna antimeningocócica B, que podría añadir algun grado de protección frente a MenC23.
Vacunación frente a sarampión, rubeola y parotiditis (vacuna triple vírica: SRP)Recomendación 2017: se recomienda que la 1.ª dosis de SRP se administre a los 12 meses de vida y la 2.ª a los 2-4 años, preferentemente a los 2 años, para la corrección precoz de posibles fallos vacunales primarios.
Siguiendo la tendencia de los últimos años, el número de casos de sarampión notificados en la región europea de la OMS disminuye, pero no lo esperado, con muertes y graves complicaciones. Persisten también los casos de rubeola y brotes de parotiditis. Todo ello es consecuencia, sobre todo, de las bajas coberturas vacunales existentes en varios países. La incidencia en España es baja, aunque participa también de esta situación24. Mantener coberturas vacunales altas y una vigilancia epidemiológica de calidad son esenciales para la eliminación de estas enfermedades. Una dosis a los 12 meses induce tasas de seroconversión ≥95% para los 3virus y se aproximan al 100% tras la 2.ª dosis.
Vacunación frente a varicelaRecomendación 2017: se recomienda la vacunación frente a varicela en todos los niños con 2 dosis: a los 15 meses y a los 2-4 años de edad. Se recomienda, además, vacunación de rescate, con 2dosis, a todos los niños y adolescentes que no hayan padecido la enfermedad (o completar la pauta de 2 dosis cuando sea necesario).
En 2016, todas las CC. AA. han incorporado la vacunación antivaricela con una pauta de 2 dosis (a los 15 meses y a los 3-4 años)1,25. Las 2vacunas disponibles (Varilrix® y Varivax®) muestran una elevada efectividad (96,8% en Navarra, 92% en EE. UU.) para reducir los casos y sus complicaciones, tanto en la población vacunada como en la no vacunada26,27, con un perfil de seguridad excelente28. Tras 20 años de vacunación en EE. UU. se ha comprobado una reducción sostenida de la enfermedad29.
No se ha constatado desplazamiento de la edad de presentación de varicela, ni cambios en la incidencia del herpes zóster (HZ). La razón coste-efectividad de la vacunación infantil frente a la varicela mostraría un perfil favorable si se demuestra que no causa un incremento del HZ en la población general, particularmente en los mayores de 50 años, en espera de establecer el papel de la vacuna frente al HZ en este grupo de edad28. En este sentido es muy importante asegurar las 2 dosis en los adolescentes, mediante las dosis de rescate necesarias.
Vacunación frente al papilomavirus humano (VPH)Recomendación CAV-AEP 2017: vacunación sistemática frente al VPH de todas las niñas, preferentemente a los 12 años, para prevenir el cáncer cervical, anal y las lesiones precancerosas del tracto genital en la mujer. Se debe informar y valorar la recomendación de la vacuna tetravalente en varones.
La edad óptima es a los 12 años de edad, con 2 dosis (fig. 1). Así, su administración antes de las primeras relaciones sexuales proporciona el máximo beneficio potencial de esta vacunación. La recomendación es también extensible a edades posteriores en caso de retraso en su administración por diferentes motivos, dados los beneficios que puede seguir aportando.
Esta vacunación está demostrando ser muy eficaz y efectiva con los programas de vacunación universal para la prevención de infección persistente por VPH, verrugas genitales y lesiones cervicales preneoplásicas, con hasta un 85% de prevención de las lesiones de alto grado30. Es muy probable que, en unos años, contemos con datos reales de prevención del cáncer de cérvix y otros tipos de cánceres asociados al VPH.
Estas vacunas, tras más de 200 millones de dosis administradas en el mundo, han demostrado ser seguras, con un balance beneficio/riesgo muy favorable30,31. Se ha descartado la asociación de estas vacunas con el desarrollo de enfermedades autoinmunes y neurológicas31,32. Aun así, la cobertura media en España no sube del 80%. Es imprescindible que todos los profesionales sanitarios refuercen los mensajes positivos sobre esta vacuna para mejorar su aceptación.
La vacuna tetravalente, aprobada para varones, está incluida en el calendario de EE. UU., Australia, Canadá, Austria, Suiza y algunas regiones italianas. Hay datos relevantes sobre el papel etiopatogénico del VPH en ciertos tipos de cáncer que afectan a ambos sexos, pero sobre todo con mayor incidencia en el varón, como el cáncer anal y el de cabeza y cuello. Además, en Europa no se ha observado que los varones se beneficien indirectamente de los programas de vacunación de chicas adolescentes33. Por ello, se debe informar y valorar la recomendación de la vacuna tetravalente en varones, preferentemente a los 12 años. La bivalente ha recibido la aprobación para varones, pero hay escasa experiencia actualmente.
La llegada próxima de una vacuna frente a VPH de 9 tipos (6/11/16/18/31/33/45/52/58), ya autorizada por la EMA, ampliará la cobertura global de la enfermedad oncológica cervical por VPH del 70 al 90%, así como una prevención potencial del 85-95% de los cánceres vulvar, vaginal y anal relacionados con VPH34.
Vacuna frente al meningococo BRecomendación 2017: presenta un perfil de vacuna sistemática para su administración a todos los niños desde los 2 meses de edad.
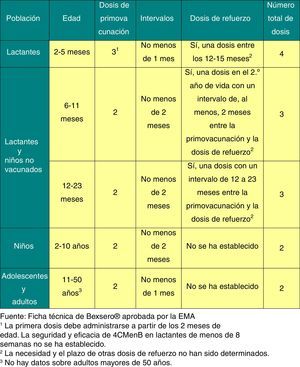
La única vacuna autorizada en Europa para la prevención de la EMI por serogrupo B (MenB) (Bexsero®) a partir de los 2 meses de edad ha demostrado en los ensayos clínicos que es inmunógena y segura e induce memoria inmunológica. Los ensayos clínicos realizados muestran que puede administrarse de forma conjunta con el resto de las vacunas del calendario, incluido con MenC, aunque puede incrementarse la reactogenicidad. El uso de paracetamol profiláctico disminuye la incidencia de efectos adversos sin afectar a la capacidad inmunogénica de la vacuna ni tampoco del resto de las vacunas de calendario administradas simultáneamente, pero, si se administra sola, no se recomienda su uso sistemático.
En septiembre de 2015, el Reino Unido incluyó en su calendario oficial esta vacuna para lactantes, con un esquema 2+1 (2, 4 y 12-13 meses)35. Se han notificado los resultados recogidos en los primeros 10 meses del programa, con una cobertura del 88% para las 2primeras dosis36. La efectividad ha sido del 83% frente a cualquier cepa de MenB y del 94% frente a las cepas de MenB cubiertas por la vacuna. Los casos notificados de EMI por MenB se han reducido en un 50% en la población diana de la vacunación36. De todas formas, el número total de casos es muy bajo y probablemente estos resultados varíen con el tiempo.
La posología de esta vacuna se refleja en la figura 2.
Vacunación frente al rotavirusRecomendación 2017: la vacunación frente al rotavirus es una medida de salud recomendable para todos los lactantes.
En 2016 se han cumplido 10 años de la comercialización de esta vacuna. En mayo de 2016, 81 países la han introducido en sus calendarios oficiales y los beneficios sanitarios han sido enormes, con un descenso importante de la morbimortalidad por gastroenteritis por rotavirus (RV) en lactantes y niños pequeños, en países de renta baja y alta.
En países de nuestro entorno con vacunación sistemática, como el Reino Unido, se ha observado una disminución de hasta un 87% de episodios respecto a las 10temporadas anteriores37.
Los beneficios que se obtienen con esta vacunación, tanto directos sobre los lactantes vacunados como indirectos, en forma de protección de grupo en convivientes, son muy claros38. Cada vez existen más evidencias de la propagación extraintestinal de los RV y de su implicación en enfermedades sistémicas (sobre todo neurológicas)39.
Los beneficios de la vacunación siguen siendo muy superiores a los hipotéticos riesgos de invaginación intestinal, único efecto adverso serio relacionado. Los estudios poscomercialización en los países industrializados en los que se vacuna sistemáticamente indican que pueden ocurrir episodios de invaginación como consecuencia de la vacunación, pero el riesgo es bajo (de 1 a 5 casos/100.000 niños vacunados)40.
La AEMPS levantó en junio de 2016 la suspensión de la comercialización de la vacuna Rotarix®, que venía manteniéndose en España desde el año 2010, por lo que ya están disponibles en las farmacias las 2vacunas frente al RV.
Ambas se pueden coadministrar con otras vacunas y su posología se puede consultar en la figura 1.
FinanciaciónLa elaboración de estas recomendaciones (análisis de los datos publicados, debate, consenso y publicación) no ha contado con ninguna financiación externa a la logística facilitada por la AEP.
Conflicto de interesesEn los últimos 5 años:
DMP ha colaborado en actividades docentes subvencionadas por Astra, Pfizer y Sanofi Pasteur MSD, y como consultor en Advisory Board de GlaxoSmithKline.
FJAG ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD y como consultor en un Advisory Board de GlaxoSmithKline y Novartis.
JAF ha colaborado en actividades docentes y como investigador en ensayos clínicos subvencionados por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en Advisory Board de Novartis, GlaxoSmithKline y Astra Zeneca.
MJCO ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigadora en ensayos clínicos de Pfizer y como consultora en Advisory Board de GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD.
JMCR ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Sanofi Pasteur MSD y Novartis.
NGS ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur MSD, Novartis y Pfizer. Ha asistido a actividades docentes subvencionadas por Novartis y Pfizer.
AHM ha recibido ayuda económica para asistir a actividades docentes nacionales.
THSM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigadora en ensayos clínicos subvencionados por GlaxoSmithKline y Pfizer.
MMM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en Advisory Board de Novartis.
LOC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline.
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
- David Moreno-Pérez. Infectología Pediátrica e Inmunodeficiencias. Unidad de Gestión Clínica de Pediatría. Hospital Materno-Infantil. Hospital Regional Universitario de Málaga. Grupo de Investigación IBIMA. Departamento de Pediatría y Farmacología. Facultad de Medicina de la Universidad de Málaga.
- Francisco José Álvarez García. Pediatra. Centro de Salud de Llanera. Asturias. Profesor Asociado en Ciencias de la Salud. Departamento de Medicina. Universidad de Oviedo.
- Javier Arístegui Fernández. Unidad de Infectología Pediátrica. Hospital Universitario de Basurto. Bilbao. Departamento de Pediatría. Facultad de Medicina de la Universidad del País Vasco (UPV/EHU).
- María José Cilleruelo Ortega. Servicio de Pediatría. Hospital Universitario Puerta de Hierro-Majadahonda, Madrid. Departamento de Pediatría. Facultad de Medicina de la Universidad Autónoma de Madrid.
- José María Corretger Rauet. Consell Assessor de Vacunacions. Departament de Salut. Generalitat de Catalunya. Barcelona.
- Nuria García Sánchez. Pediatra. Centro de Salud Delicias Sur. Zaragoza. Profesora Asociada en Ciencias de la Salud. Departamento de Pediatría. Facultad de Medicina de la Universidad de Zaragoza.
- Ángel Hernández Merino. Pediatra. Centro de Salud La Rivota. Alcorcón. Madrid.
- Teresa Hernández-Sampelayo Matos. Servicio de Pediatría. Hospital General Universitario Gregorio Marañón. Departamento de Pediatría. Facultad de Medicina de la Universidad Complutense de Madrid.
- Manuel Merino Moína. Pediatra. Centro de Salud El Greco. Getafe. Madrid. Profesor Colaborador de la Facultad de Medicina. Universidad Europea. Madrid.
- Luis Ortigosa del Castillo. Servicio de Pediatría. Hospital Universitario Ntra. Sra. de Candelaria. Departamento de Pediatría. Facultad de Medicina. Universidad de La Laguna. Santa Cruz de Tenerife.
- Jesús Ruiz-Contreras. Servicio de Pediatría. Hospital Universitario 12 de octubre. Madrid. Departamento de Pediatría. Facultad de Medicina de la Universidad Complutense de Madrid.