La infección por citomegalovirus es una infección endémica y los niños que acuden a guardería constituyen el foco de infección más importante para las gestantes.
ObjetivoEstablecer una recomendación para el diagnóstico basada en la evidencia médica sobre la infección de trasmisión vertical por citomegalovirus en prematuros menores de 1.500g al nacer.
AntecedentesLa infección en la gestante puede ser primaria o secundaria. Aunque exista infección fetal, el 85% de los recién nacidos serán asintomáticos. Los síntomas de infección son: bajo peso al nacer, hepatoesplenomegalia, trombocitopenia, microcefalia y trastornos neurológicos. El pronóstico de los niños sintomáticos suele ser grave, con elevada mortalidad y secuelas neurológicas.
El virus se puede reactivar durante la lactancia y es posible la infección precoz a través de la leche materna, probablemente con poca repercusión en niños a término, aunque en prematuros puede afectar al neurodesarrollo a largo plazo. El método diagnóstico de elección es la identificación del citomegalovirus en orina; la determinación en las 2 primeras semanas de vida indica infección congénita. Un diagnóstico posterior sugiere que puede haber sido adquirida en el parto o a través de la leche materna o transfusión de sangre contaminada.
Conclusión y recomendaciónDeterminar el ADN viral por reacción en cadena de la polimerasa a las 4-6 semanas de vida. En caso positivo, investigar en muestras obtenidas los primeros días de vida y en leche materna. Ello debe permitir clasificar al recién nacido en 3 estados: «no infectado», «infección congénita» e «infección adquirida».
Cytomegalovirus (CMV) infection is endemic, and children who attend day care are the most important source of infection.
ObjectiveTo establish recommendations based on the medical evidence on the vertical transmission of cytomegalovirus in preterm infants weighing less than 1500g at birth.
BackgroundInfection in pregnant women may be primary or secondary. Although there is fetal infection, 85% of newborn infants are asymptomatic. Symptoms of infection include low birth weight, hepatosplenomegaly, thrombocytopenia, microcephaly and neurological disorders. The prognosis of symptomatic children is very poor, with high mortality and neurological disorders. The virus can be reactivated during breast feeding, and early infection is possible through breast milk, probably with little impact in term infants, although the long-term neurological outcome worsens in preterm infants. The diagnostic method of choice is the identification of CMV in urine; the determination in the first two weeks of life suggests congenital infection; later it can be acquired at birth or through breast milk or contaminated blood transfusion.
Conclusion and recommendationDetermine viral DNA at 4-6 weeks of life by protease chain reaction. If it is positive, monitoring of samples from the first days of life and breast milk are mandatory. This should allow the newborn to be classified into three states: “Without CMV infection”, “Congenital CMV infection”, “Acquired CMV infection”.
El citomegalovirus (CMV) es un patógeno oportunista de la familia de los herpes virus. A semejanza de otros virus de la familia Herpes, tiene la capacidad de permanecer de estado latente y reactivarse1,2 (evidencia D). Es una infección endémica y la seroprevalencia en adultos en países desarrollados está alrededor del 50%. Para su contagio, se requiere el contacto directo a través de productos biológicos (saliva, orina, sangre, secreciones, etc.). Los niños pequeños que acuden a guardería constituyen el foco de infección más importante.
ObjetivoEstablecer una recomendación basada en la evidencia médica sobre la infección de trasmisión vertical por CMV en prematuros menores de 1.500g al nacer.
AntecedentesLa infección en la gestante puede ser primaria o secundaria por reinfección o por reactivación del virus3,4 (evidencia D). La infección fetal ocurre en el 30% de las gestantes infectadas. A pesar de ello, el 85% de los recién nacidos pueden ser asintomáticos. Los síntomas de infección suelen ser: bajo peso al nacer, hepatoesplenomegalia, trombocitopenia, ictericia, microcefalia, convulsiones y trastornos neurológicos. Las alteraciones que se pueden encontrar en el sistema nervioso central mediante técnicas de imagen (tomografía computarizada o resonancia magnética) son quistes periventriculares, calcificaciones, ventriculomegalia, hidranencefalia, alteraciones de migración neuronal, coriorretinitis y atrofia óptica, y sordera sensorial (70%), que suele ser progresiva. El pronóstico de los niños sintomáticos suele ser grave, con elevada mortalidad, secuelas neurológicas con trastornos del desarrollo e hipoacusia sensorial, bilateral en el 50% de los casos5 (evidencia D).
El seguimiento a largo plazo es esencial, dado que muchos trastornos cognitivos, de aprendizaje, dislexia, déficit de atención con hiperactividad y alteraciones de conducta se manifiestan tardíamente6 (evidencia A)7 (evidencia B)8,9 (evidenciaC).
En madres seropositivas, el virus se puede reactivar durante la lactancia y es posible la infección precoz del recién nacido a través de la leche materna, aunque los niños a término suelen ser poco sintomáticos y probablemente con poca repercusión a largo plazo10,11 (evidencia D)12 (evidenciaC). La infección por CMV puede ocasionar un cuadro séptico11 y empeora el pronóstico neurológico a largo plazo, aunque no parecen detectarse defectos sensoriales (sordera)12. La infección posnatal suele ser a través de la leche materna y puede minimizarse el riesgo congelándola a –20°C o pasteurizandola10,13 (evidencia D).
En un metanálisis de 695 recién nacidos prematuros, de 299 niños alimentados con leche materna cruda (no manipulada) se consideraron infectados el 19% (IC del 95%, 11%-32%), desarrolló síntomas relacionados con el CMV y parecidos a la infección prenatal el 10% (IC del 95%, 5%-17%) y en el 4% (IC del 95%, 2%-7%), un cuadro séptico agudo. En el mismo análisis, en los 212 prematuros alimentados con leche congelada la infección se dio en el 13% (IC del 95%, 7%-24%), el 7% (IC del 95%, 3%-14%) fue sintomático y el 5% (IC del 95%, 2%-12%) presentó un cuadro séptico. Entre los 184 alimentados con leche no tratada o congelada, o pasteurizada pero no de una manera uniforme, se infectó el 13% (IC del 95%, 7%-20%), el 3% (IC del 95%, 1%-8%) sintomático y el 3% (IC del 95%, 1%-7%) cuadro séptico14 (evidencia A).
En una población propia de 342 prematuros extremos, se detectaron 53 (15,5%) infecciones por CMV: 8 (2,3%) infecciones congénitas, 35 (10,2%) infecciones adquiridas y en 10 (2,9%) infecciones no se pudo precisar el momento de la infección. Tres de las 8 infecciones congénitas tenían diagnóstico prenatal con confirmación neonatal por detección de ADN en orina en los primeros días. Los otros 3 se diagnosticaron a los 42,6 días (36-49) al detectarse ADN-CMV en orina y confirmarse en la muestra de sangre seca del cribado metabólico. Los hallazgos clínicos más frecuentes fueron: hepatoesplenomegalia, neutropenia, colostasis, coagulopatía, coriorretinitis e íleo meconial. En los 35 recién nacidos con infección adquirida, el diagnóstico fue a través de la detección del ADN-CMV en orina a los 35,7días (25-60). Todos ellos tenían una determinación precoz negativa, 32 en muestra de sangre seca y 3 en orina. El ADN-CMV en leche materna fue positivo en los 3 casos de infecciones congénitas en que se practicó y en 22 de los 28 casos de infecciones adquiridas (78,5%), por lo que se consideró la lactancia materna el origen de la infección y en los restantes no se llegó a establecer15 (evidencia B).
La determinación de IgG-CMV no es útil para el diagnóstico por el paso transplacentario de IgG. La presencia de IgM-CMV indica infección congénita, pero solo se encuentra en 70% de los infectados. El método de elección es la identificación del CMV en orina por cultivo o por PCR16,17 (evidencia D). Dentro de las 2 primeras semanas de vida, indica infección congénita; después de las 2 semanas, la presencia de virus puede ser por infección adquirida en el canal del parto o a través de la leche materna o, más raramente, por transmisión horizontal (transfusiones contaminadas, infección nosocomial). La determinación de CMV por PCR en muestras de sangre seca obtenidas para el cribado de enfermedades endocrinometabólicas es sensible y específica para el diagnóstico retrospectivo de infección congénita18 (evidencia B)19 (evidenciaC)20 (evidencia A), aunque puede ser negativa en caso de baja carga viral21,22 (evidencia A). Más recientemente, se han utilizado muestras líquidas o secas de saliva obtenida a los 3 días de vida23 (evidencia A), si bien si la carga viral es baja puede haber falsos negativos24,25 (evidenciaC).
El tratamiento con ganciclovir debe reservarse las formas congénitas graves sintomáticas y especialmente con manifestaciones del sistema nervioso. No parece justificado en las formas adquiridas15,17 (evidencia D).
RecomendaciónEs necesario realizar estudios prospectivos para conocer el alcance y la repercusión de la infección por CMV en los recién nacidos prematuros y para ello es necesario establecer un protocolo clínico.
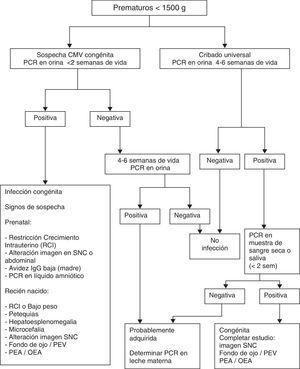
En los nacidos prematuros con peso inferior a 1.500g, ante la sospecha clínica de infección congénita por CMV, determinar el ADN viral por PCR en orina durante las 2 primeras semanas de vida.
Si no se hizo esta determinación precoz o fue negativa, se debe descartar la infección posnatal. Para ello, se debe determinar el ADN viral por PCR en el intervalo de las 4-6 semanas de vida. En caso de ser positiva, investigar la presencia de ADN viral en muestras de sangre seca, orina o saliva obtenidas en los primeros días de vida. También en muestras de leche materna.
En todos los recién nacidos de menos de 1.500g de peso al nacer, se debe seguir el algoritmo indicado (fig. 1), lo cual permitirá clasificar al recién nacido en 3 estados: «no infectado por CMV», «infección congénita por CMV» e «infección adquirida por CMV».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.