La encefalopatía hiperamoniémica inducida por ácido valproico (EHV) es una entidad grave e inusual. Para su diagnóstico, precisa un elevado índice de sospecha, pues resulta reversible con la retirada del fármaco y el tratamiento precoz de la hiperamoniemia. Presentamos el caso de un neonato tratado con valproico (AV) por convulsiones refractarias, que desarrolló una EHV grave que revirtió con la retirada del AV y el tratamiento con ácido carglúmico, junto con otras medidas para control de la hiperamoniemia.
Valproate-induced hyperammonemic encephalopathy (VHE) is an unusual and serious complication of valproate (VA) treatment. When an early diagnosis is made, it can be reversed with VA withdrawal and early treatment for hyperammonemia. We describe the case of a 20 days old male, who developed a serious VHE after receiving VA for refractory neonatal seizures. The VHE was resolved with VA withdrawal in association with carglumic acid and other measures for hyperammonemia treatment.
El ácido valproico (AV) es un antiepiléptico que, aunque no de primera línea en las convulsiones neonatales, se emplea en nuestro país como segunda o tercera opción en convulsiones refractarias a fenobarbital1. La encefalopatía hiperamoniémica inducida por ácido valproico (EHV) es una entidad inusual (< 1/10.000) pero grave y que puede llevar al fallecimiento del paciente2,3. El principal mecanismo fisiopatológico implicado en su desarrollo es el incremento progresivo de los niveles sanguíneos de amonio, provocando un cuadro consistente en vómitos, disminución del nivel de consciencia con progresión a coma, déficits neurológicos focales e incremento de la frecuencia de convulsiones4. No se ha demostrado que la incidencia y la gravedad del cuadro esté relacionada con los niveles sanguíneos de AV, pues en la mayoría de los casos publicados los niveles estaban en rango terapéutico, aunque parece que la politerapia antiepiléptica (fenobarbital, fenitoína y AV) puede ser un factor inductor de EHV5.
El tratamiento consiste en la retirada del AV y en el control de los niveles de amonio para evitar su neurotoxicidad, especialmente en neonatos6. El N-carbamilglutamato (NCG) o ácido carglúmico es un análogo sintético del N-acetilglutamato (NAG), uno de los cofactores necesarios para el correcto funcionamiento del ciclo de la urea. El NCG está indicado en el tratamiento de la hiperamoniema secundaria al déficit de N-acetilglutamato-sintetasa (NAGS), si bien se ha empleado en el tratamiento de otras causas de hiperamoniemia como la EHV7.
Presentamos el caso de un neonato con EHV que se trató de forma satisfactoria con NCG, además de otras medidas frente a la hiperamoniemia.
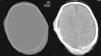
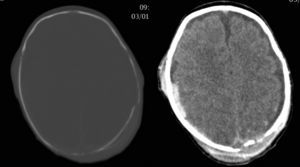
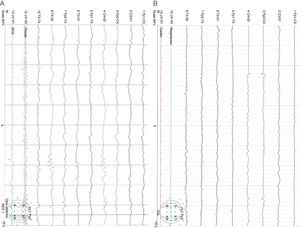
Caso clínicoNeonato varón de 20 días de vida, ingresado por fractura craneal y hematoma subdural secundario a traumatismo occipital, sin antecedentes familiares de metabolopatías ni consanguinidad. Gestación a término y parto sin incidencias, Apgar 9/10. En la exploración general a su ingreso, destacaba la presencia de cefalohematoma parietal izquierdo y en la exploración neurológica únicamente tendencia al sueño (Glasgow 13/15). La tomografía computarizada (TC) craneal mostró fracturas craneales múltiples con comportamiento diastásico, hematoma subdural derecho extenso y colecciones subgaleales parietales izquierdas (fig. 1). A las 24 h del ingreso, presentó crisis parciales que cedieron con fenobarbital (bolo 20mg/kg, mantenimiento 5mg/kg/día) y midazolam. Presentó un nuevo episodio consistente en una crisis parcial secundariamente generalizada y prolongada, por lo que se asoció tratamiento con AV (bolo 15mg/kg mantenimiento 1mg/kg/h). El electroencefalograma (EEG) al ingreso fue normal, si bien tras las crisis comiciales se constató actividad focal en regiones posteriores del hemisferio derecho, coincidentes con la localización del hematoma subdural (fig. 2A). A las 48 h de tratamiento con AV, el paciente comenzó con disminución del nivel de consciencia, menor motilidad espontánea y marcada hipotonía e hiporreflexia. A la exploración no presentaba signos de hipertensión intracraneal y la TC craneal de control no reveló cambios. Un nuevo EEG mostró actividad cerebral enlentecida, de bajo voltaje y generalizada, compatible con edema cerebral (fig. 2B). Los niveles de fenobarbital eran normales y los de AV estaban ligeramente elevados (104,9μg/ml). La analítica básica (hemograma, ionograma, pruebas hepáticas) fue normal y en la gasometría presentaba alcalosis respiratoria. Los niveles séricos de amonio eran de 398μmol/l. Ante este hallazgo, se decide suspender el AV e iniciar tratamiento con ácido carglúmico (inicio 100mg/kg, mantenimiento 25mg/kg/6h por vía oral) y carnitina (25mg/kg/6h por vía oral). A las 5 h, dado que los niveles de amonio bajaban lentamente (374μmol/l), se adicionó fenilbutirato (125mg/kg/6h) y L-arginina (600mg/kg/día), ambos por vía oral. A las 10 h, los niveles de amonio habían descendido a la mitad (182μmol/l) y los niveles de AV estaban en rango normal (69,8μg/ml). A las 18 h, los niveles de amonio eran normales (102μmol/l) y el paciente presentaba franca mejoría, suspendiéndose la medicación frente a la hiperamoniemia. Se realizó realizar un cribado ampliado de metabolopatías en sangre de talón, que resultó normal. En el seguimiento ambulatorio posterior, la evolución ha sido satisfactoria, retirándose el fenobarbital a los 4 meses de edad y mostrando al año de vida un desarrollo psicomotor normal, sin nuevos episodios convulsivos.
EEG que muestra una actividad focal irritativa en regiones posteriores del hemisferio derecho sobre un trazado de base bien integrado (A). EEG que muestra una actividad difusa de muy bajo voltaje, formada por mezcla de frecuencias lentas, sin clara diferenciación topográfica ni respuesta a estímulos externos. Sobre dicho trazado se observa foco irritativo posterior temporal derecho (B).
Aunque el tratamiento de las convulsiones neonatales ha cambiado poco en las últimas décadas, sigue siendo un tema controvertido, al no existir guías basadas en la evidencia para su manejo. En general, hay consenso en cuanto al uso del fenobarbital como fármaco de primera línea8, seguido de fenitoína y benzodiacepinas. Están empezando ya a publicarse experiencias con nuevos fármacos, como el topiramato o el levetiracetam9. El AV se utiliza también como segunda línea de tratamiento, tras el fracaso del fenobarbital, con buenos resultados, aunque se recomienda emplear con cautela dada la poca experiencia de su uso en Neonatología1,10.
La EHV es una entidad grave e inusual, especialmente en neonatos. El principal mecanismo fisiopatológico implicado en su desarrollo parece ser el incremento de los niveles sanguíneos de amonio, provocando un cuadro clínico agudo o subagudo consistente en vómitos y disminución del nivel de consciencia que progresa hacia coma y que puede asociarse a déficits neurológicos focales e incremento de las convulsiones4.
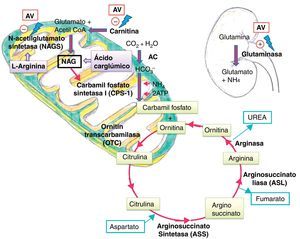
El amonio es un compuesto altamente tóxico para el sistema nervioso central, pues difunde libremente a través de la barrera hematoencefálica, alcanzando concentraciones superiores a las sanguíneas. El cerebro en desarrollo es mucho más susceptible a los efectos deletéreos del amonio que en el adulto11. Su toxicidad está relacionada con la elevación del glutamato extracelular y el desarrollo de edema cerebral e hipertensión intracraneal4. El ciclo de la urea es la principal vía metabólica para su eliminación, transformándolo en urea que será excretada por el riñón.
Se postulan varios mecanismos por los que el AV y sus metabolitos pueden causar hiperamoniemia. A nivel renal, de forma directa, por estimulación de la glutaminasa renal y a nivel hepático, de forma indirecta, por inhibición de la NAGS, produciendo depleción de NAG, cofactor necesario para el funcionamiento de la carbamil fosfato sintetasa (CPS-1), primera enzima del ciclo de la urea5. También ocasionan depleción de los niveles de carnitina, alterando la betaoxidación de los ácidos grasos y reduciendo los niveles de acetil CoA, necesario para la formación de NAG11 (fig. 3).
Aunque recientemente se describe una correlación positiva entre los niveles de amonio y las dosis y niveles séricos de AV12, no se ha encontrado una relación significativa entre la dosis diaria de AV y la aparición y gravedad de EHV, estando los niveles de AV en rango terapéutico5 o infraterapéutico2 en la mayoría de los casos publicados. Por otro lado, se han observado elevaciones leves de los niveles de amonio en pacientes a tratamiento con AV y asintomáticos, a los que no es necesario retirar el fármaco13. Por lo tanto, no parece indicada la monitorización de los niveles de amonio en todos los pacientes con AV, pero sí en aquellos que comiencen con clínica neurológica14.
Existen varios factores asociados al desarrollo de EHV, destacando la politerapia y el déficit de ornitin transcarbamilasa (OTC) y carnitina. Existen fármacos antiepilépticos como el fenobarbital, la fenitoína, carbamacepina y topiramato que aumentan la toxicidad del AV15. El déficit de OTC (enfermedad ligada al X) es la causa heredada más frecuente de hiperamoniemia. Los varones homocigotos fallecen generalmente en el periodo neonatal; sin embargo, las mujeres heterocigotas pueden ser asintomáticas y el AV inducir en ellas hiperamoniemia16.
El tratamiento de la EHV consiste en la retirada del fármaco y el control de los niveles de amonio para evitar la neurotoxicidad, mediante el empleo de carnitina y N-carbamilglutamato7. El NCG, análogo sintético del NAG, está indicado para el tratamiento de la hiperamoniema secundaria al déficit de NAGS, si bien se ha empleado en otras causas de hiperamoniemia (acidemias orgánicas, trastornos de betaoxidación) e hiperamoniemias de etiología desconocida, con buenos resultados7,17. Respecto a su uso en la EHV, se describen 2 casos en adolescentes en los que se retiró el AV y fueron tratados exitosamente con NCG durante 24-48 h18 y, recientemente, un nuevo caso en un preescolar tratado durante 2 meses con NCG, mientras se disminuía progresivamente la dosis de AV3.
Presentamos este caso por lo inusual y por su dificultad diagnóstica. Por otro lado, transmitir que aunque la EHV es una afección infrecuente, debe ser considerada en todo neonato tratado con AV que presente un deterioro inexplicable de su nivel de consciencia. Pensamos que, en nuestro caso, pudo ser un factor asociado la politerapia, descartándose otras posibles causas de hiperamoniemia. Finalmente, destacar la eficacia terapéutica de la retirada del AV, junto con el empleo del NCG combinado con otros fármacos, en la normalización de los niveles de amonio, llevando a la reversibilidad total del cuadro y la ausencia de secuelas a corto y medio plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.