Los hemangiomas infantiles son tumores benignos producidos por la proliferación de células endoteliales de vasos sanguíneos, con una alta incidencia en niños menores de un año (4-10%) y se estima que un 12% de ellos requiere tratamiento. Dicho tratamiento debe realizarse según las guías de práctica clínica y la experiencia de los especialistas, las características de los pacientes y las preferencias de sus progenitores.
MétodosEl proceso de consenso se realizó utilizando evidencias científicas sobre el diagnóstico y tratamiento de los hemangiomas infantiles, extraídas mediante una revisión sistemática de la literatura, junto con el juicio experto de los especialistas. Las recomendaciones formuladas fueron validadas por los especialistas, aportando su grado de acuerdo.
ResultadosEl presente documento recoge recomendaciones sobre la clasificación, las asociaciones, las complicaciones, el diagnóstico, el tratamiento y el seguimiento de los pacientes con hemangioma infantil. Además, se incluyen algoritmos de actuación y se aborda el manejo multidisciplinario y criterios de derivación entre los distintos especialistas que participan en el manejo clínico de este tipo de pacientes.
ConclusionesLas recomendaciones y los algoritmos diagnóstico y terapéutico de los hemangiomas infantiles recogidos en este documento son una herramienta útil en el manejo adecuado de estos pacientes.
Infantile haemangiomas are benign tumours produced by the proliferation of endothelial cells of blood vessels, with a high incidence in children under the age of one year (4-10%). It is estimated that 12% of them require treatment. This treatment must be administered according to clinical practice guidelines, expert experience, patient characteristics and parent preferences.
MethodsThe consensus process was performed by using scientific evidence on the diagnosis and treatment of infantile haemangiomas, culled from a systematic review of the literature, together with specialist expert opinions. The recommendations issued were validated by the specialists, who also provided their level of agreement.
ResultsThis document contains recommendations on the classification, associations, complications, diagnosis, treatment, and follow-up of patients with infantile haemangioma. It also includes action algorithms, and addresses multidisciplinary management and referral criteria between the different specialities involved in the clinical management of this type of patient.
ConclusionsThe recommendations and the diagnostic and therapeutic algorithms of infantile haemangiomas contained in this document are a useful tool for the proper management of these patients.
El hemangioma infantil (HI) es el tumor benigno más frecuente de la infancia, producido por la proliferación de células endoteliales de los vasos sanguíneos. Su incidencia es del 4-10% en niños menores de un año1. Un 12% de los hemangiomas diagnosticados requiere tratamiento1. La localización predominante es en la cabeza y el cuello2.
El HI es más frecuente en la raza caucásica y en el sexo femenino. Asimismo, existe más incidencia de HI en niños prematuros y en recién nacidos de bajo peso3-5. Algunos estudios relacionan el HI con la edad avanzada de la madre, la gestación múltiple, la placenta previa y la preeclampsia, si bien todos estos factores están relacionados con el bajo peso al nacer y con la prematuridad2,6. Por regla general, los HI tienen 3 fases evolutivas: una fase proliferativa en la que la lesión crece aceleradamente, un periodo de estabilidad y una fase involutiva en la que, independientemente del tratamiento, la lesión se atenúa de color y disminuye de tamaño. La duración de cada una de ellas varía en función del tipo de HI7: existen hemangiomas con una nula o mínima proliferación7, como los HI abortivos o de proliferación mínima; por el contrario, en ciertos HI generalmente profundos y segmentarios el periodo proliferativo se prolonga más allá del año.
La toma de decisiones sobre el tratamiento de los HI debe seguir las guías de práctica clínica y la evidencia científica disponible, además de orientarse por la experiencia de los especialistas, las características individuales de los pacientes y las preferencias de sus progenitores. El objetivo de este consenso es elaborar un conjunto de recomendaciones: 1) para la clasificación y el diagnóstico de los HI, y para su estratificación en grupos de riesgo bajo, medio y alto; 2) enfocadas a la identificación precoz de los HI subsidiarios de tratamiento, y 3) para abordar la manera de realizar el tratamiento. Con todo ello, este documento de consenso pretende servir como herramienta útil para el manejo de los pacientes con HI.
Material y métodosEl presente documento de consenso ha sido elaborado por un equipo multidisciplinario compuesto por 16 especialistas de diferentes especialidades: Dermatología, Pediatría, Cirugía pediátrica y Cardiología.
En una primera reunión presencial en mayo del 2014, se definieron los objetivos y un índice de contenidos del consenso. Posteriormente, se llevó a cabo una búsqueda bibliográfica exhaustiva, siguiendo los criterios utilizados en una revisión sistemática realizada en 20118 y mediante la formulación de preguntas clínicas, utilizando el método Patient/Intervention/Comparator/Outcome (PICO). Como pacientes, se incluyó a pacientes con HI único o múltiple, HI en fresa, capilar, simple, cavernoso o ulcerado; como intervenciones, se incluyeron tratamientos con láser, corticoides, cirugía, imiquimod, interferón, bleomicina, vincristina y propranolol; como comparadores, placebo, control con «espera y observación» y otras intervenciones, y, como resultados, se definió la resolución del HI según la valoración por parte del médico y de los padres.
Se priorizaron ensayos clínicos aleatorizados y revisiones, publicados desde marzo del 2011 y con texto completo disponible. Se identificaron 108 publicaciones, de las cuales 35 disponían de texto completo. Tras su lectura, se seleccionaron 16 ensayos clínicos y 12 revisiones e informes de evidencia (tabla S1, material suplementario).
Tras la lectura de los estudios seleccionados, se redactó un documento que contestaba a cada pregunta clínica e incluía las recomendaciones. Cada especialista valoró dichas recomendaciones individualmente, sin mantener ningún tipo de comunicación o intercambio de opiniones con otros participantes del consenso. Se aceptaron aquellas recomendaciones que obtuvieron unanimidad (100% de acuerdo) o consenso (≥ 80% de acuerdo) y se rechazaron aquellas con un <60% de acuerdo. Las recomendaciones dudosas (acuerdo entre el 61 y el 79%) y las consideradas controvertidas por los comentarios realizados fueron debatidas durante una reunión presencial participativa y estructurada en octubre del 2014. Al final del proceso, se validaron un total de 75 recomendaciones.
ResultadosClasificación y asociacionesLos HI son tumores heterogéneos. Su clasificación es importante para orientar el pronóstico, las potenciales complicaciones y el tratamiento. Los HI se pueden clasificar clínicamente según 2 criterios: la profundidad de los vasos afectados y el patrón forma-distribución2,9 (tabla 1).
Clasificación de los hemangiomas infantiles
| Según la profundidad de los vasos afectados | ||
|---|---|---|
| Tipo | Aspecto clínico | Localización |
| Superficiales | Pápulas, placas o tumores de color rojo brillante, con superficie lobulada o lisa | Dermis superficial |
| Profundos | Tumoraciones azuladas o del color de piel normal, presentando a veces telangiectasias en la superficie Aparecen tarde y tienden a proliferar durante más tiempo | Dermis profunda y subcutis |
| Mixtos | Componente doble: 1) superficial, que causa el color rojo de la lesión y 2) profundo, que aporta volumen | Dermis y subcutis |
| Según el patrón forma-distribución | |
|---|---|
| Tipo | Aspecto clínico |
| Focales o localizados | Redondeados, podrían trazarse con un compás a partir de un punto central |
| Segmentarios | Con bordes geográficos y siguiendo la disposición de las unidades de desarrollo embrionario |
| Indeterminados | Forma intermedia entre el focal y el segmentario |
| Multifocales | Hemangiomas focales múltiples |
Los HI, especialmente los de cabeza, cuello y de la región lumbosacra, pueden estar asociados a alteraciones estructurales subyacentes. Se han descrito 2 síndromes típicamente asociados a los HI: el síndrome Posterior fossa malformations/Hemangiomas/Arterial anomalies/Cardiac defects/Eye abnormalities/Sternal cleft/Supraumbilical raphe syndrome (PHACES) (OMIM #606519) describe las alteraciones asociadas a los hemangiomas faciales grandes y segmentarios cuyos criterios diagnósticos se establecieron en 200910. Entre un 20 y un 31% de los HI grandes y segmentarios de la cara están asociados al síndrome PHACES11. El síndrome Perineal hemangioma/External genitalia malformations/Lipomyelomeningocele/Vesicorenal abnormalities/Imperforate anus/Skin tag (PELVIS), también conocido como SACRAL o LUMBAR, se ha propuesto para referirse al conjunto de alteraciones asociadas a HI grandes o segmentarios de la región lumbosacra12,13. En la tabla 2 se recogen las anomalías que pueden presentar los pacientes con síndrome PHACES y PELVIS/SACRAL/LUMBAR.
Asociaciones de los hemangiomas infantiles
| Alteraciones asociadas al síndrome PHACES | |
|---|---|
| Cerebrales | Estructurales: anomalías de la fosa posterior, síndrome de Dandy-Walker, hipoplasia o agenesia del cerebelo y anomalías supratentoriales Vasculares: disgenesias, curso anómalo, estenosis o no visualización de vasos cerebrales Secuelas: accidentes vasculares cerebrales, hemiparesia, convulsiones, retraso psicomotor, migrañas |
| Cardiovasculares | Origen aberrante de la arteria subclavia, coartación de aorta |
| Defectos cardíacos | Defectos del septo interventricular, estenosis pulmonar, venas pulmonares anómalas |
| Anomalías oculares | Alteraciones de los vasos retinianos, atrofia óptica, hipoplasia del iris, cataratas congénitas, colobomas del cristalino, alteraciones del disco óptico y persistencia de la vasculatura retiniana fetal |
| Hendidura esternal o rafe supraumbilical | Malformaciones del esternón, rafe supraumbilical, máculas hipopigmentadas centrotorácicas, hoyuelos preesternales y onfaloceles |
| Otras asociaciones | Hipopituitarismo, déficit de hormona del crecimiento, hipotiroidismo, sordera neurosensorial |
| Alteraciones asociadas al síndrome PELVIS/SACRAL/LUMBAR | |
|---|---|
| Disrafia espinal | Lipomeningocele, médula anclada, lipoma intramedular |
| Perineales | Ano imperforado, ano anterior ectópico, fístula rectoperineal |
| Genitourinarias | Riñón único, reflujo vesicoureteral, alteraciones de la vejiga urinaria, genitales externos ambiguos, escroto bífido, hiper o hipotrofia vulvar |
PELVIS: Perineal hemangioma/External genitalia malformations/Lipomyelomeningocele/Vesicorenal abnormalities/Imperforate anus/Skin tag; PHACES: Posterior fossa malformations/Hemangiomas/Arterial anomalies/Cardiac defects/Eye abnormalities/Sternal cleft/Supraumbilical raphe syndrome.
La mayoría de los HI se diagnostica mediante el examen físico y la historia evolutiva de la lesión.
La historia clínica debe recoger datos relacionados con la gestación, el periodo perinatal y los detalles evolutivos de la lesión. Entre un 30-50% de los HI presentan una lesión precursora en forma de mácula pálida, rosada o telangiectásica, la cual puede confundirse con malformaciones capilares, nevus anémicos, nevus hipocrómicos o traumatismos.
Diagnóstico diferencialDebe realizarse un diagnóstico diferencial de los HI profundos con gliomas nasales, quistes dermoides, miofibromatosis infantil, neuroblastomas, neurofibromas plexiformes, pilomatricomas, lipomas y otros sarcomas, si bien las técnicas de imagen suelen ser suficientes para esclarecer el diagnóstico14,15. A su vez, los HI multifocales deben diferenciarse de la linfangioendoteliomatosis multifocal16, el síndrome de Bean y la histiocitosis de células de Langerhans. Por último, los HI superficiales pueden confundirse con hemangiomas en penachos, hemangioendoteliomas kaposiformes, hemangiopericitomas o angiosarcomas.
Diagnóstico de extensiónLa afectación interna de un HI no tiene por qué guardar relación anatómica con el hemangioma cutáneo, si bien los hemangiomas segmentarios o de gran tamaño tienen un mayor riesgo de asociación con hemangiomas internos17. En este sentido, existen datos que indican que la existencia de 5 o más hemangiomas cutáneos debe ser razón suficiente para realizar una ecografía abdominal18. Los HI viscerales suelen ser asintomáticos y pueden aparecer en diversas localizaciones, siendo el hígado la localización más frecuente. Sin embargo, en ciertas ocasiones, la clínica puede ser de ayuda en el diagnóstico de los hemangiomas internos: estridor, tos o afonía en los HI de la vía aérea; hemorragia intestinal en los del tracto gastrointestinal; insuficiencia cardíaca, compromiso respiratorio o síntomas y signos de hipotiroidismo en los hemangiomas hepáticos de gran tamaño o multifocales.
Técnicas diagnósticasLos estudios de imagen pueden ser de gran utilidad para establecer un diagnóstico, pero no existe consenso sobre cuándo indicarlos para determinar la extensión interna de un HI. En general, las pruebas analíticas son de escasa ayuda para el diagnóstico del HI.
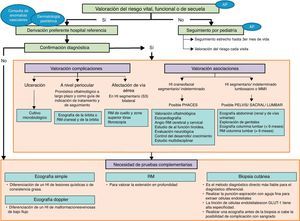
En la figura 1 se recogen las recomendaciones formuladas en cuanto al diagnóstico del HI, en forma de algoritmo.
Algoritmo diagnóstico del hemangioma infantil.
AP: Atención Primaria; HI: hemangioma Infantil; PHACES: Posterior fossa malformations/Hemangiomas/Arterial anomalies/Cardiac defects/Eye abnormalities/Sternal cleft/Supraumbilical raphe syndrome; PELVIS: Perineal hemangioma/External genitalia malformations/Lipomyelomeningocele/Vesicorenal abnormalities/Imperforate anus/Skin tag; RM: resonancia magnética.
La mayoría de los HI tiene un curso clínico predecible, con tendencia a la involución espontánea total o parcial. Sin embargo, algunos HI pueden complicarse a nivel local llegando a provocar secuelas estéticas o bien comprometer órganos vitales19. La clasificación de los HI según el riesgo de secuelas o complicaciones (tabla 3) es de utilidad en este aspecto.
Clasificación de los hemangiomas infantiles según grupos de riesgo de secuelas y complicaciones
| Tipo de hemangioma | Riesgo |
|---|---|
| Alto riesgo | |
| Hemangiomas segmentarios en cualquier localización de la cara y diámetro > cm | Síndrome PHACES |
| Hemangiomas segmentario en el área de la barba y diámetro > 5cm | Síndrome PHACES y hemangioma infantil en la vía aérea |
| Hemangiomas infantiles zona lumbosacra y diámetro > 5cm | Síndrome PELVIS |
| Hemangiomas mixtos o superficiales gruesos en la punta nasal, glabela, philtrum, centro mejilla y diámetro > 1,5cm | Compromiso estético |
| Hemangiomas que deforman el contorno del labio | Compromiso estético |
| Hemangiomas perioculares mixtos o profundos | Riesgo funcional |
| Hemangiomas en el conducto auditivo | Riesgo funcional |
| Hemangioma mixtos o superficiales gruesos en aréola mamaria | Compromiso estético |
| Hemangiomas ulcerados | Dolor y riesgo de cicatriz |
| Riesgo intermedio | |
|---|---|
| Hemangioma en otras localizaciones de cara no mencionadas | Riesgo de compromiso estético |
| Hemangiomas grandes en las manos (diámetro de 3-5cm) | Riesgo de compromiso estético |
| Hemangiomas en pliegues | Riesgo de ulceración |
| Hemangiomas segmentarios en cualquier localización y diámetro > 5cm | Riesgo de ulceración, de alteraciones arteriales asociadas y de compromiso estético |
| Hemangiomas pedunculados | Riesgo de compromiso estético |
| Bajo riesgo |
|---|
| Hemangiomas superficiales en otras localizaciones |
| Hemangiomas profundos en otras localizaciones |
| Hemangiomas mixtos pequeños |
PELVIS: Perineal hemangioma/External genitalia malformations/Lipomyelomeningocele/Vesicorenal abnormalities/Imperforate anus/Skin tag; PHACES: Posterior fossa malformations/Hemangiomas/Arterial anomalies/Cardiac defects/Eye abnormalities/Sternal cleft/Supraumbilical raphe syndrome.
Adaptado de Luuet al.39.
Las complicaciones a nivel local abarcan ulceración, infección, sangrado y dolor. La ulceración es la más frecuente, siendo sus factores predisponentes el tamaño del HI, la distribución segmentaria, la aparición de una zona grisácea superficial y la localización en regiones de fricción y humedad mantenida14,20.
Los HI ubicados en la zona periocular pueden producir astigmatismo, estrabismo y obstrucción del eje visual, con presencia de ambliopía y riesgo de pérdida de visión permanente. Otros HI, especialmente los bilaterales y localizados en la barba, tienen un alto riesgo de afectación de la vía aérea.
Merece una mención especial el impacto psicológico por el riesgo potencial de secuelas, especialmente en aquellos HI localizados en zonas visibles. Si bien el futuro estético de un hemangioma es difícil de predecir, los HI superficiales no suelen ocasionar secuelas, mientras los mixtos y voluminosos tienden a dejar un tejido fibroadiposo residual21.
La localización, el tamaño, las complicaciones, el tratamiento o la asociación a otras patologías pueden incidir de forma negativa en la calidad de vida de los pacientes y de sus familias. Un estudio reciente describió que no existen diferencias significativas en los índices de calidad de vida de los pacientes con y sin HI22, si bien otros estudios indican que los niños entre 3 y 7 años podrían ser los más susceptibles en cuanto a un impacto en la autoestima23. Recientemente se ha desarrollado un instrumento específico de valoración del impacto de los HI en la calidad de vida de los pacientes y sus familias, consistente en un cuestionario de 29 preguntas dividido en 4 subescalas que valoran los morbilidad causada por los HI, su repercusión en la interacción social del niño, así como el impacto sobre el estado emocional y psicosocial de los familiares24.
Tratamiento integralLa protocolización sobre cuándo y cómo tratar un HI es compleja. No todos los hemangiomas de igual tamaño y localización experimentan la misma evolución clínica, y el impacto psicológico del HI en el niño y la familia no es extrapolable entre pacientes con el mismo tumor.
Aun así, existen indicaciones absolutas de tratamiento de los HI: 1) HI potencialmente mortales o que ponen en peligro la capacidad funcional; 2) HI ulcerados con dolor y/o ausencia de respuesta a las medidas básicas de cuidado de heridas, y 3) HI con riesgo de cicatrices permanentes o desfiguración.
Hasta 2008, los corticoides orales fueron el tratamiento de elección para los HI complicados, a pesar de sus efectos secundarios a dosis altas y a la ausencia de respuesta al tratamiento en un tercio de los casos.
En la actualidad, el propranolol por vía oral se considera el tratamiento de elección de los HI ya que es el único aprobado para dicha indicación.
La eficacia del propranolol es superior a la de cualquier otro tratamiento, desde el inicio y en cualquier localización corporal25. Además se ha descrito su efecto positivo en la calidad de vida de los pacientes con HI y en la de sus familias26. La dosis aprobada de propranolol es de 3mg/kg, acreditando una mayor eficacia que la de 1mg/kg, sin un aumento de toxicidad observable25. No se conocen las dosis tóxicas exactas de propranolol, pero niños afectados de miocardiopatía hipertrófica han sido tratados con dosis de 5mg/kg/día, con escasa incidencia de complicaciones27. La ingesta de dosis 2 o 3 veces superiores a la terapéutica sí puede suponer una amenaza para la vida de los pacientes28.
Existe cierta controversia acerca de la administración de propranolol en pacientes con síndrome de PHACES con alteración de los grandes vasos intracraneales y coartación de aorta por el riesgo potencial de isquemia cerebral que podría provocar una hipotensión. Por ello, en estos pacientes debe realizarse al menos un estudio cardiológico e, idealmente, una angiorresonancia cerebral antes de iniciar tratamiento con propranolol. En aquellos casos en que se desaconseje la angiorresonancia con sedación, se recomienda iniciar el tratamiento con propranolol a dosis más bajas y con escalado más lento.
Otros fármacos betabloqueantes han mostrado también eficacia (acebutolol29, atenolol30 y nadolol31), aunque sin ventajas significativas sobre el propranolol.
Los efectos secundarios de los betabloqueantes son ampliamente conocidos28: 1) cardiovasculares (bradicardia e hipotensión); 2) bronquiales (reducción del tono broncodilatador e incremento de la resistencia de las vías aéreas de mediano calibre); 3) metabólicos32 (hipoglucemia); 4) renales (reducción del filtrado glomerular), y 5) sistema nervioso central30,33 (posible afectación de la memoria, la calidad del sueño, el estado de ánimo y las funciones psicomotoras).
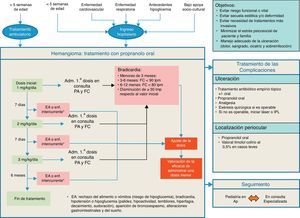
Las recomendaciones realizadas por el panel de especialistas en cuanto al tratamiento de los HI y el uso de propranolol y la prevención de sus efectos adversos se recogen en la tabla 4. Asimismo, se presenta un algoritmo de actuación para el abordaje terapéutico de los HI (fig. 2).
Recomendaciones en el tratamiento de los hemangiomas infantiles
| Inicio del tratamiento (entre las 5 semanas-5 meses de vida [edad corregida para los prematuros])a Realizar una historia y exploración clínica para descartar problemas cardiovasculares y respiratorios Realizar ECG si: FC es < 100 lpm en menores de 3 meses, < 90 lpm entre los 3 y los 6 meses y < 80 lpm entre los 6 y los 12 meses Existe historia familiar de cardiopatía congénita o arritmias, historia materna de conectivopatía, historia personal de arritmia o si esta se detecta durante la exploración. No se considera necesaria la evaluación exhaustiva cardiológica en pacientes asintomáticos sin patología cardíaca previa |
| Propranolol El tratamiento con propranolol debe iniciarse a dosis de 1 mg/kg/día administrado en 2 dosis. Se incrementa semanalmente a razón de 1 mg/kg/día hasta alcanzar la dosis recomendada en 3 semanas La dosis terapéutica de propranolol recomendada es 3 mg/kg/día, administrada en 2 dosis separadas de 1,5 mg/kg, por la mañana y a última hora de la tarde, con un intervalo mínimo de 9 h entre ambas30 Debe administrarse durante un periodo de 6 meses, realizando seguimiento clínico y reajuste de dosis por peso, al menos cada mes. En algunos pacientes, el tratamiento debe prolongarse más allá de los 12 meses Debe administrarse durante la alimentación del niño o inmediatamente después, para evitar el riesgo de hipoglucemia Administrar en la boca utilizando una jeringa dosificadora para uso oral o diluir en una pequeña cantidad de leche infantil o zumo (5 ml en niños < 5 kg de peso y 15 ml en niños de más de 5 kg de peso). Se puede administrar en el biberón con leche, si bien es aconsejable no ponerlo en el biberón lleno. Utilizar la mezcla en las 2 h siguientes En caso de vómito, no querer comer o no tomar todo el medicamento, omitir la dosis y no administrar otra antes de la siguiente dosis programada La suspensión del tratamiento no precisa una disminución progresiva de la dosis y en caso de recaída de los síntomas, después de la suspensión del tratamiento, puede reiniciarse en las mismas condiciones Se considera prudente la observación ambulatoria tras la primera administración en cada cambio de dosis, monitorizando la PA y la FC preadministración y cada 60 min, hasta pasadas 2 h, con el fin de descartar complicaciones cardiovasculares Durante el tratamiento con propranolol debe evitarse periodos de ayuno prolongado, de manera que, en caso de ser necesario ayuno prequirúrgico o si la ingesta del lactante es inadecuada, debe suspenderse temporalmente el tratamiento. Evitar el ayuno del lactante tras la administración del fármaco No existe la necesidad de realizar glucemias capilares seriadas, salvo en pacientes diabéticos insulinodependientes. En el resto de los pacientes, sería suficiente la instrucción a los padres para reconocer precozmente los signos asociados a hipoglucemia |
ECG: electrocardiograma; FC: frecuencia cardíaca, lpm: latidos por minuto; PA: presión arterial.
Otro tratamiento sistémico efectivo en el tratamiento de los HI es el interferón alfa, aunque en lactantes puede provocar diplejía espástica34. El maleato de timolol, en forma tópica, se ha mostrado efectivo en lesiones superficiales35, sin presentar efectos secundarios significativos36. Los corticoides tópicos y el imiquimod al 5% también se han empleado de forma anecdótica. Por último, el platelet derived growth factor parece útil en el tratamiento tópico de HI ulcerados37, aunque podría asociarse a una mayor incidencia de cáncer.
El tratamiento con láser en los HI está indicado en 3 situaciones: en la fase proliferativa, aunque no como primera opción, en los HI ulcerados y como tratamiento de telangiectasias y alteraciones texturales residuales.
Las intervenciones quirúrgicas están fundamentalmente indicadas en el tratamiento de las secuelas, aunque gracias al propranolol las secuelas que necesitan corrección quirúrgica han disminuido considerablemente. La cirugía puede ser la primera opción de tratamiento en HI pedunculados, HI con ulceración dolorosa y persistente, compresión sobre el globo ocular y deformidad progresiva facial. Una vez se ha establecido la indicación quirúrgica, el niño debe ser intervenido idealmente antes de los 4 años de edad.
Finalmente, la repercusión psicológica de un hemangioma sobre el entorno familiar es significativa y puede requerir atención psicológica especializada. El tratamiento correcto de los HI puede evitar conductas de riesgo posteriores, como el aislamiento social, depresión o ansiedad.
Manejo multidisciplinario y papel del pediatra de Atención PrimariaEl pediatra de Atención Primaria (PAP) es el profesional médico más cercano y accesible al niño y su familia. Su papel es fundamental en el diagnóstico y en la derivación precoz al dermatólogo de los HI susceptibles de tratamiento, el cual debe realizarse idealmente antes de los 3 meses de vida (tabla 5). Los circuitos de derivación entre los 2 niveles asistenciales deben ser ágiles y los tiempos de espera cortos, de manera que no se demore más de 15-21 días. En este sentido, la utilización compartida de recursos virtuales (telemedicina con control evolutivo fotográfico) puede facilitar mucho la derivación de pacientes y el seguimiento del tratamiento.
Motivos de derivación del pediatra de atención primaria
| Tipo de HI | Motivo de derivación a dermatología |
|---|---|
| Faciales segmentarios grandes | Riesgo de asociaciones |
| Con afectación de la punta de la nariz, pabellón auricular, glabela y zona central de la cara en general | Compromiso estético |
| Periorbitales y retrobulbares | Compromiso visual |
| Labiales y periorales | Dificultades en la alimentación y propensión a la ulceración y a producir deformidades permanentes |
| Zona lumbosacra | Riesgo de asociaciones |
| Perineo, axila, cuello | Riesgo de ulceración |
| Multifocales con 5 o más lesiones | Riesgo de afectación hepática o visceral |
| Hemangioma infantil ulcerado | Tratamiento de la ulceración y del dolor |
| Superficiales muy elevados con borde vertical abrupto y pedunculados | Riesgo de deformidad permanente |
El tratamiento con propranolol puede iniciarse de forma ambulatoria, siempre y cuando se disponga de los medios necesarios para la resolución de posibles complicaciones. El dermatólogo puede decidir, de acuerdo con el PAP, que el inicio de tratamiento y los incrementos de dosis se realicen en la consulta del PAP.
El seguimiento de los pacientes que reciben tratamiento oral con propranolol debe hacerse en Atención Primaria, por lo que el PAP deberá conocer los aspectos relevantes del tratamiento: dosis, duración, posibles efectos secundarios y qué hacer ante ellos y ante los cuadros intercurrentes que puedan afectar al tratamiento.
El PAP debe informar a los padres y cuidadores sobre los posibles efectos adversos del propranolol que pueden surgir. Dicha información debe transmitirse de una forma sencilla y comprensible, y puede reforzarse mediante el uso de materiales escritos.
La formación de equipos multidisciplinarios hospitalarios para la atención de las anomalías vasculares es importante en el manejo de los pacientes con HI, en particular para el diagnóstico y el manejo de los hemangiomas complejos38. El equipo multidisciplinar puede estar formado por diferentes especialistas: dermatólogos, pediatras, cardiólogos, anatomopatólogos, radiólogos, cirujanos, otorrinolaringólogos, oftalmólogos, neurólogos y neurocirujanos. Aunque no existe una guía universalmente aceptada del manejo intrahospitalario de los HI19,39, se sugiere seguir los siguientes pasos:
- 1.
Confirmación del diagnóstico clínico, habitualmente en el servicio de dermatología.
- 2.
Valoración del riesgo de compromiso funcional, compromiso estético, anomalías asociadas, complicaciones y secuelas (tabla 5).
- 3.
Consultas a especialistas pediátricos: otorrinolaringólogo en los HI de la zona de la barba; cirujano en HI pediculados y para la valoración de secuelas estéticas; radiólogo, neurólogo y neurocirujano en sospechas de síndrome PHACES o LUMBAR; oftalmólogo en HI con riesgo de compromiso visual.
- 4.
Decisión terapéutica de acuerdo con los especialistas implicados. Inicio en hospital de día o ingreso hospitalario en los casos que proceda. Consulta con Pediatría o Cardiología si surgen efectos secundarios.
- 5.
Programación de régimen de controles clínicos en consultas externas de dermatología y especialidades implicadas. Registro fotográfico para control de la evolución y respuesta terapéutica.
- 6.
Reuniones periódicas del equipo multidisciplinario para la discusión de los casos complejos de HI.
La toma de decisiones terapéuticas en los HI debe realizarse sobre la base de la evidencia científica disponible y la experiencia de los especialistas. Por ello, el Consenso español sobre el HI y las recomendaciones y los algoritmos recogidos que contiene suponen una herramienta útil en el manejo adecuado de los pacientes con HI.
FinanciaciónEl desarrollo del consenso, así como la elaboración de este artículo, se han realizado bajo la financiación de Laboratorios Pierre Fabre Ibérica S.A
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.