Los recién nacidos pretérmino y de muy bajo peso presentan mayor riesgo de enterocolitis necrosante (ENC) dado que su colonización a nivel intestinal se produce más tardíamente y es diferente respecto de los recién nacidos a término, además de presentar con mayor frecuencia otros factores favorecedores como isquemia intestinal. Se cree que los probióticos pueden modificar la microbiota y la respuesta inmunitaria de los recién nacidos, disminuyendo la incidencia de ENC.
ObjetivoRevisar los estudios realizados con diferentes probióticos y comparar diferentes combinaciones de estos para ver si es beneficiosa su administración de forma rutinaria en recién nacidos pretérmino de menos de 1.500g para evitar la ENC, reducir la sepsis tardía y la mortalidad.
Material y métodosSe llevó a cabo una revisión sistemática entre enero de 1980 y marzo del 2014, en MEDLINE, EMBASE y Cochrane Central Register of Controlled Trials. Se seleccionaron los estudios clínicos con recién nacidos prematuros de < 1.500g y/o < 34 semanas, descartando aquellos con puntuaciones de Jadad menores de 4.
ResultadosSe seleccionaron 9 estudios, de 24 preseleccionados, con un total de 3.521 recién nacidos. Se observó que los probióticos reducen la incidencia de ENC (RR 0,39; IC del 95%, 0,26-0,57) y la mortalidad (RR 0,70; IC del 95%, 0,52-0,93). No se detectaron diferencias significativas con el placebo en la disminución de sepsis tardía (RR 0,91; IC del 95%, 0,78-1,96). Finalmente, cuando se analizan las distintas cepas, la combinación de 2 probióticos (Lactobacillus acidophilus con Bifidobacterium bifidum) demostró reducir la mortalidad de forma significativa comparada con otras combinaciones de probióticos (RR 0,32; IC del 95%, 0,15-0,66, NNT 20; IC del 95%, 12-50).
ConclusionesLos probióticos son beneficiosos en cuanto a la prevención de ENC y reducen la mortalidad en pretérmino de menos de 1.500g. Además, la combinación de 2 probióticos (Lactobacillus acidophilus con Bifidobacterium bifidum) presenta mayor beneficio. Dada la diferencia de composición de probióticos, son necesarios estudios aleatorizados comparando diferentes combinaciones de probióticos.
Necrotising enterocolitis (NEC) is one of the most common and serious acquired bowel diseases a premature newborn can face. This meta-analysis was performed comparing different probiotic mixtures to ascertain their benefits as a routine tool for preventing necrotising enterocolitis and reducing late-onset sepsis and mortality in premature neonates of less than 1500g.
Material and methodsA systematic review of randomised controlled trials, between January 1980 and March 2014, on MEDLINE, the Cochrane Central Register of Controlled Trials, together with EMBASE, was carried out. Studies with infants <1500g or <34 weeks were selected, discarding those with Jadad scores lower than 4.
Results9 studies were selected for further investigation, pooling a total of 3521 newborns. Probiotics were found to reduce the NEC incidence (RR 0.39; 95%CI: 0.26-0.57) and mortality (RR 0.70; 95%CI: 0.52-0.93), with no difference to placebo regarding late-onset sepsis (RR 0.91; 95%CI: 0.78-1.06). Finally, when analysing the different strands, the use of a 2-probiotic combination (Lactobacillus acidophilus with Bifidobacterium bifidum) proved to be statistically significant in reducing all-cause mortality when compared to other probiotic combinations (RR 0.32; 95%CI: 0.15-0.66, NNT 20; 95%CI: 12-50).
ConclusionsProbiotics are a beneficial tool in the prevention of NEC and mortality in preterm neonates. Moreover, the combination of 2 probiotics (Lactobacillus acidophilus with Bifidobacterium bifidum) seems to produce the greatest benefits. However, due to the differences in probiotic components and administration, it would be wise to perform a randomised controlled trial comparing different probiotic mixtures.
La enterocolitis necrosante (ENC) es una de las patologías intestinales adquiridas más comunes y graves a las que se puede enfrentar un recién nacido. Aunque su etiología continúa siendo desconocida, se sospecha que es resultado de una combinación de necrosis vascular, sobrecrecimiento bacteriano y lesiones en la pared intestinal inmadura. Se supone que al daño isquémico o tóxico de la pared intestinal le sigue un sobrecrecimiento bacteriano cuyo sustrato proviene de la alimentación enteral, especialmente de bacterias que generan gases como el metano y el hidrógeno, produciendo gas intramural (neumatosis intestinal), que a su vez conduce a necrosis y gangrena intestinal y, finalmente, a la perforación intestinal con peritonitis. En los últimos años ha ido asimismo ganando aceptación la teoría de que el sistema inmunitario del huésped también desempeña un papel fisiopatológico importante en el desarrollo de la ECN1.
La ECN afecta predominantemente a recién nacidos pretérmino, con el 70-85% de los casos presentándose en recién nacidos de muy bajo peso (< 1.500g) o con edades gestacionales por debajo de 32 semanas, mientras que solo un 10-25% de los casos se dan en recién nacidos a término o pretérmino tardíos. Cuanto menor es la edad gestacional, mayor es el riesgo de ECN. Un estudio realizado en una población de 11.072 recién nacidos de muy bajo peso (RNMBP) por la Red de Investigación Neonatal (Neonatal Research Network del National Institute of Child Health) establece una incidencia global de ECN del 7% para el período 1999-20012. Otro estudio realizado entre los años 2003 y 2007 encuentra una prevalencia de ECN del 11% en recién nacidos muy pretérmino de entre 22 y 28 semanas de edad posmenstrual con pesos al nacer de 401 a 1.500g3. La mortalidad global de la ECN es aproximadamente del 20-40%, disparándose al 90-100% en los casos más graves, que representan el 2-5% del total de los ingresos en unidades de cuidados intensivos neonatales (UCIN)4. Además, entre el 27 y el 63% de los lactantes afectados acaban siendo sometidos a cirugía5 y un tercio teniendo perforaciones intestinales, cuya complicación más común es el síndrome de intestino corto.
Los probióticos se pueden definir como microorganismos vivos que cuando se administran en cantidades adecuadas confieren un beneficio a la salud del huésped (OMS/FAO 2001). Los de uso más extendido pertenecen a los géneros Lactobacillus y Bifidobacterium, y Lactobacillus rhamnosus (L. rhamnosus) GG y Bifidobacterium lactis (B. lactis) son las cepas cuyo uso en humanos tiene más apoyo científico. Si bien no se conoce aún el origen de la microbiota humana, es importante reseñar que las diferencias posnatales dependen del tipo de parto, tipo de alimentación durante la gestación y de la microbiota materna6. Los lactantes sanos que reciben lactancia materna tienen una mayor cantidad de bifidobacterias, mientras que los que reciben lactancia artificial tienden a presentar una variedad mayor de microorganismos, como bifidobacterias, bacteroides, enterobacterias, estreptococos y Clostridium spp. La microbiota humana no se estabiliza hasta los 2 o 3 años de edad y aun entonces puede presentar modificaciones posteriores debido a la dieta, las enfermedades, el uso de antibióticos y el proceso de envejecimiento. En los últimos años, han aumentado los estudios y el uso en la práctica clínica de los probióticos. Algunos ejemplos de ello son su uso para la mejora de la función intestinal en la fibrosis quística, la reducción del sobrecrecimiento bacteriano7 o la reducción de la duración de la gastroenteritis aguda8.
Los RNMBP con riesgo aumentado de ECN tienen una colonización intestinal bacteriana diferente y la colonización bacteriana empieza más tarde que en recién nacidos a término normales9. Se piensa que los probióticos pueden modificar la microbiota y la respuesta inmunitaria del recién nacido, reduciendo el riesgo de ECN a través de varios mecanismos: competición directa por nutrientes y prebióticos, transformación de ciertos elementos presentes en el intestino en sustancias inhibitorias, producción de factores de crecimiento y vitaminas que promueven una microbiota sana, síntesis de bacteriocinas, competición por sitios de adhesión, incremento de la producción de IgA, incremento de la respuesta inmunitaria y reducción de la inflamación por la estimulación de linfocitos reguladores mediante la interleucina-10 y el factor de crecimiento transformante beta β10-12. A pesar de sus posibles beneficios, este tipo de intervenciones se vienen retrasando debido al riesgo teórico de sepsis bacteriana que podría suceder en RNMBP o recién nacidos pretérmino, especialmente en los de extremado bajo peso (< 1.000g). No obstante, hay pocos datos que apoyen esta preocupación. Además, los recién nacidos que ingresan en una UCIN son sometidos a un amplio abanico de procedimientos que podrían alterar su microbiota: uso de antibióticos, modificaciones en la dieta, cateterización, etc.
El uso de probióticos ha sido analizado y estudiado por diversas sociedades científicas. Un ejemplo sería la Sociedad Española de Neonatología, que ofrece las siguientes recomendaciones13:
- -
En situaciones con alta incidencia local de enterocolitis se puede recomendar la suplementación con probióticos. Grado 1+.
- -
El uso de probióticos debería considerarse en el cuidado del prematuro ≤ 32 semanas de gestación y/o < 1.500g, incluidos los menores de 1.000g. Punto de buena práctica.
- -
El uso de probióticos implica una estrecha monitorización. Punto de buena práctica.
- -
Las evidencias existentes hacen que se prefiera el uso de una combinación de especies de Bifidobacterium y Lactobacillus, ya que disminuyen la incidencia de enterocolitis, si bien se debe plantear cuál o cuáles son los probióticos más adecuados para cada situación, su dosis y la duración óptima de su administración. Punto de buena práctica.
- -
Iniciar lo antes posible su administración y mantenerla al menos 6 semanas o hasta el alta. Punto de buena práctica.
- -
No deberían administrarse probióticos en presencia de enterocolitis necrosante o patología intestinal. Punto de buena práctica.
Hasta la fecha, se han llevado a cabo pocos estudios comparando los efectos de cepas probióticas específicas, por separado o en combinación, en la ECN, la sepsis tardía y la mortalidad. El objetivo de este estudio es comparar diferentes mezclas de probióticos para la prevención de la ENC y la reducción de la incidencia de sepsis tardía y la mortalidad en recién nacidos pretérmino de menos de 1.500g.
MétodosBúsqueda de estudiosCon el fin de encontrar el máximo número posible de estudios asociando el uso de probióticos a la prevención de ECN, se llevó a cabo una búsqueda minuciosa de MEDLINE, el Registro Central Cochrane de Ensayos Controlados, y EMBASE. La búsqueda en la base de datos MEDLINE se llevó a cabo a través de PubMed (www.ncbi.nlm.nih.gov/pubmed) utilizando los descriptores MeSH «neonate», «infant», «newborn», «probiotic» y «enterocolitis, necrotising». La búsqueda en EMBASE se realizó con el mismo método. Se tuvieron en consideración estudios realizados entre enero de 1980 y marzo del 2014.
También se efectuó una búsqueda manual de varios estudios y revisiones sistemáticas relevantes.
Selección de estudiosDe entre todos los estudios disponibles se seleccionaron aquellos ensayos clínicos controlados aleatorizados que incluían resultados de ECN y recién nacidos de muy bajo peso (< 1.500g) o de menos de 34 semanas de edad gestacional. Además, se descartaron los estudios que no proveían puntuaciones en la escala de evaluación de la calidad metodológica de Jadad, de 4 o más o sin aleatorización ciega (tabla 1). Finalmente, de los estudios restantes se seleccionaron aquellos que tenían un grupo de control de recién nacidos no tratados con probióticos, y uno de recién nacidos tratados con probióticos bacterianos mezclados con leche materna, donada o artificial.
Escala de Jadad
| Ítem | Características | Puntuación |
|---|---|---|
| Aleatorización | Descrito como aleatorizado | 1 punto |
| Aleatorización correcta | 1 punto más | |
| Aleatorización incorrecta | 1 punto menos | |
| Doble ciego | Descrito como doble ciego | 1 punto |
| Aleatorización correcta | 1 punto más | |
| Aleatorización incorrecta | 1 punto menos | |
| Pérdidas de seguimiento y abandonos | Se presentan las razones para las pérdidas | 1 punto |
Para reducir el riesgo de sesgo se examinaron todos los estudios empleando la escala de Jadad junto con los métodos estándar de la Cochrane Collaboration y del Neonatal Review Group. Se tuvieron en cuenta la información relativa al método de aleatorización, el enmascaramiento y la presentación de todos los resultados, así como las pérdidas y abandonos. Cuando faltó información, se extrajo de metaanálisis anteriores o se contactó con los autores.
Análisis estadístico y medida del efecto del tratamientoTodos los datos se analizaron mediante protocolos estandarizados de metaanálisis. Para las variables resultado dicotómicas se calcularon el riesgo relativo (RR) y el número necesario a tratar (NNT), junto con sus intervalos de confianza (IC) del 95%. Para variables resultado continuas, se calcularon la diferencia mediana y la desviación estándar. La gravedad de la ECN se clasificó de acuerdo con los criterios modificados de Bell14. Solo se consideró la ECN grave (estadios ii y iii) en el análisis. Se consideró sepsis la positividad de cultivos de muestras de sangre o líquido cefalorraquídeo tomadas después de los 5 días de edad.
En la comparación de los efectos de las distintas cepas probióticas se calcularon inferencias para 1.000 neonatos por grupo y se efectuó el contraste usando la prueba de la chi al cuadrado, estimándose también los IC del 95%.
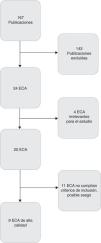
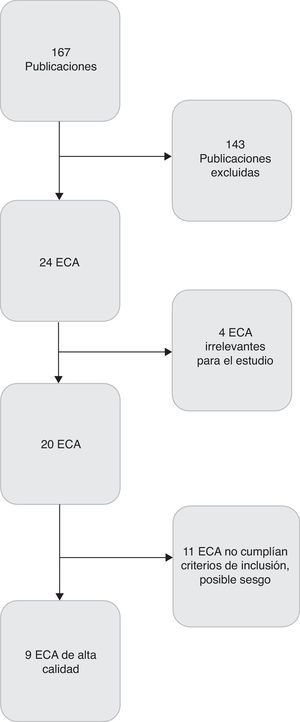
ResultadosSe seleccionó un total de 24 publicaciones para estudio adicional, de las que se eligieron 9 por su alta calidad y reducido riesgo de sesgo (fig. 1). Cabe mencionar la existencia de gran variabilidad en los ensayos clínicos en cuanto a sus criterios de inclusión, riesgo de ECN, tamaño muestral y dosis, tipo y duración de los probióticos administrados. Las características de estos ensayos se resumen en la tabla 2.
Características de los estudios seleccionados para el metaanálisis
| Ensayo | Peso al nacer y edad gestacional | Agentes probióticos | Dosificación y duración | Tipo de lactancia | Variable resultado principal |
|---|---|---|---|---|---|
| Dani et al., 200215 | < 1.500 g | L. rhamnosus GG | 6×109 UFC/24 h hasta el alta | Leche materna, donada o artificial | ITU, sepsis, ECN |
| Lin et al., 200516 | < 1.500 g | L. acidophilus y B. infantis | 125 mg/kg 2 veces al día | Leche materna o donada | ECN, muerte |
| Lin et al., 200817 | < 34 semanas y < 1.500 g | L. acidophilus y B. bifidum | 2×109 UFC/24 h durante 6 semanas | Leche materna o artificial | ECN, muerte |
| Manzoni et al., 200918 | < 1.500 g | L. rhamnosus GG | 6×109 UFC/24 h durante 4 semanas | Leche materna, donada o artificial | Sepsis tardía |
| Rougé et al., 200919 | < 32 semanas y < 1.500 g | L. rhamnosus GG y B. longum | 1×109 UFC/24 h hasta el alta | Leche materna, donada o artificial | Nutrición enteral en el día 14 |
| Samanta et al., 200920 | < 34 semanas y < 1.500 g | B. infantis, B. bifidum, L. acidophilus, B. longum | 2,5×109 UFC/12 h hasta el alta | Leche materna | ECN, muerte, sepsis |
| Sari et al., 201021 | < 33 semanas y < 1.500 g | L. sporogenes | 3,5×108 UFC/24 h hasta el alta | Leche materna o artificial | ECN, muerte |
| Bragard et al., 201122 | < 1.500 g | L. casei y B. breve | 3,5×107–3,5×109 UFC/24 h hasta que el lactante tuvo 30 días de edad | Leche materna, donada o artificial | ECN |
| Jacobs et al., 201323 | < 32 semanas y < 1.500 g | B. infantis, S. thermophilus y B. lactis | 1×109 UFC/24 h hasta el alta | Leche materna o artificial | Sepsis tardía |
Los 9 estudios incluían datos de ECN grave. Sumaban un total de 3.521 recién nacidos divididos en 2 grupos: el grupo probiótico y el grupo de control. El grupo probiótico contaba con un total de 1.756 neonatos, mientras el de control contaba con un total de 1.765 neonatos. Hubo una reducción estadísticamente significativa en el riesgo de desarrollar ECN en el grupo probiótico comparado con el de control (RR 0,39; IC del 95%, 0,26-0,57). El número necesario de recién nacidos a tratar con probióticos para prevenir un caso de ECN fue 33 (IC del 95%, 23-54) (tabla 3).
Probiótico vs. control, ECN grave (estadio ii-iii) en recién nacidos < 1.500g
| Estudios | ENC probiótico | ECN control | Riesgo relativo (IC del 95%) |
|---|---|---|---|
| Dani et al., 2002 | 4/295 | 8/290 | 0,49 (0,15-1,61) |
| Lin et al., 2005 | 2/180 | 10/187 | 0,21 (0,05-0,94) |
| Lin et al., 2008 | 4/217 | 14/217 | 0,29 (0,10-0,85) |
| Manzoni et al., 2009 | 0/151 | 3/153 | 0,05 (0,00-0,90) |
| Rougé et al., 2009 | 2/45 | 1/49 | 2,18 (0,2-23,21) |
| Samanta et al., 2009 | 5/91 | 15/95 | 0,34 (0,13-0,92) |
| Sari et al., 2010 | 6/110 | 9/111 | 0,12 (0,01-2,19) |
| Braga et al., 2011 | 0/119 | 4/112 | 0,10 (0,01-1,92) |
| Jacobs et al., 2013 | 11/548 | 24/551 | 0,56 (0,31-0,99) |
| Global | 34/1.756 | 88/1.765 | 0,39 (0,26-0,57) |
| NNT | 33 (23-54) |
Para estudiar si la cepa probiótica influía en la reducción de la ECN, se analizaron datos de Dani et al. (2002) y Manzoni et al. (2009) en comparación con Lin et al. (2005), y de Lin et al. (2008) en comparación con Samanta et al. (2009) y Jacobs et al. (2013). Los 2 primeros utilizaron L. rhamnosus GG (Bivos®), mientras que los 2 siguientes utilizaron Lactobacillus acidophilus (L. acidophilus) en combinación con Bifidobacterium bifidum (B. bifidum) (Infloran®). Por último, en los últimos 2 estudios se emplearon 3 o más probióticos (Bifidobacterium infantis [B. infantis], Streptococcus thermophilus [S. thermophilus], B. lactis, B. bifidum, Bifidobacterium longum [B. longum] y L. acidophilus).
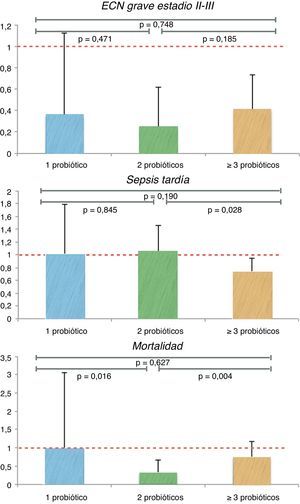
En el análisis de los 3 grupos había 446 recién nacidos tratados con Bivos®, 397 con Infloran® y 639 con 3 o más probióticos. El primer grupo, tratado con un solo probiótico, no mostró una reducción estadísticamente significativa en la incidencia de ECN, mientras que el segundo grupo, con 2 probióticos, y el tercero, con 3 o más probióticos, mostraron reducciones significativas en el RR (tabla 4). En cuanto al NNT, el número más bajo correspondió al segundo grupo (NNT 22; IC del 95%, 14-54), seguido por el tercer grupo (NNT 28; IC del 95%, 17-75). Una vez inferidos al mismo número de casos, y tras aplicar la prueba de la chi al cuadrado, no surgieron diferencias estadísticamente significativas entre ellos (fig. 2).
Diferencias asociadas a la cepa probiótica
| Probiótico | Control | Riesgo relativo (IC del 95%) | NNT (IC del 95%) | |
|---|---|---|---|---|
| ECN (estadio ii-iii) | ||||
| Un probiótico (Bivos®) | 4/446 | 11/443 | 0,36 (0,12-1’13) | – |
| 2 probióticos (Infloran®) | 6/397 | 24/404 | 0,26 (0,11-0,62) | 22 (14-54) |
| ≥ 3 probióticos | 16/639 | 39/646 | 0,41 (0,23-0,73) | 28 (17-75) |
| Mortalidad | ||||
| Un probiótico (Bivos®) | 6/446 | 6/443 | 0,99 (0,32-3,06) | – |
| 2 probióticos (Infloran®) | 9/397 | 29/404 | 0,32 (0,15-0,66) | 20 (12-50) |
| ≥ 3 probióticos | 31/639 | 42/646 | 0,74 (0,47-1,17) | – |
| Sepsis | ||||
| Un probiótico (Bivos®) | 21/446 | 21/443 | 0,99 (0,55-1,79) | – |
| 2 probióticos (Infloran®) | 62/397 | 60/404 | 1,05 (0,76-1,46) | – |
| ≥ 3 probióticos | 85/639 | 117/646 | 0,73 (0,57-0,95) | 21 (11-119) |
Todas las publicaciones incluyen datos referentes a investigaciones de sepsis por medio de distintos cultivos, como por ejemplo de sangre, líquido cefalorraquídeo y líquido peritoneal, o de secreciones respiratorias, si las había. Había 1.756 recién nacidos en el grupo probiótico y 1.765 en el grupo de control. No se detectó una diferencia significativa en el RR entre estos pacientes (RR 0,91; IC drl 95%, 0,78-1,06) (tabla 5). Se observó una ventaja discreta en el uso de 3 o más probióticos en comparación con otras combinaciones (RR 0,73; IC del 95%, 0,57-0,95). Estas diferencias se mantuvieron entre el grupo de 2 probióticos y el de 3 o más probióticos (p = 0,028) en la prueba de la chi al cuadrado (fig. 2).
Sepsis con cultivo positivo en probiótico vs control
| Estudios | Sepsis probiótico | Sepsis control | Riesgo relativo (IC del 95%) |
|---|---|---|---|
| Dani et al., 2002 | 14/295 | 12/290 | 1,15 (0,54-2,44) |
| Lin et al., 2005 | 22/180 | 36/187 | 0,63 (0,39-1,04) |
| Lin et al., 2008 | 40/217 | 24/217 | 1,67 (1,04-2,67) |
| Manzoni et al., 2009 | 7/151 | 9/153 | 0,27 (0,12-0,60) |
| Rougé et al., 2009 | 15/45 | 13/49 | 1,26 (0,67-2,34) |
| Samanta et al., 2009 | 13/91 | 28/95 | 0,48 (0,27-0,87) |
| Sari et al., 2010 | 29/110 | 26/111 | 1,13 (0,71-1,78) |
| Braga et al., 2011 | 40/119 | 42/112 | 0,90 (0,63-1,27) |
| Jacobs et al., 2013 | 72/548 | 89/551 | 0,81 (0,61-1,08) |
| Global | 252/1.756 | 279/1.765 | 0,91 (0,78-1,06) |
Los datos sobre mortalidad por todas las causas se registraron en 9 de los ensayos controlados aleatorizados, con un total de 3.521 lactantes divididos entre el grupo probiótico (n = 1.756) y el grupo de control (n = 1.765). También se registró una reducción estadísticamente significativa en la mortalidad por todas las causas (RR 0,70; IC del CI 95%, 0,52-0,93). El NNT para prevenir una muerte por cualquier causa fue 53 (IC del 95%, 30-238).
Al analizar la mortalidad asociada a la ECN, se observó que solo se informó sobre ella en 4 de los 9 ensayos. Se estudió a un total de 2.339 lactantes que se clasificaron en los grupos probiótico (n = 1.170) y de control (n = 1.169). En esta ocasión, la mortalidad asociada a la ECN fue menor en el grupo probiótico, una reducción que resultó estadísticamente significativa (RR 0,35; IC del 95%, 0,14-0,89) (tabla 6).
Mortalidad de probiótico vs. control
| Todas las causas | |||
| Estudios | Muertes probiótico | Muertes control | Riesgo relativo (IC del 95%) |
| Dani et al., 2002 | 0/295 | 2/290 | 0,20 (0,01-4,08) |
| Lin et al., 2005 | 7/180 | 20/187 | 0,36 (0,16-0,84) |
| Lin et al., 2008 | 2/217 | 9/217 | 0,22 (0,05-1,02) |
| Manzoni et al., 2009 | 6/151 | 4/153 | 0,56 (0,21-1,45) |
| Rougé et al., 2009 | 2/45 | 4/49 | 0,54 (0,10-2,83) |
| Samanta et al., 2009 | 4/91 | 14/95 | 0,30 (0,10-0,86) |
| Sari et al., 2010 | 3/110 | 3/111 | 0,76 (0,17-3,30) |
| Braga et al., 2011 | 26/119 | 27/112 | 0,91 (0,46-1,45) |
| Jacobs et al., 2013 | 27/548 | 28/551 | 0,97 (0,58-1,62) |
| Global | 77/1.756 | 111/1.765 | 0,70 (0,52-0,93) |
| NNT (IC del 95%) | 53 (30-238) | ||
| Mortalidad ECN | |||
| Dani et al., 2002 | 0/295 | 2/290 | 0,20 (0,01-2,75) |
| Lin et al., 2008 | 2/217 | 3/217 | 0,67 (0,11-3,95) |
| Sari et al., 2010 | 0/110 | 1/111 | 0,34 (0,01-8,17) |
| Jacobs et al., 2013 | 4/548 | 11/551 | 0,37 (0,12-1,14) |
| Global | 6/1.170 | 17/1.169 | 0,35 (0,14-0,89) |
| NNT (IC del 95%) | 106 (58-702) | ||
También se tuvieron en cuenta las diferencias asociadas a las cepas (tabla 4). El segundo grupo, con 2 probióticos, mostró una reducción en el RR de mortalidad que fue significativa en comparación con otros grupos (RR 0,32; IC del 95%, 0,15-0,66). El número de neonatos necesario a tratar para el grupo con Infloran® fue de 20 (IC del 95%, 12-50). Tras igualar los números de casos y aplicar la prueba de la chi al cuadrado, se observó una diferencia estadísticamente significativa entre los distintos grupos, entre 2 probióticos y un probiótico (p = 0,016) y también en comparación con 3 o más probióticos (p = 0,004) (fig. 2).
DiscusiónAunque se han publicado estudios sistemáticos y revisiones de calidad que apoyan el uso correcto de probióticos para la prevención de la ECN, el uso de probióticos a nivel mundial no está aún realmente implantado. Para proporcionar datos adicionales que apoyen el uso de probióticos como estrategia clínica para prevenir la ECN, el metaanálisis incluyó únicamente estudios de alta calidad sobre la base de los procesos de asignación oculta y enmascaramiento. Así, tras preseleccionar 24 estudios, finalmente solo se consideraron adecuados para el análisis 9 de ellos, ya que habían empleado métodos apropiados de asignación oculta y enmascaramiento y además proporcionaban datos sobre todos los factores que influyen en la incidencia de la ECN.
Por lo que respecta a los criterios de selección del estudio, se seleccionó a los recién nacidos de menos de 34 semanas o con pesos por debajo de 1.500g por su mayor riesgo de presentar ECN. Además, casi todos los estudios contemplaron estos mismos grupos de edad/peso por las razones mencionadas. Por otra parte, va a registrarse un incremento en el número de nacidos pretérmino, especialmente en países en los que la edad materna está aumentando y con un uso creciente de métodos de reproducción asistida. En estas circunstancias, parece importante prestar una atención especial al grupo con mayor riesgo de ECN, para el que sería muy importante encontrar un método preventivo. En los nacidos a término o los pretérmino tardíos la incidencia de ECN es significativamente menor, lo que quiere decir que los costes de prevenir un caso de ECN superarían con mucho a los posibles riesgos asociados con la ECN. Además, el uso profiláctico de probióticos no podría dar resultados positivos. Para evaluar el riesgo de sesgo se empleó la escala de Jadad, ya que está reconocida como un buen método para reducir el sesgo de enmascaramiento, en combinación con otros, y aumenta la calidad estadística de revisiones sistemáticas y metaanálisis24. Además de aplicar la escala de Jadad, se tuvieron en consideración los métodos estándar de la Cochrane Collaboration y del Neonatal Review Group, ya que esta institución goza de un amplio reconocimiento por su rigor científico y en investigación25.
Al considerar el efecto de los probióticos en la prevención de la ECN en la práctica, se pone de manifiesto la existencia de una reducción en la ECN grave, lo que coincide con muchos otros metaanálisis y estudios existentes5,26-31, así como una reducción de la mortalidad, sin que haya efecto alguno en la sepsis tardía: ni reducción ni aumento (la sepsis tardía es el riesgo más temido en la administración de este tipo de medidas profilácticas). Aunque el NNT para prevenir un caso de ECN es relativamente grande (33) y el número necesario para prevenir la muerte en neonatos es incluso mayor (53), estos han de contemplarse teniendo en consideración el aumento del número de nacimientos prematuros, lo elevado de los costes asociados a un episodio de ECN y el fácil manejo y bajo coste de los probióticos. En cualquier caso, dada la alta morbimortalidad de la ECN, ¿no sería poco ético privar a los neonatos de esta medida tan económica? En el futuro, sería preferible que los ensayos se centrasen en el efecto de distintas cepas de probióticos con objeto de identificar la mejor combinación posible para estos pacientes. En esta línea, en el metaanálisis aquí presentado se analizan y documentan las diferencias asociadas a las cepas. Aunque no se detectó la existencia de diferencias en la reducción de la incidencia de la ECN entre los distintos probióticos, sí se observó un beneficio claro en la reducción de la mortalidad con la administración de 2 probióticos en combinación (L. acidophilus y B. bifidum) comparada con la de 3 o más probióticos (B. infantis, S. thermophilus, B. lactis, B. bifidum, B. longum y L. acidophilus) o solamente uno (L. rhamnosus GG). Al centrar el análisis en la sepsis tardía, la combinación de 3 o más probióticos demostró ser beneficiosa en comparación con las demás opciones. Por consiguiente, tanto la combinación de 2 probióticos como la de 3 o más probióticos serían beneficiosas para los lactantes, la primera especialmente en relación con la mortalidad y la segunda a la sepsis tardía.
En cuanto a la dosis de probióticos, es importante alcanzar una masa óptima de probióticos para que sobrevivan y colonicen el intestino proliferando en cantidades adecuadas, de modo que proporcionen beneficios a la salud. La evidencia disponible indica que para lograrlo las dosis han de contener un mínimo de 106 a 107 unidades formadoras de colonias por cada gramo de producto32-34.
Finalmente, en lo que respecta a sus fortalezas y limitaciones, este es el primer metaanálisis que estudia los distintos compuestos y mezclas de probióticos disponibles y el primero en averiguar si hay una mezcla o compuesto cuya actuación sea superior en comparación con el resto. No obstante, ni la mezcla de probióticos ni la duración de su administración fueron siempre las mismas, lo que reduce la certeza de los resultados. Además, en algunos casos, aunque la asignación oculta y el enmascaramiento se realizaron correctamente, hubo una diferencia considerable entre ambos grupos en la edad al nacimiento, un factor fundamental en el riesgo de desarrollar ECN, lo que hace difícil determinar si la reducción en el RR se debía a los probióticos o simplemente a que la madurez difería entre ambos grupos. Otros estudios, aunque correctos, tenían un análisis de datos pobre y no aportaban información sobre el tipo de alimentación recibida por los lactantes, o algunos factores de riesgo o preventivos en relación con la ECN. Cabe asimismo destacar que ninguno de los estudios había evaluado el efecto de los probióticos en recién nacidos de extremado bajo peso (< 1.000g) en los que el riesgo de sepsis tardía podría ser mayor.
Para concluir, ha quedado demostrada la utilidad de los probióticos para prevenir la enterocolitis grave en neonatos prematuros, y los datos apuntan a la combinación de L. acidophilus y B. bifidum como la más eficaz para la reducción de mortalidad por todas las causas. Por lo tanto, los probióticos deberían administrarse de manera rutinaria a todos los neonatos de alto riesgo. En aquellos casos en los que se cuestione su seguridad, se podría continuar el uso de probióticos dentro de un marco de investigación que no requiera necesariamente estudios de comparación con placebo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.