En escasos trabajos previos, se ha comunicado que puede observarse la presencia de hipercalciuria en pacientes portadores de algunos tipos de CAKUT, como estenosis pieloureteral, reflujo vesicoureteral o quistes renales simples. Además, se ha descrito una prevalencia mayor de hipercalciuria y/o urolitiasis en los miembros de las familias de esos niños con algunos tipos de CAKUT, en comparación con la población en general. El presente estudio se llevó a cabo para averiguar si los niños con agenesia renal unilateral (ARU) tienen las características descritas anteriormente en otros tipos de CAKUT.
MétodosEn un estudio descriptivo y multicéntrico se determinó la prevalencia de hipercalciuria, hipocitraturia y urolitiasis en 67 niños (43 hombres y 24 mujeres) con ARU y sus familias.
ResultadosEn 26 niños (38,8%) se observaron las 2 anomalías metabólicas que favorecen la formación de cálculos renales distribuidos de la siguiente manera: hipercalciuria en 16, hipocitraturia en 9 y tanto hipercalciuria como hipocitraturia en uno. Ocho niños (11,9%) presentaron un cólico renal durante el tiempo total de seguimiento. Una historia familiar de litiasis urinaria se encontró en 42/67 de los niños (62,7%): en familiares de primer grado en 12 de ellos, en familiares de segundo grado en 15 y en ambos grados de familiares en los otros 15. En contraste, en el grupo de control histórico, solamente en el 28,1% de las familias al menos un miembro había tenido urolitiasis.
ConclusiónNuestros resultados muestran que la prevalencia de la hipercalciuria y/o hipocitraturia en pacientes pediátricos con ARU es mayor que en la población general. Asimismo, la prevalencia de urolitiasis en las familias de estos niños es también mayor que en la población general.
In few previous works, it has been reported that hypercalciuria is associated with some types of CAKUT, namely ureteropelvic junction obstruction, vesicoureteral reflux or simple renal cysts. In addition, one higher prevalence of hypercalciuria and/or urolithiasis has been described in their family members compared to the general population. This study was carried out to find out whether children with unilateral renal agenesis (URA) have these features previously described in other CAKUT types.
MethodsIn a descriptive and multicenter study we studied the prevalence of hypercalciuria, hypocitraturia and urolithiasis in 67 children (43 males and 24 females) with URA and their families.
ResultsThe two metabolic anomalies that promote stone formation were observed in 26 children (38.8%), distributed as follows: hypercalciuria in 16, hypocitraturia in 9, and both hypercalciuria and hypocitraturia in 1. Eight children (11.9%) suffered renal colic during follow-up. Familial history of urolithiasis was found in 42/67 children (62.7%): in 12 of the first-degree relatives, in 15 of the second degree relatives and in 15 patients both in the first-degree as in their second degree relatives. In contrast, in historic control group, only in 28.1% of families at least one member had urolithiasis.
ConclusionOur results show that the prevalence of hypercalciuria and/or hypocitraturia is greater in pediatric patients with URA than in the general population. Likewise, the prevalence of urolithiasis in the families of these children is also higher than that in the general population.
La asociación entre la urolitiasis y las malformaciones congénitas del riñón y del tracto urinario (CAKUT) se ha descrito en niños y adultos desde los años 201, teorizándose que la susceptibilidad a la litiasis resulta bien de la estasis urinaria2, bien de una reducción en el flujo urinario e infección del tracto urinario, siendo Proteus el microorganismo más frecuentemente involucrado3. De modo general, suele asumirse que la estasis urinaria desempeña un papel importante en la patogénesis de la nefrolitiasis asociada a anatomía renal distorsionada renal debido al retraso en el lavado de los cristales y al riesgo de infecciones del tracto urinario. La frecuencia de anomalías genitourinarias en niños con urolitiasis comunicada en la literatura oscila entre el 19,14 y el 29,8%5. Sin embargo, sigue sin conocerse con exactitud la relación patogénica entre la urolitiasis y las CAKUT.
Hemos descrito una mayor incidencia de hipercalciuria en niños con reflujo vesicoureteral (RVU)6, estenosis pieloureteral7 y quistes renales simples8 que en la población general, y una frecuencia mayor de antecedentes familiares de urolitiasis6-8. Esto implica que los niños de padres con urolitiasis, y/o con antecedentes familiares de urolitiasis serían más susceptibles a anomalías en el desarrollo del riñón. Estos niños heredan asimismo la hipercalciuria, que también puede favorecer la formación de cálculos renales.
Realizamos el presente estudio para averiguar si se da una prevalencia alta de hipercalciuria, hipocitraturia y/o antecedentes familiares de urolitiasis en niños con agenesia renal unilateral (ARU).
Sujetos y métodosPacientesSe llevó a cabo un estudio descriptivo multicéntrico que incluyó a 67 niños (43 niños y 24 niñas) con ARU con seguimiento en las unidades de nefrología pediátrica del Hospital Nuestra Señora de Candelaria en Tenerife (n=35), el Hospital Universitari Sant Joan de Reus en Tarragona (n=16), el Hospital de Fuenlabrada en Madrid (n=10) y el Hospital General Universitario Santa Lucía en Cartagena (n=8). La edad en el momento del estudio fue de 10,0±5,84 años (rango: 0,16-21,5). El seguimiento de los pacientes en cada hospital se realizó desde el momento de la confirmación posnatal mediante ecografía del diagnóstico intrauterino de ARU, es decir, desde las primeras semanas de vida.
La ARU estaba localizada en el lado izquierdo en 41 casos, y en el derecho en 26. La ARU se diagnosticó mediante ecografía renal y gammagrafía DMSA. La ARU iba asociada a RVU en 3 pacientes. No se encontró ninguna otra malformación del tracto urinario. Ningún paciente presentó signos morfológicos de displasia renal o nefrocalcinosis. Durante el seguimiento, 27 niños presentaron infecciones del tracto urinario. Ninguno de los pacientes presentaba infección en el momento en que se tomó la muestra aislada de orina. Ninguno de los pacientes fue diagnosticado de insuficiencia renal crónica. Ninguno de los niños mostró niveles elevados de creatinina plasmática, hipertensión o signos de acidosis tubular renal distal (ATRD). Se preguntó a los padres y/u otros familiares de los 67 niños sobre los antecedentes de urolitiasis. No encontramos antecedentes de consanguinidad en ninguna de las familias.
MétodosLa orina analizada correspondió a muestras recogidas no en ayunas en las que se determinaron los niveles de calcio, citrato y creatinina. De acuerdo con los criterios establecidos por la Asociación Española de Nefrología Pediátrica, en niños de 1 a 2 años se realizó el diagnóstico de hipercalciuria cuando el valor del cociente calcio/creatinina (UCa/UCr) en 2 muestras consecutivas aisladas de orina fue superior a 0,47mg/mg9. Según los resultados comunicados por So et al., entre 2 y 4 años de edad se consideró hipercalciuria cuando UCa/UCr superó los 0,28mg/mg10. En niños mayores de 4 años el diagnóstico de hipercalciuria se realizó cuando UCa/UCr excedió los 0,20mg/mg11, valor que corresponde al percentil 95 obtenido en un estudio previo llevado a cabo por uno de nuestros grupos en una muestra integrada por 100 niños sanos12. En base a los criterios de Stapleton y Kroovand, el diagnóstico de hipocitraturia se realizó cuando el valor del cociente citrato/creatinina fue inferior 400mg/g13. En pacientes mayores de 14 años, el criterio para el diagnóstico de hipocitraturia fue un cociente citrato/creatinina inferior a 250mg/g14.
Adicionalmente, se calculó el cociente UCa/UCr en base a muestras de orina aleatorias aisladas en los padres de 29/68 de los pacientes sin modificar sus dietas. En estos adultos se diagnosticó hipercalciuria cuando el UCa/UCr superó 0,2mg/mg, basándonos en el valor medio encontrado en nuestra población adulta en un estudio previo llevado a cabo por uno de nuestros grupos (UCa/UCr=0,12±0,04mg/mg)6.
Los resultados de las pruebas de concentración de orina y de la eliminación de albúmina en orina se recogieron de las historias clínicas. Los valores normales utilizados como referencia para la osmolalidad urinaria máxima15,16 y el cociente albúmina/creatinina17 se han publicado en estudios previos.
Se comparó la frecuencia de la presencia de antecedentes de urolitiasis en padres y otros familiares de nuestros pacientes con ARU con la de un grupo de control histórico realizado en uno de los hospitales que participaron en el estudio18.
Procedimientos analíticos y pruebas de la función renalEn los laboratorios de cada uno de los hospitales que participaron en el estudio se determinó la creatinina en orina mediante el método de la creatininasa, el calcio por medio de ensayo colorimétrico, el citrato urinario por el método de la citrato-liasa y la albúmina en orina mediante técnica nefelométrica (Array).
La capacidad de concentración renal se determinó tras la administración de 20μg de desmopresina intranasal o de 0,12mg (120μg) de liofilizado por vía oral de desmopresina (Melt) que se disuelve instantáneamente en la boca. Tras el vaciado de la vejiga se recogieron 3 muestras de orina en intervalos de 90 min. El valor de la prueba se estableció tomando la osmolalidad más alta de las obtenidas15,16. La osmolalidad urinaria fue determinada midiendo la depresión del punto de congelación en un osmómetro Osmostat (Menarini fabricante Arkray Factory, Inc. Osmo Station).
Métodos estadísticosSe utilizó la prueba de Kolmogorov-Smirnov para estudiar la distribución de las variables. Para variables con distribución normal, se utilizó la notación de la media ± desviación estándar. El resto de las variables cuantitativas se expresaron en términos de la mediana y el rango intercuartílico. El análisis estadístico básico se realizó con el paquete estadístico SPSS (SPSS V 19.0, SPSS Inc., EE. UU.).
Todos los procedimientos y protocolos seguidos en este estudio cumplen los requerimientos éticos, administrativos y de protección de datos impuestos por las unidades de pediatría de los hospitales participantes, que a su vez se han establecido en conformidad con la ley española. Se obtuvo el consentimiento informado de todos los padres.
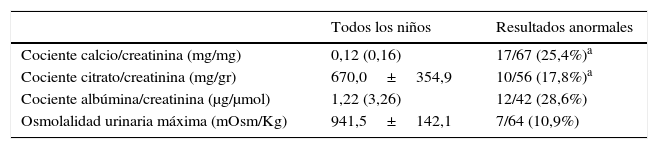
ResultadosSe observaron trastornos del metabolismo en 26 niños, hipercalciuria en 16 (11 niños y 5 niñas), hipocitraturia en 9 (5 niños y 4 niñas) y tanto hipercalciuria como hipocitraturia en un paciente. Por lo tanto, encontramos algún factor de riesgo de litiasis en el 38,8% de los niños con ARU. Ocho niños (11,9%) presentaron cólicos renales durante el seguimiento (4 con hipercalciuria y 4 con hipocitraturia).
La tabla 1 muestra los valores de los parámetros estudiados así como el porcentaje de niños con trastornos funcionales o metabólicos.
Parámetros metabólicos y funcionales. Resultados anormales
Se encontraron antecedentes familiares de urolitiasis en 42/67 niños (62,7%): en 12 pacientes en familiares de primer grado, en 15 en familiares de segundo grado y en 15 tanto en familiares de primer como de segundo grado.
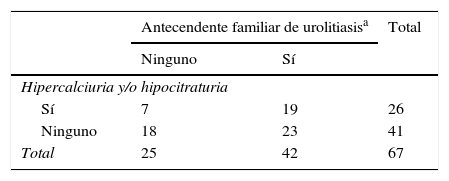
Se encontraron antecedentes familiares de urolitiasis concomitante con hipercalciuria y/o hipocitraturia en pacientes con ARU en 19 familias. En otras 23 familias solo se encontraron antecedentes familiares de urolitiasis. En otras 7 familias, los pacientes eran portadores de anomalías metabólicas con el potencial de causar cálculos renales. En resumen, hubo algún tipo de manifestación de hipercalciuria o urolitiasis en 49 familias (73,1%) de pacientes con ARU (tabla 2).
Relación entre antecedentes familiares de urolitiasis e hipercalciuria y/o hipocitraturia en pacientes con ARU
| Antecendente familiar de urolitiasisa | Total | ||
|---|---|---|---|
| Ninguno | Sí | ||
| Hipercalciuria y/o hipocitraturia | |||
| Sí | 7 | 19 | 26 |
| Ninguno | 18 | 23 | 41 |
| Total | 25 | 42 | 67 |
Hemos comunicado previamente la mayor prevalencia de hipercalciuria en pacientes pediátricos con RVU en comparación con la población general y propuesto que la urolitiasis en pacientes con RVU debe de ser de origen metabólico. También hemos comunicado que la hipercalciuria mostraba un patrón de herencia autosómica dominante, aunque es más probable que se herede de la madre6.
Recientemente, Madani et al. confirmaron que la frecuencia de la hipercalciuria es mayor en pacientes con RVU que en niños sanos, aunque no hicieron estudio familiar19.
La incidencia de urolitiasis en pacientes con estenosis de la unión pieloureteral (EPU) es del 16 al 44,7%20 y conlleva un riesgo 70 veces mayor de desarrollar cálculos renales21. En un sondeo previo, Husmann et al. comunicaron que el 76% de los pacientes con EPU y cálculos renales de origen distinto de la estruvita presentan anomalías metabólicas identificables22. La hipercalciuria es el trastorno metabólico descrito con más frecuencia en pacientes con EPU21,22, aunque también se han encontrado otros, como la hipocitraturia y la hiperoxaluria20. Estos estudios no aludieron al origen de la hipercalciuria o de otras anomalías metabólicas causantes de cálculos encontradas en pacientes con EPU.
Realizamos un estudio para averiguar si la prevalencia de hipercalciuria es mayor en niños con EPU y si los familiares de estos pacientes presentan hipercalciuria y/o urolitiasis7. Se detectó hipercalciuria en 17/27 niños (63%), en 15 de los cuales (88%) había antecedentes familiares de urolitiasis. En cuanto a los 10 niños sin hipercalciuria, 7 de ellos (70%) tenían antecedentes familiares de urolitiasis. El sexo no influyó en la prevalencia de la urolitiasis o la hipercalciuria. Resumiendo, en concordancia con la literatura existente21,22, nuestros resultados muestran que la prevalencia de la hipercalciuria es mayor en pacientes pediátricos con EPU que en la población general, y que las causas de esta diferencia son genéticas7.
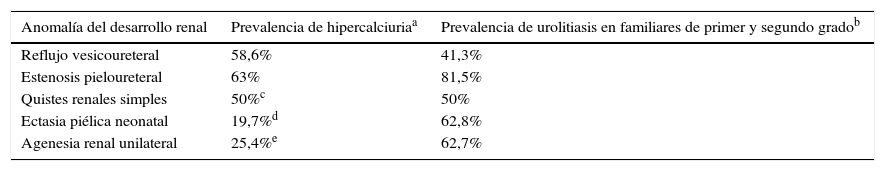
Más adelante obtuvimos resultados similares a los observados en casos de RVU y EPU en niños diagnosticados de quistes renales simples11 y ectasia piélica neonatal18. Por lo tanto, estas anomalías morfológicas asintomáticas (quistes renales y ectasia piélica neonatal), aunque carezcan de relevancia clínica, se comportan como malformaciones potencialmente más perjudiciales en cuanto a su asociación con la urolitiasis de origen genético (tabla 3).
Frecuencia de hipercalciuria en pacientes y urolitiasis en sus familiares en este trabajo y en trabajos previos que realizamos en niños con 4 tipos de anomalías del desarrollo renal (referencias 6-8, 18)
| Anomalía del desarrollo renal | Prevalencia de hipercalciuriaa | Prevalencia de urolitiasis en familiares de primer y segundo gradob |
|---|---|---|
| Reflujo vesicoureteral | 58,6% | 41,3% |
| Estenosis pieloureteral | 63% | 81,5% |
| Quistes renales simples | 50%c | 50% |
| Ectasia piélica neonatal | 19,7%d | 62,8% |
| Agenesia renal unilateral | 25,4%e | 62,7% |
Tomado de García-Nieto et al.6,7,8,18.
La ARU representa el 5% de los casos de CAKUT y se define como la ausencia congénita de parénquima renal resultante de un fallo en la organogénesis. Se considera que hay muchos factores implicados en la patogénesis de la agenesia renal, incluyendo mutaciones en varios genes importantes en el desarrollo del riñón23. En la mayoría de los pacientes es asintomática, por lo que se suele diagnosticar en base a hallazgos casuales en ecografías prenatales o evaluaciones de infecciones del tracto urinario. La ARU puede estar acompañada de otras CAKUT (32%) sin anomalías renales. El RVU es el hallazgo más frecuente (24% de los pacientes)24.
Al igual que en otras CAKUT, se ha observado la formación de cálculos renales en pacientes con ARU1,2,25. Por lo que nosotros sabemos, este estudio sería el primero que ha analizado alteraciones metabólicas causantes de cálculos en niños diagnosticados de ARU.
En nuestros pacientes, la frecuencia de la hipercalciuria fue del 25,4%. Hemos mencionado previamente la prevalencia de hipercalciuria en niños control de la isla de Tenerife (3,8%)12. La prevalencia de hipercalciuria descrita en otros países oscila entre el 0,626 y el 12,5%27. Si se añaden los pacientes con hipocitraturia, la frecuencia de alteraciones metabólicas causantes de urolitiasis en pacientes con ARU asciende al 38,8%. No sabemos de ningún estudio sobre la prevalencia de hipocitraturia realizado en una población pediátrica de control.
La prevalencia de urolitiasis en familiares de primer y segundo grado de los pacientes (62,7%) también superaba a la descrita en nuestra población general (28,1%)18. Los autores son conscientes de que el uso de una serie histórica, aunque reciente, para evaluar la prevalencia de urolitiasis es una de las limitaciones del estudio. La prevalencia de urolitiasis en la población adulta ha sido extensamente tratada en la literatura médica, pero no conocemos ningún trabajo que haya estudiado simultáneamente a familiares de primer y segundo grado.
También resulta difícil explicar por qué algunos pacientes fueron portadores de hipocitraturia y no de hipercalciuria. En nuestra experiencia, hemos visto que en muchos niños con hipercalciuria idiopática la eliminación urinaria de calcio se normaliza hacia la adolescencia, al tiempo que se reduce la citraturia. También hemos observado en algunas de las familias de niños con hipercalciuria idiopática que padres con urolitiasis tenían hipocitraturia y, por otro lado, una eliminación urinaria de calcio normal. Se trataría, aparentemente, de 2 caras de la misma moneda. Se ha descrito que la hipercalciuria idiopática puede asociarse a hipocitraturia en ausencia de ATRD28. Son necesarios estudios longitudinales para esclarecer esta cuestión.
La malformación renal para la que hay más evidencia de asociación con alteraciones metabólicas causantes de cálculos renales es la espongiosis medular renal (enfermedad de Lenarduzzi-Cacchi-Ricci). La alteración más común en esta patología es la hipercalciuria idiopática (88%)29. En otro estudio, 65 de los 97 pacientes (67%) presentaban al menos un factor de riesgo para la formación de cálculos, tal como hipercalciuria, hipocitraturia, hiperuricosuria o hiperoxaluria30. Recientemente, Fabris et al. estudiaron a las familias de 50 pacientes con espongiosis medular renal. Veintisiete probandos (54%) tenían en total 59 familiares de primer y segundo grado de ambos sexos con riñón en esponja o urolitiasis31. Los autores concluyeron que su estudio aporta evidencia contundente de que la agregación familiar es común en la espongiosis medular renal y de que esta tiene un patrón de herencia autosómico dominante, una penetrancia reducida y una expresión variable. La cuestión es si estos familiares tienen formas más suaves de riñón en esponja en algunos casos, o simplemente cálculos renales en otros, de manera similar a lo que hemos descrito en familiares de niños con otras CAKUT6,7.
Este tipo de herencia, descrito por Fabris et al. en el artículo anteriormente mencionado31 es similar al que hemos comunicado en nuestros pacientes con RVU6 y EPU7. En resumen, y según nuestra hipótesis, la espongiosis medular renal no sería una enfermedad renal en el sentido estricto del término, sino otra malformación caracterizada por la dilatación de los túbulos colectores que compartiría con otras CAKUT (RVU, EPU, quistes renales simples, ARU) una prevalencia mayor de hipercalciuria y/o urolitiasis en familiares transmitida genéticamente a sus descendientes portadores de una o varias entre muchas posibilidades de anomalías del desarrollo de tipo CAKUT. La hipótesis de que la espongiosis medular renal es una CAKUT ha sido sugerida previamente en 2 estudios32,33.
Por último, es importante recordar que la hipercalciuria idiopática también se ha descrito en otra malformación renal: el riñón en herradura34. También es curioso que en pacientes con una anomalía del desarrollo glomerular, la nefropatía de membrana basal delgada, también se han descrito hipercalciuria, hiperuricosuria y nefrolitiasis35. Incluso la nefropatía de membrana basal delgada se podría asociar a quistes renales simples36.
Durante muchos años, en la literatura médica se leía que el mecanismo fisiopatológico de la formación de cálculos en niños y adultos con malformaciones congénitas del tracto urinario eran la infección y la estasis urinaria. Los mecanismos han de ser necesariamente más complejos. En nuestra opinión, existe una conexión genética entre las anomalías en el desarrollo renal y la predisposición genética a la formación de cálculos renales que está por descubrirse en los próximos años. En ratas con formación de cálculos con hipercalciuria genética se ha descrito un número mayor de receptores de vitamina D (VDR) en huesos e intestino. En un estudio en humanos, Favus et al. demostraron que los monocitos periféricos en pacientes con hipercalciuria idiopática muestran un incremento de receptores de vitamina D37, es decir, lo mismo que se había observado en las ratas con hipercalciuria. Por lo tanto, la causa más probable de la hipercalciuria idiopática sería un incremento en la capacidad funcional de los complejos calcitriol-VDR38.
¿Está la vitamina D involucrada de alguna manera en el desarrollo intrauterino del riñón? En el año 2001, Wagner et al. demostraron que el producto del gen WT1 es un factor de transcripción que activa la expresión del gen VDR en células renales embrionarias humanas39. La expresión del gen WT1 es crítica para el desarrollo genitourinario. Se ha observado que la mutación homocigota de este gen en ratones causa agenesia renal, probablemente como resultado de la pérdida de células del blastema metanéfrico40. En humanos, mutaciones en el gen WT1,y el síndrome de Denys-Drash originan la agenesia renal. En este artículo, Wagner et al. exploraron el posible papel del sistema endocrino de la vitamina D en la regulación del crecimiento y diferenciación de las células renales durante el desarrollo, ya que regulación positiva del VDR por el factor de transcripción WT1 puede mediar la apoptosis de células renales embrionarias en respuesta al 1,25(OH)2D339. ¿Podría ser este el hilo de Ariadna que nos ayude a resolver el laberinto de la asociación entre los cálculos renales y las anomalías CAKUT?
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.