La enfermedad neumocócica invasora (ENI) puede requerir ingreso en la unidad de cuidados intensivos pediátricos (UCIP). El objetivo de este trabajo es analizar las características epidemiológicas, clínicas y microbiológicas asociadas a la ENI que predisponen el ingreso en la UCIP.
Material y métodosEstudio prospectivo de casos diagnosticados con ENI en tres hospitales pediátricos de Barcelona entre enero de 2012 y junio de 2016. Se analizaron las asociaciones entre el ingreso en la UCIP y las variables epidemiológicas, clínicas y microbiológicas.
ResultadosSe incluyeron 263 casos con ENI. El 19% (n = 50) requirió ingreso en la UCIP. El 100% (7) de los pacientes con shock séptico, 84,2% (16) con meningitis y 15,2% (23) con neumonía complicada ingresaron en la UCIP. Las complicaciones más frecuentes fueron pulmonares (35,2%) y neurológicas (39,5%). La razón entre ingreso y no ingreso en la UCIP fue 4,17 veces mayor en los sujetos con enfermedad de base. Los serotipos asociados al ingreso en la UCIP fueron el 19A (23% del total de este serotipo), el 14 (20%), el 3 (17%) y el serotipo 1 (12,5%).
ConclusionesLa ENI requiere ingreso en la UCIP en caso de shock séptico y meningitis, no así, de entrada, la neumonía complicada. El porcentaje de ingresos es mayor en los niños con enfermedad de base. El ingreso en la UCIP conlleva una estancia más prolongada, así como complicaciones durante la fase aguda y secuelas, sobre todo, neurológicas. Los serotipos de los pacientes que ingresaron en la UCIP fueron, predominantemente, serotipos vacunales.
Patients with invasive pneumococcal disease (IPD) may require admission into paediatric intensive care units (PICU). The aim of this study is to analyse the epidemiological, clinical, and microbiological characteristics associated with IPD that may require admission to the PICU.
Material and methodsA prospective study was conducted on cases of IPD diagnosed in three Paediatric Hospitals in Barcelona between January 2012 and June 2016. An analysis was made of the associations between the admission to PICU and the epidemiological, clinical, and microbiological variables.
ResultsA total of 263 cases with IPD were included, of which 19% (n = 50) required admission to PICU. Patients with septic shock (7; 100%), meningitis (16; 84.2%), and those with complicated pneumonia (23; 15.2%) were admitted to the PICU. The most frequent complications were pulmonary (35.2%) and neurological (39.5%). The ratio between admission and non-admission to PICU was 4.7 times higher in subjects with an underlying disease. The serotypes associated with PICU admission were 19A (23% of the total of this serotype), serotype 14 (20%), serotype 3 (17%), and serotype 1 (12.5%).
ConclusionsIPD required PICU admission in cases of septic shock and meningitis, and less so with complicated pneumonia. The percentage of admissions is greater in children with an underlying disease. Admission into the PICU involves a longer stay, complications during the acute phase, as well as sequelae, particularly neurological ones. The serotypes of the patients that were admitted to PICU were predominantly vaccine serotypes.
La enfermedad neumocócica invasora (ENI) todavía sigue siendo una causa importante de morbilidad y mortalidad en la infancia, incluso, después de la introducción de la vacuna antineumocócica conjugada en nuestro país1. La incidencia de ENI en menores de cinco años en nuestro entorno oscila entre 16,8 por 100.000 habitantes en 2012 y 12,3 en 20151,2.
En ocasiones, se requiere ingreso en la unidad de cuidados intensivos pediátricos (UCIP) debido a la gravedad del cuadro clínico. Algunas formas clínicas de la ENI son tributarias de ingreso en la UCIP desde su inicio, como son la sepsis o la meningitis, cuyo abordaje global se basa en la necesidad de monitorización y terapia intensiva que estas formas clínicas requieren una vez diagnosticadas. Otras formas de presentación, como la neumonía complicada, no siempre necesitan un ingreso en UCIP para su curación y podrían ser manejadas, de entrada, en un centro hospitalario que no disponga de UCIP3.
El objetivo de este trabajo es analizar las características epidemiológicas, microbiológicas y clínicas asociadas a la ENI que podría requerir ingreso en la UCIP.
MétodosDiseño del estudioSe realizó un estudio prospectivo en niños de dos a 59 meses de edad diagnosticados con ENI entre el 1 de enero de 2012 y el 30 de junio de 2016, los cuales fueron atendidos en tres hospitales pediátricos de Barcelona: Hospital Sant Joan de Déu, Hospital Materno-Infantil Vall d’Hebron y Hospital HM Nens, con una población de referencia estimada para los tres hospitales de 116.279 menores de cinco años (30,4% del total de Cataluña)2. Los dos primeros hospitales disponen de UCIP y representan los dos centros de UCIP de referencia, a pesar de existir más unidades de UCIP en Cataluña.
La ENI se definió como la presencia de hallazgos clínicos de infección junto con el aislamiento o la detección de ADN del gen LytA y un gen capsular adicional de Streptococcus pneumoniae por RT-PCR (reverse transcription polymerase chain reaction) en una muestra de territorio normalmente estéril.
Variables demográficas, clínicas y epidemiológicasPara cada caso se registraron las siguientes variables demográficas, clínicas y epidemiológicas: edad, sexo, fecha de nacimiento, fecha de inicio de los síntomas, fecha de hospitalización, forma clínica de ENI (meningitis, shock séptico, neumonía complicada y no complicada, bacteriemia oculta y otras menos frecuentes), complicaciones, ingreso en la UCIP y duración de la estancia, presencia de condiciones médicas de riesgo (anemia de células falciformes, asplenia congénita o adquirida, infección por virus de la inmunodeficiencia humana, implante coclear, inmunodeficiencia congénita grave que precisa tratamiento, enfermedad cardiaca crónica que requiere tratamiento médico o ha precisado cirugía, enfermedades pulmonares crónicas incluida el asma tratada con dosis altas de corticosteroides orales (metilprednisolona a dosis superior a 1 mg/kg/día durante más de 1 mes), fístula de líquido cefalorraquídeo, insuficiencia renal crónica incluido el síndrome nefrótico que precisa diálisis, tratamiento inmunosupresor o radioterapia en los últimos seis meses, trasplante de órgano sólido o de progenitores hematopoyéticos, y diabetes mellitus insulinodependiente), fecha y evolución al alta (alta sin secuelas, secuelas o muerte). Se consideró neumonía complicada ante la presencia de consolidación pulmonar con más de una de las siguientes características: derrame pleural > 10 mm, líquido pleural loculado, empiema paraneumónico, neumonía necrotizante o absceso pulmonar. Las secuelas se evaluaron a los seis meses del diagnóstico.
Identificación, serotipificación y clasificación de S. pneumoniaeLas cepas aisladas mediante cultivo fueron serotipificadas usando la reacción de Quellung o dot blot en el Laboratorio de Referencia de Neumococo, Centro Nacional de Microbiología, Majadahonda, Madrid. En los pacientes en quienes no pudo aislarse el neumococo por cultivo, se identificó por RT-PCR que puede determinar 43 serotipos o serogrupos diferentes por medio de la técnica MLST (multilocus sequence typing), reconocida internacionalmente.
Dado que la PCR no diferencia entre los serotipos 6A y 6C, 7F y 7A, 9V, 9A y 9N, y 19F, 19B y 19C, solo fueron considerados como serotipos vacunales los serotipos 6A, 7F, 9V y 19F, respectivamente, una vez confirmados por el Laboratorio de Referencia de Neumococo en Majadahonda, Madrid2.
La genotipificación de las muestras se realizó en el Laboratorio de Biología Molecular del Hospital Sant Joan de Déu mediante la técnica MSLT. La asignación de alelos y secuenciotipos se llevó a cabo con el software disponible en http://pubmlst.org/spneumoniae/. El análisis de los secuenciotipos y la asignación a un complejo clonal determinado se realizó con el programa eBURST.
Criterios de ingreso en la UCIPLos niños ingresados en la UCIP presentaban todas o algunas de las siguientes situaciones: ENI con inestabilidad hemodinámica grave sin mejora tras la administración de una o dos cargas de fluidos; diagnóstico de meningitis; aparición de síndrome de distrés respiratorio agudo definido como una PaO2/FiO2 < 200-250; necesidad de ventilación mecánica invasiva o no invasiva; signos de insuficiencia renal aguda (creatinina basal multiplicada por 2 o más en 12-24 horas); coagulación intravascular diseminada, y Glasgow < 83.
Vacunación antineumocócicaEl estado vacunal de cada paciente con ENI se obtuvo a partir del carnet vacunal, del registro del centro de salud o del centro privado donde el niño era atendido habitualmente, o de la historia clínica. Se consideró que un paciente estaba correctamente vacunado cuando había recibido todas las dosis de vacuna antineumocócica 13-valente (PCV13) para su edad, según las indicaciones de la ficha técnica4.
Análisis estadísticosSe analizó la posible asociación entre variables categóricas mediante el test de ?2 de Pearson o la prueba exacta de Fisher, y la de las variables continuas mediante la prueba t de Student. Para estimar la asociación entre las variables consideradas y el ingreso en UCIP se calcularon las odds ratio (OR) con sus intervalos de confianza de 95% (IC 95%). Los valores de p = 0,05 se consideraron estadísticamente significativos. Se asumió una distribución bilateral para todos los valores de p.
Comité de éticaEl estudio obtuvo el permiso del comité de ética de los tres centros participantes. Los familiares firmaban un documento en el que se exponía que entendían el estudio, aceptaban su participación y podrían declinar la misma en cualquier momento.
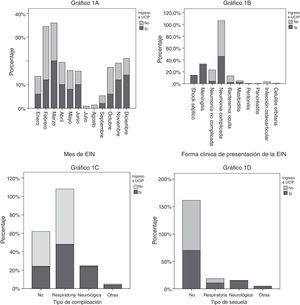
ResultadosEn el estudio se incluyeron 263 casos de ENI (155 niños y 108 niñas), con una edad media de 45 meses (desviación estándar: 37,1), de los cuales 50 (19%) requirieron ingreso en la UCIP en algún momento de su enfermedad (grupo 1). Los 213 casos restantes no requirieron ingreso en la UCIP (grupo 2). Los meses en que se observó un mayor número de casos de ENI fueron febrero (54; 20,5%) y marzo (44; 16,7%), mientras que los meses con más casos que precisaron ingreso en la UCIP fueron marzo (10; 20%) y diciembre (7; 14%) (fig. 1A).
La duración de la estancia hospitalaria fue significativamente mayor (p < 0,001) en los pacientes que requirieron ingreso en la UCIP (19,8 ± 12,5 días) que en aquellos que no lo necesitaron (9,6 ± 5,8 días). El 46,7% de los pacientes con enfermedad de base ingresaron en la UCIP, frente a 17,3% de aquellos por lo demás sanos. La razón entre ingreso y no ingreso en la UCIP fue 4,17 veces mayor en los pacientes con enfermedad de base en comparación con los que no la tenían; esta asociación fue estadísticamente significativa (OR: 4,17; IC 95%: 1,44-12,12).
Las formas clínicas de presentación del total de pacientes que padecieron ENI durante el periodo estudiado fueron: neumonía complicada (152; 57,4%), neumonía no complicada (43; 16,3%), bacteriemia oculta (25; 9,5%), meningitis (19; 7,2%), shock séptico (7; 2,7%), mastoiditis (7; 2,7%), infección osteoarticular (7; 2,7%), celulitis orbitaria (2; 0,8%), peritonitis (1) y pancreatitis (1). En el grupo 1, requirieron ingreso en la UCIP 100% de los pacientes con shock séptico (OR: 5,95; IC 95%: 4,53 - 7,82), 84,2% de los que presentaron meningitis (OR: 32,94; IC 95%: 9,11-119,10) y 15,2% de los diagnosticados de neumonía complicada (OR: 0,57; IC 95%: 0,30-1,50); en esta última la asociación no fue significativa. En el grupo 2 no requirieron ingreso en la UCIP 95% de los pacientes con neumonía no complicada (OR: 0,18; IC 95%: 0,04-0,75) (tabla 1 y fig. 1B).
Características de los sujetos con enfermedad neumocócica invasora según ingreso o no en la unidad de cuidados intensivos pediátricos
| UCIP (n = 50) n (%) | No UCIP (n = 213) n (%) | p (t Student) | OR cruda (IC 95%) | OR ajustada (IC 95%) | |
|---|---|---|---|---|---|
| Edad (meses) | 36,9 ± 36,1(26,7-47,2) | 47,6 ± 37,4(42,6-52,7) | 0,067 | -- | -- |
| Sexo | |||||
| Masculino | 28 (18,1%) | 127 (81,9%) | 0,2200,639 | 0,86(0,46-1,6) | 0,37(0,12-1,19) |
| Femenino | 22 (20,4%) | 86 (79,6%) | |||
| Días de ingreso hospitalario | 9,6 ± 5,8 (8,8-10,4) | 19,8 ± 12,5 (16,2-23,4) | < 0,001 | -- | -- |
| Enfermedad de base | |||||
| Sí | 7 (46,7%) | 8 (53,3%) | 0,011 | 4,17(1,44-12,12) | 4,97(0,61-40,64) |
| No | 43 (17,3%) | 205 (82,7%) | |||
| Forma clínica de presentación | |||||
| Shock séptico | |||||
| Sí | 7 (100%) | 0 (0%) | < 0,001 | 5,95(4,53-7,82) | |
| No | 43 (16,8%) | 213 (83,2%) | |||
| Meningitis | |||||
| Sí | 16 (84.2%) | 3 (15,8%) | < 0,001 | 32,94(9,11-119,10) | 15,27(2,39-97,67) |
| No | 34 (13.9%) | 210 (86,1%) | |||
| Neumonía complicada | |||||
| Sí | 23 (15,2%) | 128 (84,8%) | 0,07 | 0,57 (0,304-1,50) | |
| No | 27 (24,1%) | 85 (75,9%) | |||
| Neumonía no complicada | |||||
| Sí | 2 (4,7%) | 41 (95,3%) | 0,009 | 0,18(0,04-0,75) | 0,21 (0,03-1,41) |
| No | 48 (21,8%) | 172 (78,2%) | |||
| Bacteriemia | |||||
| Sí | 1 (4,0%) | 24 (96.0%) | 0,081 | 0,16(0,02-1,21) | 0,11(0,01-1,31) |
| No | 49 (20,6%) | 189 (79.4%) | |||
| Otras formas de presentación clínica | |||||
| Sí | 1 (5,6%) | 17 (94,4%) | 0,232 | 0,24(0,03-1,81) | |
| No | 49 (20%) | 196 (80%) | |||
| Complicaciones agudas | |||||
| Ninguna | 12 (12,9%) | 81 (87,1%) | Ref. | ||
| Neurológicas | 12 (85,7%) | 2 (14,3%) | < 0,001 | 33,3 (7,17-154,8) | 7,53 (0,83-68,23) |
| Respiratorias | 24 (15,8%) | 128 (84,2%) | 0,536 | 0,613 (0,33-1,14) | |
| Otras | 2 (50%) | 2 (50%) | 0,18 | 4,4 (0,6-31,9) | |
| Secuelas | |||||
| Ninguna | 33 (14,4%) | 194 (85,5%) | |||
| Neurológicas | 7 (87,5%) | 1 (12,5%) | < 0,001 | 37,1 (4,44-309,9) | |
| Respiratorias | 5 (22,7%) | 17 (77,3%) | 0,54 | 1,4 (0,48-3,93) | |
| Otras | 2 (66,7%) | 1 (33%) | 0,028 | 9,4 (0,84-106,2) | |
| Vacunación PVC13 | |||||
| Completa | 5 (11,1%) | 40 (88,9%) | (0,14) | 0,48(0,18-1,29) | |
| Incorrecta, incompleta o no vacunado | 45 (20,6%) | 172 (79,4%) | |||
IC 95%: intervalo de confianza de 95%; OR: odds ratio; PVC13: vacuna neumocócica 13-valente; UCIP: unidad de cuidados intensivos pediátricos.
* Se aplicó la corrección de continuidad a la prueba de ?2 cuando al menos el valor de una frecuencia esperada era < 5.
Las variables cuantitativas se expresan como media ± desviación estándar (IC 95%). Para valorar la OR se utilizó la razón de ventajas.
Tanto en el grupo 1 como en el grupo 2, 64,4% de los pacientes con ENI presentaron algún tipo de complicación; 57,8% fueron respiratorias y 5,3% fueron neurológicas. El 85,7% de los sujetos con lesiones neurológicas durante la fase aguda requirieron ingreso en la UCIP (OR: 33,3; IC 95%: 7,17-154,8). El 15,8% de los pacientes con lesiones respiratorias ingresaron en la UCIP (OR: 0,613; IC 95%: 0,33-1,14) (fig. 1C).
El 85,5% de los 260 pacientes con ENI que tuvieron seguimiento no presentaron secuelas a los seis meses. Dos pacientes fallecieron y uno no acudió a control. En los pacientes con lesiones inmediatas, 8,5% (22) fueron respiratorias y 3,1% (8) neurológicas (incluidos dos pacientes con sordera); hubo un caso de hipertensión arterial, una mastoidectomía radical y una trombosis venosa de seno cavernoso. Dentro del grupo 1 el porcentaje de lesiones neurológicas fue de 14,3% (OR: 37,1; IC 95%: 4,4-309-9), seguidas de las respiratorias en 10,2% (OR: 1,4; IC 95%: 0,48-3,93) (fig. 1D).
El 84,8% (223/263) de los pacientes con ENI no habían recibido tratamiento ambulatorio con antibióticos previo al ingreso hospitalario, de los cuales 20,6% (46/223) (OR: 0,43; IC 95%: 0,145-1,26; p = 0,115) pertenecen al grupo 1.
El 50,4% (132/263) de los pacientes pertenecientes tanto al grupo 1 como al grupo 2 habían recibido, al menos, una dosis de vacuna contra el neumococo. Solo 28,1% estaban correctamente vacunados para su edad (8,7% con PCV7; 2,3% con PVC10, y 17,1% con PCV13). No se observó asociación (p = 0,135) entre la necesidad de ingreso en la UCIP (Grupo 1) y el estado de vacunación completa con PCV13 (OR: 0,48; IC 95%: 0,18-1,3).
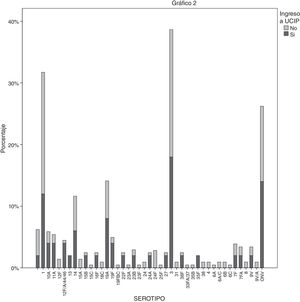
Los serotipos hallados con más frecuencia en ambos grupos fueron el 3 (53; 20,2%, de los que 17% requirió UCIP), el 1 (48; 18,3%, de los que 12,5% requirió UCIP), otros serotipos no vacunales (33; 12,5%, de los que 21% requirió UCIP), el 19A (17; 6,5%, de los que 23% requirió UCIP) y el 14 (15; 5,7%, de los que 20% requirió UCIP). Los serotipos encontrados más frecuentes en los pacientes del grupo 1 fueron el 3 (9; 18%), otros serotipos no vacunales (7; 14%), el 1 (6; 12%) y el 19A (4; 8%). Entre los serotipos no vacunales del grupo 1 destacan el 10A (2; 4%) y el 11 (2; 4%) (figura 2). Solo hubo un caso de fallo vacunal por el serotipo 3 en el grupo 1. En cuanto a la genotipificación, en el grupo 1 solo destacó el secuenciotipo 306, perteneciente al serotipo 1, en 4/6 casos; el resto de los secuenciotipos y de complejos clonales fueron variables y sin significación estadística.
DiscusiónLa posibilidad de ingreso en la UCIP en el curso de una ENI está presente y, por ello, es relevante conocer aquellos datos epidemiológicos, microbiológicos y clínicos que pueden relacionarse con una mayor frecuencia de ingreso en la UCIP. En nuestro estudio se observan ciertos factores que predisponen a ingresar en la UCIP, como son: edad menor de un año en el momento del diagnóstico, el hecho de presentar una enfermedad de base que aumente la probabilidad de padecer una ENI, ciertas formas clínicas como el shock séptico o meningitis y la estación del año que coincide con epidemias virales estacionales.
Los dos picos estacionales que aumentan la incidencia de ENI, así como la incidencia de ingreso en la UCIP, coinciden con las epidemias anuales de bronquiolitis por el virus respiratorio sincitial (VRS) y el virus de la gripe, tal como se ha señalado en otros trabajos5-9. No obstante, mientras que son los meses de febrero y marzo (la epidemia de gripe acumuló sus casos entre la semana 50 de 2013 y la semana 12 de 201410) los que acumulan la mayor incidencia de ENI, es en noviembre y diciembre (epidemia de VRS entre la semana 40 y la semana cuatro del año siguiente10) cuando la proporción de casos de ENI que requieren UCIP es mayor. Este hecho podría deberse a diversos factores, por ejemplo, la menor edad del paciente afecto de bronquiolitis, la virulencia estacional del virus, tanto de la gripe como del VRS, y las condiciones previas del paciente6,7.
El tratamiento ambulatorio con antibióticos previo al ingreso hospitalario no protege frente a un ingreso en la UCIP, como se ha demostrado en nuestra serie y en los trabajos de otros autores11.
La duración de la estancia hospitalaria es mayor en los pacientes que han requerido ingreso en la UCIP, tal como ya han demostrado otros autores12. En cuanto a las formas clínicas que requirieron UCIP, solo la inestabilidad hemodinámica resultó un criterio de ingreso en la UCIP en 100% de los casos. Aunque el diagnóstico de meningitis era un criterio de ingreso per se, no siempre se pudo establecer de entrada y la evolución de los pacientes con diagnóstico final de meningitis que no ingresaron en la UCIP fue satisfactoria. Ello se debió a que solo 39,5% de los pacientes con meningitis que ingresaron en la UCIP tuvieron complicaciones en la fase aguda, al igual que se observa en otros trabajos, como el de Casado et al11. La mayoría de los niños con ENI que ingresaron en la UCIP se recuperaron sin secuelas. Las secuelas más frecuentes fueron las neurológicas, seguidas de las respiratorias. Solo 15,2% de los pacientes con neumonía complicada con derrame pleural o empiema requirieron ingreso en la UCIP, por lo que este tipo de pacientes podría recibir tratamiento en un hospital que no disponga de ella, vigilando estrechamente su evolución11,13.
Aunque los serotipos más frecuentes (sobre todo, el 19A) están incluidos en la PCV13, 11,8% de los pacientes completamente vacunados con PCV13 ingresaron en la UCIP, frente al 18,5% de los que no lo estaban (p = 0,23), por lo que la diferencia no es estadísticamente significativa. Por ello, la vacuna PCV13 no se ha mostrado, en nuestro trabajo, protectora frente al ingreso en la UCIP de manera significativa. El único caso de fallo vacunal que requirió UCIP estuvo producido por el serotipo tres, para el cual la PCV13 ha demostrado una menor eficacia que para el resto de los serotipos en ella incluidos, tal como han demostrado otros trabajos14-16. Asner et al.16 describieron 26% de fallos vacunales que requirieron ingreso en la UCIP, en especial, por el serotipo tres. Llaman la atención dos serotipos no incluidos de la vacuna PCV13, el 10A y el 11A, que aunque son poco frecuentes en nuestra casuística presentan un gran porcentaje de ingresos en la UCIP. En un estudio prospectivo suizo con 117 casos de ENI fueron los pacientes con meningitis, sobre todo la producida por serotipos no vacunales, los que con más frecuencia requirieron ingreso en la UCIP16.
En cuanto a los serotipos, en nuestro estudio, el serotipo tres es el primero de todos los productores de ENI que requiere ingreso en la UCIP, lo cual puede explicarse por la propia idiosincrasia de este serotipo, que hace que las proteínas capsulares tengan un comportamiento más agresivo17,18, así como por su menor respuesta a la PCV13, tal como han descrito otros autores14,17,18. También ha resultado ser el serotipo más frecuente capaz de desencadenar ENI y la causa más frecuente de fallo vacunal en nuestro estudio.
Por todo ello, es necesario seguir monitorizando los serotipos neumocócicos causantes de ENI, así como sus genotipos, para poder conocer la etiología de la ENI en nuestra población en cada momento19.
Nuestro trabajo tiene algunas limitaciones: en primer lugar, la población estudiada representa solo 30,4% de la población catalana menos de cinco años, ya que únicamente estudia la ENI de tres hospitales en Cataluña. En segundo lugar, solo dos de los tres hospitales integrantes en el estudio tienen UCIP; aunque son las dos UCIP de referencia de Cataluña, existen otros hospitales que atienden pacientes con ENI. En tercer lugar, la recogida de datos clínicos en los tres centros pudo estar sesgada, así como la falta de procesamiento de alguna cepa neumocócica hizo que no se procesara 100% de las muestras obtenidas. Por último, otra limitación sería que el último año de estudio finaliza en junio, por lo que la epidemia de bronquiolitis de ese año no queda contabilizada.
ConclusionesEn nuestra serie la presencia de shock séptico y/o afectación neurològica en el contexto de ENI requirió ingreso en la UCIP y el porcentaje de ingresos fue mayor en los niños con enfermedad de base. La incidencia de ingresos en la UCIP aumentó durante la epidemia anual de bronquiolitis. El ingreso en la UCIP conllevó una estancia hospitalaria más prolongada, así como posibles complicaciones durante la fase aguda y secuelas lesiones posteriores, sobre todo neurológicas. Los serotipos de los pacientes que ingresaron en la UCIP fueron predominantemente vacunales (19A, 14, 3 y 1). Sólo el paciente afecto de ENI con shock séptico y/o afectación neurológica requirió ingreso en UCIP. En el caso de presentar neumonía complicada se puede plantear ingreso en planta de pediatría ofreciendo seguimiento estrecho.
FinanciaciónPlan Nacional I + D + I, ISCIII-Subdirección general de Evaluación y Fomento de la Investigación Sanitaria. Beca número: P111/02081, PI 11/2345; Fondo Europeo de Desarrollo regional (FEDER) y AGAUR. Beca número 2017 SGR 1342.
Juan José García García, Angela Domínguez, Fernando Moraga Llop, Alvaro Díaz Conradi, Mariona Fernández de Sevilla, Sebastià González Peris, Pilar Ciruela, Magda Campins, Carmen Muñoz-Almagro, Cristina Esteva, Conchita Izquierdo, Sonia Uriona, Johanna Martínez Osorio, Anna Solé Ribalta, Gemma Codina, Nuria Soldevila y Lluís Salleras Sanmartí.