Más de un millón de pacientes menores de 15 años desarrollan tuberculosis (TB) anualmente en el mundo, según estimaciones de la OMS. La TB por cepas resistentes a los fármacos de primera línea alcanza al 25% de los nuevos casos en algunas regiones. Aunque España es considerada un país de baja incidencia, varios centenares de niños y adolescentes enferman de TB cada año. La importancia de la TB pediátrica ha sido minimizada durante años por la dificultad en confirmar el diagnóstico microbiológico y la escasa contagiosidad que asocia. Sin embargo, en los últimos 15 años, se han reportado mejoras relevantes en los informes epidemiológicos de la TB en niños y adolescentes, han surgido nuevos test inmunodiagnósticos, se dispone de estudios de biología molecular que permiten un diagnóstico microbiológico y una identificación de mutaciones asociadas a resistencia rápidos, han surgido nuevos fármacos antituberculosos de segunda línea, también en pediatría, y se han publicado ensayos clínicos que validan tratamientos acortados en algunos pacientes. Este documento, realizado por un grupo de expertos de la Sociedad Española de Infectología Pediátrica y la Sociedad Española de Neumología Pediátrica, actualiza y complementa las recomendaciones previas para el manejo diagnóstico y terapéutico del niño con TB en España, en base a las nuevas evidencias científicas disponibles.
According to WHO estimates, more than 1 million patients aged less than 15 years develop tuberculosis (TB) each year worldwide. In some regions, up to 25% of new TB cases are caused by drug-resistant strains. Although Spain is considered a low-incidence country, several hundred children and adolescents develop TB each year. The importance of paediatric TB has been minimized for years due to the lack of microbiological confirmation in many patients and because these patients are not usually contagious. Nevertheless, in the past 15 years there have been major improvements in the epidemiological reporting of TB in children and adolescents, new immunodiagnostic tests have been developed, molecular methods that allow rapid microbiological diagnosis and detection of variants associated with drug resistance have become available, novel second-line antituberculosis drugs have been discovered, including for paediatric use, and the results of clinical trials have validated shorter courses of treatment for some patients. This document, developed by a group of experts from the Sociedad Española de Infectología Pediátrica and the Sociedad Española de Neumología Pediátrica, updates and complements the previous guidelines for the diagnostic and therapeutic management of children with TB in Spain based on the newly available scientific evidence.
La tuberculosis (TB) continúa siendo una de las enfermedades infecciosas más relevantes a nivel mundial. La estrategia End TB de la OMS fijó como objetivo un descenso en la incidencia del 20% entre 2015 y 2020, siendo Europa la única región en el mundo que lo ha conseguido. Sin embargo, esta tendencia se ha frenado a raíz de la pandemia de COVID-19, que ha tenido un fuerte impacto negativo en el control de la TB. Por primera vez desde 2005, la mortalidad asociada a TB ha aumentado1,2.
Según los últimos datos disponibles, se estimaron 7,8 casos de TB por 100.000 habitantes en España en 20203. Los menores de 15 años suponen aproximadamente el 4% de casos de TB en Europa4. Antes de la pandemia (datos de 2019), la incidencia de TB infantil en España fue de 6,1 casos/100.000 habitantes en el grupo de 0 a 4 años, y de 3,4/100.000 en los niños de 5 a 14 años3. Los principales factores de riesgo son la inmigración y la inmunosupresión5.
Inmunodiagnóstico de la infección tuberculosaLa prueba de la tuberculina (PT) se basa en la reacción de hipersensibilidad retardada tras la inyección intradérmica de 0,1ml de derivado proteico purificado de Mycobacterium tuberculosis complex (MTB) en la cara anterior del antebrazo. A las 48-72h se debe leer el diámetro transversal máximo de induración. Su interpretación depende de factores epidemiológicos y clínicos (tabla 1)5. La positividad de la PT solo indica infección TB (ITB), y los pacientes con resultado positivo deben ser evaluados para descartar enfermedad. La PT puede presentar falsos positivos en pacientes con infecciones por micobacterias no tuberculosas (MNT) o que han recibido la vacuna con bacilos de Calmette-Guérin (BCG). La PT puede presentar falsos negativos por errores de la técnica, en pacientes con peor inmunidad celular (recién nacidos y lactantes, inmunodeficiencias primarias o adquiridas) y en casos de TB diseminada, infección viral reciente o vacunas atenuadas administradas en las 6 semanas previas. Aunque aún no están disponibles, existen nuevos test intradérmicos basados en los antígenos específicos de MTB (ESAT6 y CFP10), con mayor especificidad, que pueden ser una alternativa en el futuro6,7
Dintel de positividad de la prueba de tuberculina, independientemente del antecedente de vacunación BCG
| Induración ≥5mm |
| • Niños en contacto íntimo con el caso índice o sospechoso de enfermedad tuberculosa• Niños con sospecha clínica y/o radiológica de enfermedad tuberculosa• Niños inmunodeprimidos• Niños con conversión de la prueba de la tuberculina, previamente negativa |
| Induración ≥10mm |
| • Cualquier otro caso: niño inmigrante o viajero, y en el cribado de niños sanos |
BCG: bacilos de Calmette-Guérin.
Los interferon-gamma release assay (IGRA) son técnicas para la detección en sangre de interferón-gamma producido por células T sensibilizadas por antígenos específicos de MTB (ESAT6 y CFP10). Su sensibilidad es similar a la PT, pero su especificidad es mayor ya que estos antígenos no están presentes en la cepa vacunal BCG de M. bovis ni en las MNT, salvo M. kansasii, M. marinum, M. szulgai y M. flavescens. Al igual que la PT, su positividad solo indica ITB y, en los pacientes con resultado positivo, se debe descartar enfermedad. Los IGRA incorporan un control positivo, que evalúa la inmunidad celular del paciente, y no requieren de una segunda visita de lectura; sin embargo, precisan de la extracción de sangre y de infraestructura de laboratorio, y tienen un coste elevado. Su resultado puede ser positivo, negativo o indeterminado (<5%, especialmente en menores de 2 años)8. Existen diversas técnicas IGRA disponibles en el mercado, de entre las cuales QuantiFERON®-TB Gold-Plus (QIAGEN, EE. UU.) es la más extendida y con la que hay más experiencia en pediatría9,10. Estudios recientes demuestran que el rendimiento diagnóstico de las distintas técnicas IGRA es muy similar9–11.
Recomendaciones para el uso de PT/IGRA (tabla 2)
Recomendaciones para el uso de la prueba de tuberculina y técnicas IGRA en niños y adolescentes
| Población | Recomendación | |
|---|---|---|
| Cribado de la infección tuberculosaa | Menores de 2 años (a valorar en <5 años)Paciente inmunodeprimido | PT+IGRAb simultáneos |
| Mayores de 5 años no inmunodeprimidos | PT o IGRA; si antecedentes de vacuna BCG o infección por MNT, preferiblemente IGRA | |
| Sospecha de enfermedad tuberculosa | Todos | PT o IGRA; si resultado negativo, realizar la otra técnica para maximizar la sensibilidadb |
BCG: bacilos de Calmette-Guérin; IGRA: interferon-gamma release assay; MNT: micobacterias no tuberculosas; PT: prueba de la tuberculina.
Estudio de contactos, cribado de población inmigrante, cribado previo a tratamiento inmunosupresor y en el paciente inmunodeprimido.
Interpretación de resultados discordantes. En el paciente de riesgo (menor de 5 años, inmunodeprimido o que va a recibir tratamiento inmunosupresor, exposición intensa conocida y reciente, sospecha de enfermedad), siempre debe considerarse infección por Mycobacterium tuberculosis. En el paciente de bajo riesgo, PT positiva/IGRA negativo: si existe antecedente de vacuna BCG o infección por MNT, se podría repetir el IGRA a las 6-8 semanas, y considerar al paciente no infectado si sigue siendo negativo. PT negativa/IGRA positivo: confirmar la adecuación de la técnica PT.
La sensibilidad de la PT y los IGRA por separado en el diagnóstico de ITB/TB se encuentra en torno al 70-80%, pero su combinación supera el 90%10,12. Las principales guías internacionales discrepan sobre las indicaciones de PT e IGRA en pediatría13–16. Considerando la inmadurez inmunológica del niño pequeño y la menor evidencia disponible sobre los IGRA en pediatría, las guías recomiendan la PT de elección en menores de 5 años, sola o en combinación con los IGRA, y discrepan sobre la posibilidad de que los IGRA sustituyan a la PT en mayores de 5 años13–16. En nuestro medio, recomendamos realizar ambas técnicas para el cribado de ITB en pacientes de riesgo (paciente inmunodeprimido de cualquier edad y menores de 2 años; a valorar también en menores de 5 años, ya que el riesgo de desarrollar TB es inversamente proporcional a la edad), y emplear una de ambas, PT o IGRA, en pacientes de bajo riesgo (mayores de 5 años, no inmunodeprimidos). En pacientes con sospecha clínica de TB, se recomienda maximizar la sensibilidad diagnóstica realizando ambas técnicas si fuera necesario (cuando la primera ha sido negativa).
Las pruebas de imagen en el diagnóstico de la tuberculosisLa radiografía de tórax (Rx) en proyección postero-anterior y lateral está indicada ante cualquier sospecha de TB, pulmonar o extrapulmonar17,18. Está indicada asimismo en el niño con diagnóstico de ITB (PT y/o IGRA positivos), y en el estudio de los pacientes de riesgo (paciente inmunodeprimido de cualquier edad y menores de 2-5 años) expuestos a TB. Aunque sigue siendo la prueba de elección habitual, es poco específica, no siempre muestra hallazgos característicos, y muestra pobre concordancia entre distintos observadores16–18. La lectura de Rx mediante sistemas de detección asistida por ordenador es ya una realidad en el diagnóstico de la TB del adulto, existiendo varios software disponibles19,20. Algunos de ellos están validados para la edad pediátrica, pero ninguno aún por debajo de los 2 años de edad.
La tomografía computarizada (TC) es más sensible que la Rx, pero su realización sistemática no se recomienda21. Es útil en niños con hallazgos radiológicos equívocos, pacientes sintomáticos con Rx normal, ante dudas diagnósticas en grupos de riesgo, para la valoración de complicaciones en TB endobronquial y en el seguimiento de casos complejos17,18,22. Para el diagnóstico de formas osteoarticulares y en TB del sistema nervioso central (SNC), la resonancia magnética es más sensible y permite un diagnóstico precoz.
La ecografía es una prueba cada vez más utilizada que se puede realizar a pie de cama23. En el pulmón permite visualizar consolidaciones, cavitaciones y nódulos miliares, siempre que los cambios estén en contacto con la pleura, sin pulmón aireado intermedio. Detecta linfadenopatías mediastínicas y, con más dificultad, hiliares. En manos expertas, tiene mayor sensibilidad que la Rx para detectar linfadenopatías mediastínicas24. También es útil en el diagnóstico del derrame pleural, adenopatías abdominales o lesiones focales esplénicas25.
En los últimos años, ha aumentado el uso de pruebas de medicina nuclear como el PET/TC, que es capaz de detectar enfermedad activa en la mayoría de los órganos (con la excepción de riñones y SNC), pero presenta un grado de irradiación superior a la TC26,27. Permite diferenciar enfermedad TB de ITB e imágenes residuales, evaluar la extensión de la enfermedad, monitorizar la respuesta al tratamiento e identificar focos de enfermedad candidatos a biopsia27.
Diagnóstico microbiológico de la tuberculosisMuestras. En niños sin capacidad de expectorar, la muestra de elección para el diagnóstico de la TB pulmonar es el aspirado de jugo gástrico (mínimo 3-4ml; a mayor volumen, mayor sensibilidad) recogido en ayunas en 3 días consecutivos, o el esputo inducido, que tiene una sensibilidad similar y se obtiene administrando salbutamol inhalado y posteriormente suero salino hipertónico al 3%, nebulizado durante 15min. La mayor rentabilidad se obtiene realizando el mismo día esputo inducido y jugo gástrico28. El aspirado nasofaríngeo tiene menor sensibilidad, pero puede ser una alternativa en niños no ingresados o en los que las técnicas anteriores no sean productivas. En adolescentes o niños mayores con tos productiva se recogerá esputo y en pacientes intubados, aspirado bronquial o lavado broncoalveolar. Recientemente se ha incluido el estudio de una muestra de heces como técnica de rutina en niños pequeños29. En pacientes con enfermedad diseminada o extrapulmonar se pueden incluir muestras de líquido cefalorraquídeo, líquido sinovial, material de biopsia, etc.
Baciloscopia. Se trata de técnicas de tinción (Ziehl-Neelsen, auramina-rodamina) que permiten la identificación del bacilo de forma rápida y sencilla. Tienen una sensibilidad inferior al 15% en niños con primoinfección TB, siendo más elevada en la TB congénita y las formas cavitadas de los adolescentes. Una baciloscopia negativa nunca descarta la enfermedad. La tinción directa es menos específica en situaciones donde son frecuentes las infecciones por MNT (fibrosis quística, bronquiectasias, adenitis o pacientes inmunodeprimidos).
Cultivo. Es la prueba diagnóstica de referencia. Permite identificar la especie y realizar estudios fenotípicos de resistencia a los fármacos antituberculosos. Tiene el inconveniente de su baja sensibilidad (30-50%) y de la necesidad de 2 a 4 semanas para obtener el resultado definitivo30.
Técnicas moleculares, reacción en cadena de la polimerasa y secuenciación masiva. Aunque no reemplazan al cultivo como técnica de referencia, tiene una sensibilidad próxima a éste, alta especificidad en niños y permiten obtener resultados en pocas horas31. La técnica más extendida es Xpert® MTB/RIF Ultra (Cepheid, EE. UU.), que permite detectar simultáneamente la resistencia a rifampicina (R). Además, existen técnicas de secuenciación masiva, como el Deeplex® Myc-TB (Genoscreen, Francia), que permiten la identificación de especie, la detección de resistencias a fármacos antituberculosos y el rastreo filogenético para un mejor control de la transmisión poblacional32.
Métodos moleculares de detección de resistencias. La prueba de referencia para el estudio de la sensibilidad a los fármacos antituberculosos es el cultivo. Sin embargo, se han desarrollado pruebas moleculares rápidas para la detección de mutaciones asociadas a resistencia que tienen la gran ventaja de su rapidez, alta sensibilidad (90-97% si baciloscopia positiva, 67% si baciloscopia negativa) y especificidad (99%). Además de Xpert® MTB/RIF Ultra, las más empleadas en nuestro medio son aquellas que detectan mutaciones de resistencia a isoniazida (H) y R, como BD MAX® MDR-TB (BD, EE. UU.), Genotype® MTBDRplus (Hain Lifescience, Alemania) o FluoroType® MTBDR (Hain Lifescience, Alemania), y a fármacos de segunda línea, como Xpert® MTB/XDR (Cepheid, EE. UU.) o GenoType® MTBDRsl (Hain Lifescience, Alemania)33.
Nuevas técnicas diagnósticas. En los últimos años se están desarrollando pruebas diagnósticas en muestras fácilmente accesibles como técnicas moleculares en sangre capilar34 o biomarcadores en saliva35 y en orina36, aún no disponibles.
Tratamiento preventivo de la exposición a tuberculosis y de la infección tuberculosaEn los menores de 5 años y pacientes inmunodeprimidos de cualquier edad en contacto con pacientes con TB bacilífera y tras descartar ITB/TB, se mantiene la recomendación de profilaxis post-exposición con H hasta repetir el estudio inmunodiagnóstico después del periodo ventana (8-12 semanas). Ante cepas resistentes a H, se recomienda R. En pacientes expuestos a TB multirresistente (TB-MDR) existe muy poca evidencia, debiéndose valorar la profilaxis de forma individual (habitualmente con una quinolona), considerando el riesgo del paciente y la intensidad de la exposición5,16. En el paciente inmunocompetente mayor de 5 años no se recomienda profilaxis post-exposición.
Todos los niños y adolescentes diagnosticados de ITB deben recibir tratamiento. En España, las pautas recomendadas son H más R durante 3 meses, R durante 4 meses y H durante 6 a 9 meses (tabla 3)5,37. La eficacia es similar para todos los regímenes, pero con mejor cumplimiento y menor toxicidad en las pautas cortas. La OMS recomienda también la combinación de H y rifapentina, pero aún no se dispone de rifapentina en Europa38,39. En pacientes que reciben otras medicaciones, debe valorarse el riesgo de interacciones farmacológicas37. En ITB por cepa TB-MDR se seleccionará el tratamiento según el perfil de resistencias. Las pautas más habituales incluyen levofloxacino, acompañado o no de etambutol (E). La duración no está bien establecida, recomendándose entre 6 y 12 meses38,40.
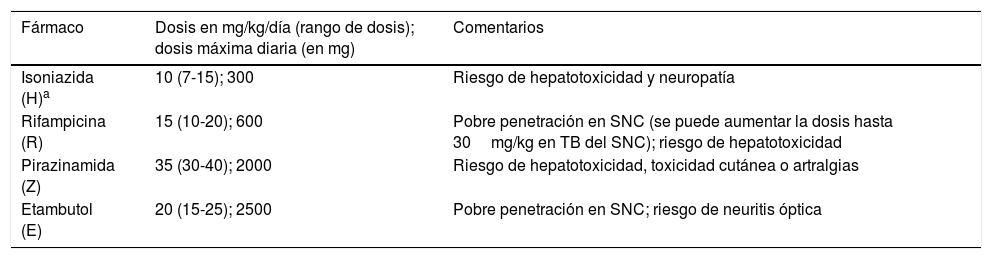
Dosis recomendadas de los fármacos antituberculosos de primera línea5,16
| Fármaco | Dosis en mg/kg/día (rango de dosis); dosis máxima diaria (en mg) | Comentarios |
|---|---|---|
| Isoniazida (H)a | 10 (7-15); 300 | Riesgo de hepatotoxicidad y neuropatía |
| Rifampicina (R) | 15 (10-20); 600 | Pobre penetración en SNC (se puede aumentar la dosis hasta 30mg/kg en TB del SNC); riesgo de hepatotoxicidad |
| Pirazinamida (Z) | 35 (30-40); 2000 | Riesgo de hepatotoxicidad, toxicidad cutánea o artralgias |
| Etambutol (E) | 20 (15-25); 2500 | Pobre penetración en SNC; riesgo de neuritis óptica |
SNC: sistema nervioso central; TB: tuberculosis; VIH: virus de la inmunodeficiencia humana.
El tratamiento de la TB es el mismo en la enfermedad confirmada microbiológicamente y en la enfermedad probable (diagnóstico basado en los antecedentes epidemiológicos, los hallazgos clínicos y radiológicos, el resultado de los test inmunodiagnósticos y la respuesta al tratamiento). El régimen de tratamiento dependerá de la edad, de factores clínicos y de la localización de la TB. Los fármacos antituberculosos de primera línea (tabla 3) deben administrarse en toma única en ayunas, habitualmente por la mañana. No se recomiendan pautas intermitentes de tratamiento5. Las formulaciones comercializadas en España no son adecuadas para el niño pequeño, salvo la de R41,42. Las recomendaciones para la preparación y administración del tratamiento de la TB en pediatría (medicamentos comerciales y fórmulas magistrales), la monitorización de su toxicidad y el empleo de tratamiento directamente observado se resumen en los documentos del Proyecto Magistral41,43. Dada la prevalencia de cepas resistentes a H en España (>4%), debe asociarse E en la fase intensiva si no se ha confirmado enfermedad por cepa sensible a fármacos de primera línea en el paciente o el caso índice. Las indicaciones de corticoterapia se resumen en la tabla 4.
Indicaciones del uso de corticoidesa en tuberculosis en pediatría
| - Meningitis tuberculosa o con afectación del sistema nervioso central.- Osteomielitis espinal con afectación medular.- Pericarditis tuberculosa.- Obstrucción severa de la vía aérea secundaria a compresión extrínseca por linfadenopatía o tuberculosis endobronquial.- A valorar en reacción paradójica en adenitis periférica o hiliar (atelectasia de novo) y ante pleuritis (u otras serositis) con importante componente inflamatorio. |
Prednisona (o equivalente): dosis de 2mg/kg/día (máximo 60mg/día) durante 4 semanas, con reducción progresiva durante 2 semanas (total 6 semanas)5,15.
Nuevo régimen corto derivado de los resultados del ensayo clínico SHINE44, 4 meses de tratamiento: H, R, pirazinamida (Z)±E durante 2 meses (fase intensiva), continuar con H y R durante 2 meses más (fase de mantenimiento), si se cumplen los siguientes criterios:
- •
Edad entre 3 meses y 16 años.
- •
Enfermedad no grave: adenitis periférica; adenitis intrapulmonar sin obstrucción de vía aérea; enfermedad pulmonar no cavitada, limitada a un lóbulo pulmonar sin patrón miliar, con/sin derrame pleural no complicado.
- •
Baciloscopia negativa.
- •
Cepa sensible o presumiblemente sensible a fármacos de primera línea.
- •
Cabe recordar que el estudio excluyó a prematuros, lactantes con menos de 3kg de peso y embarazadas.
Régimen tradicional, 6 meses de tratamiento: H, R, Z±E durante 2 meses, continuar con H, R durante al menos 4 meses más5,15,16,45. Indicado en los pacientes que no cumplen los criterios para régimen corto y en niños con formas extrapulmonares, salvo adenitis periférica (régimen corto) y ante afectación del SNC, TB diseminada/miliar o TB osteoarticular.
Ante meningitis TB u otra afectación del SNC, se recomiendan H, R, Z±E durante 2 meses, y continuar con H, R al menos durante 10 meses; deben utilizarse las dosis máximas permitidas. Ante casos de TB de SNC por cepa sensible, podría valorarse tratamiento intensivo con H, R, Z y etionamida durante 6 meses; este régimen no está recomendado en pacientes con infección VIH16. En TB osteoarticular, se recomiendan H, R, Z±E durante 2 meses, y continuar con H, R durante al menos 7-10 meses15,45. En TB diseminada/miliar (afectación de ≥2 órganos no contiguos, aislamiento MTB en sangre u orina), el tratamiento no está bien establecido. Se recomiendan H, R, Z±E durante 2 meses, y continuar con H, R durante al menos 4-10 meses, dependiendo de la evolución clínica, la afectación o no del SNC y de si el paciente presenta inmunosupresión5,46.
En el seguimiento del tratamiento de la TB en el niño, es importante5,45:
- 1.
Seguimiento de la adherencia, los problemas relacionados y la adecuación de la posología en cada visita. El mal cumplimiento es la causa más común de fracaso del tratamiento47. En ocasiones, es posible utilizar el tratamiento directamente observado o la monitorización de los niveles plasmáticos de fármacos para monitorizar la adherencia.
- 2.
Evaluar la potencial toxicidad hepática. Se recomienda analítica sanguínea con transaminasas previa al inicio del tratamiento; valorar nuevo control en las primeras semanas y en caso de efectos adversos. También debe monitorizarse la función hepática en pacientes con hepatopatía previa o que reciban otros fármacos hepatotóxicos.
- 3.
En pacientes bacilíferos (habitualmente adolescentes) debe repetirse la baciloscopia periódicamente (cada 1-2 semanas) hasta comprobar su negativización, que permite finalizar el aislamiento respiratorio5,16.
- 4.
Debe realizarse al menos un control clínico a las dos semanas del inicio del tratamiento, a los dos meses para pasar a fase de mantenimiento y cada dos meses hasta completar el tratamiento.
La TB resistente siempre es un diagnóstico microbiológico48. Puede ser confirmada, cuando se aísla la cepa en el paciente; probable, cuando se aísla la cepa solo en el caso índice; o posible, si el paciente empeora recibiendo un tratamiento de primera línea a pesar de una buena adherencia, si el patrón de resistencia del caso índice adulto es desconocido, si es un fallo de respuesta a un tratamiento previo en casos de retratamiento, o si fallece por la TB durante el tratamiento a pesar de buen cumplimiento.
La transmisión de TB por cepas resistentes a fármacos en niños se produce generalmente a partir de un adulto contagioso, generando una resistencia primaria en el menor48. No obstante, el paciente pediátrico puede presentar también formas secundarias de resistencia a partir de un tratamiento inicial inadecuado o de adherencia subóptima. Las definiciones actuales de TB resistente son las siguientes49,50:
- •
TB-RR: cepas de MTB resistentes a R (por métodos moleculares) con resistencia o susceptibilidad a otros fármacos desconocida. En estos casos, se recomienda considerar patrón de TB-MDR.
- •
TB-RMR (monorresistencia a R): cepas resistentes a R y fenotípicamente sensibles a H (no solo por método genotípico). En estos casos, se recomienda considerar patrón de TB-MDR, aunque se puede incluir H en el régimen.
- •
TB monorresistente a H: cepa únicamente resistente a H. En estos pacientes, se recomiendan 6 meses de tratamiento combinado con R, Z, E y levofloxacino, con o sin H51.
- •
TB polirresistente: cepa sensible a R, pero resistente a otros 2 o más fármacos antituberculosos. Se diseñará un régimen que incluya R.
- •
TB-MDR: cepas resistentes a H y R, con/sin otras resistencias asociadas.
- •
Pre-TB-XDR: cepas que cumplen la definición de TB-MDR y además muestran resistencia a cualquier fluoroquinolona.
- •
TB-XDR: cepas que cumplen la definición de TB-MDR, muestran resistencia a una fluoroquinolona y al menos a otro fármaco del grupo A (bedaquilina o linezolid).
Las decisiones sobre el esquema a administrar deben tomarse según el criterio clínico del profesional responsable y las preferencias del paciente y su familia, considerando los siguientes aspectos: localización y gravedad de la TB; estudio de resistencias e historial de tratamiento del paciente y/o del caso índice; potenciales efectos adversos; y disponibilidad, sostenibilidad e idoneidad para su uso en niños de los fármacos potencialmente activos16. Se recomienda consultar a un experto en todos los casos.
Principios básicos para el tratamiento de la TB-MDR16,48,52,53:
- •
Intentar confirmar microbiológicamente la TB por cepa resistente en el niño; alternativamente, usar el patrón de sensibilidades del caso índice para decidir el esquema de tratamiento.
- •
En la fase intensiva, utilizar al menos 4 o 5 fármacos de segunda línea de administración oral activos de acuerdo al estudio fenotípico; en la fase de mantenimiento, utilizar al menos 3 fármacos activos.
- •
Los fármacos se seleccionarán de acuerdo a su actividad contra MTB (tabla 5). Los inyectables (aminoglucósidos) se utilizarán solo como última opción.
Tabla 5.Fármacos antituberculosos de segunda línea categorizados según la prioridad en su inclusión en los regímenes de tratamiento de la TB-MDR48,52
Grupo A 1.° Incluir los 3 fármacos Levofloxacino o moxifloxacinoBedaquilinaLinezolid Grupo B 2.° Añadir uno o ambos fármacos ClofaziminaCicloserina o terizidona Grupo C 3.° Añadir hasta completar el esquema, cuando alguno de los fármacos de los grupos A y B no se puedan usar DelamanidaEZImipenem o meropenemEtionamida o protionamidaÁcido paraaminosalicílico (amikacina) TB-MDR: Tuberculosis multirresistente.
- •
Las dosis recomendadas se describen en la tabla 6; se recomienda revisar las actualizaciones en la posología en la Guía Sentinel48.
Tabla 6.Dosis recomendadas de los fármacos antituberculosos de segunda línea; se recomienda revisar las actualizaciones en la posología en la Guía Sentinel48
Fármaco Dosis recomendadas Efectos adversos Grupo A de la OMS Levofloxacina 15-20mg/kg/día Trastornos del sueño, molestias gastrointestinales, artralgias y artritis, hipertensión intracraneal benigna, prolongación del intervalo QT Moxifloxacina 10-15mg/kg/día Mayor riesgo de prolongación del QT que levofloxacina Bedaquilina • De 3 a <10kg y de 0 a <3 meses: 30mg/una vez al día en fase intensiva (2 semanas) y 10mg/3 días por semana, posteriormente• De 3 a <10kg y de 3 a <6 meses: 60 y 20mg, respectivamente• De 7 a <10kg y ≥6 meses: 80 y 40mg, respectivamente• De 10 a <16kg y ≥6 meses: 120 y 60mg, respectivamente• De 16 a <30kg: 200 y 100mg, respectivamente• ≥30kg: 400 y 200mg, respectivamente Cefalea, náuseas, alteración de la función hepática, prolongación del intervalo QT Linezolid ≤15kg: 15mg/kg/una vez al día>15kg: 10-12mg/kg/una vez al día Diarrea, cefalea, náuseas, mielotoxicidad, neuropatía periférica, neuritis óptica, acidosis láctica y pancreatitis Grupo B de la OMS Clofazimina 2-5 mg/kg/día, dada la presentación disponible se puede dar en días alternos (fármaco con larga vida media) Decoloración cutánea, ictiosis, prolongación del intervalo QT, dolor abdominal Cicloserina 15-20mg/kg/día Efectos adversos neurológicos y psicológicos (alucinaciones, psicosis, etc.) Grupo C de la OMS Pirazinamida y etambutol Ver tabla 3 Delamanida 3-5 años y 10-20kg: 25mg/cada 12h6-12 años y 20-34kg: 50mg/cada 12h>12 años de edad y ≥35kg: 100mg/cada 12h Náuseas, vómitos, parestesias, ansiedad, prolongación del intervalo QT, alucinaciones y terrores nocturnos o pesadillas Meropenem 20-40mg/kg/8h (vía intravenosa) Molestias gastrointestinales, reacciones de hipersensibilidad, convulsiones, alteración de la función hepática y renal Etionamida/proteonamida 15-20mg/kg/día Molestias gastrointestinales, sabor metálico de los alimentos ingeridos, hipotiroidismo Ácido paraaminosalicílico 200-300mg/kg/día en una sola toma (se puede dividir la dosis cada 12h en casos de intolerancia) Molestias gastrointestinales, hipotiroidismo, hepatitis Amikacina 15-20mg/kg/día Ototoxicidad (irreversible), nefrotoxicidad OMS: Organización Mundial de la Salud.
Fuente: adaptada de Howell et al.53.
- •
Administrar el tratamiento de forma diaria.
- •
Administrar el tratamiento directamente observado. Alternativamente, monitorizar la adherencia de forma exhaustiva.
- •
En el seguimiento, supervisar la evolución clínica y radiológica, y la negativización de los cultivos si aplica.
- •
Monitorizar los efectos adversos de los fármacos empleados.
En España, el tratamiento del niño con TB por cepa resistente debe ser individualizado y de acuerdo a los principios básicos descritos más arriba. Actualmente, se pueden utilizar todos los fármacos de segunda línea en cualquier franja de edad pediátrica, con la excepción de la pretomanida (tablas 5 y 6). Según la OMS, la duración mínima de la fase intensiva será de 4-6 meses16. El tiempo total mínimo de tratamiento será de 9 meses en aquellas formas leves de TB y que cumplan los siguientes requisitos: 1) que se haya comprobado sensibilidad a las fluoroquinolonas; 2) en formas leves de TB pulmonar (no cavitadas, afectación de un solo lóbulo) o ante linfadenopatía periférica aislada; y 3) no exposición previa por más de un mes a los fármacos incluidos en el esquema de tratamiento. En el resto de casos, la duración mínima del tratamiento será de 12 a 18 meses, y dependerá del patrón de resistencias y la gravedad de la enfermedad.
En el tratamiento de las TB-MDR de SNC o las formas diseminadas/miliares debe tenerse en cuenta la capacidad de los fármacos para cruzar la barrera hematoencefálica; los que penetran mejor son las fluoroquinolonas, linezolid, cicloserina, etionamida, meropenem y pirazinamida. También delamanida y H a dosis altas (en resistencia por mutaciones que confieren un nivel bajo de resistencia a la H) serían útiles.
FinanciaciónAlicia Hernanz-Lobo está financiada por el Ministerio Español de Ciencia e Innovación-Instituto de Salud Carlos III y Fondos FEDER (Contrato Río Hortega CM20/00128).
Paula Rodríguez-Molino está financiada por el Ministerio Español de Ciencia e Innovación-Instituto de Salud Carlos III y Fondos FEDER (Contrato Río Hortega CM21/00174).
Conflicto de interesesFernando Baquero-Artigao ha participado en trabajos de investigación financiados por Qiagen y Cepheid. Begoña Santiago-García ha participado en trabajos de investigación financiados por Cepheid. El resto de autores declaran no tener conflicto de intereses.
Los autores quieren agradecer a la Dra. María José (Pepa) Mellado una larga carrera de liderazgo y maestría en el estudio de la TB pediátrica en España.