Durante los últimos años ha habido un aumento en la aparición de resistencias antimicrobianas, lo cual supone un grave problema de salud pública. El mal uso de antimicrobianos es un factor determinante en su desarrollo. La población pediátrica no queda exenta de dicha problemática ya que la prescripción de antibióticos en pediatría es elevada, y en muchas ocasiones inadecuada.
La incorporación de los programas de optimización de uso de antimicrobianos (PROA) ha resultado ser una medida crucial para disminuir el riesgo en la aparición de resistencias antibióticas. A nivel internacional se reconoce la necesidad de crear PROA específicos en pediatría (PROA-P) debido a las diferencias existentes entre pacientes adultos y pediátricos en referencia a las infecciones, así como al abordaje tanto diagnóstico como terapéutico de las mismas. Por esta misma razón, los PROA-P deben ser programas multidisciplinares liderados por especialistas en infecciones pediátricas y trabajar con indicadores específicos pediátricos (DOT, patrones de sensibilidad antibiótica de población pediátrica, indicadores clínicos…), que permitan detectar puntos de mejora y establecer estrategias dirigidas eficaces. Por otro lado, es imprescindible el apoyo y liderazgo por parte de las distintas sociedades científicas implicadas.
El objetivo de este documento es dar a conocer el posicionamiento de la Sociedad Española de Infectología Pediátrica (SEIP) sobre la implementación de los PROA pediátricos hospitalarios en nuestro territorio, así como aportar herramientas que ayuden en la aplicación de dichos programas en los diferentes hospitales de las distintas regiones sanitarias del país.
In the past few years, antimicrobial resistance has increased, becoming a serious public health problem. The irrational use of antimicrobials is one of the main contributors to antimicrobial resistance. The paediatric population is not free from this problem, as antimicrobials are widely prescribed in this age group, often inappropriately.
The introduction of antimicrobial stewardship programmes (ASPs) has proven crucial in curbing the emergence of antimicrobial resistance. At the international level, the need to develop specific paediatric ASPs has been recognised on account of the differences between adult and paediatric patients as concerns infection and approaches to diagnosis and treatment. For this reason, paediatric ASPs should be multidisciplinary programmes led by paediatric infectious disease specialists and use specific paediatric indicators (such as days of treatment, antimicrobial susceptibility patterns in the paediatric population, or clinical indicators) to help identify areas of improvement and develop effective targeted interventions. On the other hand, the support and leadership of the pertinent scientific societies are also essential.
The purpose of this document is to present the position of the Sociedad Española de Infectología Pediátrica (SEIP, Spanish Society of Paediatric Infectious Diseases) concerning the implementation of paediatric ASPs in hospitals in Spain and to provide tools to facilitate their application in hospitals throughout the regional health care systems in the country.
El auge en la aparición de resistencias a los antimicrobianos (RA) supone un importante problema de salud pública que también afecta a la población pediátrica. La generación de RA es multifactorial, siendo el uso excesivo e inadecuado de los antimicrobianos crucial en su desarrollo1.
Los antibióticos son los fármacos más utilizados en pediatría, observándose en los últimos años un aumento en el uso y en la duración de los tratamientos antibióticos de amplio espectro para tratar las infecciones en las que no están indicados2. A nivel hospitalario, el último corte de prevalencia de consumo de antimicrobianos en Europa realizado por los European Centre for Disease Prevention and Control (ECDC) mostró que un 38% de los pacientes pediátricos ingresados recibieron al menos un tratamiento antibiótico durante su ingreso. Estratificado por edades, el porcentaje de pacientes de entre uno y 5 años que recibieron antibióticos ascendía hasta un 49%, cifra muy superior a la media en población adulta (no superior al 38% en cualquier franja etaria)3.
Programas de optimización de uso de antimicrobianos en pediatría hospitalariaLa incorporación de los programas de optimización de uso de antimicrobianos (PROA) en la atención médica se ha convertido en una de las principales acciones para minimizar el riesgo de aparición de RA, prolongando el tiempo de vida útil de los antimicrobianos disponibles. Se trata de programas multidisciplinares dirigidos a mejorar la calidad en el uso de los antimicrobianos. Los objetivos de los PROA son mejorar los resultados clínicos de los pacientes con infecciones, minimizar los efectos adversos asociados a la utilización de antimicrobianos (incluyendo RA) y garantizar la utilización de tratamientos coste-eficaces4. Desde hace más de 10 años, sociedades científicas como la Infectious Diseases Society of America (IDSA), la Pediatric Infectious Diseases Society (PIDS) o la American Academy of Pediatrics (AAP) han reconocido como prioridad la creación de programas PROA específicos para los pacientes pediátricos1. Esta necesidad responde al elevado e inadecuado consumo antibiótico en este grupo de edad, a las diferencias existentes en la etiología y las características clínicas de las infecciones en los niños, a las características farmacocinéticas de los agentes utilizados en esta población, a la incidencia de las infecciones debidas a microorganismos resistentes y a la menor evidencia respecto a la eficacia y seguridad de algunos antimicrobianos en neonatos y niños.
El PROA es un programa de calidad asistencial que ha de diseñarse bajo el marco de la Comisión de Infecciones y Política de Antibióticos, y debe ser asumido como propio por parte de la dirección médica de cada centro o área sanitaria. Para una implantación eficaz es necesario un compromiso claro por su parte. Igualmente se precisa un liderazgo profesional por parte de las distintas sociedades científicas, y por parte de profesionales especialistas en enfermedades infecciosas (EI). En 2012 la Sociedad Española de Infecciosas y Microbiología Clínica (SEIMC), la Sociedad Española de Farmacia Hospitalaria (SEFH) y la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH) redactaron un documento para concienciar a profesionales de la sanidad de la necesidad de implantar estos programas y que, a su vez, sirviera como modelo de funcionamiento de un PROA adaptado a las diferentes circunstancias sociosanitarias4.
Ha sido en 2022 cuando se ha redactado un documento más específico que incluye la visión pediátrica aportada por la Sociedad Española de Infectología Pediátrica (SEIP)5. En cuanto al liderazgo individual, es crucial que los PROA pediátricos (PROA-P) sean dirigidos y liderados por especialistas en EI pediátricas conformando un equipo-PROA con microbiólogos, farmacéuticos, medicina preventiva, enfermería y los prescriptores. Si la atención pediátrica de un centro no tiene un volumen asistencial suficiente para llevar a cabo un programa pediátrico específico, un pediatra experto en antibióticos deberá formar parte del equipo-PROA del centro, trabajando indicadores específicos pediátricos1. Además, desde la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) se ha desarrollado el Plan Nacional frente a las Resistencias a los Antibióticos (PRAN), en el que se ha establecido un marco de actuación nacional en la lucha contra las RA. En él, se definen estrategias para la implantación de los PROA y se establecen los criterios para la certificación de los equipos-PROA en base a unos estándares definidos que evalúan su grado de excelencia.
Pese a que en los últimos años han aumentado las acciones PROA específicas en pediatría, se hace imprescindible seguir trabajando en difundir conocimiento a través de documentos que a su vez ayuden a aplicar programas PROA-P en los distintos hospitales y áreas sanitarias hospitalarias del país.
Intervenciones de los programas de optimización de uso de antimicrobianosComprenden las estrategias dentro del marco de actuación del PROA para obtener sus objetivos. Los tipos principales se resumen en la tabla 11,6,7. Por su momento de aplicación se dividen en previas y posteriores a la prescripción.
Tipos de intervenciones de los PROA en pediatría
| Tipo de actividad | Características | Momento de aplicación |
|---|---|---|
| Formación pasiva y activa | Actividades de formación y educación en conceptos y principios sobre el uso adecuado de antimicrobianos:Pasivas: el instructor da soporte formativo (sesiones teóricas, material informativo, notificaciones en la intranet)Activas: el desarrollo del aprendizaje es protagonizado por el prescriptor (talleres prácticos, simulaciones). | Pueden aplicarse en cualquier momento del proceso de prescripción (antes, durante y después)Deben aplicarse de forma constante para generar un efecto a largo plazo. |
| Guías clínicas y algoritmos de manejo | Planes de manejo multidisciplinar estandarizados y basados en evidencia, que identifican una secuencia adecuada de intervenciones clínicas, plazos, hitos y resultados esperados. Incluye:Desarrollo de guías institucionales.Elaboración de informe acumulado de sensibilidad a antimicrobianos.Elaboración de un plan para detectar, descartar y desensibilizar alergias a antimicrobianos.Integración de sistemas informáticos de apoyo a la prescripción.Realización de visitas educativas y recordatorios con la distribución de material en reuniones. | Deben elaborarse previo a la prescripción. |
| Restrictivas | Cuando se restringe el uso de ciertos antimicrobianos o grupos de antimicrobianos de alto impacto ecológico, precisando la autorización de un asesor experto para su uso. Puede incrementar el uso de los antimicrobianos no restringidos cambiando el perfil de resistencias microbiológicas; por lo cual se suele reservar solo en situaciones de brotes o cuando se precisen resultados de manera precoz. | Se definen antes de la prescripción y tienen efecto durante la misma. |
| Impositivas | Cuando un asesor experto tiene total autonomía para modificar las prescripciones con el fin de optimizar el tratamiento antimicrobiano. Poco aceptadas por los prescriptores, se recomienda su aplicación solo en circunstancias de urgencia. | Posterior a la prescripción. |
| Consenso-formativas | Cuando un asesor experto revisa de manera conjunta con los prescriptores los tratamientos antimicrobianos, consensuando con el prescriptor el tratamiento óptimo. Las más aceptadas actualmente, tienen un impacto superior y a largo plazo sobre los prescriptores. Se denominan comúnmente auditorías prospectivas con retroalimentación o asesorías clínicas o entrevistas educacionales | Posterior a la prescripción. |
La puesta en marcha de actividades previas a la prescripción de los antimicrobianos permite optimizar su uso. Generalmente requieren pocos recursos y tienen un elevado impacto. Su facilidad de implementación hace que sean actividades básicas en cualquier PROA.
FormaciónElemento esencial del PROA8, su objetivo no es solo disminuir el consumo de antimicrobianos, sino que, cuando estén indicados, se prescriba el antimicrobiano de elección, a la dosis y vía de administración correctas y con la duración más adecuada8. Las actividades formativas generan conocimiento y modifican los hábitos de prescripción.
Es conveniente implicar en la formación sobre uso racional de antimicrobianos a todos los profesionales sanitarios relacionados con su prescripción, dispensación y administración, incluyendo planes de formación continuada para profesionales en activo, y su integración en el plan formativo de los médicos internos residentes y estudiantes. Las actividades formativas deben realizarse de forma periódica para mejorar la adquisición del conocimiento.
Existen diferentes actividades formativas, complementarias entre sí, pudiendo clasificarse en actividades formativas pasivas y activas (tabla 1)9. La discusión de aspectos prácticos del abordaje de casos concretos, simulados o reales, con participación de los receptores de la formación, suele tener mayor impacto que las actividades pasivas.
Las nuevas tecnologías suponen un recurso fundamental en la educación, permitiendo la realización de cursos formativos online, a los cuales pueden asistir un número elevado de alumnos de forma telemática, así como el desarrollo de aplicaciones para dispositivos electrónicos o páginas web con información útil.
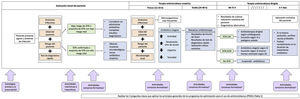
Los objetivos de aprendizaje y competencias a adquirir están incluidos en la tabla 28. Los cuatro momentos en la prescripción de antimicrobianos (fig. 1) es una estrategia formativa muy útil10.
Objetivos de aprendizaje y competencias para la correcta utilización de los antimicrobianos
| Área | Objetivos de aprendizaje y competencias |
|---|---|
| Resistencia antimicrobiana | • Conocer la epidemiología de la resistencia antimicrobiana: extensión nacional, regional y local del problema para los principales microorganismos. |
| • Aprender la importancia de la prevención de la transmisión de los microorganismos resistentes e incorporar los principios de control de infección a la práctica diaria. | |
| Diagnóstico de enfermedades infecciosas | • Evaluar clínicamente a pacientes con sospecha de infección. |
| • Identificar a los individuos que se benefician del inicio de antibioterapia empírica y aquellos en los que no es necesario iniciarlo. | |
| • Conocer la epidemiología de las enfermedades infecciosas en los distintos grupos etarios. | |
| • Indicar apropiadamente las pruebas microbiológicas disponibles. | |
| • Extraer, transportar y procesar adecuadamente las muestras microbiológicas. | |
| • Interpretar correctamente los resultados microbiológicos. | |
| Tratamiento antimicrobiano y principios del tratamiento de las enfermedades infecciosas | • Conocer los antimicrobianos disponibles y si están aprobados en pediatría, así como el impacto ecológico y valor estratégico de los mismos. |
| • Optimizar la selección de antimicrobianos y su dosificación en tratamientos empíricos (principios básicos de farmacocinética/farmacodinámica). | |
| • Adecuar la selección de antimicrobianos y su dosificación en tratamientos dirigidos. | |
| • Optimizar la utilización de la terapia secuencial. | |
| • Adecuar la duración de los tratamientos antimicrobianos. | |
| • Utilizar adecuadamente la profilaxis antimicrobiana: seleccionar adecuadamente los pacientes en los que está indicada, así como los agentes a utilizar, su dosis, tiempo de administración y duración. | |
| • Evaluar y tratar al paciente con alergia a antimicrobianos. | |
| Gestión de la información | • Registrar y documentar en la historia clínica la indicación de antibioterapia y la duración prevista del tratamiento. |
| • Informar al paciente y sus familiares sobre las decisiones en antibioterapia (tanto cuando se prescribe, como cuando no). | |
| • Gestionar las expectativas de los pacientes y familiares sobre la prescripción de antimicrobianos. |
Fuente: Adaptado del documento del PRAN «Herramientas e intervenciones educativas a profesionales sanitarios», 20178.
Cuatro momentos en la prescripción de antimicrobianos.
Fuente: Adaptado de Tamma et al., 201910 y de «Four Moments of Antibiotic Decision Making». Disponible en: https://www.ahrq.gov/antibiotic-use/acute-care/four-moments/index.html.
Las guías de tratamiento antimicrobiano son una de las herramientas más importantes para la implementación de políticas antimicrobianas11. Es conveniente que los centros dispongan de guías locales para el diagnóstico y tratamiento de las principales EI, realizadas de forma multidisciplinar, con la participación de las diferentes áreas implicadas en la atención de estos pacientes para garantizar la correcta adherencia a las mismas. Las recomendaciones tienen que estar adaptadas a la microbiología local, teniendo en cuenta la prevalencia de RA en la elección del tratamiento1,4.
Las guías deben incluir el tratamiento empírico y dirigido, las alternativas en el caso de alergias medicamentosas, la duración y recomendaciones sobre el paso a vía oral, las dosis de los antimicrobianos y su ajuste en insuficiencia renal y hepática. Además, es fundamental implementar protocolos de profilaxis quirúrgica, al suponer una de las indicaciones más frecuentes de antibioterapia en los hospitales.
Deben contar con un plan de difusión, y estar accesibles de forma sencilla (p. ej., a través de la intranet, trípticos, aplicaciones móviles, etc.). Es importante realizar un plan de revisión y actualización periódica de las mismas, para asegurar la máxima evidencia de las recomendaciones emitidas. Conviene disponer de guías de tratamiento tanto para la infección comunitaria como para las relacionadas con la asistencia sanitaria.
Las guías sirven también de referencia para la evaluación de la adecuación del tratamiento antimicrobiano. Lo ideal es utilizar guías locales (guías nacionales adaptadas a la epidemiología local). En su ausencia, es posible acceder a guías internacionales, priorizando las más próximas al ámbito del centro por su mayor similitud epidemiológica.
Informe acumulado de sensibilidad a antimicrobianosTambién denominados mapas microbiológicos, se trata de informes realizados de forma periódica por los servicios de microbiología que incluyen el porcentaje de aislamientos sensibles de una selección de microorganismos a determinados antibióticos12. Estos informes presentan varios usos: a) monitorización de la prevalencia de microorganismos resistentes; b) ayudar a la elaboración de las guías de tratamiento antimicrobiano adaptadas a la epidemiologia local, y c) facilitar la toma de decisiones empíricas del clínico en situaciones concretas en las que aún no dispone de resultados microbiológicos13.
La selección de los microorganismos y los antibióticos para estos informes se realizará de acuerdo con criterios epidemiológicos, priorizando los de mayor interés por su frecuencia e impacto clínico. En nuestro medio se recomienda clasificar la sensibilidad según los puntos de corte indicados por el European Committee on Antimicrobial Susceptibility Testing (EUCAST), que también se revisan de forma periódica, indicando el porcentaje de microorganismos sensibles, sensibles incrementando exposición y resistentes. Los aislamientos incluidos deben ser los obtenidos de muestras clínicas, excluyendo los de vigilancia epidemiológica y ambientales.
La periodicidad mínima recomendada es anual, tiene que haber un plan de difusión y deben estar accesibles de forma sencilla. Además, conviene monitorizar los fenotipos asociados a los mecanismos de resistencia y no exclusivamente los datos brutos de resistencia por antimicrobianos.
Debido a la diferente epidemiología entre adultos y niños, es importante reportar los datos disgregados por edad14. Igualmente, en hospitales con unidades pediátricas especializadas con alto número de pacientes (p. ej., UCIP, oncohematología, neonatología…), es conveniente realizar un análisis específico en cada unidad. En los centros con un número reducido de pacientes pediátricos, si el número total de aislamientos por especie o grupo es inferior a 30, se pueden agrupar los datos de varios años, y/o los datos disgregados por unidades. Para la infección comunitaria, agrupar datos de distintos laboratorios de un área geográfica próxima sería una alternativa.
Alergia a antimicrobianosEl antecedente de alergia a antimicrobianos, confirmada o sospechada, es frecuente y condiciona la selección de antimicrobianos alternativos, frecuentemente menos eficaces o más tóxicos que los de primera línea, asociándose a peores resultados clínicos14. Aunque la prevalencia de alergia a β-lactámicos autodeclarada en niños oscila entre el 1,7 y el 5,2%, solo una minoría son verdaderamente alérgicos15.
Es fundamental realizar una anamnesis detallada a la hora de atender a estos pacientes, evaluando las características y los riesgos asociados, con el fin de seleccionar el antimicrobiano óptimo. La valoración alergológica, que puede realizarse a todas las edades, será determinante para definir correctamente la sospecha y el tipo de alergia. En ocasiones, será preciso realizar una desensibilización, al ser prioritario tratar de preservar el antimicrobiano de primera línea.
Sistemas informáticos de apoyo a la prescripciónCada vez es más frecuente la disponibilidad de sistemas informáticos integrados en la prescripción farmacológica de los hospitales que apoyan la prescripción4. Las herramientas más frecuentes son la inclusión de protocolos de síndromes infecciosos en las aplicaciones de prescripción farmacológica, que seleccionan el antimicrobiano o antimicrobianos de primera línea según las guías locales y las dosis ajustadas al peso, incluido la dosis máxima. Esto evita errores de prescripción y mejora la adherencia a las guías institucionales.
Estrategias posteriores a la prescripciónEstas intervenciones (tabla 1) tienen como función la evaluación dinámica de los tratamientos administrados buscando su adecuación a las guías institucionales1,6,7.
Auditorías prospectivas con retroalimentación o asesorías clínicasSon actividades consenso-formativas que por su aceptación e impacto en los prescriptores suponen el eje central en la mayoría de los PROA1,6,7,16. Requieren un trabajo conjunto entre el equipo-PROA y el prescriptor para evaluar y seleccionar la mejor alternativa antibiótica para el paciente1,6,7,16. Para una adecuada recepción de la actividad, debe desarrollarse una relación de respeto y confianza entre los miembros, donde cada uno aportará su conocimiento en beneficio del paciente, entendiendo que un tratamiento optimizado favorecerá los resultados clínicos y reducirá los efectos negativos de un uso inadecuado de los antimicrobianos. El asesor debe obtener la mayor información disponible sobre el paciente, e identificar aspectos clave para optimizar el tratamiento1,6,7,16.
Las auditorías prospectivas con retroalimentación (APR) se pueden realizar en cualquier momento de la evolución del tratamiento. Las asesorías clínicas pueden ser globales o dirigidas según antimicrobiano/grupos de antimicrobianos o unidad/servicio hospitalario o en procesos concretos. Se sugiere su aplicación en 5 momentos clave: al inicio del tratamiento, a las 12-24h (tratamiento empírico precoz), a las 24-48h (tratamiento empírico tardío), a las 48-72h (tratamiento dirigido) y a los 5-7 días (final de tratamiento o ajuste de duración en caso de precisar tratamientos prolongados)6,17. En una APR se deben evaluar 5 preguntas clave que aplican los principios generales de los PROA (tabla 3)7,18,19. Su aplicación en el proceso de la evaluación del paciente y la prescripción se detallan en la figura 2.
Preguntas clave que aplican los principios generales de los PROA
| Pregunta | Descripción |
|---|---|
| ¿Está indicado el tratamiento antibiótico en este paciente? | Debe evaluarse la indicación del tratamiento antimicrobiano, suspendiendo el mismo en situaciones donde no supondrá beneficio para el paciente (infecciones virales, patología no infecciosa)1,7,19. Si la sospecha de una infección bacteriana es baja, o el síndrome infeccioso no supone un compromiso vital o potenciales complicaciones graves, puede retrasarse el tratamiento antimicrobiano6,17. Los antibióticos deben iniciarse precozmente si se sospecha una infección bacteriana grave6,17. La indicación de un tratamiento se define por la evaluación de6,17: |
| A. Síndrome infeccioso: Su diagnóstico ponderará la potencial gravedad de la infección y las posibilidades etiológicas más frecuentes. | |
| B. Edad del paciente: La edad en pediatría (neonato, lactante, niño, adolescente) es un factor de evaluación fundamental, ya que por sí misma define un nivel de riesgo y varía los agentes etiológicos más frecuentes para un síndrome infeccioso determinado. | |
| C. Riesgo del paciente: Identificar factores de riesgo adicionales a la edad como inmunosupresión, susceptibilidades en función a patologías de base, historia de exposición. | |
| D. Test de diagnóstico rápido: Permiten identificar infecciones subsidiarias de tratamiento antimicrobiano (o causas alternativas que no lo requieran), con una precocidad superior a los cultivos.40 Incluyen tinciones (tinción de Gram, tinción de Ziehl-Neelsen, tinción de auramina-rodamina, tinta china, tinción de Giemsa, etc.), técnicas de visualización directa (KOH, campo oscuro, gota gruesa, etc.) y pruebas moleculares de detección de antígenos o de ácidos nucleicos de los microorganismos que pueden realizarse en distintas muestras biológicas (respiratoria, urinaria, suero, líquido cefalorraquídeo, exudados) identificando bacterias, virus, hongos o parásitos, con un tiempo de respuesta desde varios minutos hasta 4-6 horas40. Pueden detectarse también determinantes de resistencia del patógeno que permitan optimizar el tratamiento en la fase empírica precoz (ejemplo: genes de resistencia a beta-lactámicos/carbapenemas en Enterobacterales y P. aeruginosa, detección del gen mecA/mecC para identificar resistencia a meticilina en S. aureus)40. Su rendimiento puede ser variable según la muestra, técnica utilizada y probabilidad pre-test, por lo cual la interpretación debe realizarse con cautela con personal experto de enfermedades infecciosas. | |
| ¿Cuál es el síndrome infeccioso sospechado? | El síndrome infeccioso se identifica mediante la anamnesis, exploración física y pruebas complementarias6,17. Su identificación es crucial, ya que influirá en la indicación y elección del antimicrobiano. Los antimicrobianos deben prescribirse para el tratamiento de un síndrome infeccioso determinado y evitar su uso indiscriminado por sensación de seguridad ante un paciente con una evolución desfavorable por patología vírica o causa no infecciosa6,17. |
| ¿Qué muestras microbiológicas debo extraer para el diagnóstico? | Antes de iniciar el tratamiento antibiótico, deben extraerse todas las muestras microbiológicas necesarias para poder realizar la confirmación diagnóstica del síndrome infeccioso sospechado6,17,40. Debe incidirse con respecto a la indicación, métodos de extracción, preservación y transporte de estas muestras; así como la correcta interpretación de los resultados microbiológicos: lectura interpretada del antibiograma y la identificación de resultados positivos no indicativos de infección (contaminación, colonizaciones)40. |
| ¿Cuál es el antibiótico más apropiado? | El tratamiento empírico se determina mediante la evaluación del síndrome infeccioso, edad, factores de riesgo y microbiología local, concretando los patógenos más frecuentes y sus patrones de resistencia1,6,17. El tratamiento dirigido se elegirá basado en la lectura interpretada del antibiograma1,6,17. Debe seleccionarse el antibiótico con mayor actividad y penetración en el sitio de la infección, y con menor espectro y toxicidad posible (Figura 2). Al seleccionar el antibiótico se debe definir la vía de administración, dosis, intervalos y duración prevista1,6,17. |
| ¿He aplicado las medidas para el control del foco de la infección? | El correcto manejo de una infección comprende el adecuado control del foco. Retirada de catéteres vasculares, sondajes y otros dispositivos infectados, así como el drenaje de abscesos son medidas fundamentales. Un inadecuado control del foco conlleva fallos terapéuticos, tratamientos prolongados, o ampliación innecesaria del espectro antimicrobiano. En un paciente que reciba un tratamiento antibiótico correcto para su síndrome infeccioso que no responda adecuadamente, sospechar la posibilidad de un foco no controlado. |
PROA: programas de optimización de uso de antimicrobianos.
Aplicación de actividades PROA en el paciente pediátrico.
ISTA: Infección subsidiaria de tratamiento antimicrobiano; ISTA-CM: Infección subsidiaria de tratamiento antimicrobiano confirmada microbiológicamente; ISTA-SCM: Infección subsidiaria de tratamiento antimicrobiano sin confirmación microbiológica; SI: Síndrome infeccioso.
Fuente: Adaptado de Goycochea-Valdivia y Neth6, 2019 y Bielicki et al., 201717. Las flechas en los recuadros morados indican el momento de aplicación de las actividades PROA (tabla 1) en el proceso de prescripción.
1 El SI, edad, factores de riesgo y test de diagnóstico rápido definirán el riesgo de ISTA y el nivel de riesgo vital, según lo cual valorar retrasar o iniciar antibioterapia.
2 El SI, edad, factores de riesgo y microbiología local orientarán los microorganismos más frecuentes (elección de antibioterapia empírica). Evaluar:
Espectro adecuado: adaptarlo siempre al mínimo posible para evitar el aumento de la presión ecológica.
Vía de administración: parenteral u oral, en función del SI, edad del paciente, tolerancia enteral, absorción intestinal y concentración en el sitio de acción.
Vía parenteral: asegura mayor biodisponibilidad, se suele utilizar en infecciones graves y en lugares donde es difícil alcanzar altas concentraciones.
Vía oral: se suele utilizar en infecciones leve-moderadas o para completar tratamientos de infecciones graves (valorar el paso a vía oral siempre que sea posible). En algunos casos es la única vía disponible. Verificar situaciones que puedan interferir con la absorción.
Dosis: en pediatría debe ajustarse al peso o superficie corporal. Verificar la dosis máxima permitida, situaciones que precisen monitorización de niveles plasmáticos, situaciones que alteren la farmacocinética (función renal, hemofiltración, soporte circulatorio mecánico, volumen de distribución, interacciones) y en las que el dintel actividad/toxicidad sea relevante (antibióticos-concentración dependiente).
Intervalo: puede variar en función de la edad (sobre todo en neonatos), al SI y de las situaciones que alteren la farmacocinética. Valorar situaciones que se puedan beneficiar del uso de perfusión extendida o continua (antibióticos tiempo-dependiente).
Duración: la duración debe definirse desde al inicio del tratamiento y revisarse tras confirmación microbiológica. La evidencia cada vez soporta más el uso de tratamientos cortos, aunque en pediatría aún es limitada.
3 Guiar antibioterapia con información microbiológica preliminar.
4 Definir si el paciente tiene una ISTA-CM, ISTA-SCM o si no tiene una ITSA, y actuar en función.
5 Confirmar el cumplimiento de la duración correcta del tratamiento antibiótico, verificando los casos que requieran tratamientos prolongado.
La monitorización y la comparación con la situación previa u otros centros, así como la comunicación transparente de los resultados, son aspectos inherentes a estos programas. La monitorización de los resultados en pacientes pediátricos hospitalizados tiene diferencias considerables respecto a los adultos.
Indicadores clínicosLos principales indicadores utilizados son la duración de la estancia hospitalaria (DEH), el reingreso, la mortalidad y la RA7,14,20–26. Los indicadores utilizados en adultos pueden no ser adecuados en niños (p. ej., las tasas de infección por Clostridioidesdifficile que precisan la exclusión en el análisis de los menores de dos años por ser portadores frecuentes).
Indicadores de consumoLos indicadores más habituales en pediatría hospitalaria se indican en la tabla 4. Actualmente, el indicador de consumo más recomendado en pediatría es «Días de Tratamiento» (DOT). Estos indicadores idealmente deberán ser calculados por el conjunto del hospital y detallados por unidad de tratamiento o servicio, con una periodicidad según los recursos disponibles (anual, trimestral o mensual).
Indicadores de consumo antimicrobiano hospitalario de uso más habitual en población pediátrica
| Indicador de consumo | Consideraciones |
|---|---|
| Días de tratamiento (DOT) (del inglés: Days Of Therapy)a | • Número de días que un paciente recibe un determinado antimicrobiano, independientemente de la dosis utilizada.• Se trata del indicador de consumo recomendado en la actualidad para la medición en pacientes pediátricos y neonatales en el hospital.• Debería calcularse para fármacos específicos, por unidad clínica o para grupos de pacientes asociados a un diagnóstico específico.• Deben expresarse ponderadas a la actividad asistencial, habitualmente calculada por 100 o 1.000 pacientes/día, estancias o altas hospitalarias.• Limitaciones: Su cálculo puede implicar cierta complejidad, necesita disponer de prescripción electrónica e idealmente de registro de administración. No considera las dosis utilizadas. En neonatos puede dar resultados diversos a otros grupos etarios, debido a las pautas de dosificación de cada 18 o 48 h. |
| Dosis diaria prescrita (PDD) (del inglés: Prescribed daily dose) | • Dosis prescrita habitualmente de un determinado antimicrobiano.• Mayor utilidad para evaluar el cumplimiento de protocolos o el uso de agentes específicos.• Limitaciones: Mayor dificultad para establecer comparaciones entre centros. |
| Duración de la terapia (LOT) (del inglés: Length of Therapy) | • Número de días de tratamiento antibiótico, independientemente del número de antibióticos por día.• Inversamente relacionado a los días libres de antimicrobiano.• Limitaciones: No tiene en cuenta el intervalo de dosificación. |
| Días de tratamiento/duración de la terapia (DOT/LOT) | • Limitaciones: Su cálculo puede implicar cierta complejidad, no considera las dosis utilizadas. |
| Dosis diarias definidas (DDD) (del inglés: Defined daily dose) | • Dosis media de mantenimiento diaria de un antimicrobiano utilizado para su principal indicación en adultos.• Puede realizarse una variante ajustada por peso. Se calcula la dosis pediátrica de mantenimiento diaria del antimicrobiano ajustada por kilogramo de peso, estandarizado a un peso promedio del servicio evaluada.• Resulta preferible y necesario utilizar DOT en población pediátrica y neonatal.• Limitaciones: Dependiente del peso, muy variable en niños, por lo que presenta un sesgo considerable en su cálculo. Pueden sobreestimar el consumo antibiótico en situaciones en las que se utilicen dosis mayores a las definidas (multirresistencias, pacientes críticos, etc.) |
| Inicio de tratamiento (SOT) (del inglés: Start of treatment) | • Número de pacientes que reciben un antimicrobiano, con independencia del número, del espectro y de la duración, durante un periodo de tiempo determinado.• Habitualmente, se determina por cada 100 o 1.000 pacientes ingresados durante un periodo de tiempo determinado.• Especialmente útil en la evaluación de determinadas enfermedades (p. ej., pacientes hospitalizados con bronquiolitis aguda que reciben tratamiento antimicrobiano).• Limitaciones: No tiene en cuenta la duración, las combinaciones ni el espectro antimicrobiano. |
| Conversión de intravenoso a vía oral | • Indicador de antimicrobianos con alta biodisponibilidad oral.• Se suele calcular el porcentaje de pacientes que cambian a antibiótico oral dentro de las primeras 24 h tras estar indicado según guías de práctica clínica, así como la mediana del tiempo en que se demora la ejecución del cambio desde el momento de la indicación.• Debería calcularse para fármacos específicos, por unidad clínica o para grupos de pacientes asociados a un diagnóstico específico. |
Una limitación importante de los indicadores de consumo es que no consideran la adecuación del uso de los antimicrobianos monitorizados. Los cortes de prevalencia son evaluaciones puntuales de los antimicrobianos prescritos que permiten medir su adecuación e identificar oportunidades de mejora y prioridades de acción. Se realizan periódicamente e incluyen idealmente el porcentaje de pacientes con indicación documentada, ajuste del tratamiento a las guías establecidas, adecuación de la dosis para el síndrome infeccioso y peso, duración del tratamiento, alergias a antimicrobianos espurias, uso adecuado de profilaxis quirúrgica y de la vía oral.
Evidencias actualesVarios documentos internacionales definieron hace años los principios y las estrategias clave para desarrollar los PROA en niños7,14,19. Desde entonces, las evidencias de su utilidad en pediatría se han expandido, aunque más lentamente que en adultos21,27. El desarrollo de guías pediátricas específicas de tratamiento antibiótico empírico y las asesorías por parte de infectólogos pediátricos han demostrado mayor impacto.
La mortalidad intrahospitalaria en pediatría es menor que en adultos, por lo que una disminución de la mortalidad resulta difícil de documentar. Sin embargo, los PROA han demostrado ser seguros, ya que la mortalidad antes y después de estas intervenciones se mantuvo estable tras la implementación de varias estrategias neonatales28 y pediátricas16,23,29–31. La reducción de la DEH y el reingreso han sido los indicadores clínicos más frecuentemente utilizados en el PROA-P.
Un estudio multicéntrico realizado en hospitales pediátricos de los EE. UU. estableció una reducción global del uso de antibióticos después de una intervención PROA26. Otros estudios unicéntricos han documentado reducciones globales significativas usando APR en intervenciones con o sin restricción16,30,32–34. La APR, por sí sola, es eficaz para disminuir el uso de antimicrobianos en los niños, y los médicos prescriptores podrían lograr una adherencia a las recomendaciones más duradera. Se ha documentado una reducción de antibióticos seleccionados o de amplio espectro también en otros estudios35,36.
Se han realizado pocos estudios para evaluar la reducción de la RA en niños. Lighter-Fisher et al.32 y Horikoshi et al.37 documentaron una reducción en las RA para organismos gramnegativos. A diferencia de en los adultos, los datos actuales que respalden que los PROA en niños reducen la RA son aún escasos7.
Varios estudios en pediatría han documentado una disminución significativa de los costes después de un PROA30,34, por lo que destinar personal facultativo para estas intervenciones en niños puede resultar coste-efectivo7.
Lagunas y barrerasLos PROA son intervenciones que pretenden una modificación en la conducta de la prescripción de antimicrobianos que sea duradera. Su éxito depende, en gran medida, de que sus intervenciones sean diseñadas considerando el conocimiento de las ciencias sociales y del comportamiento38. En pediatría, la prescripción antimicrobiana viene condicionada habitualmente por una alta proactividad terapéutica con una escasa proactividad diagnóstica.
El argumento tradicional de la utilidad de los PROA ante la urgencia de las RA a nivel global frecuentemente no es percibido por los prescriptores como un factor que condicione de forma inmediata a sus pacientes. Sin embargo, argumentos dirigidos al riesgo optimizable de los efectos adversos por el uso inadecuado del tratamiento antimicrobiano podrían tener un mayor impacto inmediato39. La educación sanitaria de la población en estos aspectos y la gestión de las expectativas y creencias de pacientes y familiares son también importantes.
Previamente al establecimiento de un PROA deberían analizarse, mediante encuestas y/o entrevistas a los prescriptores, qué factores están jugando un papel prioritario a la hora de prescribir antimicrobianos en la práctica clínica habitual. No existen modelos universales para la implementación de los PROA que garanticen el éxito. El diseño de estrategias dirigidas que combinen la detección de oportunidades de mejora, las conductas prescriptoras que en definitiva se pretenden cambiar, con el análisis de estos factores locales que influyen en la toma de decisiones a la hora de prescribir antimicrobianos será lo que conduzca al éxito. Es recomendable la utilización de técnicas bien establecidas de cambio de comportamiento y realizar evaluaciones durante el proceso para aprender por qué las estrategias propuestas fracasan o tienen éxito.
Es de vital importancia conocer datos específicos de consumo pediátricos. Para ello, es fundamental la implementación de las herramientas necesarias. Vincular los PROA-P hospitalarios con los de atención primaria, con políticas antimicrobianas compartidas y coordinadas entre ambos niveles, supone otra barrera necesariamente abordable.
La institucionalización de los PROA-P, con equipos-PROA multidisciplinares, complementados con otros especialistas del área de intervención que trabajen conjuntamente con indicadores específicos en cada una de las especialidades pediátricas (cuidados intensivos, cirugía, primaria, neonatología, etc.) es una de las herramientas que pueden favorecer la integración de estos programas de mejora de la calidad en nuestras instituciones en el futuro.
FinanciaciónEl presente manuscrito no ha recibido ninguna financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Emilia Cercenado Mansilla (Servicio de Microbiología y Enfermedades Infecciosas, Hospital General Universitario Gregorio Marañón, Universidad Complutense de Madrid. CIBERES, Centro de Investigación Biomédica en Red de Enfermedades Respiratorias, CB06/06/0058, Madrid); Cristina Epalza Ibarrondo (Sección de Enfermedades Infecciosas Pediátricas, Departamento de Pediatría. Grupo PROA. Instituto de Investigación Sanitaria Hospital Universitario 12 de Octubre [IMAS12], Madrid); Aurora Fernández Polo (Servicio de Farmacia, Hospital Universitario Vall d’Hebron, Barcelona); Marta García Ascaso (Unidad de Infectología Pediátrica, Hospital Infantil Universitario Niño Jesús, Madrid); Cristian Launes Montaña (Servei de Pediatria, Hospital Santa Joan de Déu, Barcelona. Grupo de Investigación en Enfermedades Infecciosas Pediátricas, Institut de Recerca Sant Joan de Déu, Barcelona. CIBER en Epidemiología y Salud Pública [CIBERESP], Madrid); Guillermo Martín-Gutiérrez (Unidad Clínica de Enfermedades Infecciosas, Microbiología y Medicina Preventiva del Hospital Universitario Virgen del Rocío. Grupo de investigación de Enfermedades Infecciosas, Instituto de Biomedicina de Sevilla [IBiS]. Universidad de Sevilla, Sevilla); Francisco Moreno Ramos (Servicio de Farmacia Hospitalaria. Instituto de Investigación del Hospital Universitario La Paz [IdiPAZ], Madrid); José Tomás Ramos Amador (Departamento de Pediatría, Universidad Complutense. Instituto de Investigación Sanitaria, Hospital Universitario Clínico San Carlos [IdISSC], CIBER de Enfermedades Infecciosas [CIBERINFEC], Instituto de Salud Carlos III, Madrid); Carlos Rodrigo Gonzalo de Liria (Servicio de Pediatría, Hospital Germans Trias i Pujol y Universidad Autónoma de Barcelona); María del Carmen Suarez Arrabal (Centro de Salud La Marina, Santander. Gerencia de Atención Primaria, Servicio Cántabro de Salud) y Eneritz Velasco Arnaiz (Unitat d’Infectologia, PROA-SJD. Hospital Sant Joan de Déu, Barcelona).