La neutropenia febril es una de las principales complicaciones infecciosas que sufren los pacientes pediátricos oncohematológicos, y a pesar los avances en diagnóstico y tratamiento, siguen condicionando una mortalidad y morbilidad significativa. Estos pacientes agrupan una serie de factores de riesgo de infección, donde destaca la neutropenia asociada a quimioterapia, la disrupción de barreras cutáneo-mucosas y el uso de dispositivos intravasculares. El abordaje diagnóstico y terapéutico precoz de los episodios de neutropenia febril en los pacientes oncohematológicos, ajustado a las características individuales de cada paciente, es fundamental para mejorar su pronóstico. Por ello, diseñar protocolos de abordaje, que sistematicen su atención, permite optimizar y homogeneizar su abordaje. Además, racionalizar el uso de los antimicrobianos, ajustando la duración y el espectro de los mismos, es crucial para hacer frente al incremento de resistencias a antimicrobianos.
El objetivo de este documento, elaborado entre la Sociedad Española de Infectología Pediátrica y la Sociedad Española de Hematología y Oncología Pediátrica, es dar recomendaciones de consenso sobre el manejo de la neutropenia febril en el paciente oncohematológico, respecto al abordaje inicial, terapia secuencial y de soporte e infección fúngica invasiva, que cada centro debe adaptar a las características de sus pacientes y epidemiología local.
Febrile neutropenia is one of the main infectious complications experienced by paediatric patients with blood or solid tumours, which, despite the advances in diagnosis and treatment, are still associated with a significant morbidity and mortality. These patients have several risk factors for infection, chief of which are chemotherapy-induced neutropenia, the disruption of cutaneous and mucosal barriers and the use of intravascular devices. Early diagnosis and treatment of febrile neutropenia episodes based on the patient's characteristics is essential in patients with blood and solid tumours to improve their outcomes. Therefore, it is important to develop protocols in order to optimise and standardise its management. In addition, the rational use of antibiotics, with careful adjustment of the duration of treatment and antimicrobial spectrum, is crucial to address the increase in antimicrobial drug resistance.
The aim of this document, developed jointly by the Spanish Society of Pediatric Infectious Diseases and the Spanish Society of Pediatric Hematology and Oncology, is to provide consensus recommendations for the management of febrile neutropenia in paediatric oncology and haematology patients, including the initial evaluation, the stepwise approach to its treatment, supportive care and invasive fungal infection, which each facility then needs to adapt to the characteristics of its patients and local epidemiological trends.
A pesar de los avances en el tratamiento y el aumento de la supervivencia en el cáncer infantil, las infecciones continúan siendo una causa importante de morbimortalidad, especialmente en los pacientes que reciben quimioterapia y asocian neutropenia, pudiendo ser la fiebre el único signo presente o asociarse a signos y síntomas inespecíficos.
Los pacientes pediátricos que reciben quimioterapia suelen presentar una disrupción de las barreras mucosas («mucositis»)1 que predispone a la infección por microorganismos oportunistas de la microbiota de la piel, de la mucosa oral2 y del tracto gastrointestinal. Por otra parte, el aumento de las resistencias a antimicrobianos en las infecciones relacionadas con la asistencia sanitaria complica el abordaje de estos pacientes.
Desde los Grupos de Trabajo de Infección Bacteriana y de Infección Fúngica Invasiva de la Sociedad Española de Infectología Pediátrica y el Grupo de Soporte de la Sociedad Española de Hematología y Oncológica Pediátrica se ha elaborado un documento de consenso para actualizar el diagnóstico y el tratamiento de la neutropenia febril (NF) en los pacientes pediátricos oncohematológicos, considerando que cada centro debe, a su vez, adaptar sus protocolos a la epidemiología local y los medios disponibles para su mejor diagnóstico y tratamiento.
Preguntas y recomendacionesEn la tabla 1 se resumen las recomendaciones de consenso de este grupo de trabajo.
Resumen de las recomendaciones de consenso sobre el manejo de la neutropenia febril en el paciente pediátrico oncohematológico
| 1. ¿Cuál es la definición de paciente pediátrico oncohematológico con NF?- La definición de NF implica la presencia de:Neutropenia: recuento absoluto de neutrófilos ≤500mm3 o ≤1.000mm3 con expectativa de descenso en las siguientes 24-48h por debajo de 500mm3.- Fiebre: registro único de temperatura axilar ≥38,3-38,5°C (>38°C en las recomendaciones del Reino Unido y Australia) o 2 mediciones ≥38°C separadas/mantenidas al menos una hora. |
| 2. ¿Cuáles son los microorganismos implicados en los episodios de NF en los pacientes pediátricos oncohematológicos? ¿Cuál es la importancia de los MR?Se aísla un microorganismo en hemocultivo entre el 10-30% de los episodios febriles en pacientes pediátricos con NF. La etiología de las bacteriemias muestra diferencias con respecto a los pacientes adultos, entre áreas geográficas y según la epidemiología de los distintos centros hospitalarios. Se ha evidenciado un incremento progresivo en la prevalencia de bacilos gramnegativos MR. |
| 3. ¿Cómo podemos estratificar el riesgo en el paciente pediátrico oncohematológico con NF?El uso de modelos validados de estratificación de riesgo en los episodios de NF en pediatría permite distinguir grupos de pacientes con mayor riesgo (tabla 2) de infecciones graves o evolución tórpida, frente a otros de menor riesgo. Implementar estos modelos permite adecuar los tratamientos a cada situación, así como la posibilidad de tratamientos ambulatorios o altas precoces.Cada centro ha de seleccionar los criterios de clasificación de riesgo que desea utilizar, priorizando los modelos evaluados en poblaciones similares, e idealmente validándolos localmente. |
| 4. ¿Cuál debe ser la actuación inicial en el paciente pediátrico oncohematológico con NF?La neutropenia condiciona una respuesta inflamatoria escasa, por lo que la fiebre en un paciente con neutropenia grave o en riesgo de esta, precisa una evaluación precoz y minuciosa para detectar posibles focos de infección, orientar la etiología del proceso e instaurar el tratamiento más adecuado. Ésta debe incluir hemocultivos, hemograma y biomarcadores inflamatorios. Otras pruebas complementarias (tabla 3) estarán dirigidas por los signos o síntomas presentes. |
| 5. ¿Cuál es la terapia antibacteriana empírica recomendada en el paciente pediátrico oncohematológico con NF?Los pacientes oncohematológicos pediátricos atendidos con NF deben recibir tratamiento antibiótico de amplio espectro, incluyendo cobertura frente a P. aeruginosa, tan pronto como se haya realizado la evaluación inicial, siendo fundamental iniciarlo en los primeros 60min de su atención.Según el riesgo individual se pueden establecer diferentes abordajes:5.1 Pacientes de alto riesgo5.1.1 Paciente hemodinámicamente estables- Recibirán de forma empírica tratamiento con un β-lactámico con actividad frente a P. aeruginosa (cefepima, piperacilina-tazobactam o ceftazidima), ajustando la elección a la epidemiología de cada centro.- Se debe considerar el tratamiento combinado junto a un antibiótico con actividad frente a BGN resistentes a β-lactámicos (aminoglucósidos, fluoroquinolonas o colistina) y/o junto a un antibiótico con actividad frente a CGP resistentes a meticilina (vancomicina, teicoplanina o daptomicina) en situaciones determinadas, como sospecha de infección relacionada con catéter o de piel, mucosas y/o partes blandas (tabla 4).- Se recomienda restringir el uso de carbapenémicos (meropenem o imipenem-cilastatina), aunque puede valorarse individualmente en pacientes con riesgo elevado de infecciones por microorganismos MR.5.1.2 Pacientes hemodinámicamente inestablesSe debe iniciar tratamiento inmediato con un carbapenémico con actividad frente a P. aeruginosa (meropenem o imipenem/cilastatina), recomendándose su asociación en pacientes con shock séptico con un antibiótico activo frente a BGN resistentes a β-lactámicos y un antibiótico con actividad frente a CGP resistentes a meticilina, considerando las características del paciente y la epidemiología local.5.2 Pacientes de bajo riesgoEn los pacientes clínicamente estables considerados de bajo riesgo, en los que sea posible un adecuado seguimiento (entorno familiar adecuado, infraestructura del centro y cercanía física que permitan rápida revaloración), con buena tolerancia oral y sin signos de trastornos malabsortivos, puede valorarse la antibioterapia empírica vía oral de forma ambulatoria, tras una vigilancia hospitalaria de 12-24h, asegurando un seguimiento estrecho del paciente (tablas 4 y 5). |
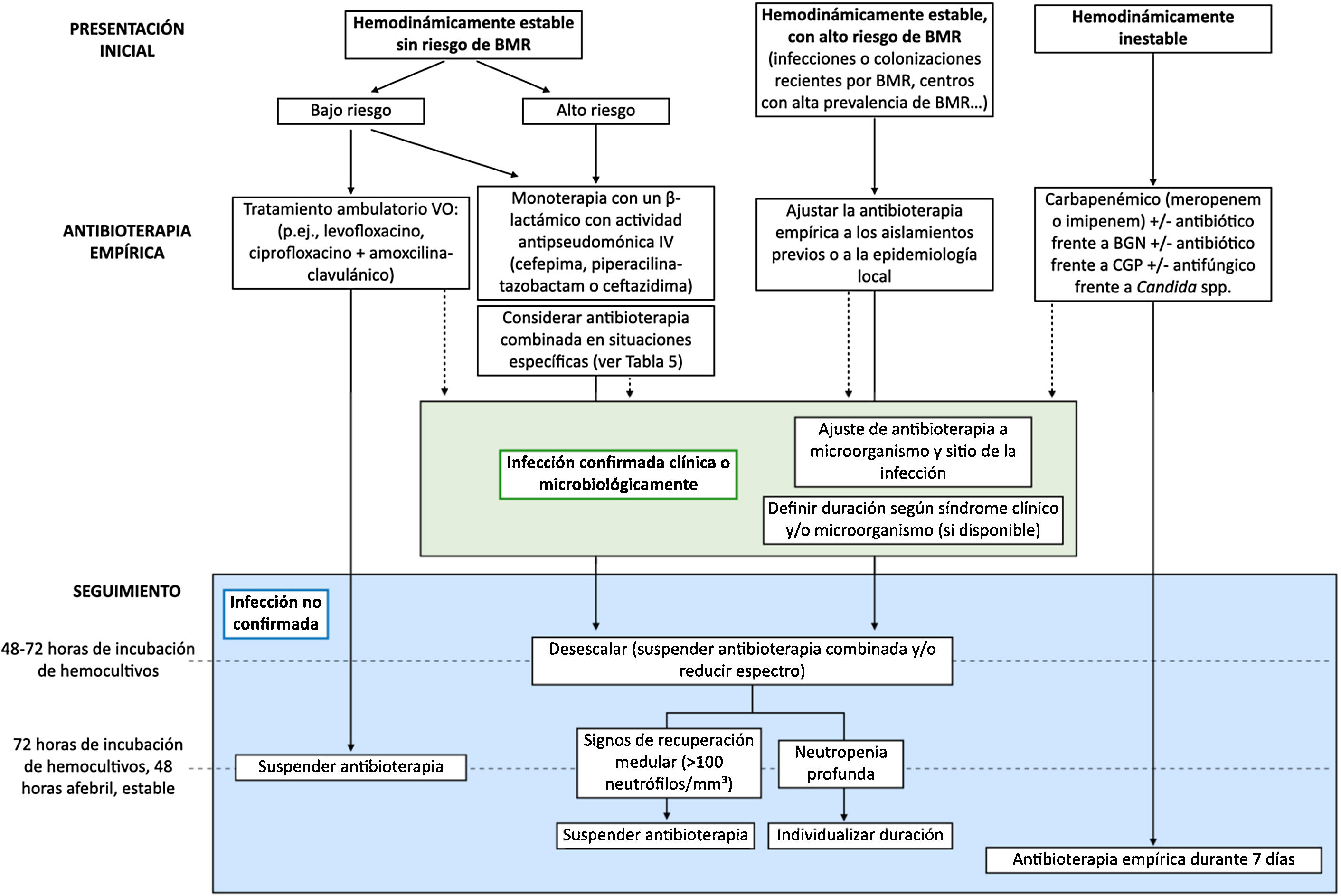
| 6. ¿Cómo debe realizarse la evaluación posterior en el paciente pediátrico oncohematológico con NF? (fig. 1)Una vez instaurada la antibioterapia empírica, la evaluación posterior debe guiarse idealmente por los aislamientos microbiológicos o foco detectado, para establecer una terapia dirigida ajustada al microorganismo aislado con control del foco si existiese, así como por el estado clínico y el riesgo individual.6.1. Infección bacteriana documentada clínica y/o microbiológica• Si hay algún aislamiento bacteriano que se considere patógeno relacionado con el episodio febril, se debe ajustar el tratamiento a antibióticos de espectro dirigido según el antibiograma del microorganismo y el sitio de la infección. El control del foco (p. ej., drenaje de abscesos, retirada de catéteres infectados), siempre que sea posible, es importante.• La duración del tratamiento dependerá del síndrome clínico, la evolución clínica y el aislamiento microbiológico, en caso de estar disponible, debiendo adecuarse a las guías específicas. En general, el tratamiento puede interrumpirse cuando los signos clínicos y síntomas se han resuelto, tras por lo menos 72h afebril y un mínimo de 7 días de duración. En caso de persistir neutropenia grave es recomendable mantener vigilancia clínica durante 24-48h tras la suspensión.• En caso de objetivar buena respuesta clínica y microbiológica, y disponer de un antibiótico activo frente al microorganismo aislado o al síndrome clínico, con buena disponibilidad vía oral, adecuada tolerancia y ausencia de signos malabsortivos, puede valorarse el paso secuencial a vía oral.6.2. Infección bacteriana no documentada clínica y/o microbiológicamente• No se recomienda ampliar el espectro antibiótico por persistencia de la fiebre si el paciente continúa estable, sin nuevos signos o síntomas, y sin aislamientos microbiológicos.• En los pacientes que se mantienen clínicamente estables a las 48-72h y que reciben antibioterapia empírica combinada, se deben suspender los antibióticos adicionales al β-lactámico (p. ej., aminoglucósidos, glucopéptidos) si no presenta ningún aislamiento microbiológico que justifique su mantenimiento. En el caso de tratamiento empírico con carbapenémicos, se puede desescalar a cefepima, piperacilina-tazobactam o ceftazidima si se dan las mismas circunstancias.• En el paciente inicialmente estable, la antibioterapia empírica se podría suspender tras 48h afebril, sin aislamientos microbiológicos tras 72h de incubación de los hemocultivos e inicio de la recuperación medular (p. ej., >100 neutrófilos/mm3), o con independencia del recuento de neutrófilos en los pacientes de bajo riesgo. En los pacientes de alto riesgo habría que individualizar la decisión en caso de no documentarse datos de recuperación medular, pudiendo ser seguro suspender la antibioterapia empírica tras 5-7 días y 48h afebril, manteniéndose en observación durante 24-48h.Si el paciente estaba clínicamente inestable al ingreso (sepsis grave o shock séptico), presenta mejoría clínica, pero con cultivos estériles, se recomienda mantener la antibioterapia empírica tras un mínimo de 7 días. |
| 7. ¿Cuál es la importancia de la IFI en el paciente pediátrico oncohematológico con NF?La incidencia de la IFI en pacientes pediátricos con cáncer o sometidos a TPH oscila entre el 2-20%33,35. El riesgo de IFI de cada paciente depende de su enfermedad de base y de diversos factores de riesgo asociados (tabla 6), siendo la neutropenia grave y prolongada el más relevante. |
| 8. ¿Cómo investigar la posibilidad de IFI en el paciente pediátrico oncohematológico con NF?Se debe investigar la posibilidad de IFI en pacientes con NF persistente ≥96h a pesar de tratamiento antibiótico adecuado. Se recomienda realizar pruebas de imagen (TC torácica, valorando otros según clínica), así como cultivos y biomarcadores fúngicos. |
| 9. ¿Cuándo y cómo iniciar la terapia antifúngica en el paciente pediátrico oncohematológico con NF? ¿Cómo debe realizarse la evaluación posterior tras el inicio de tratamiento antifúngico?Ante una sospecha de IFI, se debe valorar el uso inmediato de tratamiento empírico (con caspofungina o anfotericina B liposomal) o anticipado (según resultados de pruebas de imagen y biomarcadores fúngicos). Ambas estrategias son válidas en pediatría, así que su elección dependerá de las características de cada paciente, del microorganismo sospechado y de los recursos y epidemiología de cada centro. Además, es fundamental el control del foco y la reversión de los factores predisponentes. La monitorización y duración del tratamiento dependerá del microorganismo aislado o sospechado. |
| 10. ¿Qué tratamientos no antimicrobianos están indicadas en el tratamiento del paciente pediátrico oncohematológico con NF?El tratamiento del paciente con NF incluye medidas generales de soporte, así como preventivas dirigidas a disminuir la incidencia y la gravedad de las infecciones, y sus complicaciones, en el paciente neutropénico (tabla 7).Entre ellas destaca el tratamiento con G-CSF en pacientes con tumores sólidos y linfomas, que acorta el tiempo de neutropenia. Muchas de las medidas de prevención han ido cambiando con el tiempo o caído en desuso por falta de evidencia. |
BGN: bacilos gramnegativos; CGP: cocos grampositivos; IFI: infección fúngica invasiva; MR: microorganismos multirresistentes; NF: neutropenia febril; TC: tomografía computarizada; TPH: trasplante de progenitores hematopoyéticos.
La NF implica la coexistencia de fiebre y neutropenia3–5. La definición de NF permite establecer indicaciones validadas para su atención. La aplicación de las indicaciones de la presente guía en otras situaciones de sospecha o riesgo de infección (p. ej., fiebre sin neutropenia grave) pueden no ser las más adecuadas, debiendo establecerse protocolos específicos para las mismas.
¿Cuáles son los microorganismos implicados en los episodios de NF en los pacientes pediátricos oncohematológicos? ¿Cuál es la importancia de los microorganismos multirresistentes (MR)?La relación entre el aislamiento de cocos grampositivos (CGP) y los bacilos gramnegativos (BGN) depende de diversos factores, como la utilización de catéteres vasculares centrales y sus cuidados (estafilococos coagulasa negativos [ECN]), emergencia de estreptococos del grupo viridans en relación con trasplante de progenitores hematopoyéticos (TPH), quimioterapias de inducción más agresivas y la presencia de mucositis1,2,6,7, mayor frecuencia de CGP en neoplasia hematológicas frente a los tumores sólidos, así como en los pacientes sometidos a TPH y tratamientos de inducción intensivos.
Se observa un incremento de microorganismos MR, destacando BGN productores de β-lactamasas de espectro extendido (BLEE)6,8–11 y las resistentes a carbapenémicos (especialmente Pseudomonas aeruginosa y Klebsiella pneumoniae)6–8,12, que se correlaciona con mayor gravedad y mortalidad, siendo estable en nuestro medio la prevalencia de Staphylococcus aureus resistentes a meticilina. Por ello, es necesario adecuar la terapia antimicrobiana empírica al riesgo individual, así como a la epidemiología local.
La identificación de un virus se ha correlacionado con menor gravedad del episodio y días de hospitalización13,14, aunque su impacto en la interrupción de antimicrobianos en estos pacientes todavía es bajo14, probablemente debido a la imposibilidad de descartar por completo la coinfección bacteriana y a la excreción prolongada de virus respiratorios en estos pacientes, que dificulta su interpretación. Por otra parte, la identificación de un patógeno viral es útil para tomar medidas de control de la infección e instaurar terapia antiviral específica para aquellos virus frente a los que se disponga. Además, en los pacientes de bajo riesgo clínicamente estables y con buena evolución, podría ayudar a tomar decisiones de desescalar o suspender la antibioterapia5.
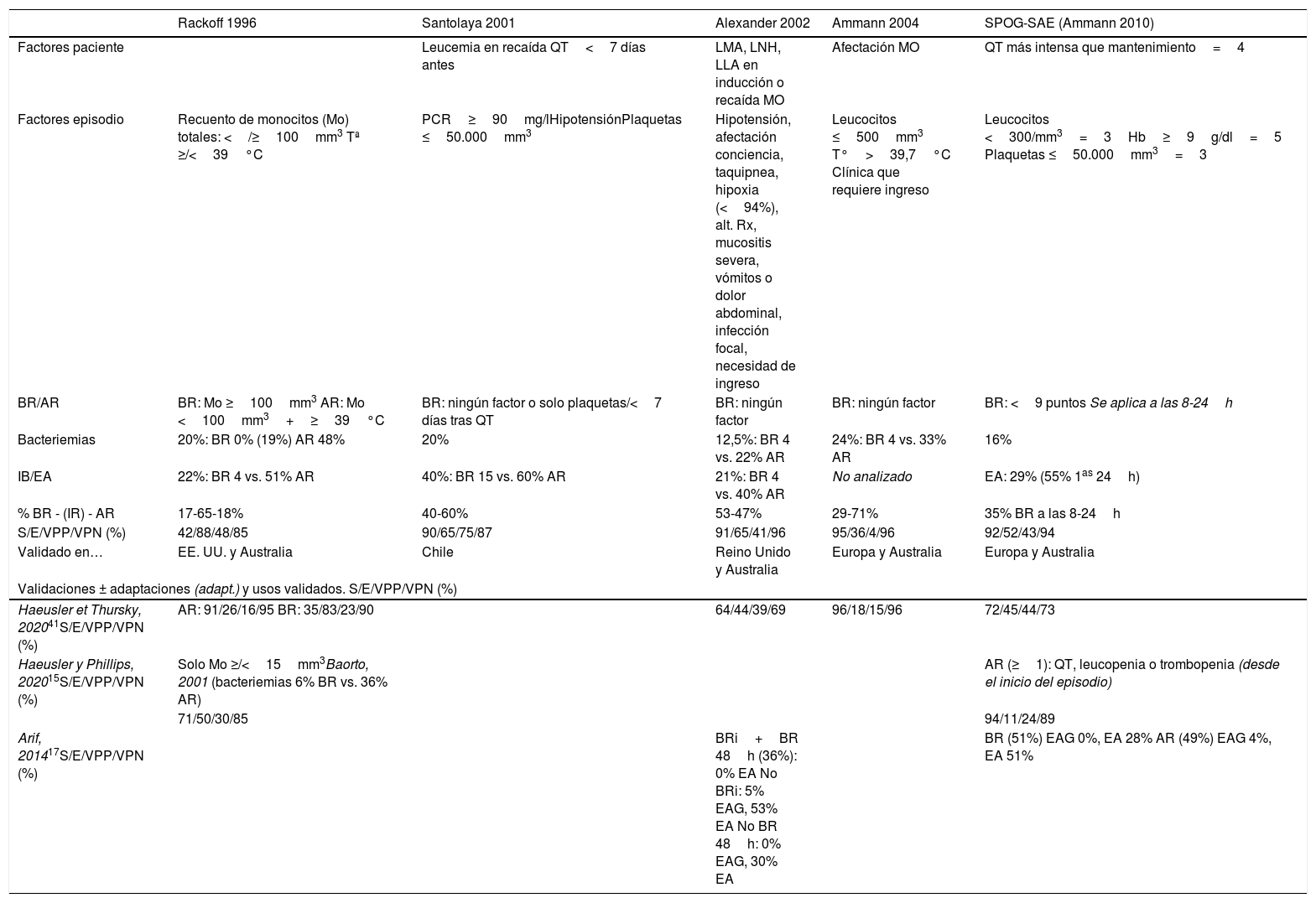
¿Cómo podemos estratificar el riesgo en el paciente pediátrico oncohematológico con NF?Existen diversos modelos de estratificación de riesgo validados en pediatría (tabla 2) que permiten distinguir una cohorte de pacientes con NF con un riesgo menor al 10% de infección bacteriana y con baja probabilidad de desarrollar complicaciones. Su utilización permite implementar protocolos de atención ambulatoria y/o altas precoces en NF de bajo riesgo. Aunque muchos excluyen pacientes menores de un año o que inician fiebre ingresados, Haeusler et al. los validaron incluyendo estas poblaciones15.
Escalas de estratificación de riesgo en el paciente pediátrico oncohematológico con neutropenia febril
| Rackoff 1996 | Santolaya 2001 | Alexander 2002 | Ammann 2004 | SPOG-SAE (Ammann 2010) | |
|---|---|---|---|---|---|
| Factores paciente | Leucemia en recaída QT<7 días antes | LMA, LNH, LLA en inducción o recaída MO | Afectación MO | QT más intensa que mantenimiento=4 | |
| Factores episodio | Recuento de monocitos (Mo) totales: </≥100mm3 Tª ≥/<39°C | PCR≥90mg/lHipotensiónPlaquetas ≤50.000mm3 | Hipotensión, afectación conciencia, taquipnea, hipoxia (<94%), alt. Rx, mucositis severa, vómitos o dolor abdominal, infección focal, necesidad de ingreso | Leucocitos ≤500mm3 T°>39,7°C Clínica que requiere ingreso | Leucocitos <300/mm3=3Hb≥9g/dl=5 Plaquetas ≤50.000mm3=3 |
| BR/AR | BR: Mo ≥100mm3 AR: Mo <100mm3+≥39°C | BR: ningún factor o solo plaquetas/<7 días tras QT | BR: ningún factor | BR: ningún factor | BR: <9 puntos Se aplica a las 8-24h |
| Bacteriemias | 20%: BR 0% (19%) AR 48% | 20% | 12,5%: BR 4 vs. 22% AR | 24%: BR 4 vs. 33% AR | 16% |
| IB/EA | 22%: BR 4 vs. 51% AR | 40%: BR 15 vs. 60% AR | 21%: BR 4 vs. 40% AR | No analizado | EA: 29% (55% 1as 24h) |
| % BR - (IR) - AR | 17-65-18% | 40-60% | 53-47% | 29-71% | 35% BR a las 8-24h |
| S/E/VPP/VPN (%) | 42/88/48/85 | 90/65/75/87 | 91/65/41/96 | 95/36/4/96 | 92/52/43/94 |
| Validado en… | EE. UU. y Australia | Chile | Reino Unido y Australia | Europa y Australia | Europa y Australia |
| Validaciones ± adaptaciones (adapt.) y usos validados. S/E/VPP/VPN (%) | |||||
| Haeusler et Thursky, 202041S/E/VPP/VPN (%) | AR: 91/26/16/95 BR: 35/83/23/90 | 64/44/39/69 | 96/18/15/96 | 72/45/44/73 | |
| Haeusler y Phillips, 202015S/E/VPP/VPN (%) | Solo Mo ≥/<15mm3Baorto, 2001 (bacteriemias 6% BR vs. 36% AR) | AR (≥1): QT, leucopenia o trombopenia (desde el inicio del episodio) | |||
| 71/50/30/85 | 94/11/24/89 | ||||
| Arif, 201417S/E/VPP/VPN (%) | BRi+BR 48h (36%): 0% EA No BRi: 5% EAG, 53% EA No BR 48h: 0% EAG, 30% EA | BR (51%) EAG 0%, EA 28% AR (49%) EAG 4%, EA 51% | |||
AR: alto riesgo; BR: bajo riesgo; BRi: Bajo riesgo inicial; E: especificidad; EA: evento adverso; EAG: evento adverso grave; Hb: hemoglobina; HC: hemocultivo; IB: infección bacteriana; LLA: leucemia linfoblástica aguda; LMA: leucemia mieloide aguda; LNH: linfoma no Hodgkin (Burkitt); MO: médula ósea; QT: quimioterapia; RAN: recuento absoluto de neutrófilos; Rx: radiografía; S: sensibilidad; Tª: temperatura; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Adaptado de Lechrember et al.3
Estos modelos tienen buena sensibilidad y valor predictivo negativo, permitiendo detectar pacientes candidatos a tratamiento ambulatorio inicial o desescalada y alta precoz (tras 24-48h de buena evolución)16,17, con una tasa de ingresos/reingresos menores al 10% y muy baja probabilidad de eventos adversos relevantes.
Actualmente, en España se está llevando a cabo el ensayo clínico multicéntrico e-STOP (EudraTC 2018-000775-32) que, además de estudiar la seguridad de la suspensión precoz de antibióticos en NF, pretende validar un score en nuestra población.
Más recientemente, se ha desarrollado y publicado DISCERN-FN, un algoritmo de clasificación de riesgo altamente sensible (95-98%), con una aceptable especificidad (38-58%) para detectar infección grave, que precisaría ser validado en nuestro medio18.
¿Cuál debe ser la actuación inicial en el paciente pediátrico oncohematológico con NF?La valoración inicial del paciente pediátrico oncohematológico con NF debe incluir una exhaustiva anamnesis general y dirigida a detectar posibles focos infecciosos, así como a valorar el grado de inmunosupresión y riesgos asociados, una cuidadosa exploración física completa —incluyendo la toma de constantes y la valoración de signos de sepsis— y la realización de analítica sanguínea con hemograma, bioquímica y biomarcadores de respuesta inflamatoria, como la proteína C reactiva (PCR)5 y la procalcitonina (PCT)18, pudiendo ampliar su sensibilidad combinándola con otros marcadores (p. ej., IL-6, IL-8, etc.)7. La anamnesis y las pruebas complementarias se han incluido en la tabla 3.
Anamnesis y pruebas complementarias en el paciente oncohematológico con neutropenia febril
| Anamnesis general | • Síntomas actuales.• Antecedentes personales y comorbilidades.• Intervenciones recientes.• Contacto con mascotas.• Viajes recientes.• Ambiente epidémico familiar. |
| Anamnesis oncológica | • Enfermedad de base.• Dispositivos (CVC, VDVP, gastrostomía, etc.) y manipulaciones recientes de los mismos.• Tratamientos recibidos (quimioterapia) y fechas.• Toma actual o reciente de corticoides.• Infecciones y/o colonizaciones previas con resistencias antibióticas (multirresistentes).• Resultados última analítica.• Transfusiones recientes.• Tratamientos actuales (incluida profilaxis antimicrobiana). |
| Examen físico | • Constantes: Temperatura, frecuencia cardiaca, frecuencia respiratoria, tensión arterial y saturación de O2.• Triángulo de evaluación pediátrica (identificación precoz sepsis).• Exploración completa por aparatos incluyendo: exploración neurológica, perfusión, piel, mucosas (oral y perianal, evitar tacto rectal), cualquier área dolorosa, cicatrices, dispositivos, etc. |
| Analítica sanguínea | • Hemograma.• Bioquímica con iones, función renal y hepática (marcadores de sepsis, estado de hidratación y toxicidades de las quimioterapias que puedan requerir ajuste de los tratamientos).• Biomarcadores inflamatorios: PCR±PCT, IL-8, IL-6… |
| Pruebas microbiológicas | • Hemocultivo de vía central (de todas las luces) ± periférico (diferenciales).• Urocultivo (y sedimento) de manera no invasiva (baja rentabilidad).• Aspirado/exudado nasofaríngeo (estacional epidémico o PCR multiplex).• Muestra de lesiones cutáneas o mucosas (herpes simple, varicela-zóster, enterovirus, hongos).• Muestra de posibles focos identificados (heces, exudados, líquido cefalorraquídeo…). |
| Otras pruebas complementarias | • Radiografía de tórax: si síntomas respiratorios.• Ecografía de abdomen: si dolor abdominal, peritonismo, etc.• TC/RM craneal ± punción lumbar: si focalidad neurológica. |
CVC: catéter vascular central; IL: interleucina; O2: oxígeno; PCR: proteína C reactiva; PCT: procalcitonina; RM: resonancia magnética; TC: tomografía computarizada; VDVP: válvula de derivación ventrículo peritoneal.
La realización de otras pruebas complementarias, que no deben retrasar el inicio del tratamiento, incluye la recogida de hemocultivos de todas las luces de las vías centrales. Adicionalmente, hay que valorar la extracción de hemocultivo venoso periférico, especialmente si sospecha de infección relacionada con el catéter vascular central (extraídos en forma de hemocultivos cuantitativos o cualitativos diferenciales en tal caso, asegurando el mismo volumen y momento de incubación), muestra de orina no invasiva y detección de virus respiratorios si periodo epidémico y/o síntomas respiratorios. Otras pruebas complementarias estarán dirigidas por signos o síntomas3–5.
Además, el seguimiento clínico, hemodinámico y analítico, ayuda a detectar focos infecciosos inicialmente no evidentes, así como complicaciones y respuesta al tratamiento instaurado, adecuándolo según precise7.
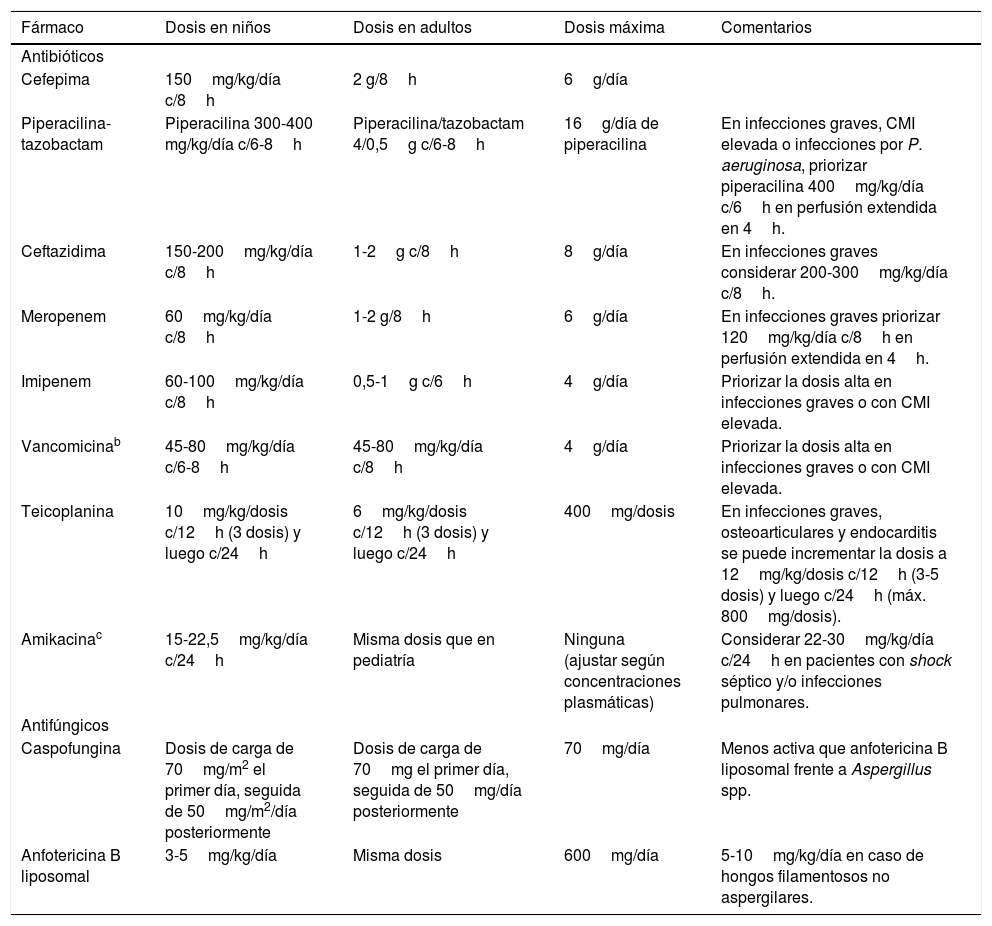
¿Cuál es la terapia antibacteriana empírica recomendada en el paciente pediátrico oncohematológico con NF?El inicio precoz del tratamiento antibiótico de amplio espectro en estos pacientes es un aspecto fundamental que condiciona el pronóstico3,4. Debido al elevado riesgo de infecciones por P. aeruginosa y su alta morbimortalidad, se recomienda su cobertura empírica. La figura 1 resume el abordaje terapéutico según el riesgo individual y la tabla 4 incluye la dosis de los principales antimicrobianos
Algoritmo terapéutico de los episodios de neutropenia febril en pacientes oncológicos pediátricos.
BGN: bacilos gramnegativos; BMR: bacterias multirresistentes; CGP: cocos grampositivos; VO: vía oral.
Fuente: adaptado de Lehrnbecher T et al., 20144.
Dosis de los principales antimicrobianos en el tratamiento de la neutropenia febril en el paciente pediátrico oncohematológicoa
| Fármaco | Dosis en niños | Dosis en adultos | Dosis máxima | Comentarios |
|---|---|---|---|---|
| Antibióticos | ||||
| Cefepima | 150mg/kg/día c/8h | 2 g/8h | 6g/día | |
| Piperacilina-tazobactam | Piperacilina 300-400 mg/kg/día c/6-8h | Piperacilina/tazobactam 4/0,5g c/6-8h | 16g/día de piperacilina | En infecciones graves, CMI elevada o infecciones por P. aeruginosa, priorizar piperacilina 400mg/kg/día c/6h en perfusión extendida en 4h. |
| Ceftazidima | 150-200mg/kg/día c/8h | 1-2g c/8h | 8g/día | En infecciones graves considerar 200-300mg/kg/día c/8h. |
| Meropenem | 60mg/kg/día c/8h | 1-2 g/8h | 6g/día | En infecciones graves priorizar 120mg/kg/día c/8h en perfusión extendida en 4h. |
| Imipenem | 60-100mg/kg/día c/8h | 0,5-1g c/6h | 4g/día | Priorizar la dosis alta en infecciones graves o con CMI elevada. |
| Vancomicinab | 45-80mg/kg/día c/6-8h | 45-80mg/kg/día c/8h | 4g/día | Priorizar la dosis alta en infecciones graves o con CMI elevada. |
| Teicoplanina | 10mg/kg/dosis c/12h (3 dosis) y luego c/24h | 6mg/kg/dosis c/12h (3 dosis) y luego c/24h | 400mg/dosis | En infecciones graves, osteoarticulares y endocarditis se puede incrementar la dosis a 12mg/kg/dosis c/12h (3-5 dosis) y luego c/24h (máx. 800mg/dosis). |
| Amikacinac | 15-22,5mg/kg/día c/24h | Misma dosis que en pediatría | Ninguna (ajustar según concentraciones plasmáticas) | Considerar 22-30mg/kg/día c/24h en pacientes con shock séptico y/o infecciones pulmonares. |
| Antifúngicos | ||||
| Caspofungina | Dosis de carga de 70mg/m2 el primer día, seguida de 50mg/m2/día posteriormente | Dosis de carga de 70mg el primer día, seguida de 50mg/día posteriormente | 70mg/día | Menos activa que anfotericina B liposomal frente a Aspergillus spp. |
| Anfotericina B liposomal | 3-5mg/kg/día | Misma dosis | 600mg/día | 5-10mg/kg/día en caso de hongos filamentosos no aspergilares. |
CMI: concentración mínima inhibitoria.
Consultar las dosis recomendadas de los antibióticos según la sensibilidad del microorganismo en el siguiente enlace: https://www.seipweb.es/dosis-de-antibioticos/42.
La terapia combinada no ha demostrado mejores resultados clínicos en pacientes estables. Por ello, el tratamiento combinado de un β-lactámico junto a un segundo antibiótico quedará reservado para situaciones específicas, como shock séptico y/o riesgo de microorganismos MR, teniendo en cuenta la epidemiología de cada centro (tabla 5).
Situaciones en las que considerar el tratamiento empírico combinado
| Antibiótico con actividad ampliada frente a bacilos gramnegativos resistentes a β-lactámicos (p. ej., aminoglucósidos, fluoroquinolonas, colistina):• Paciente hemodinámicamente inestable.• Antecedente de infección o colonización reciente por bacilos gramnegativos resistentes a la antibioterapia de elección (individualizar).• Aislamiento en hemocultivo de un bacilo gramnegativo, a la espera de su identificación y antibiograma, especialmente si no ha respondido al tratamiento empírico y/o inestabilidad clínica.• Antibioterapia de amplio espectro reciente. |
| Antibiótico con actividad ampliada frente a cocos grampositivos resistentes a meticilina (p. ej., vancomicina, teicoplanina, daptomicina):• Paciente hemodinámicamente inestable.• Historia previa de infección o colonización por Staphylococcus aureus resistente a meticilina o Streptococcus pneumoniae resistente a cefalosporinas.• Aislamiento en hemocultivo de un coco grampositivo, a la espera de su identificación y antibiograma, especialmente si no ha respondido al tratamiento empírico y/o inestabilidad clínica.• Mucositis grave (grados III-IV) o quimioterapia que pueda inducirla (altas dosis de citarabina o fludarabina) en unidades con una elevada de prevalencia de resistencia a β-lactámicos en Streptococcus del grupo viridans.• Signos de infección del catéter vascular o fiebre tras manipulación del mismo.• Signos de infección localizada en piel o tejidos blandos.• Centros con alta prevalencia de Staphylococcus aureus resistente a meticilina. |
Algunas consideraciones pueden hacer priorizar un β-lactámico frente a otro. Piperacilina-tazobactam presenta buena actividad anaerobicida, actividad frente a Enterococcus spp. y conserva actividad frente a algunas cepas de BGN productoras de BLEE. Cefepima atraviesa adecuadamente la barrera hematoencefálica y es activa frente a la mayoría de las cepas de BGN productoras de beta-lactamasas de tipo AmpC. Ceftazidima presenta escasa actividad frente a CGP y se ha documentado un incremento creciente en la prevalencia de resistencias al mismo. Así, es fundamental evaluar la epidemiología local en la elección de la antibioterapia empírica. En cuanto al uso de carbapenémicos, hay que considerar su alto impacto ecológico, al ser un antibiótico que conviene reservar para casos seleccionados19,20.
La colonización o infecciones recientes por microorganismos MR en los pacientes oncológicos es un factor de riesgo de presentar infecciones asociadas a los mismos21, por lo que hay que considerar valorar la sensibilidad de esos microorganismos en la selección del tratamiento antibiótico (tabla 6).
Clasificación del riesgo de infección fúngica invasiva y factores de riesgo
| Clasificación riesgo IFI | Enfermedad de base | |
|---|---|---|
| Alto riesgo | ≥10% | LMALLA de alto riesgo y/o recaídaTPH alogénico |
| Bajo riesgo | 2-9% (generalmente <5%) | LLA riesgo estándar/intermedioLinfoma no HodgkinTPH autólogo |
| Esporádico | ≤1% | Tumores órgano sólidoLinfoma de Hodgkin |
| Otros factores que aumentan el riesgo de IFI | ||
| Factores clínicos:• Neutropenia grave y prolongada (≤500 neutrófilos/mm3 durante ≥7-10 días).• Mucositis grave.• Catéter venoso central.• Colonización fúngica previa.• Linfopenia grave y prolongada.• Enfermedad de injerto contra receptor en los receptores de TPH.• Infección por citomegalovirus en receptores de TPH.Factores farmacológicos:• Corticoides a dosis altas (≥0,3mg/kg/día de prednisona o equivalente) durante ≥3 semanas.• Fármacos anti-TNF y otros anticuerpos monoclonales (p. ej., alemtuzumab).• Análogos de nucleósidos (p. ej., citarabina).• Terapia de células T con receptores quiméricos de antígenos (CAR-T).• Inhibidores de la tirosín quinasa (p. ej., ibrutinib). | ||
IFI: infección fúngica invasiva; LMA: leucemia mieloblástica aguda; LLA: leucemia linfoblástica aguda; TNF: factor de necrosis tumoral; TPH: trasplante de precursores hematopoyéticos.
En el caso de pacientes con un foco infeccioso identificado se seleccionará la antibioterapia empírica según los microorganismos más frecuentes en cada foco, asegurando el buen control del mismo (p. ej., retirada de catéteres infectados, drenaje de abscesos, etc.).
Pacientes hemodinámicamente inestablesLos pacientes oncológicos con shock séptico presentan una mortalidad elevada. Entre los principales factores asociados a mortalidad se encuentra el uso de tratamiento antibiótico empírico inadecuado, sin actividad frente al agente causal22. Por ello, se recomienda ampliar el espectro antibiótico con el objetivo de aumentar las posibilidades de incluir un agente activo frente al microorganismo implicado, considerando su ajuste posterior según la evolución y aislamientos microbiológicos.
Los nuevos antibióticos comercializados (p. ej., ceftazidima-avibactam, ceftolozano-tazobactam, meropenem-vaborbactam, cefiderocol), con desigual estado de aprobación en niños en el momento de publicarse este documento, ofrecen nuevas oportunidades de tratamiento23. Su uso de forma empírica será restringido a pacientes hemodinámicamente inestables con infecciones o colonizaciones recientes resistentes a los carbapenémicos y, en el caso del tratamiento dirigido, en aislamientos resistentes a los antibióticos de elección, principalmente en infecciones graves24.
Pacientes con alergia a β-lactámicosEn pacientes con alergia a β-lactámicos y evaluación alergológica previa, conviene seleccionar la antibioterapia empírica de acuerdo con los resultados alergológicos. Entre las opciones en aquellos casos sin estudio alergológico previo, se debe considerar el uso de aztreonam (asociado a un antibiótico activo frente a CGP) o meropenem.
Pacientes de bajo riesgoUna revisión sistemática no demostró diferencias significativas en el fracaso del tratamiento ni en la mortalidad asociada a infecciones en los pacientes de bajo riesgo tratados con antibioterapia vía oral de forma empírica frente a los que recibieron tratamiento intravenoso3. Se han propuesto diferentes opciones (p. ej., levofloxacino, amoxicilina-clavulánico junto a ciprofloxacino, etc.), que habrá que valorar según la epidemiología local o infecciones previas del paciente.
Es importante realizar un seguimiento clínico estrecho del paciente. Si presentan deterioro clínico, intolerancia oral, signos de focalidad infecciosa de alto riesgo de progresión, o en los que se produzcan aislamientos microbiológicos sin opciones vía oral o en los que se priorice la vía intravenosa, deberán ser ingresados. En los centros con posibilidad de tratamiento antimicrobiano domiciliario endovenoso, puede plantearse su utilización, si reúne los criterios considerados.
¿Cómo debe realizarse la evaluación posterior del paciente pediátrico oncohematológico con NF?El tiempo medio de positividad de los hemocultivos en pacientes febriles neutropénicos es de unas 12h, siendo la mayoría positivos en las primeras 24h25. Un crecimiento más allá de las 24-48h corresponde generalmente a microorganismos de crecimiento lento (Candida spp., anaerobios o ECN) o microorganismos contaminantes.
En adultos con neoplasias hematológicas y neutropenia febril de alto riesgo y sin diagnóstico etiológico la interrupción del antibiótico empírico después de 72h de apirexia y resolución de todos los signos y síntomas infecciosos, comparada con el enfoque estándar de mantenimiento hasta la recuperación de neutrófilos, es segura, permitiendo reducir el número de días de exposición a los antimicrobianos sin afectar a la mortalidad. Las últimas recomendaciones europeas en pacientes adultos emitidas por The European Conference on Infections in Leukemia (ECIL-4) establecen que en pacientes con NF sin documentación clínica ni microbiológica de infección, el tratamiento antibiótico empírico puede suspenderse después de al menos 72h de tratamiento intravenoso en pacientes que han estado hemodinámicamente estables desde la presentación y afebriles durante al menos 48h, independientemente del recuento de neutrófilos o de la duración esperada de la neutropenia.
En pacientes pediátricos, Kobayashi et al.26 analizaron 170 episodios de NF en los cuales se había interrumpido el antibiótico antes de la recuperación de los neutrófilos, para valorar el riesgo de recurrencia. En el análisis multivariante, el recuento de neutrófilos al suspender los antibióticos <100 neutrófilos/mm3 fue un factor de riesgo independiente para la recurrencia de la fiebre. De forma similar, otro estudio observacional en niños con neutropenia febril concluyó que la interrupción de la antibioterapia empírica en niños con NF sin infección bacteriana y un recuento de neutrófilos >100mm3 tras 24h de apirexia resulta seguro27. Una guía internacional pediátrica considera segura la interrupción de la antibioterapia empírica en pacientes de bajo riesgo sin infección documentada, tras 24 horas de apirexia y 72h de antibioterapia, con independencia de la cifra de neutrófilos, sin establecer ninguna recomendación en el caso de persistir neutropenia grave3.
De acuerdo con la evidencia disponible, recomendamos revisar la antibioterapia empírica a las 48-72h de su inicio, valorando su desescalada y la interrupción de tratamientos empíricos combinados. Una vez instaurada la antibioterapia empírica, la evaluación posterior debe guiarse idealmente por los aislamientos microbiológicos o foco detectado, para establecer una terapia dirigida ajustada al microorganismo aislado con control del foco si existiese (fig. 1).
En cuanto a la utilización biomarcadores de respuesta inflamatoria, en la actualidad no hay suficientes datos que avalen su uso en la toma de decisiones respecto a la duración de la antibioterapia28.
¿Cuál es la importancia de la infección fúngica invasiva (IFI) en el paciente pediátrico oncohematológico con NF?La incidencia de (IFI) en pacientes pediátricos con cáncer o sometidos (TPH) oscila entre el 2-20%29,30. El riesgo de cada paciente depende de su enfermedad de base y de diversos factores asociados (tabla 5), siendo la neutropenia grave y prolongada el más relevante.
Los hongos más frecuentemente aislados en estos pacientes son Candida spp. y Aspergillus spp., con una mortalidad entre el 10-25% y el 20-50%, respectivamente29.
¿Cómo investigar la IFI en el paciente pediátrico oncohematológico con NF?Se debe sospechar e investigar una posible IFI en pacientes con NF persistente ≥96h a pesar de tratamiento antibiótico adecuado, especialmente en aquellos pacientes clasificados como de alto riesgo de IFI. Es esencial la recogida de muestras biológicas, tanto de sangre como del foco sospechado de infección31,32.
Se recomienda realizar antígeno galactomanano en suero en pacientes con neutropenia febril prolongada y riesgo de aspergilosis (punto de corte 0,5). También puede determinarse en muestras de lavado broncoalveolar y líquido cefalorraquídeo (punto de corte de 1)31–33. Por el momento no se recomienda el uso sistemático de otros biomarcadores para el diagnóstico de IFI en pediatría31. Las pruebas moleculares (PCR específicas, PCR panfúngica [18S], T2RM) presentan algunas ventajas respecto a los métodos tradicionales y deben ser interpretadas con ayuda de un microbiólogo experto31,34.
Está indicada la realización de TC torácica en los niños de alto riesgo con NF de más de 96h de duración o en aquellos con síntomas respiratorios y radiografía de tórax no concluyente. En casos de TC torácica patológica es de suma importancia la realización de lavado broncoalveolar o biopsia pulmonar para estudio microbiológico31,35. Se debe valorar imagen abdominal para despistaje de candidiasis invasiva en ausencia de foco, y otras pruebas de imagen según la clínica y riesgo de los pacientes. Según los resultados obtenidos, se clasifica la IFI en posible, probable o probada (criterios European Organization for Research and Treatment of Cancer (EORTC) / Mycoses Study Group (MSG))36.
¿Cuándo y cómo iniciar la terapia antifúngica en el paciente pediátrico oncohematológico con NF? ¿Cómo debe realizarse la evaluación posterior tras el inicio de tratamiento antifúngico?Se han establecido 2 estrategias en el abordaje de las IFI en el paciente oncohematológico con NF:
El tratamiento empírico consiste en iniciar tratamiento antifúngico en el momento en el que se sospecha la infección, sin esperar al resultado de las pruebas diagnósticas correspondientes. Se valorarán como opciones de tratamiento caspofungina o anfotericina B liposomal (de elección si alto riesgo de hongos filamentosos), valorando cambio de familia de antifúngicos si el paciente recibía previamente profilaxis antifúngica (especialmente en el caso de los azoles).
El tratamiento anticipado consiste en realizar en primer lugar las pruebas (de imagen y biomarcadores fúngicos) e iniciar tratamiento antifúngico una vez alguno de los resultados haya sido positivo en función de los mismos31,37.
Ambas estrategias han demostrado ser seguras en pediatría38, así que su elección dependerá de las características de cada paciente, del microorganismo sospechado y de los recursos y epidemiología de cada centro. En caso de paciente inestable con factores de riesgo adicionales de candidemia, se priorizará el tratamiento empírico dirigido a hongos levaduriformes, mientras que en caso de paciente estable con NF prolongada o sospecha clínica de infección por hongos filamentosos, se propone esperar al resultado de las pruebas si se dispone de los mismos de forma rápida.
En el caso de confirmar la infección fúngica, es fundamental el control del foco de infección, ya sea mediante la retirada de dispositivos o la cirugía si es necesaria, y de los factores predisponentes.
Una vez instaurado el tratamiento, y realizadas todas las exploraciones complementarias para establecer el diagnóstico etiológico y de extensión, se recomienda evaluar la respuesta clínica, analítica y de pruebas de imagen. En el caso de candidemia se deberá realizar hemocultivo de control cada 48h hasta desaparición de la fiebre y hasta que se disponga de uno o más hemocultivos seriados negativos.
Respecto al control de imagen, la recomendación de la EORTC/MSG es realizar evaluación a las 4-6 y 12 semanas de inicio del tratamiento. Sin embargo, algunos pacientes pueden precisarla a partir de la segunda semana de tratamiento31,32,34.
Es fundamental monitorizar concentraciones plasmáticas de voriconazol, posaconazol suspensión oral e itraconazol; también se debe valorar para isavuconazol hasta no disponer de más datos pediátricos34,37.
En el caso de infecciones por Candida spp., la duración mínima será de 14 días tras el primer cultivo negativo en caso de candidemia, precisando duración mayor en caso de infección de órgano39. Si la infección está relacionada con catéteres, su retirada es fundamental. En caso de infecciones por hongos filamentosos, se recomienda un mínimo de 6 semanas de tratamiento, alargando posteriormente el tratamiento hasta la completa resolución clínica/analítica/radiológica de la infección31,32,34.
¿Qué tratamientos no antimicrobianos están indicadas en el tratamiento del paciente pediátrico oncohematológico con NF?El tratamiento de soporte (tabla 7) engloba medidas generales, como fluidoterapia, analgesia, antipiréticos, tratamientos habituales del paciente, valorar necesidad de hidrocortisona a dosis de estrés (corticoterapia actual o reciente), así como medidas dirigidas a disminuir la incidencia de infecciones en el paciente neutropénico40.
Medidas de soporte y prevención de neutropenia febril
| Soporte NF | • Fluidoterapia: asegurar adecuado estado hidroelectrolítico.• Analgésicos y antitérmicos (evitar AINE).• Tratamiento de base: analgesia, profilaxis, suplementos… con precaución con antihipertensivos.• Generalmente suspender quimioterapia oral y valorar con oncólogo/hematólogo completar o no ciclos intravenosos en pacientes estables.• Valorar necesidad de hidrocortisona de estrés: pacientes recibiendo corticoides o que han recibido dosis altas en últimos meses.• Continuar/iniciar G-CSF en pacientes con tumores sólidos/linfomas. |
| Prevención | • G-CSF en tumores sólidos con tratamientos intensivos (>20% NF), necesidad de mantener dosis-intensidad de la quimioterapia y/o antecedente de NF.• Equipos de protección individual (bata, guantes…) en pacientes con infecciones contagiosas o colonizados por microorganismos MR.• Vacunación gripal anual de paciente, convivientes y sanitarios.• Asepsia en el uso de CVC.• Higiene de manos, higiene de superficies y en la preparación de los alimentos.• Evitar contacto con mascotas de riesgo: tortugas, el arenero de los gatos, establos y nuevas mascotas. No aplicable a otras mascotas correctamente vacunadas, de las que únicamente se recomienda no manipular excrementos. |
| Prevención IFI(pacientes/situaciones alto riesgo) | • Evitar flores y plantas en habitaciones hospitalarias y dormitorio de pacientes.• Habitaciones hospitalarias con filtros HEPA y presión positiva (>12 recambios/h).• Uso de mascarilla FPP2 en lugares cerrados sin filtros HEPA (salvo domicilio habitual, donde se recomienda ventilación, evitar plantas, humedades y obras).• Evitar piscinas, especialmente públicas y/o cubiertas. |
| Sin evidencia para recomendarlas | • Dieta de baja carga bacteriana: no ha demostrado reducir incidencia de infecciones o gravedad de estas.• Equipos de protección en pacientes sin aislamientos microbiológicos que los justifiquen. |
AINE: antinflamatorios no esteroideos; CVC: catéter vascular central; G-CSF: factor estimulador de colonias de granulocitos; IFI: infección fúngica invasiva; NF: neutropenia febril; MR: multirresistentes.
El tratamiento con el factor estimulador de colonias granulocíticas (G-CSF) acorta el tiempo de neutropenia, reduciendo el tiempo de antibioterapia e ingreso hospitalario, pero no ha demostrado disminuir las infecciones ni gravedad de estas. Se recomienda generalmente en pacientes con tumores sólidos y linfomas, pero solo puntualmente en pacientes con leucemias3.
FinanciaciónNinguno de los autores recibió financiación por el presente trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Coordinadora: Leticia Martínez Campos (Hospital Universitario Torrecárdenas, Almería).
Secretario: Jesús Saavedra Lozano (Hospital Gregorio Marañón, Madrid).
Integrantes: David Aguilera Alonso (Hospital Gregorio Marañón, Madrid); Cristina Calvo Rey (Hospital la Paz, Madrid); Jaime Carrasco Colom (Hospital Universitario Son Espases, Mallorca); Elena Colino Gil (Hospital de las Palmas, Gran Canaria); David López Martín (Hospital Costa del Sol, Marbella); Ana Isabel Menasalvas Ruiz (Hospital Virgen de la Arrixaca, Murcia); Esmeralda Núñez Cuadros (Hospital Carlos Haya, Málaga) y Carlos Rodrigo Gonzalo de Liria (Hospital Vall d’Hebrón, Barcelona)
Grupo de Trabajo de Infección Fúngica Invasiva de SEIP
Coordinador: Peter Olbrich (Hospital Virgen del Rocío, Sevilla)
Secretaria: Begoña Carazo Gallego (Hospital Carlos Haya, Málaga)
Integrantes: Laura Ferreras Antolín (St. George's Hospital, Londres); Carlos Daniel Grasa Lozano (Hospital La Paz, Madrid); Natalia Mendoza Palomar (Hospital Vall d’Hebron, Barcelona); Marisa Navarro Gómez (Hospital Gregorio Marañón, Madrid); Olaf Neth (Hospital Virgen del Rocío, Sevilla); José Tomás Ramos Amador (Hospital Clínico San Carlos, Madrid); Elena Rincón López (Hospital Gregorio Marañón, Madrid); Jesús Ruiz Contreras (Hospital 12 de octubre, Madrid) y Pere Soler Palacín (Hospital Vall d’Hebrón, Barcelona)
Grupo de Trabajo de Soporte de SEHOP
Coordinadora: Paula Pérez-Albert, (Hospital Vall d’Hebron, Barcelona)
Integrantes: Laia Ferres Ramis (H. Universitario Son Espases, Mallorca); Jorge Huerta Aragonés (Hospital Universitario Gregorio Marañón); Silvia López Iniesta (Complejo Universitario del Hospital de León); Raquel Olivas Mazón (Hospital Clínico Universitario de Valencia); Raquel Portugal Rodríguez (Hospital Universitario de Burgos); Alexandra Regueiro García (Hospital Clínico Universitario de Santiago); Susana Riesco (Hospital Clínico Universitario de Salamanca) y José Antonio Villegas Rubio (Hospital Universitario Central de Asturias)
Los miembros del Grupo de Trabajo de Infecciones Bacterianas de la Sociedad Española de Infectología Pediátrica (SEIP), Grupo de Soporte de la Sociedad Española de Hematología y Oncología Pediátrica (SEHOP) y Grupo de Trabajo de Infección Fúngica Invasiva de la Sociedad Española de Infectología Pediátrica (SEIP) se presentan en el Anexo 1.