Las resistencias antibióticas de Helicobacter pylori(H. pylori) son el principal factor que afecta a la eficacia de los regímenes terapéuticos actuales. El objetivo principal del estudio es describir el patrón de resistencias antibióticas en niños con infección por H. pylori.
Pacientes y métodosEstudio observacional retrospectivo de 2014 a 2019 en el que se incluyen pacientes entre 5-17 años a los que se realizó gastroscopia, con cultivo de biopsia gástrica positivo para H. pylori y estudio de sensibilidad a antibióticos. Los estudios de sensibilidad antibiótica se realizaron mediante E-test. Los puntos de corte para definir las resistencias fueron los propuestos por el EUCAST. El estudio de erradicación se realizó con test del aliento con urea marcada con C 13 o test monoclonal de antígeno de H. pylori en heces a las 6-8 semanas de finalizar el tratamiento.
ResultadosOchenta pacientes (63,8% mujeres). Media de edad 11,9 años (±2,7DS). Un 38,8% habían recibido tratamiento previo para H. pylori. Un 10% presentaron en la endoscopia lesiones ulcerosas pépticas. El 67,5% presentaba resistencia al menos a un fármaco. Un 16,3% presentaron doble resistencia. Las resistencias primarias fueron: claritromicina 44,9%, metronidazol 16,3%, levofloxacino 7,9% y amoxicilina 2%. Los pacientes que recibieron tratamiento acorde a las nuevas guías ESPGHAN 2017 presentaron tasas de erradicación significativamente superiores en comparación con los que recibieron tratamiento acorde a las guías previas (80% vs. 55,8% p=0,04).
ConclusionesLa alta tasa de resistencias de H. pylori y, en consecuencia, las bajas tasas de erradicación, siguen siendo una preocupación muy importante. El tratamiento de primera línea, cuando esté indicado debe hacerse guiado por estudios de sensibilidad antibiótica y en los casos en el que no se puedan realizar o no estén disponibles, al menos de acuerdo con las tasas regionales de resistencia. La aplicación correcta de las nuevas guías mejora de forma significativa el nivel de erradicación.
The resistance to antibiotics of Helicobacter pylori (H. pylori) is the main factor that affects current therapeutic treatments. The main objective of this study is to describe the pattern of antibiotic resistances in children with an infection due to H. pylori.
Patients and methodsAn observational, retrospective study was conducted from 2014 to 2019, which included patients between 5 and 17 years old, on whom a gastroscopy, with a gastric biopsy culture positive for H. pylori, and an antibiotic sensitivity study was performed. The antibiotic sensitivity studies were performed using an epsilometer (E-test). The cut-off points to define the resistances were those proposed by the European Committee on Antimicrobial Susceptibility Testing – EUCAST. The eradication study was performed using the 13C-urea breath test or the H. pylori monoclonal test in faeces 6-8 weeks after finalising the treatment.
ResultsThe study included 80 patients (63.8% females), with a mean age of 11.9 years (SD±2.7DS). Over one-third (38.8%) of the patients had received previous treatment for H. pylori. In the endoscopy, peptic ulcer lesions were observed in 10% of patients. More than two-thirds (67.5%) had resistance to at least one drug. 16.3% presented double resistance. The primary resistances were: clarithromycin, 44.9%, metronidazole 16.3%, levofloxacine 7.9%, and amoxicillin 2%. Patients that received treatment according to the new ESPGHAN 2017 guidelines had significantly higher eradication rates compared to those that received treatment according to previous guidelines (80% vs. 55.8%, P=.04).
ConclusionsThe high rate of H.pylori resistances, and as a result, the low eradication rates, are still a very important cause for concern. The first line treatment, when this is indicated must be given following the antibiotic sensitivity studies, and in the cases where these cannot be done or are not available, at least in accordance with the regional resistance rates. The correct application of the new guidelines significantly improves the eradication rate.
Se estima que la infección por Helicobacter pylori(H. pylori) afecta aproximadamente al 50% de la población mundial y desempeña un papel fundamental en el desarrollo de diversas enfermedades digestivas como la gastritis crónica, la úlcera péptica y el cáncer gástrico1. La infección es adquirida habitualmente durante la infancia, sin embargo, en comparación con los adultos, los niños desarrollan con poca frecuencia complicaciones. Además, la tasa de reinfección en niños pequeños después de conseguir la erradicación puede ser significativamente alta (hasta un 20% de reinfección al año en menores de 10 años)2.
Las recomendaciones para el diagnóstico y tratamiento de la infección por H. pylori difieren en niños y adolescentes respecto de las de los adultos por la diferente ratio beneficio-riesgo dependiendo de la edad3. En niños, en ausencia de enfermedad ulcerosa péptica, definida como úlceras o erosiones gástricas o duodenales, la erradicación de la infección por H. pylori no se asocia con una mejoría de los síntomas4,5. El objetivo principal en los niños con síntomas gastrointestinales debe ser estudiar las posibles causas subyacentes y no solo la presencia de infección por H. pylori6.
A diferencia de los adultos las estrategias «test and treat» (diagnóstico no invasivo y tratamiento) no están indicadas. Se realizará diagnóstico invasivo mediante endoscopia solo a aquellos pacientes con sospecha clínica de enfermedad péptica ulcerosa. En aquellos pacientes en los que se demuestre enfermedad ulcerosa asociada a infección por H. pylori estará indicado el tratamiento. En los pacientes que presenten gastritis asociada a H. pylori en ausencia de enfermedad ulcerosa se valorará de forma individual con el paciente y la familia, realizar tratamiento erradicador7.
Las resistencias antibióticas son el principal factor que afecta a la eficacia de los regímenes terapéuticos actuales. La prevalencia de resistencias varía en función del área geográfica, la edad, la administración de terapias erradicadoras previas y el consumo de antibióticos en la población general8,9. Como la resistencia a los antibióticos es un proceso evolutivo con gran variabilidad geográfica, es recomendable realizar estudios actualizados de prevalencia de resistencias para guiar a los médicos en la mejor elección terapéutica.
El objetivo principal del estudio es describir el patrón de resistencias antibióticas en niños con infección por H. pylori. Como objetivos secundarios se plantean describir las tasas de erradicación en pacientes tratados según antibiograma siguiendo las recomendaciones de la European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) vigentes en cada momento y valorar posibles factores de riesgo asociados a la ausencia de erradicación.
Pacientes y métodosSe realizó un estudio observacional retrospectivo, incluyendo todos los pacientes con diagnóstico de infección por H. pylori desde enero 2014 a diciembre 2019, con una edad comprendida entre 5-17 años a los que se realizó gastroscopia, con cultivo de biopsia gástrica positivo para H. pylori con estudio de sensibilidad a antibióticos, aunque no recibieran tratamiento o no tuvieran control de erradicación.
Las muestras obtenidas se sembraron en un medio de cultivo selectivo para H. pylori, PYL (BioMerieux, Francia). Los estudios de sensibilidad antibiótica se realizaron mediante E-test (BioMerieux, Francia). Los puntos de corte para definir las resistencias fueron los propuestos por el European Committee on Antimicrobial Susceptibility Testing (EUCAST) en 2011: CMI para amoxicilina>0,12mg/l, claritromicina>0,5mg/l, metronidazol>8mg/l, levofloxacino>1mg/l, tetraciclina>1mg/l y rifampicina>1mg/l10.
Los pacientes que recibieron tratamiento lo hicieron dirigido según antibiograma y siguiendo las recomendaciones ESPGHAN vigentes en cada momento.
El estudio de erradicación se realizó con test del aliento con urea marcada con C 13 (UBTest Otsuka Pharma) o test monoclonal de antígeno de H. pylori en heces (H. pylori Turbidimetría Materlab) a las 6-8 semanas de finalizar el tratamiento.
Se registraron datos demográficos como la edad, sexo y país de nacimiento y clínicos como los síntomas, las enfermedades asociadas, el tratamiento previo, los hallazgos endoscópicos, el patrón de resistencias y las tasas de erradicación. Se consideran resistencias primarias cuando no han recibido terapia erradicadora previa y resistencias secundarias cuando han recibido tratamiento sin éxito previo al cultivo. Se definen como dobles resistencias aquellas cepas resistentes a claritromicina y metronidazol.
Se realizó un análisis descriptivo presentando frecuencias absolutas y relativas para las variables cualitativas y media y desviación o mediana y rango intercuartílico en el caso de variables cuantitativas. Como resultado principal se presenta la frecuencia de resistencias y el intervalo de confianza al 95% calculado por el método de Wilson. Se realizó un análisis univariante de carácter exploratorio para estudiar factores asociados con la presencia de resistencias y la erradicación. Se calculó el test chi cuadrado o el test exacto de Fisher en el caso de variables cualitativas y el test t de Student para dos muestras independientes o el test no paramétrico U de Mann Whitney, según la distribución de los datos, en el caso de variables cuantitativas. Todos los test se consideran bilaterales y como estadísticamente significativos aquellos p-valores menores de 0,05.
Aspectos éticos: el protocolo de estudio fue revisado y aprobado por el CEIm.
ResultadosA lo largo del periodo de estudio se incluyeron 80 pacientes (2014: n=12; 2015: n=15; 2016: n=15; 2017: n=9; 2018: n=15; 2019: n=14). El 63,8% eran mujeres. La media de edad al diagnóstico fue 11,9 años (±2,7DS). El país de nacimiento fue España en un 82,5% de los casos, mientras que un 7,5% procedían de Europa del este, 3,7% Sudamérica, 3,7% del norte de África y un 2,5% de Asia. El síntoma principal más frecuente fue la epigastralgia (57,5%), seguido de dolor abdominal en otras localizaciones (22,5%), náuseas/vómitos (5%) y anemia ferropénica resistente al tratamiento (2,5%). Un 12,5% de los pacientes presentaban otros síntomas o el diagnóstico se realizó como hallazgo casual en el contexto de una endoscopia por otro motivo. En cuanto a las enfermedades digestivas asociadas las más frecuentes fueron: reflujo gastroesofágico (13,7%), enfermedad celiaca (7,5%) y esofagitis eosinofílica (5%). En la endoscopia un 10% de los pacientes presentaron lesiones ulcerosas pépticas definidas como erosiones o úlceras gástricas o duodenales. Un 38,8% había recibido tratamiento previo sin éxito para H. pylori. Un 92,5% (74/80) de los pacientes incluidos recibió tratamiento erradicador tras la endoscopia y el cultivo con diferentes pautas acorde a antibiograma. El 100% de los pacientes tratados realizó estudio de erradicación a las 6-8 semanas de finalizar el tratamiento.
De forma global en el periodo de estudio el 67,5% (n=54, IC95%: 56,6%-76,8%) presentaba resistencia al menos a un fármaco: claritromicina 52,5% (n=42, IC95%: 41,7-63,1%), metronidazol 31,3% (n=25, IC95%: 22,2%-42,1%), levofloxacino 7,9% (n=5/63, IC95%: 3,4%-17,3%), amoxicilina 7,5% (n=6, IC95%: 3,5%-15,4%). Un 16,3% (n=13, IC95%: 9,8%-25,8%) presentaron doble resistencia a claritromicina y metronidazol.
Los pacientes que no habían recibido tratamiento previo presentaron resistencias significativamente menores (resistencias primarias: 57,1%) que aquellos que habían recibido tratamiento sin éxito (resistencias secundarias: 83,9%) p=0,01 (tabla 1). Los pacientes nacidos en España presentan con mayor frecuencia cepas resistentes a algún fármaco y resistencias significativamente mayores a claritromicina que el grupo nacido fuera de España donde no se detectaron resistencias a este fármaco (63,6% vs. 0% p<0,001). Respecto al resto de antibióticos no existían diferencias significativas en cuanto al sexo, edad o país de nacimiento (tabla 2).
Patrón de resistencias antibióticas
| Resistenciastotales (%) | Resistenciasprimarias (%) | Resistenciassecundaria (%) | p-valor | ||||
|---|---|---|---|---|---|---|---|
| n=80 | n=49 | n=31 | |||||
| Amoxicilina | 6 | 7,5% | 1 | 2,0% | 5 | 16,1% | 0,03 |
| Claritromicina | 42 | 52,5% | 22 | 44,9% | 20 | 64,5% | 0,087 |
| Metronidazol | 25 | 31,3% | 8 | 16,3% | 17 | 54,8% | <0,001 |
| Dobles resistencias | 13 | 16,3% | 2 | 4,1% | 11 | 35,5% | <0,002 |
| Levofloxacino (n=63) | 5 | 7,9% | 3 | 7,9% | 2 | 8,0% | 1 |
| Tetraciclina | 0 | 0 | 0 | - | |||
| Rifampicina (n=38) | 0 | 0 | 0 | - | |||
Factores de riesgo para el desarrollo de resistencias
| Sensible | Resistente | p-valor | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Resistencias globales (resistencia a algún fármaco) | |||||
| Edad | 11,7±2,6 DS | 12±2,7 DS | 0,683 | ||
| Sexo | |||||
| mujer | 16 | 31,4% | 35 | 68,6% | 0,775 |
| varón | 10 | 34,5% | 19 | 65,5% | |
| Nacido España | |||||
| sí | 17 | 25,8% | 49 | 74,2% | 0,01 |
| no | 9 | 64,3% | 5 | 35,7% | |
| Tratamiento previo | |||||
| sí | 5 | 16,1% | 26 | 83,9% | 0,015 |
| no | 21 | 42,9% | 28 | 57,1% | |
| Claritromicina | |||||
| Edad | 11,4±2,7 DS | 12,4±2,6 DS | 0,112 | ||
| Sexo | |||||
| mujer | 21 | 41,2% | 30 | 58,8% | 0,133 |
| varón | 17 | 58,6% | 12 | 41,4% | |
| Nacido España | |||||
| sí | 24 | 36,4% | 42 | 63,6% | <0,001 |
| no | 14 | 100,0% | |||
| Tratamiento previo | |||||
| sí | 11 | 35,5% | 20 | 64,5% | 0,11 |
| no | 27 | 55,1% | 22 | 44,9% | |
| Metronidazol | |||||
| Edad | 12,2±2,5 DS | 11,3±2,9 DS | 0,188 | ||
| Sexo | |||||
| mujer | 35 | 68,6% | 16 | 31,4% | 0,975 |
| varón | 20 | 69,0% | 9 | 31,0% | |
| Nacido España | |||||
| sí | 46 | 69,7% | 20 | 30,3% | 0,755 |
| no | 9 | 64,3% | 5 | 35,7% | |
| Tratamiento previo | |||||
| sí | 14 | 45,2% | 17 | 54,8% | <0,001 |
| no | 41 | 83,7% | 8 | 16,3% | |
| Dobles resistencias | |||||
| Edad | 11,9±2,6 | 11,9±3,1 | 0,969 | ||
| Sexo | |||||
| mujer | 40 | 78,4% | 11 | 21,6% | 0,119 |
| varón | 27 | 93,1% | 2 | 6,9% | |
| Nacido España | |||||
| sí | 53 | 80,3% | 13 | 19,7% | 0,11 |
| no | 14 | 100,0% | |||
| Tratamiento previo | |||||
| sí | 20 | 64,5% | 11 | 35,5% | <0,001 |
| no | 47 | 95,9% | 2 | 4,1% | |
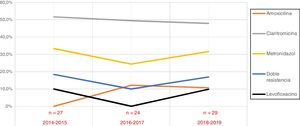
En cuanto a la evolución de las resistencias a lo largo del periodo de estudio, no se ha observado una modificación significativa de las mismas en los años de estudio (fig. 1).
De los pacientes que recibieron tratamiento, lo hicieron guiado por antibiograma y siguiendo las recomendaciones ESPGHAN vigentes en cada momento. Las tasas de erradicación globales fueron de un 65,8%, siendo mayores en aquellos pacientes que no habían recibido tratamiento previo (71,1% vs. 57,1% p=0,31). Del mismo modo los pacientes que presentaban dobles resistencias tenían tasas de erradicación inferiores respecto al resto de pacientes (50% vs. 68,9% p=0,31). En los pacientes que recibieron tratamiento acorde a las nuevas guías ESPGHAN 2017 las tasas de erradicación fueron significativamente superiores en comparación con los que recibieron tratamiento acorde a las guías previas (80% vs. 55,8% p=0,04). La tasa de erradicación de los pacientes tratados en el último año de estudio (2019) fue del 100% (n=12/12).
DiscusiónEn nuestro medio, las resistencias antibióticas en el periodo de estudio son muy altas, similares a las descritas previamente en nuestro país11–14. Estas resistencias se mantienen estables en el periodo de tiempo estudiado y son similares a las descritas en los países del sur de Europa, donde las resistencias a claritromicina son claramente superiores al resto de regiones europeas15–18.
Respecto a los factores de riesgo para el desarrollo de resistencias, el uso de terapias erradicadoras previas sin éxito aparece como un claro factor de riesgo para el desarrollo de resistencias. Por lo tanto, es fundamental que cuando esté indicado el tratamiento, este se base en estudios de susceptibilidad antibiótica para evitar el fracaso terapéutico y el desarrollo de resistencias secundarias.
Las resistencias primarias a claritromicina son notablemente superiores en niños (44,9%) que las descritas en adultos en nuestro medio (14,7-22%)19–23. La mayor tasa de resistencias primarias en niños en comparación con adultos apunta a una adquisición in vivo de la resistencia durante la infancia. Los alarmantes niveles de resistencia a claritromicina en pacientes sin tratamiento previo pueden correlacionarse con el consumo creciente de macrólidos que se usan comúnmente en la terapia empírica de H. pylori y también en otras infecciones muy comunes en esta edad, fundamentalmente infecciones respiratorias. La claritromicina no debe utilizarse nunca como primera línea de tratamiento cuando no se ha realizado cultivo o no se ha conseguido crecimiento de H. pylori o antibiograma, puesto que el nivel de resistencias es muy superior al 20%.
Por el contrario, las resistencias primarias a metronidazol (16,3% vs. 27-40%) y levofloxacino (7,9% vs. 13,9-38%) son claramente superiores en los estudios realizados en población adulta en nuestro medio20–23. Aunque las quinolonas no están aprobadas para su uso en la edad pediátrica, la tasa de resistencia primaria a levofloxacino en niños es notable (7,9%), reflejando posiblemente la resistencia en la cepa infectante y la propagación intrafamiliar de la misma a partir de los adultos. Los niños adquieren la infección por H. pylori principalmente de sus padres infectados, sobre todo de su madre24.
La prevalencia de lesiones ulcerosas pépticas en nuestro estudio es de un 10%. Estos hallazgos son concordantes con los descritos en un estudio europeo multicéntrico de resistencias donde el 6,8% presentaron lesiones ulcerosas (10,4% de los mayores de 11 años)15.
En junio de 2017, se publicaron las nuevas guías ESPGHAN para el manejo de la infección por H. pylori en niños y adolescentes3. Estas guías insisten en la necesidad de que el objetivo primario de la investigación clínica de los niños con síntomas gastrointestinales debe ser determinar la causa subyacente de los síntomas y no solo la presencia de infección por H. pylori. No se debe investigar la presencia de H. pylori en niños con dolor abdominal funcional y a diferencia de los adultos tampoco están indicadas las estrategias «test and treat» (diagnóstico no invasivo y tratamiento). Se recomienda que el diagnóstico inicial de la infección por H. pylori se realice utilizando métodos invasivos basados en la endoscopia con biopsias gástricas y cultivo. Los tratamientos de erradicación, cuando estén indicados, deben hacerse adaptados a los estudios de susceptibilidad antibiótica. Las nuevas guías incluyen cambios sustanciales en la pauta terapéutica respecto a las guías previas, como un aumento en la duración de las terapias y una mayor dosis de inhibidores de la bomba de protones (IBP), particularmente en niños pequeños (dosis de 1,5 a 2,5mg/kg/día).
Al analizar si estas nuevas recomendaciones terapéuticas mejoraban las tasas de erradicación se ha observado que existe una mejoría significativa en los pacientes tratados acorde a las nuevas guías ESPGHAN.
Para evitar la inducción de resistencias secundarias en las cepas infectantes de H. pylori, las tasas de erradicación deben alcanzar al menos el 90% en el análisis por protocolo25. Sin embargo, este objetivo rara vez se obtiene en la mayoría de los ensayos publicados recientemente en niños. En nuestro estudio, aunque existe una mejoría importante en las tasas de erradicación en los últimos años, todavía están por debajo de las deseadas. Aquí pueden jugar un papel muy importante diferentes factores como la alta tasa de resistencias y la elevada proporción de pacientes con dobles resistencias en nuestro medio, donde las tasas de erradicación son inferiores.
El creciente número de pacientes pediátricos infectados con cepas multirresistentes exige la evaluación de los regímenes de tratamiento. Los antibióticos de segunda línea como las quinolonas o las tetraciclinas no están aprobadas en la edad pediátrica o solo a partir de una determinada edad. La rifabutina se ha utilizado con éxito en adultos, pero puede causar problemas de resistencia en el tratamiento de la tuberculosis, por lo que las opciones terapéuticas en este grupo de pacientes son muy limitadas. Debido a que la resistencia in vitro a metronidazol puede superarse in vivo usando dosis altas y una ingesta prolongada, un estudio multicéntrico europeo evaluó la tasa de erradicación y los efectos secundarios de una triple terapia con dosis altas (amoxicilina ∼75mg/kg/día, metronidazol ∼25mg/kg/día y esomeprazol ∼1,5mg/kg/día) durante 2 semanas en pacientes pediátricos con doble resistencia probada con cultivo. En este estudio la tasa de erradicación en el análisis por intención de tratar fue del 66% (IC 95% 54-78) y del 73% (IC 95% 60-86) en el análisis por protocolo26. Aunque estas tasas de erradicación son mejores que las descritas previamente todavía están muy alejadas de las consideradas como ideales. Es importante tener en cuenta que este estudio es previo a la publicación de las guías actuales y en el mismo se usaron dosis de IBP más bajas (∼1,5mg/kg/día) que las recomendadas actualmente (1,5-2,5mg/kg/día). Actualmente las guías recomiendan tratar a los pacientes con dobles resistencias con triple terapia con dosis altas 14 días (IBP-amoxicilina-metronidazol) o cuádruple terapia con bismuto (< 8 años: bismuto-IBP-amoxicilina-metronidazol;>8 años: bismuto-IBP-metronidazol-tetraciclina).
Además de la alta resistencia de H. pylori a los agentes antimicrobianos, existen otras razones para el fracaso terapéutico, tales como la falta de adherencia, dosis o duración inadecuadas, metabolismo rápido de ciertos IBP, factores de virulencia bacteriana, penetración ineficaz de antibióticos en la mucosa gástrica e inactivación de antibióticos a pH gástrico bajo.
Un estudio reciente ha evaluado el papel de la adherencia terapéutica en pacientes pediátricos tratados según antibiograma para comprender las razones del fracaso del tratamiento27. En este estudio los niños con adherencia al tratamiento por encima del 90% tuvieron una tasa de erradicación del 89,9%, mientras que los no adherentes erradicaban en un 36,8%. Por lo tanto, es fundamental explicar al paciente y su familia la importancia de una adecuada adherencia al tratamiento ya que esto puede influir de forma muy significativa en la mejora de las tasas de erradicación.
La alta tasa de resistencias de H. pylori y, en consecuencia, las bajas tasas de erradicación, siguen siendo una preocupación muy importante. Por lo tanto, el tratamiento de primera línea debe hacerse guiado por estudios de sensibilidad antibiótica y en los casos en los que no se puedan realizar o no estén disponibles, al menos de acuerdo con las tasas regionales de resistencia. La aplicación correcta de las nuevas guías mejora de forma significativa el nivel de erradicación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados preliminares de este estudio se presentaron como comunicación oral breve en los congresos de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP) celebrados en Gijón 2016 y Santander 2019.