La neuromonitorización de la función cerebral mediante electroencefalografía continua (aEEG/cEEG) es una herramienta esencial en el cuidado estándar del niño a término, y de utilidad creciente en el niño prematuro como biomarcador de lesión y maduración cerebral. Sin embargo, la colocación de los electrodos supone un gran reto, especialmente en el niño prematuro extremo, desalentando frecuentemente su neuromonitorización. El objetivo de este estudio es analizar los diferentes electrodos disponibles, seleccionar el que mejor se adapta a las peculiaridades del niño prematuro extremo y evaluar su aplicabilidad en la práctica clínica.
Población y métodosCon motivo del diseño de un protocolo de estudio de neuromonitorización mediante aEEG/cEEG en niños prematuros<28 semanas, analizamos nuestra experiencia con los tipos de electrodos disponibles y seleccionamos el que consideramos más adecuado para esta población mediante la valoración de: necesidad de preparación del cuero cabelludo, rapidez de colocación, si se trataba de una aplicación invasiva, posibilidad de reposicionamiento, riesgo de lesiones cutáneas, esterilidad de la técnica y durabilidad. El electrodo elegido se utilizó para la monitorización continua electroencefalográfica iniciada en las primeras 24h de vida y mantenida al menos hasta las 72h.
ResultadosLos electrodos evaluados fueron: agujas subdérmicas, cucharillas de plata y 2 tipos de electrodos autoadhesivos (de hidrogel sólido y de gel conductor líquido). Los electrodos de gel conductor líquido fueron los elegidos. Se utilizaron en 41 neonatos con una edad gestacional media de 25,8±1,1 semanas. Se obtuvo una buena impedancia duradera de forma rápida y sin necesidad de manipulaciones excesivas y no observamos lesiones cutáneas. La satisfacción del personal involucrado en su colocación fue muy elevada.
ConclusiónLos electrodos autoadhesivos desechables con gel conductor líquido y cable integrado permiten una colocación rápida y no invasiva para una monitorización aEEG/cEEG prolongada y de buena calidad en el niño prematuro extremo.
Monitoring of brain function using continuous electroencephalography (aEEG/cEEG) is an essential tool in the standard care of the term infant, and its use is growing in the premature infant as a biomarker of lesion and brain maturity. However, the placing of the electrodes is a great challenge, particularly in the extremely premature infant, which often discourages neuromonitoring. The aim of this study is to assess the different electrodes available, to select the one that best suits the peculiarities of the extremely premature infant, and evaluate its applicability in clinical practice.
Population and methodsWith the aim of designing a neuromonitoring study protocol using aEEG/cEEG in<28 weeks premature infants, an analysis was made of our experience with the type of electrodes available. The electrode that was considered most suitable for this population was chosen by assessing: the need of preparing the scalp, speed in positioning the electrodes, if the application was invasive or not, the possibility of repositioning, risk of skin injuries, sterility of the technique, and durability. The electrode chosen was used for continuous electroencephalographic monitoring started in the first 24h of life, and maintained until at least 72h of life.
ResultsThe electrodes evaluated were: subdermal needles, silver cups, and 2 types of self-adhesive electrodes (solid hydrogel and wet gel). The wet gel electrodes were chosen. They were used on 41 neonates with a mean gestational age of 25.8±1.1 weeks. Good stable impedance was rapidly obtained, without the need of excessive manipulations, and no skin injuries were observed. The satisfaction of the staff involved in positioning them was very high.
ConclusionThe self-adhesive disposable electrodes with wet gel and integrated cable enabled the electrodes to be positioned rapidly and provided continuous non-invasive and good quality aEEG/cEEG monitoring in the extremely premature infant.
La aplicación clínica de la monitorización continua de la función cerebral mediante electroencefalografía integrada por amplitud (aEEG) es indiscutible en las unidades neonatales1,2. En el niño a término las indicaciones están bien establecidas3–5. En el niño prematuro, estudios recientes muestran su utilidad como biomarcador de la lesión cerebral aguda y la maduración de la actividad eléctrica cerebral, así como para la determinación del pronóstico neurológico6–20.
El reto de una colocación adecuada de los electrodos con frecuencia retrasa el inicio de la monitorización, artefacta el registro impidiendo su interpretación y/o implica múltiples manipulaciones en pacientes inestables. Estos obstáculos se magnifican en el niño prematuro extremo, especialmente en sus primeros días de vida, desalentando su neuromonitorización21,22. El espacio de maniobra es estrecho, pues requieren estar en incubadora y frecuentemente con soporte respiratorio. La superficie para colocar los electrodos es reducida dado el tamaño pequeño de la cabeza, y de difícil acceso ya que la mayoría van a necesitar gorros para la sujeción de dispositivos respiratorios (nCPAP). Además, el tiempo es una limitación debido a que la pérdida de calor y humedad durante manipulaciones prolongadas podría alterar la estabilidad de su homeostasis térmica, y en los pacientes más inestables puede implicar un deterioro de su situación cardiorrespiratoria. De modo que a pesar de ser una técnica de monitorización no invasiva, requiere de una gran destreza para su puesta en marcha23.
El objetivo de este estudio es analizar los diferentes electrodos disponibles para la monitorización aEEG/electroencefalografía continua (cEEG), seleccionar el que mejor se adapta a las peculiaridades del niño prematuro extremo y evaluar su aplicabilidad en la práctica clínica.
Pacientes y métodosEl estudio se realizó en una unidad de neonatología de nivel IIIC que dispone de monitores de función cerebral desde el año 2006. Desde que se inició la monitorización mediante aEEG en la unidad se han utilizado diferentes tipos de electrodos: agujas subdérmicas (Ambu® Neuroline Subdermal Needle), cucharillas de plata (Pediatric Silver Cup Electrodes, Natus® Neurology), electrodos autoadhesivos de hidrogel sólido (Neonatal Hydrogel Sensors, Natus® Neurology y Ambu® Neuroline 700) y electrodos autoadhesivos con gel líquido conductor con cable integrado (Ambu® Neuroline 720) y sin cable integrado (Ambu® BlueSensor N con el cable de presión Reusable Snap Leads, Natus® Neurology).
Con motivo del diseño de un protocolo de estudio de neuromonitorización continua en prematuros<28 semanas revisamos nuestra experiencia en el uso de los diferentes tipos de electrodos disponibles para la monitorización aEEG/cEEG. Dos neonatólogos expertos en la técnica de monitorización aEEG realizaron la evaluación. El análisis se basó en la propia experiencia en la práctica clínica con los diferentes tipos de electrodos, así como en una encuesta dirigida a enfermeras docentes y/o con más de 10 años de experiencia de la unidad. Se evaluó la necesidad de preparación previa del cuero cabelludo para conseguir una adecuada impedancia, el tiempo empleado en su colocación, si era una técnica de aplicación invasiva o no, la posibilidad de reposicionamiento, el riesgo de lesiones cutáneas en monitorizaciones prolongadas, la esterilidad y la durabilidad.
El electrodo seleccionado, autoadhesivo de gel líquido conductor con cable integrado (Ambu® Neuroline 720), se utilizó para la monitorización cEEG de niños prematuros<28 semanas, iniciada en las primeras 24h de vida y mantenida al menos hasta las 72h. Se utilizó el montaje neonatal simplificado derivado del sistema internacional 10-20 (10 electrodos/paciente: Fp1, Fp2, C3, C4, T3, T4, O1, O2, toma de tierra y referencia)23. Como tendencia se utilizó la aEEG derivada de 3 canales (C3-T3, C4-T4, C3-C4).
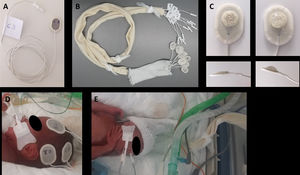
Procedimiento de colocación de los electrodosPara minimizar el tiempo de manipulación del paciente y de trabajo dentro de la incubadora y asegurar una aplicación sistemática, se siguieron algunos pasos modificados del método descrito por Lloyd et al.24: 1) etiquetar ambos extremos de cada electrodo con una localización topográfica: con rotulador en el reverso del sensor y con una etiqueta en el cable, próxima al conector a la caja amplificadora, lo que permite conectar los electrodos a la caja amplificadora en un segundo tiempo; 2) agrupar todos los cables dentro de una larga porción de venda tubular (Tubinet®) para impedir que se enreden con otros cables, alargaderas de infusión o tubuladuras y disminuir las interferencias; 3) agrupar los electrodos de cada hemisferio con el fin de colocar los electrodos de cada lado conjuntamente y reducir así los cambios posturales cefálicos25 (fig. 1).
Preparación y colocación de los electrodos: A) etiquetar ambos extremos de cada electrodo con una localización; B) agrupar todos los cables utilizando una venda tubular; C) aplicar una pequeña cantidad de gel adhesivo conductor en la esponja del electrodo; D) colocar los electrodos de cada hemisferio conjuntamente; E) deslizar la malla tubular sobre la cabeza a modo de gorro de sujeción.
Se introdujeron los electrodos dentro de la incubadora unos minutos antes de proceder a su colocación con el fin de calentarlos y favorecer su adherencia. Se procedió posteriormente a retirar el plástico protector del electrodo y se aplicó la cantidad equivalente a un grano de arroz de gel adhesivo conductor (Pâte ReegaPha Conductrice Tube, MEI). Tras colocar cada electrodo en su localización, se presionó durante unos segundos en los bordes (no en la zona del gel y sensor) para conseguir una adhesión máxima. A los pacientes que no precisaban gorro de nCPAP se les colocó un gorro de sujeción hecho con malla tubular (Tubifix®). Para los registros se utilizó el monitor NicoletOneTM EEG System (Natus Medical Inc., EE. UU.). Se evaluó, a través de una encuesta personal sobre los parámetros de idoneidad establecidos en la selección inicial del electrodo, la satisfacción del personal de enfermería involucrado en la colocación y mantenimiento de los electrodos de los pacientes incluidos en el estudio. Los electrodos se retiraron utilizando un espray elimina adhesivos (Brava® adhesive remover spray, Coloplast).
El estudio de neuromonitorización fue aprobado por el Comité de Ética de Investigación Clínica. Los pacientes fueron incluidos en el estudio tras firmar el consentimiento informado.
Las variables cuantitativas se expresan como media±desviación estándar.
ResultadosAnálisis de los pros y contras de los diferentes tipos de electrodosAgujas subdérmicas (Ambu® Neuroline Subdermal Needle)No requieren preparación previa del cuero cabelludo salvo aplicación de un antiséptico, y se colocan de forma rápida. Tienen el inconveniente de ser un procedimiento invasivo que supone la pérdida de la integridad de la piel y un riesgo de lesiones cutáneas e infección. Permiten registros prolongados, aunque se descolocan con relativa frecuencia, requiriendo de recolocación. Conllevan el riesgo de pinchazo accidental del personal.
Cucharillas de plata (Pediatric Silver Cup Electrodes, Natus® Neurology)Se colocan de manera no invasiva cuantas veces sean necesarias y son los de menor tamaño (6mm de diámetro). Tienen en su contra el hecho de que su colocación es lenta, ya que hay que preparar el cuero cabelludo con pasta abrasiva, rellenar cada cucharilla con pasta conductora y cubrirlas con cinta adhesiva para conseguir una buena fijación. Además, se descolocan frecuentemente, asocian riesgo de lesiones cutáneas por decúbito y no son desechables.
Electrodos autoadhesivos de hidrogel sólido (Neonatal Hydrogel Sensors, Natus® Neurology y Ambu® Neuroline 700)Son planos y tienen un sensor de plata que se asienta sobre una lámina de hidrogel conductivo, flexible y adhesivo, que facilita el reposicionamiento. Así, el área de contacto con la piel equivale al área adhesiva y al área de medición. Los de la marca Ambu® son más pequeños (15×20mm). Se colocan de forma rápida y no invasiva, se retiran fácilmente sin dejar residuos sobre la piel y son desechables. Sin embargo, requieren de una preparación previa del cuero cabelludo con pasta abrasiva y, en nuestra experiencia, su durabilidad es recortada y pierden frecuentemente el contacto adecuado con el cuero cabelludo, precisando recolocaciones frecuentes.
Electrodos autoadhesivos con gel líquido conductor con cable integrado (Ambu® Neuroline 720) y sin cable integrado (Ambu® BlueSensor N con el cable de presión Reusable Snap Leads, Natus® Neurology)Tienen un sensor de plata que se asienta sobre una pequeña esponja impregnada en gel líquido conductor y que está rodeada por una superficie de adhesivo acrílico (fig. 2). Así, en estos electrodos, el área de medición es menor que el área de contacto del electrodo con la piel y diferente al área adhesiva. No requieren de preparación del cuero cabelludo, se colocan de manera rápida y no invasiva, la adhesión del acrilato es fuerte y duradera, y el gel es altamente conductivo. En las monitorizaciones prolongadas, al secarse el gel conductor, disminuye el contacto del sensor con el cuero cabelludo, pero se puede solventar sin necesidad de despegar el electrodo, añadiendo un gel conductor adhesivo entre el electrodo y el cuero cabelludo. Sin embargo, si el electrodo se despega por completo del cuero cabelludo pierde su capacidad de adhesión y no es posible reutilizarlo. Tanto para retirar los electrodos como el posible gel conductor adhesivo añadido que se va secando hace falta un espray quita adhesivos.
El modelo con cable integrado es plano (30×22mm) y totalmente desechable. El modelo sin cable integrado es de mayor tamaño (44,8×22mm) ya que incluye el conector al cable, el cual, a su vez, ofrece los inconvenientes de ser voluminoso en su unión al electrodo y no ser desechable.
Selección del electrodo idóneoLa evaluación comparativa de los parámetros de idoneidad analizados para los diferentes tipos de electrodos por 2 neonatólogos expertos en neuromonitorización electroencefalográfica y enfermeras de la Unidad de Cuidados Intensivos Neonatales queda reflejada en la figura 3.
Aplicabilidad en la práctica clínicaSe utilizaron los electrodos autoadhesivos con gel líquido conductor y cable integrado (Ambu® Neuroline 720) en 41 niños con una edad gestacional media de 25,8±1,1 semanas y un peso medio de 820±186g. El tiempo medio total empleado en el procedimiento de preparación y colocación de los electrodos hasta el inicio del registro fue de 30min. Se consiguió una impedancia<10kOhms en todos los electrodos en el primer intento de colocación en 36/41 (88%) pacientes, siendo<5kOhms para todos los electrodos en 25/41 (61%). La duración media de la monitorización aEEG/cEEG fue de 71±17h.
Durante los registros, se hicieron un total de 375 pruebas de impedancia: en 286 (76%) todos los electrodos tenían una impedancia<10kOhms, siendo<5kOhms para todos los electrodos en 195 (52%) ocasiones. No hubo necesidad de cambiar los electrodos en ningún paciente. La aplicación de una pequeña cantidad de gel adhesivo conductor (Pate ReegaPha Conductrice Tube, MEI) bajo el disco autoadhesivo mediante una cánula de plástico conectada a una jeringa cargada con el gel, fue suficiente para reducir la impedancia en las ocasiones en las que algún sensor perdió el contacto adecuado con el cuero cabelludo. No se registraron lesiones cutáneas. El grado de satisfacción del personal involucrado en su colocación y mantenimiento fue muy elevado. Los electrodos se retiraron fácilmente con el espray para eliminar adhesivos (Brava®, Coloplast).
DiscusiónEn este estudio presentamos una manera sistemática, sencilla, no invasiva y duradera de colocación de electrodos para la monitorización continua mediante aEEG/cEEG en niños prematuros extremos. Abordamos 2 retos: 1) el de encontrar el electrodo idóneo para esta población de niños prematuros respetando el principio de la mínima manipulación e invasividad tanto en la colocación como en el mantenimiento de los mismos, y 2) el de conseguir monitorizaciones prolongadas manteniendo impedancias bajas y registros de calidad.
El gran enemigo es la impedancia y la vencemos. La impedancia se define como la oposición o resistencia al paso de la corriente entre la superficie de la corteza cerebral y el cuero cabelludo, y en los electrodos de superficie refleja la calidad del contacto piel-electrodo. Una impedancia elevada en un electrodo aumenta la probabilidad de que recoja otras señales comunes del entorno (respiradores, bombas de infusión, luces), artefactando el registro. Las agujas subdérmicas permiten conseguir una impedancia baja y estable de manera inmediata sin necesidad de exfoliar la piel26. Sin embargo, su aplicación invasiva es poco aceptada entre el personal sanitario y las familias. La Sociedad Americana de Neurofisiología Clínica27 contraindica su uso. La alternativa a las agujas es la laboriosa preparación del cuero cabelludo con pasta o gel abrasivo para el uso de electrodos de superficie (autoadhesivos y cucharillas)24,28. Su aplicación a modo de peeling elimina la capa seca más superficial de la epidermis y humedece el estrato córneo mejorando la conductividad, pero su uso se desaconseja en el niño prematuro extremo por el riesgo de lesión cutánea. Con los electrodos autoadhesivos con gel líquido y aplicando en ocasiones una pequeña cantidad de gel conductor adhesivo conseguimos impedancias por debajo de 5-10kOhms sin necesidad de aplicar la pasta abrasiva. Lo óptimo es lograr impedancias por debajo de 5kOhms; sin embargo, las guías de neurofisiología aceptan impedancias menores de 10kOhms, especialmente en neonatos, para evitar manipulaciones excesivas o abrasiones cutáneas27. En los niños menores de 30 semanas de gestación la epidermis está excesivamente hidratada, ejerciendo una pobre función de barrera que rápidamente madura a partir de la semana de vida29. Esto podría justificar que se consigan bajas impedancias sin necesidad de abrasión de la piel en esta población. No obstante, el gel líquido hidrata más y más rápido la piel que el hidrogel, lo que también contribuye a una mejor conductividad, además de que el gel incorporado en los electrodos con gel conductor líquido es altamente conductivo. Así, con estos electrodos de gel líquido conductor autoadhesivos se reduce el tiempo de manipulación y el posible malestar que pueda generar la preparación de la piel, y además, obtenemos impedancias bajas y mejor calidad de la señal.
Preparamos los electrodos de una manera similar a la descrita por Lloyd et al.24, lo que permite también disminuir el tiempo de preparación dentro de la incubadora y la necesidad de cambios posturales de la cabeza. Es muy útil además tener los electrodos etiquetados en el extremo del cable cercano a la caja amplificadora, lo que permite desconexiones y reconexiones rápidas en caso, por ejemplo, de necesitar un gorro por extubación accidental y paso urgente a ventilación no invasiva con CPAP. Lloyd et al.24 utilizan con éxito electrodos de hidrogel sólido. En nuestra experiencia, los electrodos de hidrogel requieren recolocaciones frecuentes, si bien no los fijamos con cinta adhesiva y pasta conductora como describen. Además, para mantener los electrodos en su sitio y tener fácil acceso a ellos, usan como sujeción gorros de nCPAP cortados por la línea media anterior (en pacientes con y sin ventilación no invasiva), que después cierran con el propio velcro del gorro y cinta adhesiva. Refieren que no se pierde el sello de la nCPAP pero, en nuestra opinión, no nos parece una solución adecuada, dada la importancia del ajuste del gorro a la cabeza para mantener la interfase bien ajustada. Schumacher et al.30 también describen buenos resultados con electrodos de hidrogel sólido utilizando un gorro de sujeción similar al que utilizan Lloyd et al.24, pero específicamente diseñado para ello. La capacidad adhesiva de los electrodos con gel líquido es mayor que la de los electrodos de hidrogel al utilizar el acrilato como adhesivo, por lo que no precisan un sistema añadido de sujeción tipo cinta adhesiva, si bien los gorros de nCPAP o hechos con malla tubular también ayudan a mantener su posición al organizar los cables y evitar desplazamientos durante manipulaciones. Por otro lado, a pesar de que en las guías de mínimos no esté aceptado27, ambos métodos24,30 toleraron impedancias más altas (20 y 40kOhms, respectivamente) según los resultados de Ferree et al.31, quienes comparan, sin encontrar diferencias, registros con impedancias de 10 vs. 40kOhms.
Los electrodos de hidrogel y la cinta adhesiva de sujeción de cucharillas y agujas no se adhieren bien en presencia de pelo, lo que obliga en ocasiones a rasurar la zona. Los electrodos de gel líquido pueden requerir preparado del cuero cabelludo en estos casos para alcanzar una buena impedancia, pero su adhesividad no se ve truncada.
El adhesivo acrílico de los electrodos de gel líquido es, por tanto, muy ventajoso a la hora de colocar los electrodos, pero a la vez les confiere una desventaja a la hora de retirarlos. Es necesario un espray elimina adhesivos para poder despegarlos sin provocar molestias. Una vez quitados pierden su capacidad adhesiva y, por consiguiente, a diferencia del resto, no se pueden recolocar. Sin embargo, cuando su sensor pierde el contacto adecuado con el cuero cabelludo, a diferencia del resto, se puede solucionar sin necesidad de retirarlos para reacondicionar la piel: basta con añadir una pequeña cantidad de gel conductor bajo el disco adhesivo. El gel conductor que utilizamos no solo disminuye la impedancia de manera rápida, sino que además tiene capacidad adhesiva, prolongando la durabilidad del electrodo. Es importante hacer énfasis en que las cantidades de gel que se apliquen bajo los sensores deben ser pequeñas, ya que, en exceso, puede crear puentes entre los electrodos o, al secarse, una costra de gel que acaba haciendo de barrera y aumentando más la impedancia, siendo entonces necesario cambiar los electrodos.
La presencia de cable integrado o no cabe resaltarla en el niño prematuro extremo, pero nos resulta indiferente en el niño a término. El volumen cefálico tan reducido de estos niños hace que el espacio extra que ocupan los botones pueda interferir con la colocación de los gorros de CPAP, añada puntos de presión a la piel y que, con frecuencia, la zona de unión corchete-botón no quede debidamente apoyada sobre el cuero cabelludo, sino que cuelgue y tire del electrodo.
Aunque nuestro estudio utilizó la monitorización mediante electroencefalografía convencional, en la práctica clínica se utiliza la monitorización mediante aEEG, es decir, con menos electrodos. Según el monitor de función cerebral empleado se necesitarán de 3 a 6 electrodos por paciente. Así, los tiempos (de preparación, de puertas abiertas de la incubadora y de manipulación del paciente) en la práctica habitual en las unidades de neonatología serían menores.
Todo el personal involucrado en su colocación y mantenimiento se mostró claramente satisfecho con su uso. Fueron muchos los que admitieron abiertamente que con este sistema y electrodos no demoraban o esquivaban el inicio de la neuromonitorización, y lo que se veía antes como un reto tedioso se afronta ahora con una actitud proactiva en nuestra unidad.
La principal limitación de este estudio es que no se trata de una comparación directa prospectiva entre electrodos. El Ters et al.32 han sido los únicos que han presentado hasta el momento resultados basados en un estudio prospectivo comparativo entre electrodos. Compararon los electrodos de hidrogel con los de cucharilla, sin encontrar diferencias en cuanto a seguridad y calidad de los registros. En nuestra experiencia, los electrodos autoadhesivos de gel líquido conductor tienen una mayor conductividad y capacidad de adhesión que los de hidrogel sólido, lo que nos permite obtener registros de mayor calidad y durabilidad en el tiempo. Hasta el momento, no hay datos en la literatura que analicen los electrodos autoadhesivos de gel líquido conductor en la población neonatal.
Convendría ahora diseñar un estudio prospectivo comparativo de los electrodos de hidrogel sólido con los electrodos autoadhesivos de gel líquido. No obstante, el futuro está en los electrodos secos33 integrados en gorros que a su vez sirvan de sujeción para los dispositivos respiratorios tipo CPAP, pero queda un largo camino por recorrer.
ConclusionesLos electrodos autoadhesivos con gel líquido conductor y cable integrado permiten una colocación rápida y no invasiva para una monitorización aEEG/cEEG prolongada y de buena calidad en el niño prematuro extremo. Ayudar a superar el reto de la colocación de los electrodos favorecerá la neuromonitorización de esta población y redundará en la calidad asistencial de las unidades de cuidados intensivos neonatales, dada la creciente evidencia que apoya la utilidad clínica de la monitorización de la función cerebral mediante aEEG en los niños prematuros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a todo el personal de enfermería y TCAE de la Unidad de Neonatología por su colaboración y enorme contribución en este trabajo.
Presentado en el XXVII Congreso de Neonatología y Medicina Perinatal celebrado en Madrid, 2-4 de octubre de 2019.