El citomegalovirus (CMV) es una de las infecciones congénitas más frecuentes, con una prevalencia del 0,3-2,4%. En España, al no formar parte del cribado gestacional, se realiza screening de los recién nacidos con factores de riesgo y, en muchos centros, de los que presentan bajo peso para la edad gestacional (BPEG). Para ello se realiza, generalmente, determinación de Polymerase Chain Reaction (PCR) del virus en orina y/o ecografía transfontanelar en busca de imágenes compatibles.
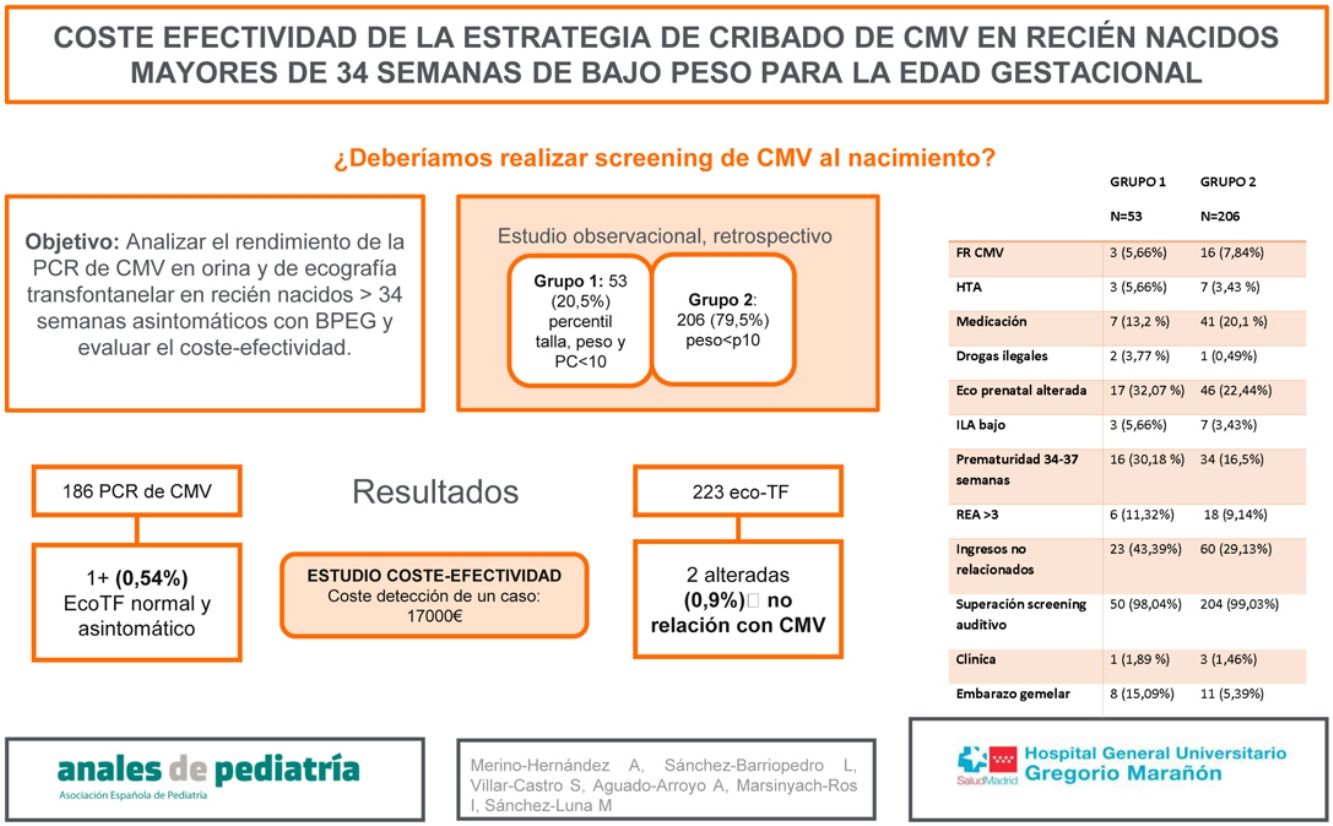
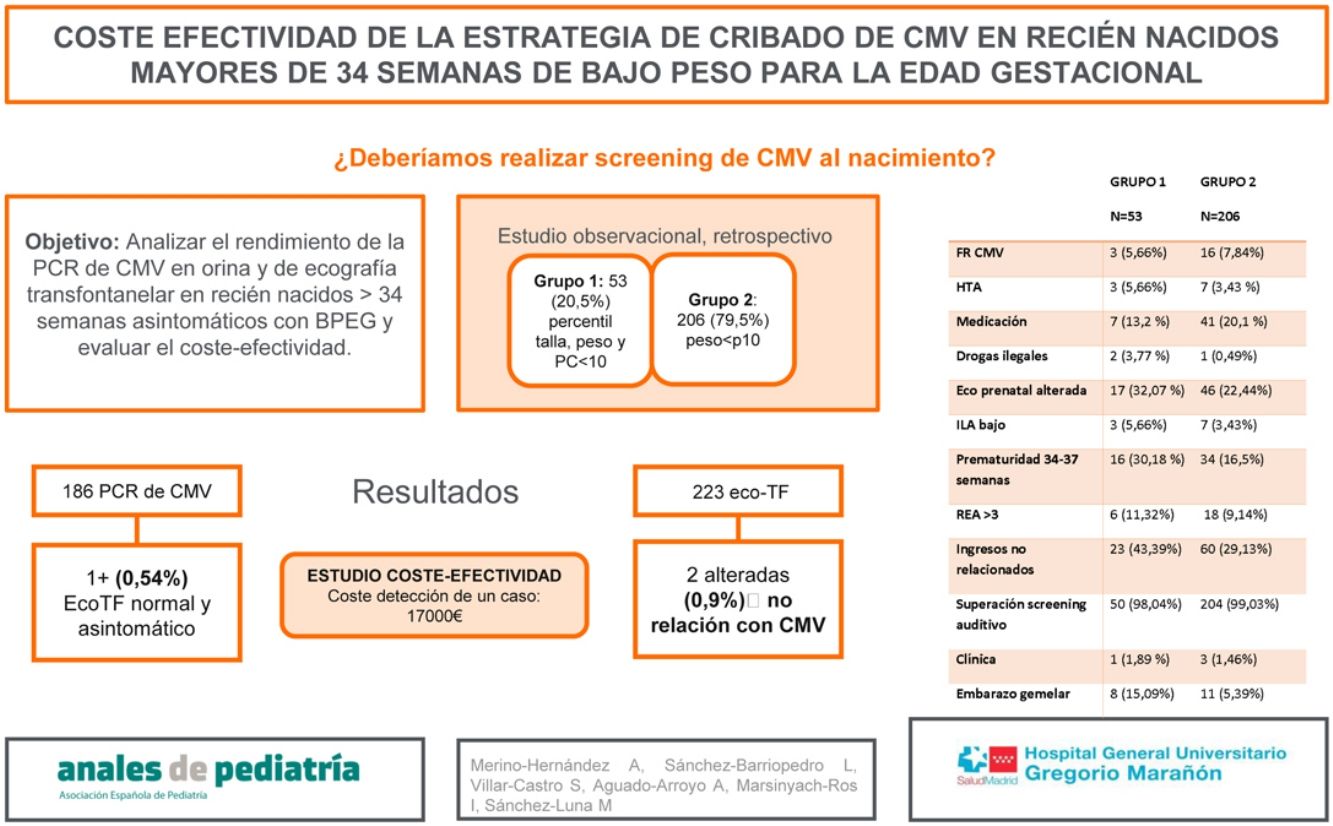
El objetivo del estudio es evaluar el rendimiento de la PCR de CMV en orina y ecografía transfontanelar, en recién nacidos >34 semanas asintomáticos, sin factores de riesgo, con BPEG. El objetivo secundario es evaluar el coste-efectividad.
Material y métodosEstudio observacional, descriptivo y retrospectivo, entre enero y diciembre de 2019, en un hospital de tercer nivel (IIIC). Incluye recién nacidos >34 semanas, sin factores de riesgo con BPEG, con PCR de CMV en orina y/o ecografía transfontanelar realizada.
ResultadosSe incluyeron en el estudio 259 pacientes. Se dividió la muestra en grupo 1 (pacientes con percentil menor de 10 para talla, peso y perímetro cefálico [53 pacientes, 20,5%]) y grupo 2 (percentil menor de 10 para peso [206 pacientes, 79,5%]). En el grupo 1 se objetivó mayor incidencia de prematuridad tardía, embarazo gemelar, ingreso y consumo de drogas ilegales durante el embarazo. Se realizaron 186 PCR de CMV en orina y 223 ecografías transfontanelares, siendo más frecuente la realización de ambas pruebas en el grupo 1 (p=0,002). Se obtuvo un único resultado positivo en orina en el total de la muestra (0,54%) (grupo 2), sin alteraciones en la ecografía y sin sintomatología a lo largo de su evolución. Se encontraron 2 ecografías transfontanelares alteradas con hallazgos no relacionados con infección congénita por CMV. Se realizó un estudio de coste-efectividad, en el cual el coste del total de ecografías transfontanelares y CMV en orina realizadas en nuestra muestra ascendió a 17.000€, para detección de un caso positivo asintomático.
ConclusionesEn nuestra población no parece coste efectivo realizar pruebas de cribado de infección congénita por CMV a recién nacidos a término, y casi a término asintomáticos, cuyo único factor de riesgo es BPEG. Sería necesario ampliar la muestra a otras poblaciones.
Infection by cytomegalovirus (CMV) is one of the most common congenital infections, with a global prevalence of 0.3%-2.4%. In Spain, CMV screening is not performed during pregnancy, but rather in neonates with risk factors, and, in many hospitals, in those born small for gestational age (SGA). Screening is usually performed by measurement of the viral load in urine by polymerase chain reaction (PCR) and/or head ultrasound in search of compatible features.
The aim of the study was to assess the yield of the CMV PCR test in urine and head ultrasound examination in asymptomatic neonates born SGA after 34 weeks’ gestation. The secondary objective was to assess the cost-effectiveness of this strategy.
Design and methodsWe conducted an observational and retrospective study between January and December 2019 in a tertiary care hospital. It included neonates delivered after 34 weeks, SGA and without additional risk factors assessed with a CMV PCR test in urine and/or head ultrasound.
ResultsThe sample included 259 patients. It was divided in two groups: group 1, patients with a head circumference, weight and length below the 10th percentile (53 patients; 20.5%), and group 2, patients in whom only the weight was below the 10th percentile (206 patients; 79.5%). The incidence of late preterm birth, twin pregnancy, neonatal admission and exposure to illicit drugs during gestation was higher in group 1. A total of 186 urine PCR tests and 223 head ultrasounds were performed overall, and both tests were performed more frequently in group 1 (P=.002). There was only one positive CMV PCR test result in the sample (0.54%), corresponding to a patient in group 2 with no abnormal sonographic findings who remained asymptomatic throughout the followup. Two head ultrasound examinations yielded abnormal findings, in both cases unrelated to congenital CMV infection. We performed a cost-effectiveness analysis and determined that the cumulative cost of head ultrasound examinations and urine CMV PCR tests in our sample amounted to €17000 for the detection of a single asymptomatic positive case.
ConclusionIn our population, screening for congenital CMV infection in asymptomatic late preterm and term newborns whose only risk factor is SGA does not seem to be cost effective. It would be necessary to expand the sample to other populations.
La infección por citomegalovirus (CMV) es una de las infecciones congénitas que mayor morbilidad produce a los recién nacidos que la padecen. La prevalencia de esta en la población general oscila entre el 0,3-2,4%1. Pertenece al conjunto de infecciones congénitas2 conocidas como TORCH (toxoplasmosis, rubéola, CMV y sífilis) que comparten unas características similares, entre las que destacan: transmisión transplacentaria o por contacto directo tras el parto, una enfermedad que suele pasar inadvertida durante el embarazo, diagnóstico por serología o técnica molecular (reacción en cadena de la polimerasa o polimerase chain reaction [PCR]) y una expresión clínica similar.
Los programas de cribado (screening) a los que se somete la embarazada durante la gestación, y la constante investigación en este campo, ha disminuido significativamente la incidencia de las infecciones congénitas en los últimos años. En la actualidad, hay una tendencia a la investigación posnatal de recién nacidos con factores de riesgo para padecer alguna de las infecciones congénitas que no forman parte del screening de sistemático, como puede ser el CMV. En este contexto, desde hace años se han establecido técnicas de cribado posnatal de CMV congénito en el recién nacido para su diagnóstico.
Durante años, se ha intentado relacionar a los recién nacidos de bajo peso con una posterior alteración del desarrollo en las funciones cerebrales. Sin embargo, Lohaugen et al.3 mostraron que el bajo peso, como único factor, no aumenta el riesgo de menor capacidad funcional cerebral, advirtiendo un incremento de riesgo con la asociación con otros signos como la microcefalia. Aun así, se han utilizado durante años estrategias de cribado de las enfermedades TORCH en este grupo de riesgo asumiendo su relación con el bajo peso. Sin embargo, Krishnamurthy et al.4, observaron que el bajo peso como único factor de riesgo, no justifica la realización de pruebas de screening en recién nacidos, ya que no se obtuvieron resultados significativos al comparar las infecciones congénitas en este grupo de riesgo con la población general.
En publicaciones previas se ha intentado evidenciar la asociación de alteraciones en la ecografía prenatal5 y la clasificación de los fetos con crecimiento intrauterino retardado (CIR) tipo 1 o tipo 2 con los potenciales candidatos a cribado de CMV, objetivándose un riesgo bajo en ambos grupos, sin diferencias significativas entre ellos6.
No obstante, el cribado para CMV en recién nacidos con bajo peso se sigue realizando en muchos centros. Entre los motivos de esta dinámica están probablemente su alta prevalencia en la población general y ausencia de clínica en la mayoría de los casos, lo que dificulta el diagnóstico en la paciente embarazada. El cribado de estos recién nacidos se realiza, generalmente, mediante la obtención de una muestra de orina al nacimiento para el estudio de una PCR del virus y/o la realización de una ecografía transfontanelar en busca de las lesiones compatibles con CMV congénito. Existen otras pruebas de cribado como la serología en sangre, pero son menos frecuentes como técnicas de screening por su invasividad.
La falta de protocolos estrictos deja la elección de la prueba de cribado a los médicos de la unidad. Además de la carga emocional a las familias que provoca la realización de estas pruebas, estas estrategias de cribado suponen un gasto significativo para el sistema sanitario, ya que el número de recién nacidos cuyo único factor es el bajo peso es elevado, lo que supone realizar gran cantidad de pruebas de screening. Aún así, continúan siendo práctica clínica habitual en muchos centros.
El objetivo principal de este estudio es evaluar el rendimiento clínico de solicitar PCR de CMV en orina y ecografía transfontanelar, en aquellos recién nacidos, a término o casi término, cuyo único factor de riesgo para una infección congénita por CMV sea el bajo peso para la edad gestacional. El objetivo secundario es determinar si se trata de una estrategia coste-efectiva.
Material y métodosDiseño del estudioEstudio observacional, descriptivo y retrospectivo realizado en el departamento de Neonatología del Hospital Universitario Gregorio Marañón de Madrid (HGUGM) entre enero y diciembre de 2019. Este estudio no intervencionista y observacional fue autorizado por el Comité Ético del centro (código: CMVBAJO 1.0).
PoblaciónSe incluyeron en el estudio, recién nacidos de 34 o más semanas de gestación a los que se les realizó estudio de CMV en orina y/o ecografía transfontanelar por bajo peso para la edad gestacional durante el periodo mencionado.
El HGUGM es un hospital terciario (nivel asistencial IIIC)7 con un volumen medio de partos anual aproximado de 4.500-5.000. Los criterios de exclusión fueron: recién nacidos con cromosomopatías o malformaciones severas, aquellos nacidos por debajo de las 34 semanas de gestación o aquellos que precisan ingreso al nacimiento por enfermedad relacionada con el bajo peso.
Recogida de datosSe realizó una recogida de datos epidemiológicos y clínicos de pacientes neonatales que no precisaron ingreso al nacimiento y a los que se solicitó, por bajo peso, pruebas de cribado de infección connatal: PCR en orina para CMV y/o ecografía transfontanelar. Estos pacientes, tras el alta de la planta de maternidad fueron citados para informar de los resultados de manera telefónica.
Se procedió a la creación de una base de datos donde se registraron variables obtenidas de la historia clínica hospitalaria de cada paciente: edad materna, factores de riesgo de CMV (hermanos menores de 3 años, contacto materno de riesgo, VIH materno o hallazgos compatibles en ECO prenatal), hipertensión arterial (HTA) materna gestacional o pregestacional, medicación o consumo de drogas durante el embarazo, hallazgos en ecografía prenatal, edad gestacional, fecha de nacimiento, sexo, necesidad de reanimación, pH arterial de cordón, puntuación de Apgar al minuto y a los 5min de vida, necesidad de ingreso, cribado auditivo, peso, talla y perímetro cefálico al nacimiento con sus respectivos percentiles, clínica propia de CMV (hepatoesplenomegalia, petequias, coriorretinitis, hipoacusia...), y los resultados de la PCR de CMV en orina y de la ecografía transfontanelar en el caso de haberse realizado.
Procedimiento en la unidadEn nuestra unidad, de rutina, realizamos despistaje de CMV congénito en recién nacidos de bajo peso para la edad gestacional, considerándose bajo peso un percentil por debajo del p108. Para los percentiles se han utilizado las tablas de INTERGROWTH. Para los gemelares se emplearon las mismas tablas que para las gestaciones únicas.
Contamos con 2 pruebas complementarias cuya indicación depende exclusivamente del médico responsable. En primer lugar, se coloca una bolsa de orina donde se determina PCR de CMV, considerándose negativos valores por debajo de 150 copias/ml. En el caso de presentar alteración de esta determinación se realiza PCR y serología en sangre del recién nacido para la confirmación de esta. La realización de PCR de CMV en orina se realiza mediante el analizador Abbott Real Time CMV® y tiene un coste de 18€ más IVA/prueba.
La indicación de la ecografía transfontanelar al nacimiento se realiza en pacientes con bajo peso (además de otras indicaciones que están fuera del objetivo del estudio). Esta prueba la realizan radiólogos pediátricos con amplia experiencia neonatal empleando un equipo Samsung RS80A con sonda convex CF4-9 y lineal L3-12 con un coste aproximado de 60€ por ecografía. La ecografía se realiza a través de la fontanela anterior según el estado de arte de la técnica obteniéndose los cortes estandarizados que son 6 cortes coronales (en localización prefrontal, Monro, núcleo ventrolateral del tálamo, pulvinar, atrio y surco parieto-occipital) y 5 cortes sagitales (en línea media y en el surco caudado talámico y región insular de ambos lados) y utilizando la sonda de alta frecuencia para la valoración del parénquima9.
En el caso de positividad para alguna de estas pruebas complementarias se realiza un estudio más completo confirmando el resultado con una nueva prueba en orina, PCR en sangre y prueba de imagen. Además, aunque no se repite el cribado auditivo, se realiza interconsulta a otorrinolaringología para realizar un seguimiento al paciente.
Análisis estadísticoSe realizó análisis de normalidad de las variables cuantitativas de la muestra a través de la prueba de Shapiro-Wilk objetivándose falta de normalidad de las distribuciones. Por lo tanto, los resultados de variables cuantitativas de los parámetros de estudio de cada paciente se han expresado como mediana y rango intercuartílico (RIQ). Los resultados de variables categóricas se han expresado como porcentaje y recuento total. Para la comparación de variables cuantitativas se ha utilizado la prueba de U de Mann-Whitney y para la comparación de variables cualitativas la prueba de Chi-cuadrado. El análisis estadístico se ha realizado mediante el programa Stata® 14.0. Se han considerado estadísticamente significativos aquellos resultados con una p<0,05.
ResultadosEntre enero y diciembre de 2019 fueron incluidos en el estudio 259 pacientes. Se dividió la muestra en 2 grupos. En el grupo 1 se incluyen aquellos recién nacidos con peso, talla y perimétrico cefálico por debajo del percentil 1010. En el grupo 2 se incluyen los recién nacidos con peso por debajo del percentil 10, pero con perímetro cefálico y talla por encima del percentil 10. En el grupo 1, se incluyeron 53 recién nacidos (20,5%) y en el grupo 2, 206 (79,5%), y se describieron los factores de riesgo relacionados con infección por CMV.
En el grupo 1 se encontró mayor incidencia de prematuridad tardía (p=0,02), embarazo gemelar (p=0,01), ingresos no relacionados con CMV congénito (p=0,047) y de consumo de drogas ilegales durante el embarazo (p=0,04), sin encontrarse diferencias significativas en el resto de las variables (tabla 1). Además, se encontró una media de edad gestacional inferior en este mismo grupo (tabla 2), pudiendo relacionarse con que 10 de los 53 partos (18,9%) del grupo 1 fueron inducidos por CIR y 7 (13,2%) por registro cardiotocográfico poco tranquilizador.
Comparación de grupos; N (%)
| Grupo 1N=53 | Grupo 2N=206 | TotalN=259 | Nivel de significación | |
|---|---|---|---|---|
| FR CMV; N (%) | 3 (5,66) | 16 (7,84) | 19 (7,42) | p=0,61 |
| HTA; N (%) | 3 (5,66) | 7 (3,43) | 10 (3,91) | p=0,43 |
| Medicación; N (%) | 7 (13,2) | 41 (20,1) | 48 (18,75) | p=0,27 |
| Drogas ilegales; N (%) | 2 (3,77) | 1 (0,49) | 3 (1,17) | p=0,04 |
| Eco prenatal alterada; N (%) | 17 (32,07) | 46 (22,44) | 63 (24,51) | p=0,12 |
| ILA bajo; N (%) | 3 (5,66) | 7 (3,43) | 10 (3,91) | p=0,43 |
| Prematuridad 34-37 semanas; N (%) | 16 (30,18) | 34 (16,5) | 50 (19,31) | p=0,02 |
| REA>3; N (%) | 6 (11,32) | 18 (9,14) | 24 (9,27) | p=0,58 |
| Ingresos no relacionados; N (%) | 23 (43,39) | 60 (29,13) | 83 (32,05) | p=0,047 |
| Superación screening auditivo; N (%) | 50 (98,04) | 204 (99,03) | 254 (98,83) | p=0,55 |
| Clínica; N (%) | 1 (1,89) | 3 (1,46) | 4 (1,54) | p=0,82 |
| Embarazo gemelar; N (%) | 8 (15,09) | 11 (5,39) | 19 (7,39) | p=0,01 |
CMV: citomegalovirus; Eco: ecografía; FR: factores de riesgo; HTA: hipertensión arterial; ILA: índice de líquido amniótico; REA: reanimación.
* Comparación de los grupos de bajo peso para la edad gestacional. Grupo 1: aquellos con peso, talla y perímetro cefálico <p10. Grupo 2: aquellos con peso <p10.
Comparación de grupos; (mediana y RI)
| Grupo 1N=53 | Grupo 2N=206 | Total | Valor de p | |
|---|---|---|---|---|
| Edad materna (años); mediana (RI) | 34 (32-37) | 34 (31-37) | 34 (29-39) | p=0,82 |
| Edad gestacional (semanas); mediana (RI) | 37 (36-39) | 38 (37-40) | 38 (36-40) | p=0,03 |
| pH cordón; mediana (RI) | 7,27 (7,21-7,32) | 7,25 (7,19-7,3) | 7,25 (7,14-7,36) | p=0,13 |
| Apgar 1min; mediana (RI) | 9 (8-9) | 9 (9-9) | 9 (8-10) | p=0,07 |
| Apgar 5min; mediana (RI) | 10 (9-10) | 10 (9-10) | 10 (9-10) | p=0,03 |
| Peso (g); mediana (RI) | 2150 (1.880-2.420) | 2.470 (2.220-2.640) | 2.420 (1.940-2.900) | p≤0,01 |
RI: rango intercuartílico.
* Comparación de los grupos de bajo peso para la edad gestacional. Grupo 1: aquellos con peso, talla y perímetro cefálico <p10. Grupo 2: aquellos con peso <p10.
* No encontramos explicación a la diferencia estadísticamente significativa en la puntuación del test de Apgar a los 5min.
Se realizaron en total 186 PCR de CMV en orina y 214 ecografías transfontanelares a los pacientes de la muestra, siendo más frecuente la realización de ambas pruebas diagnósticas en el grupo 1 frente al grupo 2, con una diferencia estadísticamente significativa (p=0,002).
En el grupo 1 no se obtuvo ningún resultado positivo para CMV en orina. En el grupo 2, un único paciente presentó un resultado positivo, un valor de 704.058 copias/ml, que representa un 0,54% del total de la muestra a la que se le realizó PCR de CMV en orina. Este paciente fue diagnosticado de CIR por ecografía doppler prenatal. No presentó alteraciones en la ecografía transfontanelar postnatal y fue diagnosticado de CMV congénito asintomático tras el resultado de la PCR para CMV positiva en orina. Se le realizó una resonancia magnética de control a las 3 semanas de vida con discreta alteración de la señal focal periatrial bilateral y de manera menos evidente frontal, sin asociación clara con afectación de sustancia blanca por CMV, por lo que se recomendó repetir nuevo estudio de resonancia magnética que no se realizó por permanecer el paciente asintomático durante el seguimiento con cribado auditivo superado. Presentó seguimiento posterior en enfermedades infecciosas y otorrinolaringología y no precisó tratamiento antiviral.
Se encontraron 2 ecografías transfontanelares alteradas, ambas en el grupo 2, que representa un 0,93% del total de ecografías realizadas. Las alteraciones encontradas fueron hallazgos casuales, posteriormente confirmados por resonancia magnética, no relacionados con infección por CMV congénito: lesión isquémica del núcleo caudado e hipoplasia y hemorragia cerebelosa derecha.
Se realizó un estudio de coste-efectividad, en el que el coste de la realización de ecografía transfontanelar y CMV en orina, asciende a un total aproximado de 17.000€ para la detección de un caso de CMV congénito, en este caso asintomático. Debido a la ausencia de casos sintomáticos no se ha podido calcular el número necesario para tratar. Si no se consideran los recién nacidos con factores de riesgo prenatales de bajo peso el coste descendería a 15.800€. Si elimináramos las ecografías transfontanelares realizadas y solo se hubiera realizado cribado mediante PCR en orina, el coste para la detección de un caso hubiera sido de 4.050€.
DiscusiónLa prevalencia de pruebas positivas de cribado de CMV en los recién nacidos a término y casi término asintomático de nuestra muestra fue baja (0,54%), acorde con estudios similares en los que la prevalencia oscila entre un 0,2 y un 2,5%1,11.
A pesar de su baja prevalencia, el CMV sigue siendo la infección congénita más frecuente en nuestro medio. Puede producir secuelas importantes como la sordera, la discapacidad intelectual, la parálisis infantil, las convulsiones y las dificultades en el aprendizaje, que pueden aparecer hasta en un 20% de los afectados12. El CMV congénito es la causa más frecuente de sordera neurosensorial de origen no genético. La presencia y gravedad de estas secuelas puede disminuir con el tratamiento precoz de los recién nacidos con CMV congénito, y esta es la razón por la que algunos autores, como Rawlinson et al.13, argumentan que se debería considerar el cribado universal, estrategia que defienden Gantt et al. por considerarla coste-efectiva14. Sin embargo, otros muchos estudios de coste-efectividad no recomiendan este cribado universal, ya que presenta baja rentabilidad, alto coste, y por el hecho de que en estos mismos documentos no recomiendan el tratamiento de recién nacidos asintomáticos2,15.
El uso de la PCR de CMV en orina es actualmente uno de los métodos de cribado más utilizados por ser no invasivo y por haber mostrado alta sensibilidad16,17. En estudios recientes, proponen la utilización de otras estrategias de cribado, como la realización de PCR de CMV en saliva, por la facilidad de extracción de la muestra18 y el estudio de PCR en sangre en papel de cribado endocrino-metabólico, por su potencial bajo coste y alto rendimiento19.
En nuestra muestra, el único paciente con PCR de CMV positiva en orina, no recibió tratamiento y se realizó seguimiento por parte de las consultas de infectología infantil con una evolución sin incidencias, que es lo más frecuente. Así, según el estudio de Baquero Artiago et al., solo un 13% de los recién nacidos asintomáticos con PCR positiva, desarrollan sintomatología en la evolución11.
Otra de las estrategias de cribado frecuente consiste en la realización de ecografía transfontanelar a los recién nacidos de bajo peso, con objeto de encontrar alteraciones características de esta infección congénita, como las calcificaciones intraparenquimatosas, la ventriculomegalia, la atrofia cortical o los quistes de la matriz germinal8. Sin embargo, algunos estudios argumentan que estos hallazgos pueden ser poco específicos de infección congénita por CMV4,20,21. En nuestro estudio, la prevalencia de ecografías transfontanelares alteradas es del 0,93%; sin embargo, la mayoría de las alteraciones podrían ser considerados hallazgos incidentales no relacionados con la infección por CMV. La realización de ecografía transfontanelar como estrategia de cribado de CMV a pacientes asintomáticos de bajo peso, según nuestros datos y otros estudios similares, no parece una estrategia rentable11.
El bajo peso se ha asociado clásicamente a infecciones congénitas, pero hasta en el 40% de estos pacientes se identifican, además, otros factores de riesgo de crecimiento intrauterino retardado (HTA materna, tabaco, gemelaridad...) que lo justifican. En el estudio de Vaundry et al., la prevalencia de CMV congénito realizada únicamente en recién nacidos de bajo peso no difiere de la prevalencia de la población general22.
Hay estudios que muestran la relación entre el CIR simétrico y la presencia de CMV congénito23. Sin embargo, en el trabajo de Espiritu et al., se encontró un riesgo bajo de CMV congénito tanto el grupo de CIR simétrico como asimétrico, sin diferencias significativas entre ellos6. En nuestra muestra, de los 186 recién nacidos a los que se les realizó PCR en orina, solo uno presentó un resultado positivo; este paciente pertenecía al grupo 1 (solo bajo peso).
En total, durante el tiempo de estudio, se realizaron 186PCR de CMV en orina, y 214 ecografías transfontanelares. Esto asciende a un coste total de 17.000€ para el diagnóstico de un único paciente. A este coste se le suma la ansiedad familiar y la preocupación ocasionada por la realización de pruebas complementarias para la detección de una enfermedad con baja prevalencia6. Ante estos resultados, el cribado de pacientes asintomáticos, cuyo único factor de riesgo es el bajo peso podría valorarse, en determinados contextos y poblaciones con baja prevalencia, como una estrategia poco coste-efectiva24.
Hasta hace poco tiempo, por la ausencia de un tratamiento eficaz de la infección congénita por CMV durante la gestación que apoyara el cambio de pronóstico, la introducción del cribado universal de CMV en mujeres gestantes no parecía ser coste-efectiva. Sin embargo, estudios recientes25, arrojan resultados prometedores sobre la eficacia del valaciclovir en reducir la incidencia de infección congénita por CMV en las madres con primoinfección durante el embarazo26. Estos resultados podrían suponer, en un futuro valorar iniciar cribado universal de las gestantes para la detección precoz y el posible tratamiento de los CMV congénitos. La introducción de este cribado, asociado al tratamiento de las mujeres con primoinfección durante el embarazo y la baja incidencia de CMV congénito en los recién nacidos de bajo peso, podrían ir en contra de la realización de cribado de infección congénita por CMV en este grupo de pacientes.
El presente estudio muestra varias limitaciones, como su diseño; al tratarse de un estudio retrospectivo, en el que los recién nacidos seleccionados para el estudio provienen de la revisión de la consulta de neonatología, es posible que haya pérdida de información, que se intentó subsanar con una revisión exhaustiva de las historias de los recién nacidos y madres y de las pruebas complementarias. A esto se le añade los posibles falsos negativos de la prueba de PCR en orina.
ConclusiónComo conclusión, en nuestra población no parece coste-efectivo realizar pruebas de cribado de infección congénita a CMV a los recién nacidos a término y casi términos asintomáticos cuyo único factor de riesgo es presentar un bajo peso al nacimiento, especialmente mediante la realización de ecografía transfontanelar. La realización de PCR en orina podría reservarse para aquellos pacientes de bajo peso sin otros factores de riesgo para esta condición (gemelaridad, enferrmedad hipertensiva materna, etc.). La ecografía transfontanelar, en este contexto no parece tener ninguna indicación. Sin embargo, para poder generalizar los resultados, sería necesario ampliar la muestra a otras poblaciones.