La infección por citomegalovirus es la infección congénita más frecuente en los países desarrollados y una de las principales causas de retraso psicomotor y sordera neurosensorial de origen infeccioso.
El presente estudio tiene como objetivos describir las características clínico-analíticas y de neuroimagen de los pacientes con secuelas neurológicas secundarias a la infección congénita por citomegalovirus y compararlas con el grupo de pacientes con infección congénita por citomegalovirus que no presentaron clínica neurológica durante su seguimiento.
Material y MétodosEstudio de cohortes retrospectivo, observacional. Se incluyeron todos los casos de infección congénita por citomegalovirus desde 2003 hasta 2018 y se evaluaron las secuelas neurológicas a corto-medio plazo. Se compararon datos prenatales, perinatales y posnatales de los pacientes con secuelas neurológicas frente a los que no las presentaron.
ResultadosEn el periodo descrito se registraron 60 pacientes con infección congénita por citomegalovirus: un 65% presentó afectación neurológica durante su periodo de seguimiento (retraso psicomotor 62,2%; microcefalia 61,5%, hipoacusia 46,2%; trastornos motores 27,8%; epilepsia 20,5% y coriorretinitis 5,6%). En el grupo de pacientes que presentó secuelas, la presencia de clínica en el periodo neonatal así como las alteraciones en el estudio de neuroimagen fueron más frecuentes y ambas fueron estadísticamente significativas respecto al grupo asintomático. Los pacientes con afectación neurológica también presentaron mayor puntuación en la escala de neuroimagen según Noyola et al.
ConclusionesLa sintomatología al nacimiento y ciertos hallazgos en la neuroimagen, como la presencia de alteraciones de la sustancia blanca o trastornos de la migración neuronal, podrían predecir las secuelas neurocognitivas en los pacientes con infección congénita por citomegalovirus.
The infection due to cytomegalovirus is the most common congenital infection in developed countries, and on of the main causes of psychomotor impairment and neurosensory hearing loss of infectious origin.
The present study has its objectives to describe the clinical-analytical and neuroimaging of patients with secondary neurological sequelae secondary to the congenital cytomegalovirus infection and then compare them with the group of patients with a congenital cytomegalovirus infection that did not have neurological symptoms during their follow-up.
Material and methodsA retrospective, observational, cohort study was conducted that included all the cases of congenital cytomegalovirus infection from 2003 until 2018 and the short-medium term neurological sequelae were evaluated. Prenatal, perinatal, and postnatal data of patients with neurological sequelae were compared against those that did not present with any.
ResultsA total of 60 patients with congenital cytomegalovirus infection were recorded during the study period, with 65% having neurological involvement during their follow-up period (62.2% with psychomotor impairment, 61.5% with microcephaly, 46.2% loss of hearing, 27.8% motor disorders, 20.5% epilepsy, and 5.6% with chorioretinitis). In the patient group that had sequelae, the presence of clinical symptoms during the neonatal period, as well as changes in the neuroimaging study, were the most common, with both being statistically significant compared to the asymptomatic group. The patients with neurological involvement also had a higher score on the Noyola et al. neuroimaging scale.
ConclusionsThe symptoms at birth, and certain findings in the neuroimaging, like the changes in the white matter or neuronal migration disorders, could predict neurocognitive sequelae in patients with congenital cytomegalovirus infection.
La infección por citomegalovirus (CMV) es la infección congénita más frecuente en países desarrollados, con una prevalencia del 0,6%1. Supone la principal causa de pérdida auditiva neurosensorial no hereditaria2, aunque también puede producir secuelas neurológicas como afectación motora y cognitiva, epilepsia o coriorretinitis3.
El riesgo de transmisión fetal de CMV es mayor en la primoinfección materna, comparado con las recurrencias o reinfecciones virales. A pesar de que la transmisión de la infección fetal puede producirse durante toda la gestación, la probabilidad aumenta en el tercer trimestre4,5. Sin embargo, las secuelas son más graves si la infección se produce en el primer trimestre6.
Existen signos ecográficos prenatales sugestivos de infección por CMV como hiperecogenicidad intestinal, retraso en el crecimiento intrauterino, oligohidramnios o polihidramnios, microcefalia, ventriculomegalia, hepatoesplenomegalia, calcificaciones hepáticas o cerebrales, ascitis o hidrops fetal7.
La mayoría de las infecciones congénitas por CMV cursan de manera asintomática; sin embargo, el 10% de los neonatos presentan síntomas al nacimiento, tales como petequias, ictericia, hepatoesplenomegalia, anemia hemolítica, letargia, convulsiones, clínica parecida a la sepsis o neumonía, con una tasa de mortalidad del 4%1.
El diagnóstico puede realizarse de forma prenatal mediante cultivo viral o PCR positiva de CMV en líquido amniótico, o posnatal en las primeras 3semanas tras el nacimiento, con PCR positiva en orina/saliva o cultivo virológico en sangre8. El diagnóstico a partir de las 3 semanas de vida ha de ser retrospectivo: hay que recurrir a la PCR en sangre del papel secante del cribado metabólico neonatal9.
Las alteraciones en la neuroimagen están presentes en más del 60% de los pacientes sintomáticos, y comprenden calcificaciones cerebrales (característicamente periventriculares), ventriculomegalia, vasculopatía lenticuloestriada en el periodo neonatal, alteraciones de la sustancia blanca, alteraciones de la migración neuronal, atrofia cortical, quistes periventriculares e hipoplasia cerebelar10-12.
El tratamiento antiviral ha demostrado mejorar el pronóstico auditivo y el desarrollo psicomotor en pacientes sintomáticos al nacimiento13,14. Por ello, está indicado en los pacientes con infección sintomática y recomendado en los que no superan el cribado auditivo neonatal15. El fármaco depende de la situación clínica: se reserva el ganciclovir para pacientes con riesgo vital y el valganciclovir para el resto de los casos3,16.
Los factores pronósticos más relevantes para el desarrollo de secuelas neurológicas son los síntomas al nacimiento y las alteraciones en la neuroimagen en el primer mes de vida17,18. La replicación viral activa en el oído interno es un factor de mal pronóstico para el desarrollo de hipoacusia neurosensorial19,20.
El objetivo de este estudio es describir las características de los pacientes diagnosticados de infección congénita por CMV, así como estudiar la existencia de factores predictivos de pronóstico respecto a la evolución neurológica de estos pacientes.
Material y métodosEstudio epidemiológico, observacional retrospectivo de cohortes, en pacientes diagnosticados de infección congénita por CMV entre enero de 2003 y diciembre de 2018. El estudio lo realizó el servicio de Neuropediatría en colaboración con el servicio de Neonatología del Hospital Universitario y Politécnico La Fe, un hospital terciario de la Comunidad Valenciana (España).
Se incluyó en el estudio a los pacientes diagnosticados de infección por CMV en las 3primeras semanas de nacimiento con PCR en orina o en sangre positivos. Se incluyó también a aquellos mayores de 3 semanas de vida con serología (IgM específica de CMV) o carga viral positiva en plasma o en muestra de sangre en papel secante procedente del cribado neonatal. Las muestras de orina y sangre se procesaron para detección de CMV mediante PCR múltiple en tiempo real o cultivo viral empleando la técnica Shell-vial.
La infección fue considerada sintomática al nacimiento cuando los pacientes presentaron alguna de las siguientes manifestaciones clínicas: retraso del crecimiento intrauterino (definido como un peso al nacimiento menor de 2 desviaciones estándar [DE]), microcefalia (definida como un perímetro cefálico al nacimiento menor de 2 DE), petequias, hepatomegalia, esplenomegalia, clínica neurológica (hipotonía), sordera neurosensorial (alteración de las otoemisiones acústicas, confirmada con potenciales evocados auditivos), coriorretinitis, trombocitopenia (<100.000 plaquetas/μL), elevación de enzimas hepáticas (alanina transferasa > 100 U/L; rango de referencia 10-40 U/L) o colestasis (bilirrubina directa > 3mg/dL; rango de referencia: 0,1-1,1mg/dL)3.
Se recogieron datos epidemiológicos (sexo), antecedentes prenatales (infecciones maternas, consumo de tóxicos, ecografías prenatales y crecimiento intrauterino), antecedentes perinatales (edad gestacional, peso al nacimiento) y datos posnatales como clínica neonatal y secuelas neurológicas, carga viral, hallazgos radiológicos en resonancia magnética (RM) y ecografía transfontanelar y tratamiento (fármaco administrado y duración).
Se clasificó a los pacientes según la presencia o no de secuelas neurológicas en los 2primeros años. Se definió como secuela neurológica la presencia de hipoacusia neurosensorial (pérdida auditiva mayor de 20dB), microcefalia (definida como un perímetro cefálico menor de 2 DE), retraso psicomotor (definido como rendimiento menor de 2 DE en al menos 2 escalas de desarrollo psicomotor), discapacidad intelectual, trastorno del comportamiento (incluyendo trastorno del espectro autista y déficit de atención e hiperactividad) o trastornos específicos del lenguaje, parálisis cerebral infantil (según la escala Gross Motor Function Cassification System, GMFCS), coriorretinitis o epilepsia. Los pacientes que no manifestaron secuelas neurológicas se incluyeron en el grupo A y los pacientes que sí las desarrollaron, en el grupo B.
Estudios de neuroimagen. Se utilizó ultrasonografía y RM de 1,5 teslas. Se realizaron cortes sagital, axial y coronal, incluyendo en la mayoría de los estudios secuencias FLAIR. Las imágenes fueron interpretadas por un radiólogo pediátrico experimentado. Se catalogó la afectación en neuroimagen según la a clasificación de Noyola et al. modificada por Alarcón et al.19,21.
El análisis estadístico fue efectuado a través del paquete estadístico SPSS, versión 19.0; se consideró estadísticamente significativa una p menor de 0,05. Los datos cuantitativos se expresan como media con su desviación estándar y los cualitativos como porcentajes. Se aplicó el test de normalidad (Shapiro-Wilk), que indica que la población tiene una distribución diferente a la normal, por lo que se ha empleado la prueba no paramétrica U de Mann Whitney para la comparación entre variables cuantitativas y la prueba chi-cuadrado o la prueba exacta de Fisher para la comparación entre variables cualitativas. Se realizó, a su vez, una regresión logística binaria por pasos hacia delante, incluyendo las posibles variables pronósticas (edad gestacional, retraso de crecimiento intrauterino, ecografía transfontanelar, RM patológica y tratamiento administrado).
El estudio fue aprobado por el Comité de Bioética de nuestro centro.
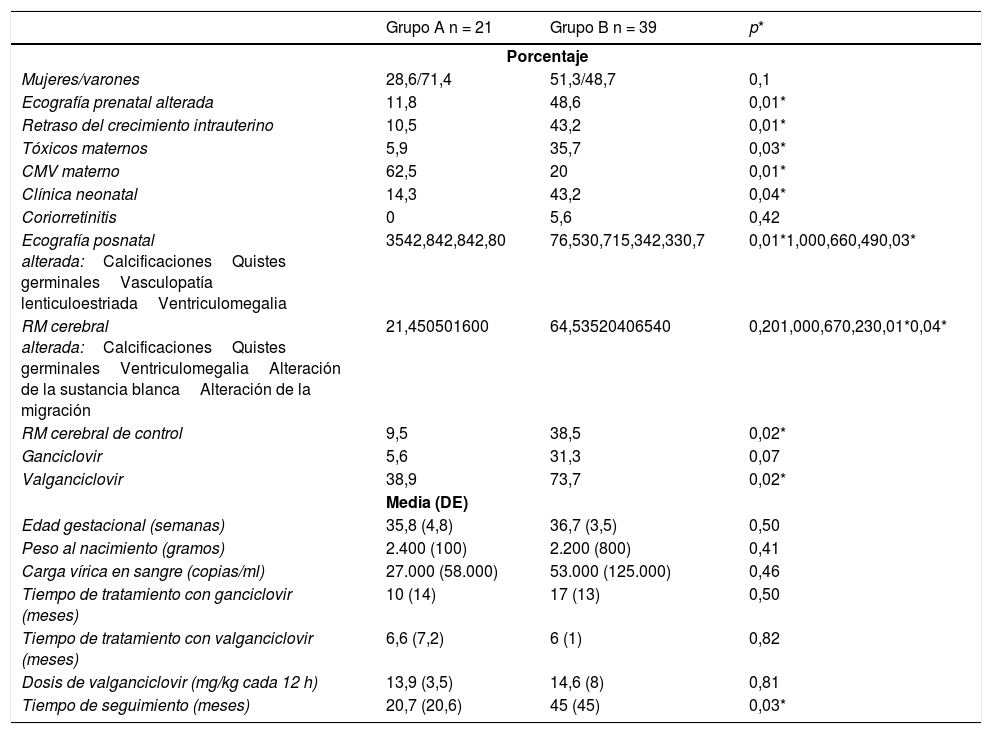
ResultadosSe incluyó a un total de 60 pacientes con infección congénita por CMV, 21 de ellos (35%) sin afectación neurológica (grupo A) y 39 (65%) con secuelas neurológicas (grupo B). Los resultados se muestran en la tabla 1.
Comparación entre variables del grupo A (sin secuelas neurológicas) y grupo B (con secuelas neurológicas)
| Grupo A n = 21 | Grupo B n = 39 | p* | |
|---|---|---|---|
| Porcentaje | |||
| Mujeres/varones | 28,6/71,4 | 51,3/48,7 | 0,1 |
| Ecografía prenatal alterada | 11,8 | 48,6 | 0,01* |
| Retraso del crecimiento intrauterino | 10,5 | 43,2 | 0,01* |
| Tóxicos maternos | 5,9 | 35,7 | 0,03* |
| CMV materno | 62,5 | 20 | 0,01* |
| Clínica neonatal | 14,3 | 43,2 | 0,04* |
| Coriorretinitis | 0 | 5,6 | 0,42 |
| Ecografía posnatal alterada:CalcificacionesQuistes germinalesVasculopatía lenticuloestriadaVentriculomegalia | 3542,842,842,80 | 76,530,715,342,330,7 | 0,01*1,000,660,490,03* |
| RM cerebral alterada:CalcificacionesQuistes germinalesVentriculomegaliaAlteración de la sustancia blancaAlteración de la migración | 21,450501600 | 64,53520406540 | 0,201,000,670,230,01*0,04* |
| RM cerebral de control | 9,5 | 38,5 | 0,02* |
| Ganciclovir | 5,6 | 31,3 | 0,07 |
| Valganciclovir | 38,9 | 73,7 | 0,02* |
| Media (DE) | |||
| Edad gestacional (semanas) | 35,8 (4,8) | 36,7 (3,5) | 0,50 |
| Peso al nacimiento (gramos) | 2.400 (100) | 2.200 (800) | 0,41 |
| Carga vírica en sangre (copias/ml) | 27.000 (58.000) | 53.000 (125.000) | 0,46 |
| Tiempo de tratamiento con ganciclovir (meses) | 10 (14) | 17 (13) | 0,50 |
| Tiempo de tratamiento con valganciclovir (meses) | 6,6 (7,2) | 6 (1) | 0,82 |
| Dosis de valganciclovir (mg/kg cada 12 h) | 13,9 (3,5) | 14,6 (8) | 0,81 |
| Tiempo de seguimiento (meses) | 20,7 (20,6) | 45 (45) | 0,03* |
En la primera parte de la tabla se describen las variables cualitativas expresadas en porcentaje y en la segunda parte las variables cuantitativas, expresadas en media y desviación estándar.
DE: desviación estándar; RM: resonancia magnética.
En cuanto a los factores prenatales estudiados, en un 32,1% de los pacientes se diagnosticó un retraso del crecimiento intrauterino, y se detectaron, además, en un 30%, anomalías relacionadas con infección por CMV en las ecografías prenatales (tales como calcificaciones periventriculares o ventriculomegalia). Se diagnosticaron 16 casos (34,8%) de infección materna por CMV durante la gestación, de los cuales la mayoría se detectaron en el primer trimestre. También se detectaron coinfecciones por VIH materno en 3 casos, sin que los recién nacidos llegaran a presentar infección activa; también hubo coinfección por virus del papiloma humano en un caso.
Con respecto a los factores de riesgo en el periodo neonatal estudiados, la infección congénita fue mayoritariamente asintomática en la época neonatal (67,2%): la clínica más frecuente fue la aparición de petequias e hipotonía. En un caso se diagnosticó la infección congénita mediante la detección de CMV en la muestra de sangre en papel secante utilizada en el cribado metabólico neonatal, el resto se diagnosticaron en las 3primeras semanas de vida. El seguimiento hasta la fecha del estudio ha sido de una media de 19 meses (DE 11 meses).
Como segundo objetivo del presente análisis, se realizó una comparación entre los pacientes diagnosticados de infección congénita por CMV que desarrollaron secuelas neurológicas (grupo B) y los que no (grupo A).
Las secuelas neurológicas que desarrolló el grupo B son, por orden de frecuencia, retraso psicomotor (62,2%), microcefalia (61,5%), hipoacusia neurosensorial (46,2%), parálisis cerebral infantil (27,8%): 8 pacientes con tetraparesia espástica (7 pacientes con GMFCS 5 y un paciente con GMFCS 3) y 2 con hemiparesia (ambos con GMFCS 1), epilepsia (20,5%) y coriorretinitis (5,6%).
Un dato perinatal importante fue el mayor porcentaje de pacientes con retraso del crecimiento intrauterino en el grupo B (43,2% frente a 10,5% en el grupo A) y un mayor consumo de tóxicos maternos, que fue estadísticamente significativo. Es importante subrayar también las diferencias estadísticamente significativas en la detección de alteraciones en ecografía prenatal (11,8% en el grupo A frente a 48,6% en el grupo B). Con respecto a los datos posnatales, clínicamente se manifestó la infección por CMV en un 14,3% en el grupo A frente a un 43,2% en el grupo B, dato con significación estadística.
La primera prueba de neuroimagen realizada en la mayoría de los pacientes fue la ecografía transfontanelar, que fue llevada a cabo en un 97% de los pacientes. Se objetivaron hallazgos sugestivos de infección por CMV en un 76,5% de los pacientes del grupo B, frente al 35% del grupo A, dato estadísticamente significativo. Entre los hallazgos del grupo B, se objetivó de forma mayoritaria vasculopatía lenticuloestriada (42,3%), calcificaciones periventriculares (30,7%), ventriculomegalia (30,7%) o quistes de la matriz germinal (15,3%). Otros hallazgos detectados con menos frecuencia fueron hidranencefalia hemorragias intraventriculares grado I-III, alteraciones de la migración neuronal o atrofia cerebral. Al realizar el análisis individual de cada anomalía, solo la detección de ventriculomegalia fue estadísticamente significativa.
Se realizó RM cerebral en un 77% de los casos y se detectaron anomalías relacionadas con la infección congénita por CMV en un 56,6% (en un 64,5% de los pacientes del grupo B, frente al 21,4% en el grupo A, sin llegar a la significación estadística). Entre ellas se encontraron alteraciones de la sustancia blanca (28,2%), calcificaciones periventriculares (21,7%), ventriculomegalia (19,5%), alteraciones de la migración neuronal (17,4%) y quistes germinolíticos (7%). De estos hallazgos, solo presentaron mayor porcentaje en el grupo B con significación estadística las alteraciones de la sustancia blanca y de la migración neuronal. Se realizó un control de RM cerebral a los 2 años en mayor porcentaje en los pacientes con secuelas neurológicas (grupo A 9,5% frente al grupo B 38,5%), en el que no se observan cambios francos respecto al estudio previo.
Hubo 10 pacientes con ecografía transfontanelar normal y a 9 de ellos se les realizó RM cerebral: en un caso fue patológica, con alteración de la migración neuronal (paquigiria). En este caso, el paciente presentó parálisis cerebral infantil con GMFCS V, sordera, microcefalia y epilepsia. Por otro lado, en los 5 pacientes en los que solo se detectó vasculopatía lenticuloestriada en la ecografía, todos ellos presentaron RM cerebral sin hallazgos patológicos. No obstante, evolutivamente sí desarrollaron secuelas neurológicas: 2 hipoacusia neurosensorial, 2 retraso psicomotor y otro microcefalia. Si nos centramos en los pacientes que han desarrollado parálisis cerebral infantil, las alteraciones en neuroimagen no difirieron de forma significativa de las del resto de los pacientes con secuelas neurológicas. Existe una mayor detección de atrofia cerebral (20%) y un mayor porcentaje de pacientes con alteraciones de la migración neuronal (77,8%) como polimicrogiria, paquigiria, lisencefalia y esquisencefalia.
Según la clasificación de Noyola et al.19, modificada por Alarcón et al.21, hubo 21,4% (6 de 28) de pacientes sin afectación neurológica con alteraciones tipo 2 y ninguno con afectación tipo 3: lo más frecuente fueron las alteraciones tipo 0 (71,4%). Hasta en el 28% de los pacientes con afectación neurológica las alteraciones en la neuroimagen fueron de tipo 0: lo más frecuente en este grupo fueron las alteraciones tipo 3 (34,4%) (tabla 2).
Comparación de la alteración en neuroimagen en los grupos A y B
| Escala de Noyola modificada | Grupo A n (%) | Grupo B n (%) | |
|---|---|---|---|
| Clasifi-cación | Hallazgos en neuroimagen | ||
| 0 | Ninguno de los siguientes | 20 (71,4) | 9 (28,1) |
| 1 | Calcificaciones periventriculares únicas, vasculopatía lenticuloestriada, germinolisis caudotalámica, ventriculomegaliaa (excepto grave) o anomalías unifocales/multifocales de la sustancia blanca | 2 (7,14) | 8 (25) |
| 2 | Calcificaciones periventriculares múltiples, quistes germinolíticos paraventriculares, ventriculomegalia grave, alteración difusa de la sustancia blanca o afectación del lóbulo temporal | 6 (21,4) | 4 (12,25) |
| 3 | Calcificaciones extensas, atrofia cerebral, alteraciones de la migración neuronal, malformaciones corticales, disgenesia del cuerpo calloso o hipoplasia cerebelosa | 0 (0) | 11 (34,4) |
En cuanto a la regresión logística binaria, ninguna de las variables estudiadas (edad gestacional, retraso de crecimiento intrauterino, ecografía transfontanelar, RM patológica ni tratamiento administrado) mostró ser un factor de riesgo independiente para la mala evolución neurológica.
Por último, cabe destacar la diferencia significativa en cuanto al tiempo de seguimiento. En el grupo B la duración media ha sido de 45 meses (DE 45) y en el grupo A de 20,7 meses (DE 20). Ningún paciente ha fallecido durante el periodo de seguimiento.
DiscusiónEntre el 60 y el 90% de los pacientes con infección por CMV sintomáticos al nacimiento y el 10-15% de los asintomáticos desarrollan secuelas neurológicas que pueden variar desde sordera neurosensorial aislada hasta discapacidad intelectual o déficit motor22,23. Debido a esta variabilidad clínica, es interesante determinar qué factores pueden predecir el pronóstico neurológico a largo plazo. Se han abordado diversos estudios para relacionar las alteraciones en neuroimagen (ecografía transfontanelar, tomografía computarizada craneal y RM cerebral) con su correlación clínica11,18,24-26.
La ecografía transfontanelar es una herramienta útil, económica, accesible e inocua, que permite identificar numerosas alteraciones cerebrales relacionadas con la infección por CMV. Sin embargo, presenta limitaciones para detectar alteraciones corticales, de la sustancia blanca y de la fosa posterior11. Por tanto, aunque se ha discutido que la normalidad de la ecografía puede predecir un buen pronóstico neurológico21, lo cierto es que la RM cerebral es superior para la detección de ciertas alteraciones. En el estudio de Capretti et al., el 8,8% de los pacientes con ecografía normal presentaron alteraciones en la RM cerebral y hasta en un 20% de todos los casos la RM cerebral proporcionó información adicional relevante11. En nuestro estudio, de los 10 pacientes con ecografía transfontanelar normal, uno presentó alteración de la migración neuronal (paquigiria) en la RM cerebral y desarrolló importantes secuelas neurológicas: parálisis cerebral infantil con GMFCS V, sordera, microcefalia y epilepsia, y 2presentaron microcefalia. Por tanto, coincidimos con Capretti et al. en que la RM cerebral en el periodo neonatal parece ser mejor predictor de las alteraciones psicomotoras que la ecografía transfontanelar11.
Ciertas lesiones, como las malformaciones corticales, ventriculomegalia y displasia de hipocampo, se relacionan con peor pronóstico neurológico18,22. En concreto, Minsun et al. encontraron una asociación significativa entre polimicrogiria, ventriculomegalia, calcificaciones y alteraciones de la sustancia blanca con epilepsia y de polimicrogiria con retraso psicomotor26. Sin embargo, la alteración de la sustancia blanca aislada puede confundirse con un retraso de la mielinización en menores de 2 años y no se ha relacionado un patrón específico de esta lesión con el pronóstico neurológico a largo plazo ni con la presencia de sordera neurosensorial18,22,27,28. En nuestro estudio, la RM cerebral se realizó en el 77% de los pacientes durante el primer año de vida, y las alteraciones más frecuentemente encontradas fueron las calcificaciones periventriculares, la ventriculomegalia y las alteraciones de la migración neuronal, entre las que destaca la polimicrogiria y la paquigiria.
Se han elaborado diversas escalas de valoración en función de los resultados de los estudios de neuroimagen. Respecto a la utilización de la tomografía axial computarizada craneal, Noyola et al. desarrollaron un sistema de gradación relacionado con la situación clínica que incluía la presencia de calcificaciones, ventriculomegalia y atrofia. Determinaron la existencia de una buena correlación entre la ausencia de estas alteraciones y un buen pronóstico neurológico19. Respecto a la aplicación de RM para el estudio de la afectación central por CMV, aunque presenta limitaciones en la detección de las calcificaciones cerebrales11, es más sensible para detectar alteraciones de la sustancia blanca, malformaciones corticales, quistes periventriculares y displasia de hipocampo, además de tener la ventaja de estar exenta de radiación ionizante17. Por ello, Alarcón et al. modificaron la escala de Noyola et al. en pacientes sintomáticos e incluyeron también disgenesia cerebral y alteración de la señal de la sustancia blanca en la RM cerebral21. Teniendo en cuenta la gradación de la escala de 0 a 3, en nuestro estudio hubo un 28% de los pacientes con secuelas neurológicas con una puntuación 0, entre las que se encuentran hipoacusia neurosensorial, retraso psicomotor y epilepsia; si bien es cierto que ningún paciente sin secuelas neurológicas presentó alteraciones de tipo 3.
Para el establecimiento de factores pronósticos en el caso de los trastornos de conducta y afectación cognitiva en estos pacientes, Inaba et al. estudiaron la correlación entre el volumen de sustancia blanca lesionado y su localización con el coeficiente intelectual y la presencia de autismo, y determinaron que un mayor volumen de alteración de la sustancia blanca detectada en RM cerebral en mayores de 18 meses se asoció con menor coeficiente intelectual, pero no con aumento de la probabilidad de padecer autismo28. En nuestro estudio ningún paciente ha presentado autismo durante el periodo de seguimiento.
La microcefalia es el indicador clínico más específico de secuela neurológica grave19,24. En nuestro estudio, los pacientes con microcefalia asociaron también en el 54% de los casos retraso psicomotor, en el 45% pérdida auditiva neurosensorial, en el 25% epilepsia y en el 29% parálisis cerebral infantil.
Según nuestros datos, la alteración precoz en la neuroimagen y la clínica infecciosa neonatal permitirían predecir el pronóstico neurológico en estos pacientes, lo que coincide con la bibliografía descrita. Debido a que el tratamiento antiviral mejora el pronóstico auditivo, se debe descartar infección congénita por CMV en pacientes con cribado auditivo alterado19,20.
Nuestro estudio incluye a pacientes tanto sintomáticos como asintomáticos, con un tamaño muestral de 60 pacientes, cifra superior a otros estudios. Sin embargo, presenta ciertas limitaciones, ya que se trata de un estudio restrospectivo. Además, solo en el 28% de los pacientes se repitió la RM cerebral a partir de los 2 años de edad, por lo que parte de las lesiones de la sustancia blanca pueden haberse confundido con un retraso de la mielinización. Esto probablemente sea debido a que no existe un protocolo de realización de RM durante el seguimiento de estos pacientes. A su vez, existe una limitación en el seguimiento a largo plazo de los pacientes sin secuelas neurológicas, quienes podrían presentar secuelas tardías como trastornos del aprendizaje, trastornos de conducta, trastornos del espectro autista, déficit de atención e hiperactividad, trastornos del lenguaje, etc. Por tanto, sería conveniente abordar un estudio multicéntrico prospectivo a largo plazo para incidir en qué factores de riesgo contribuyen al desarrollo de secuelas neurológicas en pacientes con infección congénita por CMV. Por otra parte, hay que tener en cuenta que las escalas empleadas son mayoritariamente cualitativas.
ConclusiónComo conclusión podríamos decir que un 65% de nuestros pacientes presentaban secuelas neurológicas, que se correlacionaron con el retraso del crecimiento intrauterino, el consumo de tóxicos en el embarazo, la presencia de otras infecciones, la clínica infecciosa en el periodo neonatal y la presencia de alteraciones de la sustancia blanca y de trastornos de la migración neuronal en la neuroimagen. Un dato interesante es el hecho de que la presencia de alteraciones en la RM cerebral no se asocia obligatoriamente a la existencia de secuelas neurológicas y viceversa, de modo que solo un 64% del grupo con secuelas neurológicas tenía alteraciones en la neuroimagen, mientras que hasta un 21% de los niños sin secuelas neurológicas tenían una neuroimagen alterada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado como comunicación oral en la XLI Reunión Anual de la Sociedad Española de Neuropediatría Pediátrica. Gerona, del 14 al 16 de junio de 2018.