La vitamina D se ha relacionado siempre con el metabolismo fosfocálcico, pero se han encontrado receptores de la vitamina D o de sus metabolitos en diferentes células del organismo, lo que indica que puede estar implicada en otros mecanismos fisiológicos. El déficit de vitamina D se ha relacionado con un mayor riesgo de infecciones, enfermedades autoinmunitarias, diabetes, síndrome metabólico, obesidad, asma y ciertas enfermedades neurológicas, como la esquizofrenia.
Actualmente existen diferentes técnicas para la determinación del 25(OH) colecalciferol en sangre y hay discrepancias entre ellas en cuanto a los resultados obtenidos en una misma muestra. Es importante conseguir una uniformización de las técnicas que permitan estudios de investigación comparables.
Todavía no se han establecido los valores adecuados de vitamina D en el organismo que aseguren todas sus funciones, pero se considera que no debe ser inferior a 20 ng/ml (50 nml/l), estando en discusión cómo conseguir estos niveles mínimos en toda la población. Dado que la principal fuente de vitamina D es la irradiación solar, hay que buscar estrategias que no entren en contradicción con los mensajes de prevención del cáncer de piel. En los últimos años se han producido variaciones en cuanto las recomendaciones de ingesta de vitamina D que implican a las actividades profilácticas que se realizan en el ámbito de la atención primaria.
Este texto revisa la fisiología, las acciones, la determinación de laboratorio, los niveles deseables en el organismo y las recomendaciones de ingesta de la vitamina D, y resalta las numerosas cuestiones que plantean nuevas investigaciones.
Vitamin D has always been associated with calcium –phosphate metabolism, but vitamin D receptors or its metabolites have been found in different body cells, indicating a possible involvement in other physiological mechanisms. Vitamin D deficiency has been associated with an increased risk of infections, autoimmune diseases, diabetes, metabolic syndrome, obesity, asthma and certain neurological diseases such as schizophrenia.
Currently there are different techniques for measuring 25 (OH) cholecalciferol in blood, but the results are variable and controversial. It is important to achieve standardization of these techniques to be able to compare the results obtained in different studies.
Normal physiological vitamin D levels have not yet been established, but they must be higher than 20 ng/ml (50 nmol/l) in order to perform it physiological function. It is still under discussion on how to achieve these minimum levels. Since the main source of vitamin D is sunlight, we should look for strategies that do not contradict the messages of prevention of skin cancer. In recent years, recommendations for vitamin D intake have changed, involving prophylactic activities carried out in Primary Care.
This manuscript reviews the physiology, actions, laboratory determination, desirable levels, and vitamin D intake recommendations, and it highlights many questions raised by new research.
La vitamina D, o mejor, las vitaminas D (ergocalciferol o vitamina D2 y colecalciferol o vitamina D3) son vitaminas liposolubles precursoras de sus formas activas, las cuales precisan para su formación de procesos interorgánicos.
El hecho de que la forma activa de la vitamina D precise de una síntesis interna y que tenga un importante papel en la regulación del metabolismo fosfocálcico ha hecho que muchos autores la consideren más una hormona que una vitamina.
La historia de la vitamina D se puede ligar a la del raquitismo1. La enfermedad, producida por deficiencia de vitamina D, fue descrita clínicamente en el siglo xvii. En 1931, Askaw definió la composición química de la vitamina D2 y durante los años siguientes se investigaron los mecanismos de producción de las formas activas de la vitamina D en el organismo y sus acciones sobre el metabolismo fosfocálcico. Aunque era una observación generalizada que los niños diagnosticados de raquitismo tenían más predisposición a las enfermedades infecciosas2 y la vitamina D estaba relacionada con la modulación del sistema inmunitario, no es hasta el presente siglo cuando se realizan numerosos estudios observacionales sobre su papel en diferentes enfermedades, unas que implican al sistema inmunitario y otras en las que esta relación no está establecida, como hipertensión, diabetes o síndrome metabólico3,4. El interés de la comunidad científica por esta vitamina se demuestra con el hecho de que, en 2 años, PubMed registra más de 5.500 artículos sobre el tema.
El objeto de este texto es revisar los estudios recientes sobre fisiología, acciones, determinación, niveles deseables en el organismo y recomendaciones de ingesta de la vitamina D, además de plantear ciertas cuestiones relacionadas con nuevas líneas de investigación.
Fisiología de la vitamina DLa vitamina D es una vitamina liposoluble que se puede encontrar en el organismo en forma endógena y exógena5–7.
La forma de producción endógena, colecalciferol (D3), es la principal fuente de vitamina D. Se sintetiza en la piel de los mamíferos por la acción de la radiación ultravioleta B (UVB), que produce la fotolisis del 7-dehidrocolesterol, convirtiéndolo en vitamina D36,8–10. También puede haber una aportación externa de colecalciferol a través de algunos alimentos.
El ergocalciferol (D2) se obtiene a través de la dieta y se absorbe en el duodeno y el yeyuno; su absorción es favorecida por la presencia de grasas y supone entre un 55 y un 99% de la ingesta oral5–7,11.
Los 2 tipos de vitamina D deben sufrir unos procesos previos complejos para ser metabólicamente activos5,6,9. La prohormona sufre 2 hidroxilaciones: una en el hígado, que da lugar a la 25-hidroxivitamina D (25(OH)D) o calcidiol7,11,12, y otra principalmente en el túbulo renal, mediante la 1-α hidroxilasa, dando lugar a la 1,25-dihidroxivitamina D (1,25(OH)D) o calcitriol, que es al menos 10 veces más potente que 25(OH)D, aunque tiene una concentración circulante 1.000 veces inferior7,12. La 1-α hidroxilasa también se encuentra en otros tejidos que también expresan receptores de vitamina D, como placenta, colon, queratinocitos, células mononucleares activadas y osteoblastos, que podrían producir 1,25(OH)D con una función local autocrina o paracrina7,8,11,12.
Los valores de 1,25(OH)D están regulados por la 1-α hidroxilasa. La hidroxilación es activada por la parathormona (PTH) y la calcitonina, y es inhibida por las cifras plasmáticas de calcio, fósforo y la propia 1,25(OH)D. Las fosfatoninas (FGF23), la hormona del crecimiento, la IGF-I o la prolactina también actúan de manera directa o indirecta sobre la 1-α hidroxilasa renal, aunque la relación exacta y su significado clínico están todavía sin aclarar6,12–14.
En circunstancias normales, aproximadamente el 85% de 1,25(OH)D está unido a la proteína fijadora de la vitamina D o transcalciferina (DBP)6 y el 15% a albúmina, siendo la circulación libre en plasma inferior al 0,5% para 1,25(OH)D e inferior al 0,05% para 25(OH)D. Estas formas libres circulantes son las únicas disponibles para su unión a los receptores de las células diana11,12.
La vida media varía según el metabolito, la de 25(OH)D es de unos 15 días7,11,12. A altas dosis, la vitamina D puede ser almacenada en el tejido adiposo y puede tener una vida media de varios meses7,11.
Aunque ambas vitaminas (D2 y D3) tienen funciones biológicas idénticas, algunos estudios sugieren que la vitamina D3 puede ser 2 o 3 veces más potente para mantener los niveles de 25(OH)D6,7,12; además, 25(OH)D3 podría unirse a DBP con mayor afinidad que 25(OH)D212.
La principal acción de la vitamina D es mantener las cifras de calcio y fósforo dentro del rango fisiológico que permita el metabolismo, la transmisión neuromuscular y la mineralización ósea6,7, pero se ha descrito la presencia de receptores de vitamina D en hueso, médula ósea, cartílago, folículo piloso, tejido adiposo, suprarrenal, cerebro, estómago, intestino delgado, túbulo renal distal, colon, páncreas (células β), hígado, pulmón, músculo, linfocitos B y T activados, corazón, aparato yuxtaglomerular, células del músculo liso vascular, gónadas, próstata, mama, células paratiroideas, parótida, placenta, retina, timo y tiroides7,10,12. Por este motivo, se le suponen funciones diversas10,12,15. Se ha observado que la vitamina D inhibe el crecimiento de los queratinocitos y estimula su diferenciación, y que las concentraciones de vitamina D por encima de 75 mmol/l (30 ng/ml) mantienen el crecimiento celular bajo control y previenen que las células sean autónomas y se malignicen15.
Determinación de la vitamina D y valores de normalidadLas unidades utilizadas en la determinación del 25(OH)D en sangre son ng/ml y nmol/l, 1 ng/ml de 25(OH)D corresponde a 2,496 nmol/l. La cantidad que se aporta de vitamina D (colecalciferol o ergocalciferol) por parte de alimentos o medicamentos se suele expresar en «unidades internacionales» (UI); 40 UI equivalen a 1μg de vitamina D2 o D3.
Los resultados de los valores de 25(OH)D en sangre varían según el método utilizado para su obtención e incluso puede haber diferencias intermétodo dependientes del calibrado16,17, lo que puede dar lugar, para una misma muestra, a resultados superiores o inferiores según el laboratorio. El valor de 25(OH)D puede ser determinado mediante técnicas de inmunoensayo competitivo, quimioluminiscencia o por cromatografía no inmunológica de detección directa (HPLC-UV y LC-MS/MS)18. Los métodos cromatográficos pueden medir independientemente 25(OH)D2 y 25(OH)D3, pero en la mayoría de los inmunoensayos la proporción de 25(OH)D2 detectada es variable. La UK Food Standards Agency comparó 5 métodos diferentes19. Los cromatográficos tuvieron resultados similares pero no así los realizados mediante inmunoensayo. Se decantaron por recomendar el LC-MS/MS. Este método es el utilizado por los CDC de EE. UU. desde 2007. En España son más comúnmente empleados los métodos basados en inmunoensayo, por ser más económicos.
Desde un punto de vista clínico, todos los métodos son válidos para detectar deficiencias graves de vitamina D16. Para las moderadas se asume un cierto riesgo de error que puede ser aliviado parcialmente considerando los valores de referencia de cada laboratorio. Esto no es aplicable para estudios de investigación en los que los métodos han de ser estandarizados16–20.
Periódicamente, se realiza un taller de trabajo sobre la vitamina D en el que se reúnen más de 400 expertos de 35 países diferentes para llegar a un consenso sobre los valores ideales de vitamina D en sangre. La mayoría de los expertos reunidos en 2009 estuvieron de acuerdo en que es necesario un valor mínimo de 20 ng/ml (50 nmol/l) para una buena salud ósea y mineral, aunque de acuerdo con este criterio una gran proporción de la población mundial es deficiente en vitamina D. Pero hay autores que se basan en estudios que implican patologías no óseas y consideran como normal una cifra entre 30 y 40 ng/ml21–23.
Fuentes de vitamina DEl ser humano puede obtener vitamina D a partir de la exposición solar (vitamina D3) y la ingesta (vitamina D2, principalmente).
En el recién nacido, las reservas de vitamina D dependen del estado materno de la vitamina D, que pasa por vía placentaria, y a partir del nacimiento depende de la producción propia y del aporte exógeno7,13,14. El recién nacido prematuro tiene menos tiempo para acumular vitamina D y, por lo tanto, tiene mayores requerimientos de vitamina D que el recién nacido a término15.
Fuente solarSe considera que el 80-90% de la vitamina D en seres humanos proviene de la síntesis cutánea a partir de la acción de la radiación UVB8,10.
Hay varios factores que influyen en la producción de la vitamina D en la piel. La melanina de la piel pigmentada absorbe los fotones de la UVB y se comporta como un protector solar natural, pero hace que las personas de piel oscura requieran hasta 5 o 10 veces más exposición solar que las de piel clara para sintetizar cantidades similares de vitamina D7,8,10,12,15,24,25.
La incidencia de los rayos UVB disminuye con el aumento de latitud, debido a que el ángulo oblicuo con el que la luz solar alcanza la atmósfera hace que el recorrido a través de ella sea mayor y se produzca una mayor dispersión y absorción de los rayos UV7,12,15,25.
Se forma muy poca cantidad de vitamina D durante los meses de invierno, debido al aumento de ropa de abrigo, la disminución del tiempo pasado fuera de casa y la disminución de la radiación UV que alcanza la superficie terrestre por la mayor oblicuidad de los rayos solares, lo que hace que por encima de los 35-40° de latitud (la península ibérica está entre los 36° y los 43,5°) en los meses de invierno, el número de fotones de UVB que llegan a la atmósfera terrestre disminuya un 80-100%, no consiguiendo el umbral mínimo requerido para inducir la síntesis de vitamina D y, por lo tanto, su producción es insignificante durante estos meses7,8,12,15,24,25.
Los rayos penetran más oblicuamente en las horas más tempranas y más tardías del día. Por este motivo, en estas horas solo se producen pequeñas cantidades de vitamina D en la piel, incluso en los meses de verano. El único momento en que llegan a la superficie de la tierra suficientes fotones de UVB para producir vitamina D es entre las 10 y las 15 horas (hora solar) en primavera, verano y otoño. Se ha observado que una breve exposición al mediodía tiene un máximo beneficio sobre la vitamina D con el menor riesgo de eritema15,24–26.
La contaminación y la nubosidad pueden disminuir la cantidad de radiación solar que llega a la superficie terrestre7,15.
Un protector solar de factor 2 bloquea aproximadamente el 50% de la radiación UVB, de factor 15 un 94% y de factor 30 un 97%, si se aplican correctamente. Estos protectores parecen bloquear más la radiación efectiva para la síntesis de vitamina D que para el eritema7,8,12,15,24,26.
Se ha observado que para aumentar la concentración de vitamina D, al menos el 20% de la superficie corporal tiene que estar expuesta a UVB7,8,12,15,24,26. La ropa puede disminuir la cantidad de vitamina D sintetizada por la radiación UVB y el tipo de tela es importante, siendo la lana negra 2 veces más efectiva absorbiendo y previniendo la incidencia de UVB en la piel que el algodón blanco.
Cuanto mayor es el grosor de la capa de ozono24, menos rayos UVB llegan a la superficie terrestre, por lo que altitudes elevadas se asocian con mayor cantidad de radiaciones UV15. Se considera que por cada kilómetro que se asciende, aumenta un 6% la incidencia de radiaciones UV15. Por otro lado, la nieve puede reflejar de un 20% a un 30% las radiaciones que llegan al suelo al igual que el agua o la arena.
Los niños pueden requerir menos exposición solar para producir suficientes cantidades de vitamina D por la gran área de superficie en relación con la talla y por la mayor capacidad de producir vitamina D que los adultos7,15.
La fototerapia aplicada a recién nacidos no influye en los valores de vitamina D27 porque las lámparas de fototerapia actuales no emplean UVB.
El exceso de exposición solar es una causa infrecuente de intoxicación por vitamina D, ya que la previtamina D puede ser degradada por la radiación UVB a productos inertes como lumisterol y taquisterol y la vitamina D se fotoisomeriza a suprasterol y otros productos inertes12,15,28.
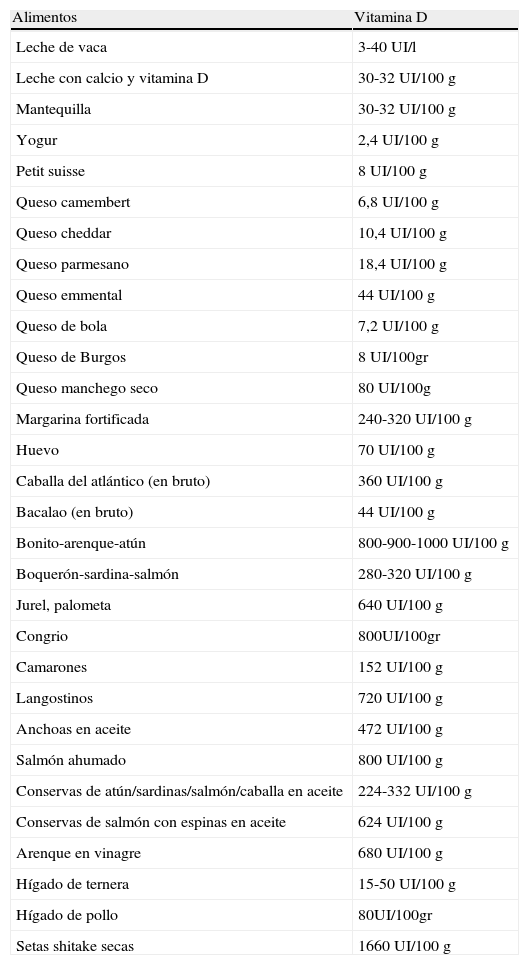
Fuentes dietéticas de vitamina DLa vitamina D también puede obtenerse a partir de alimentos que la contienen de forma natural o que han sido suplementados. En la tabla 1 se expone el contenido aproximado de vitamina D de diferentes alimentos. Estos valores pueden ser variables según el «estado» del alimento. Por ejemplo, en la anguila puede variar de 200 UI a 800 UI, y su forma de alevín, la angula, puede llegar a tener hasta 4.400 UI por 100g; las setas son muy ricas en vitamina D solo si han sido sometidas a irradiación solar durante 5 o 10 min o han sido tratadas con rayos UV. La forma de cocinar también influye: freír el pescado disminuye su contenido en vitamina D aproximadamente un 50%, mientras que cocerlo no lo afecta9,15,29.
Contenido aproximado de vitamina D de diferentes alimentos
| Alimentos | Vitamina D |
| Leche de vaca | 3-40 UI/l |
| Leche con calcio y vitamina D | 30-32 UI/100 g |
| Mantequilla | 30-32 UI/100 g |
| Yogur | 2,4 UI/100 g |
| Petit suisse | 8 UI/100 g |
| Queso camembert | 6,8 UI/100 g |
| Queso cheddar | 10,4 UI/100 g |
| Queso parmesano | 18,4 UI/100 g |
| Queso emmental | 44 UI/100 g |
| Queso de bola | 7,2 UI/100 g |
| Queso de Burgos | 8 UI/100gr |
| Queso manchego seco | 80 UI/100g |
| Margarina fortificada | 240-320 UI/100 g |
| Huevo | 70 UI/100g |
| Caballa del atlántico (en bruto) | 360 UI/100 g |
| Bacalao (en bruto) | 44 UI/100 g |
| Bonito-arenque-atún | 800-900-1000 UI/100 g |
| Boquerón-sardina-salmón | 280-320 UI/100 g |
| Jurel, palometa | 640 UI/100 g |
| Congrio | 800UI/100gr |
| Camarones | 152 UI/100 g |
| Langostinos | 720 UI/100 g |
| Anchoas en aceite | 472 UI/100 g |
| Salmón ahumado | 800 UI/100 g |
| Conservas de atún/sardinas/salmón/caballa en aceite | 224-332 UI/100 g |
| Conservas de salmón con espinas en aceite | 624 UI/100 g |
| Arenque en vinagre | 680 UI/100 g |
| Hígado de ternera | 15-50 UI/100 g |
| Hígado de pollo | 80UI/100gr |
| Setas shitake secas | 1660 UI/100 g |
La leche materna tiene un bajo contenido en vitamina D que varía entre 4 y 100 UI/l dependiendo de las reservas maternas, la alimentación y la exposición solar de la madre7,9,14,15. En el caso de un consumo medio de 750ml/día, la lactancia exclusiva materna sin exposición solar proporciona de 11 a 38 UI/día15, pero no se conoce cómo se relacionan estos valores con la absorción óptima del calcio y es posible que la biodisponibilidad del calcio de la leche materna sea diferente y que el transporte sea menos dependiente de la vitamina D9,14.
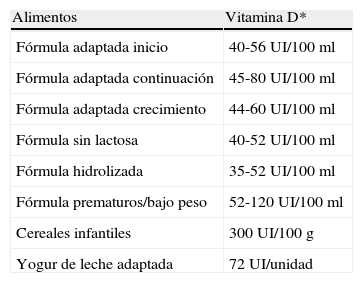
La suplementación de los diferentes alimentos con vitamina D se basa en asegurar un aporte poblacional que erradique el raquitismo y, en caso de alimentos para niños mayores y adultos, que prevenga la osteomalacia y la osteoporosis. La suplementación de alimentos varía en diferentes partes del mundo. En España está muy poco extendida la suplementación con vitamina D, solo en fórmulas adaptadas, cereales infantiles y algunos otros alimentos (tabla 2). Las fórmulas adaptadas están fortificadas con vitamina D y la mayoría aportan un mínimo de 400 UI de vitamina D por litro de leche reconstituida9,14, siguiendo las recomendaciones de la AAP (American Academy of Pediatrics) y ESPGHAN.
Alimentos infantiles fortificados con vitamina D en España
| Alimentos | Vitamina D* |
| Fórmula adaptada inicio | 40-56 UI/100 ml |
| Fórmula adaptada continuación | 45-80 UI/100 ml |
| Fórmula adaptada crecimiento | 44-60 UI/100 ml |
| Fórmula sin lactosa | 40-52 UI/100 ml |
| Fórmula hidrolizada | 35-52 UI/100 ml |
| Fórmula prematuros/bajo peso | 52-120 UI/100 ml |
| Cereales infantiles | 300 UI/100 g |
| Yogur de leche adaptada | 72 UI/unidad |
*1μg=40 UI.
Otra fuente de vitamina D son las formas galénicas, disponibles en forma de vitamina D2 o D3.
En situaciones de malabsorción intestinal, como ocurre en la celiaquía, la resección gástrica o intestinal, la insuficiencia pancreática (como la fibrosis quística), la enfermedad de Crohn y las hepatopatías colestásicas, puede disminuir mucho la absorción de vitamina D15.
Valores de vitamina D en poblaciones aparentemente sanasEn países como Irán, la deficiencia de vitamina D es muy prevalente30, especialmente entre las mujeres preadolescentes y adolescentes31, muy probablemente debido a la indumentaria. En EE. UU. se han encontrado valores < 50 nmol/l en más de una cuarta parte de los niños pequeños de familias de baja renta32 y en el 12,1% de niños y adolescentes33. En Canadá, en una encuesta que incluía a población de 6 a 79 años, el 10% tenía cifras < 37,5 nmol/l34, y en otro estudio observaron que las niñas de familias con bajos ingresos económicos tenían cifras bajas de vitamina D35. Se han encontrado valores muy bajos de vitamina D en niñas paquistaníes adolescentes (media de 10,9 nmol/l) inmigradas a Dinamarca36. En España se realizó un estudio en Madrid que incluyó a 102 niños de 9 a 13 años y se encontró un valor < 50 nmol/l en el 51% de los casos37, y en un estudio en lactantes valencianos la media de los valores de 25(OH)D en invierno, en el grupo con lactancia materna, era 16,8 ng/ml (42 nmol/l)38.
Las cifras bajas de vitamina D en niños aparentemente sanos se han relacionado con exposición solar, raza, baja ingesta de alimentos con vitamina D, obesidad, edad y estrato social39–42.
También es importante conocer el estado respecto de la vitamina D en las mujeres embarazadas, ya que ello puede afectar al recién nacido43,44, especialmente al prematuro. En un estudio realizado en EE. UU., las madres árabes y sus hijos prematuros presentaban mayores deficiencias de vitamina D en relación con las madres caucásicas y sus hijos45. También se han encontrado altos índices de deficiencia en madres de Paquistán, Turquía y Somalia inmigradas a Noruega46. Esto es especialmente relevante debido a la prevalencia actual elevada de inmigración en nuestro país.
Patologías óseas relacionadas con el déficit de vitamina DLas patologías relacionadas clásicamente con la deficiencia de vitamina D han sido óseas (raquitismo, osteomalacia y osteoporosis)4,43. Estas patologías también se pueden producir por deficiencias importantes de calcio y en ciertos trastornos metabólicos.
El raquitismo parecía ser una patología erradicada en la gran mayoría de los países del primer mundo gracias a la mejora de la alimentación, la suplementación con vitamina D y el aumento de las actividades al aire libre en zonas industriales, pero la inmigración ha comportado su resurgimiento48–53. Se origina con valores de vitamina D < 25 nmol/l (10 ng/ml).
La osteomalacia o raquitismo del adulto, cursa con una mineralización insuficiente de la cortical y la esponjosa del hueso maduro. Se ha encontrado osteomalacia en pacientes con valores < 62 nmol/l (25 ng/ml)4.
La osteoporosis cursa con pérdida de fuerza del hueso trabecular y reducción de la zona cortical y los huesos se vuelven susceptibles a las fracturas. Los suplementos de vitamina D y calcio podrían ser útiles para su prevención si se alcanzan cifras de vitamina D de 62 nmol/l, aunque esto es cuestionable.
La mineralización del hueso se produce predominantemente en las 2 primeras décadas de la vida y se ha estudiado si la administración de vitamina D podría aumentar la densidad ósea. No se ha comprobado en niños con niveles adecuados de vitamina D (50 nmol/l) y hay que realizar más estudios en los niños con deficiencia54.
Patologías no óseas relacionadas con deficiencia de vitamina DMuchas patologías han estado relacionadas con valores bajos (< 50 nmol/l) o moderados (entre 50 y 75 nmol/l o entre 50 y 100 nmol/l) de 25(OH)D4,47. En las patologías no óseas en que se ha demostrado su asociación, esto no demuestra un efecto causal y en muchos casos hay factores etiológicos confusores que hacen que los resultados hayan de ser observados con cautela. Se han realizado estudios de intervención caso/control, pero prácticamente todos concluyen que son necesarios más trabajos de investigación22.
La vitamina D puede aumentar la secreción y la sensibilidad a la insulina. Un metaanálisis de 5 estudios observacionales de suplementación con vitamina D en la infancia encontró una reducción de casi el 30% en el riesgo de diabetes tipo 1 en niños que habían recibido alguna vez suplementos de vitamina D55, pero estos estudios adolecían de problemas metodológicos.
Se realizó un metaanálisis56 en relación con la vitamina D y los factores de riesgo cardiovascular, entre ellos la diabetes tipo 2. Tres de 6 análisis (de 4 cohortes diferentes) encontraron una menor incidencia de diabetes en las personas con un valor más alto de vitamina D. Por otra parte, 8 ensayos no encontraron ningún efecto de la suplementación con vitamina D sobre la glucemia o la diabetes recientemente instaurada.
La deficiencia de vitamina D se ha relacionado con la obesidad57–61, pero no se conoce si como causa o efecto. Parece que la grasa corporal excesiva «secuestraría» la vitamina D circulante, pero también se ha postulado que la deficiencia de vitamina D aumenta el acúmulo de grasa en el organismo.
La deficiencia importante/moderada se ha relacionado con un aumento de la mortalidad general62 y con diversos factores de riesgo cardiovascular63,64 y síndrome metabólico56,65: hipertensión66, hipertrigliceridemia y diabetes tipo 256,67. Un estudio realizado en escolares en Madrid relaciona la deficiencia de vitamina D con la hipertrigliceridemia68: los niños con un valor de vitamina D < 17,4 ng/ml tenían significativamente más triglicéridos en sangre que los que tenían más de 27,6 ng/ml. Por otra parte, un estudio ha relacionado la suplementación con vitamina D con un aumento de colesterol LDL69.
La deficiencia se ha relacionado con más crisis de asma y más complicadas, además de una menor respuesta a los corticoides70,71. Se realizó un estudio con 1.024 niños con asma grave o moderada72, determinándose 25(OH)D al inicio del estudio. Los que tenían valores<30 ng/ml tuvieron una probabilidad más alta de cualquier hospitalización o visita al servicio de urgencias.
Se han realizado muchos estudios relacionando vitamina D con diversas neoplasias73,74. Valores <33 ng/ml se han asociado a mayor riesgo de cáncer colorrectal. También se ha observado que disminuía el riesgo de cáncer de mama si se suplementaba a mujeres con deficiencia, pero esto se invertía en caso de mujeres con ingestas altas. Por otra parte, parece ser que los suplementos de vitamina D en personas que tienen un nivel adecuado no disminuye el riesgo de cáncer y, en cambio, niveles altos pueden ser un factor de riesgo de cáncer esofágico y cifras >40 ng/ml se han asociado a un riesgo superior de neoplasia de páncreas y con una mayor agresividad del cáncer de próstata75.
Los suplementos con vitamina D parecieron reducir las infecciones de vías respiratorias de forma significativa en adultos76,77, pero no todos los estudios han tenido el mismo resultado. Un estudio realizado con 468 pacientes encontró una importante asociación entre la infección crónica con el virus de la hepatitis C y valores de 25(OH)D <10 ng/ml78. Hay muy pocos estudios de intervención en niños. En uno de ellos, un suplemento de 1.200 UI de vitamina D disminuyó la incidencia de gripe A durante la epidemia y entre los niños asmáticos incluidos en el estudio disminuyeron las crisis secundarias a la infección79. No se ha encontrado relación con la deficiencia de vitamina D y bronquiolitis que precisaron ingreso80 ni con amigdalitis de repetición81.
Los valores bajos de vitamina D se han asociado también a enfermedades autoinmunitarias82,83, urticaria/angioedema crónico84, artritis inflamatoria no diferenciada85, esquizofrenia86 y esclerosis múltiple87.
Recomendaciones de cribadoLas patologías que se han asociado a la deficiencia de vitamina D han hecho que aumentara exponencialmente la solicitud de determinación de 25(OH)D.
Se ha de valorar si el aumento de gasto que esto supone justifica su determinación en la población general, teniendo en cuenta que solo aporta el dato de unos 15 días previos (la vida media de 25(OH)D en sangre), que no se conocen los valores ideales de referencia y que los valores obtenidos pueden ser diferentes según los laboratorios, y considerando que no está suficientemente estudiada la repercusión para la salud de valores bajos en individuos sanos. Podría considerarse más eficiente, en sujetos sanos, asegurar unas cifras adecuadas de vitamina D mediante suplementación profiláctica y/o con una correcta educación sanitaria respecto a la dieta y la exposición solar.
En cambio, hay situaciones que sí justificarían la determinación de 25(OH)D22,88: clínica sospechosa de raquitismo, genu varo en niños o adolescentes, fracturas patológicas, dolores óseos, hipocalcemia o hipofosfatemia, niños con enfermedades crónicas hepáticas o renales, enfermedades que cursan con malabsorción, desnutrición grave, falta de exposición solar, mujeres embarazadas de piel oscura o que van muy cubiertas, y pacientes que siguen tratamiento con anticonvulsivantes, hormona de crecimiento, glucocorticoides o fármacos contra el sida.
Recomendaciones para la vitamina DLa principal fuente de vitamina D es la exposición solar, lo que hace difícil establecer unos requerimientos generalizados de ingesta de la misma, especialmente a causa de las muchas variables asociadas con la deficiencia. El IOM (Institute of Medicine) recomendaba en 1997 la ingesta de 200 UI/día de vitamina D. Sin embargo, debido a que una ingesta de 200 UI/día parece insuficiente para mantener concentraciones de 25(OH)D superiores a 50 nmol/l89,90, la AAP y otras instituciones8,13,22,24,29,88 recomiendan una ingesta de 400 UI/día en menores de un año y de 600 UI/día en niños mayores. El IOM14,91 también ha revisado recientemente sus recomendaciones sobre aporte de vitamina D: la ingesta dietética de referencia (dietary reference intakes [DRI]), expresadas como RDA (recommended dietary allowances) o como ingesta adecuada (AI), así como el nivel máximo tolerado (UL) de vitamina D.
La forma de aumentar exógenamente el aporte de vitamina D es muy variada. En España, son varios los alimentos infantiles que están suplementados con vitamina D y respecto a la suplementación farmacológica, la situación en los últimos años ha sido muy irregular, coexistiendo pautas muy variadas en dosis y tiempo de administración14.
Las recomendaciones de aportes sistemáticos de vitamina D en niños corresponden a opiniones o consenso de expertos (nivel C de evidencia), basados en estudios que permiten asegurar unos valores mínimos de 50 nmol/l en su población con las ingestas recomendadas, pero no están realmente respaldadas por estudios clínicos cuyo diseño y resultados permitieran incrementar este grado de evidencia a nivel A o B92, dado que hay muchos factores que condicionan los niveles de vitamina D en cada individuo.
Ninguna revisión sistemática aclara si hay un grado de exposición solar suficiente y seguro para mantener una cifra óptima de vitamina D22, pero sí está demostrado que su exclusión habitual es un riesgo de deficiencia. Una adecuada exposición solar no es fácil de definir, pero parece ser que en adultos los efectos beneficiosos se obtienen con la exposición de la cara, las manos y los brazos (aproximadamente el 25% de la superficie corporal), 2 o 3 veces por semana, que es el tiempo necesario para una dosis mínima eritema (DME) en verano, primavera y otoño, lo que equivale a una dosis oral de 1.000 UI de vitamina D. Esto sería adecuado para satisfacer los requerimientos de vitamina D a lo largo del año. Otras organizaciones, como la UK National Radiological Protection Board, opinan que períodos cortos en el exterior, como ocurre durante la vida diaria, serían suficientes para la producción adecuada de vitamina D28. Esto se contradice con los altos índices de deficiencia de vitamina D en poblaciones que se supone que cumplen esta recomendación. Según Specker, 30 min por semana en pañal o 2h vestido y sin gorro permitirían mantener valores de 25(OH)D superiores a 11 ng/ml93 en lactantes. Ho encontró que exponer la cara 24 min al día sería suficiente94. Otros investigadores recomiendan cortos períodos de exposición solar para obtener vitamina D en niños mayores de un año, como la exposición de brazos, cara y manos durante 5 a 30 min entre las 10:00 y las 15:00 horas, 2 veces por semana9,10,15,25,95. Sin embargo, esto entra en conflicto con las actuales guías clínicas para la prevención del cáncer de piel por tanto muchos autores están de acuerdo en disminuir la exposición solar y no recomendar la exposición solar intencionada sin protección8,24,25,96. El conocimiento poco claro del balance beneficio/riesgo de la exposición solar dificulta la elaboración de mensajes de salud pública no contradictorios14.
Por ello, hasta que no existan recomendaciones bien equilibradas de protección solar que aseguren un estado de suficiencia de vitamina D sin incrementar significativamente el riesgo de desarrollar cáncer, parece adecuada la suplementación con vitamina D10.
En algunos estudios se ha probado la suplementación con vitamina D en mujeres embarazadas y madres lactantes, obteniéndose un mínimo efecto en los niveles de 25(OH)D en los recién nacidos8,97, pareciendo que las dosis de suplementación deberían ser mayores a las recomendadas para causar algún efecto beneficioso en la madre o el recién nacido98.
Las recomendaciones actuales realizadas por la AAP desde 2008 son las siguientes8:
- 1.
Los lactantes deben seguir profilaxis con 400 UI/día de vitamina D empezando a los pocos días de vida. La suplementación debe continuar excepto si el lactante toma un litro al día de leche de fórmula suplementada con vitamina D.
- 2.
Los niños mayores que ingieren menos de un litro al día de leche de fórmula o de leche suplementada con vitamina D deben recibir 400 UI/día de vitamina D. Otras fuentes dietéticas de vitamina D, como alimentos enriquecidos con esta vitamina, pueden ser incluidas en la ingesta diaria de cada niño.
- 3.
Los adolescentes que no obtienen 400 UI de vitamina D al día a través de alimentos enriquecidos con vitamina D deben recibir 400 UI/día de vitamina D.
- 4.
Los niños con riesgo incrementado de deficiencia de vitamina D pueden necesitar dosis más altas de vitamina D (de hasta 2 o 3 veces superior)88 para alcanzar un valor normal, y su estado debe ser estudiado y controlado.
En España, el grupo de trabajo sobre prevención en la infancia y adolescencia, de la Asociación Española de Pediatría de Atención Primaria y el Comité de Lactancia Materna de la Asociación Española de Pediatría, siguen estas recomendaciones aunque con algunos matices10:
- 1.
Los lactantes menores de un año lactados al pecho deben recibir un suplemento de 400 UI/día de vitamina D, iniciando su administración en los primeros días de vida. Todos los lactantes menores de un año que ingieren menos de un litro diario de leche enriquecida con vitamina D han de recibir un suplemento de 400 UI/día (recomendación grado B).
- 2.
Los niños o adolescentes que tienen factores de riesgo de déficit de vitamina D y que no obtienen 400 UI/día con la ingesta de un litro de leche enriquecida o alimentos enriquecidos o una adecuada exposición solar, deben recibir un suplemento de vitamina D de 400 UI/día (recomendación grado B).
- 3.
En los niños mayores de un año o adolescentes, de forma general, se recomienda para la adecuada producción de vitamina D la exposición al sol de mediodía sin protección durante 10-15 min al día durante la primavera, el verano y el otoño teniendo el rostro y parte de los brazos al descubierto. En invierno, por encima de 42° de latitud norte, no se producirá vitamina D (recomendación grado I).
- 4.
Los niños prematuros menores de un año de edad corregida precisan una ingesta de vitamina D de 200 UI/kg/día hasta un máximo de 400 UI/día (recomendación grado A).
Recientemente, algunos grupos de trabajo han cambiado estas recomendaciones, sugiriendo que las necesidades de vitamina D en mayores de un año serían de 600 UI/día para mantener los beneficios no esqueléticos de la vitamina D22,23,88.
A pesar de estas recomendaciones, todavía no hay estudios que demuestren que la suplementación galénica universal con vitamina D sea imprescindible para la mejora de la salud de la población. Idealmente, la decisión de indicar vitamina D en forma galénica se habría de realizar individualmente, teniendo en cuenta la dieta (ingesta o no de alimentos ricos en vitamina D o suplementados con ella), la exposición al sol, la época del año, la latitud donde se vive, la raza y el grado de aceptación, considerada de forma realista, de modificación de hábitos. En el lactante también hay que considerar todas las variables anteriores en su madre y si ha sido prematuro o no. Pero a efectos prácticos y de salud pública, puede ser útil asegurar una ingesta mínima de manera cómoda y fácil mediante las suplementaciones universales. Los suplementos de vitamina D comercializados pueden estar preparados a partir de vitamina D2 o D3. Aunque se pensaba que el potencial era similar, en algunos estudios se demuestra que la vitamina D3 puede ser de 1,7 hasta 3 veces más potente que la vitamina D2 en su capacidad para elevar los niveles de 25(OH)D, por lo que son principalmente recomendados los suplementos con vitamina D38,10,15. En España está comercializada la vitamina D3 en gotas y cada gota corresponde a 66 UI de vitamina D. Para la profilaxis en casos de malabsorción se recomienda el calcifediol, soluble en agua, en gotas, cada gota proporciona 240 UI de vitamina D, o en ampollas, cada una tiene 15.960 UI.
A pesar de que se han usado durante muchos años, hay pocos estudios publicados sobre la administración de dosis masivas de vitamina D y los pocos que hay se han realizado en adolescentes y preadolescentes, llegando a la conclusión de que la administración de dosis altas de suplementación con vitamina D es efectiva y segura en adolescentes y que podría facilitar el cumplimiento terapéutico99,100.
Existen otros productos con vitamina D2 o con vitamina D3, pero están asociados a otras vitaminas o a calcio, o son polivitamínicos con minerales. También existen comercializados metabolitos de la vitamina D para casos con patologías asociadas a la vitamina D más complejas.
Solo se ha demostrado efecto tóxico de la vitamina D con niveles sanguíneos muy altos (en general, superiores a 150 ng/ml) y que no suelen ser observados hasta que se ingieren 10.000 UI diarias durante 5 meses. Aunque el margen terapéutico es alto, se ha de considerar el peligro de la sobredosificación, sobre todo con la utilización de dosis masivas22. Se han publicados casos de intoxicación por vitamina D con síntomas importantes de hipercalcemia por suplementos administrados sin receta médica101.
Hay que recordar que además de la ingesta adecuada de vitamina D, la ingesta de calcio debe ser óptima para asegurar una formación y un modelado adecuados del hueso.
Conclusiones- –
La multitud de factores que influyen en el estatus de la vitamina D condiciona la extrapolación de datos de otros países, por lo que sería recomendable realizar estudios sobre la situación de los niños y adolescentes con respecto la vitamina D, en nuestro medio.
- –
Son necesarios más estudios prospectivos sobre la suplementación con vitamina D focalizados en las consecuencias para el paciente, más que en biomarcadores.
- –
A la luz de los conocimientos actuales, se recomienda el cribado de la deficiencia de vitamina D sólo en población de riesgo.
- –
Se han de estandarizar los métodos de determinación del 25(OH)D en todos los estudios de investigación sobre la vitamina D.
- –
Teniendo en cuenta las recomendaciones actuales con respecto a la vitamina D, el pediatra ha de tener presente la necesidad de atender individualmente cada caso, elegir el preparado adecuado y supervisar los tratamientos pautados.
- –
Dado que las dosis masivas de vitamina D podrían mejorar el cumplimiento terapéutico, sería interesante realizar estudios sobre esta forma de administración, de cara especialmente a poblaciones de riesgo.
- –
Las recomendaciones respecto a la exposición solar han de ajustarse, de manera que se eviten mensajes contradictorios dirigidos a la población (mucha protección solar para evitar cáncer de piel frente exposición solar para evitar deficiencia de vitamina D), hasta llegar a un equilibrio beneficioso, todo ello basado en la evidencia.
- –
Hay que promover la inclusión en la dieta de alimentos ricos en vitamina D de forma natural.
Los autores declaran no tener ningún conflicto de intereses.