Las recomendaciones incluidas en este documento forman parte de una revisión actualizada de la asistencia respiratoria en el recién nacido. Están estructuradas en 12 módulos, y en este trabajo se presentan los módulos 4, 5 y 6. El contenido de cada módulo es el resultado del consenso de los miembros del Grupo Respiratorio y Surfactante de la Sociedad Española de Neonatología. Representan una síntesis de los trabajos publicados y de la experiencia clínica de cada uno de los miembros del grupo. Cada módulo se acompaña de un resumen de la evidencia científica con 4 grados de recomendaciones.
The recommendations included in this document will be part a series of updated reviews of the literature on respiratory support in the newborn infant. These recommendations are structured into twelve modules, with modules 4, 5, and 6 presented here. Each module is the result of a consensus process of all members of the Surfactant and Respiratory Group of the Spanish Society of Neonatology. They represent a summary of the published papers on each specific topic, and of the clinical experience of each one of the members of the group. Each module includes a summary of the scientific evidence available, graded into 4 levels of recommendations.
Cuando el soporte respiratorio a un recién nacido requiere la intubación endotraqueal introduciendo un volumen de gas al pulmón mayor que el espacio muerto fisiológico a una frecuencia menor de 150 ciclos por minuto, estamos ante la ventilación o asistencia respiratoria invasiva convencional. Desde el inicio de los años sesenta del siglo xx se han conocido diferentes términos y técnicas como ventilación con presión positiva intermitente (IPPV) o ventilación mandatoria intermitente (IMV)1. La ventilación se realizaba con dispositivos de flujo continuo, ciclados por tiempo y limitados por presión independientemente de los esfuerzos respiratorios, favoreciendo la asincronía tanto inspiratoria como espiratoria. A este proceso se asociaron efectos adversos como la fuga aérea, y la alteración en el intercambio gaseoso y en el flujo sanguíneo cerebral con mayor riesgo de hemorragia intraventricular2. La parálisis neuromuscular y la ventilación con frecuencias altas fueron soluciones propuestas para disminuir estas complicaciones3,4. La falta de monitorización ventilatoria ocasionaba periodos de ventilación excesiva o insuficiente que no eran detectados.
En los años noventa del siglo xx los avances tecnológicos incorporados al diseño de los respiradores neonatales introdujeron importantes novedades en la ventilación neonatal. Se desarrollaron mejoras en la monitorización de la función pulmonar y la mecánica ventilatoria, así como en las distintas modalidades ventilatorias, encaminadas a sincronizar el esfuerzo respiratorio del paciente con el ciclado del respirador.
Ajustes prácticos de la asistencia respiratoria invasivaPara el manejo práctico de la diferentes modalidades ventilatorias hemos de considerar que los parámetros programados iniciales son orientativos y que sus ajustes dependerán del estado de oxigenación y ventilación del recién nacido. No se ha identificado la mejor estrategia ventilatoria para evitar el daño pulmonar en el recién nacido. Además, hemos de tener en cuenta que la oxigenación tisular dependerá no solo de la función respiratoria sino también de la cardiocirculatoria5,6.
Los parámetros que habitualmente controlamos son:
- -
Frecuencia respiratoria (FR): influye en el volumen minuto (Vm) y en la eliminación de CO2. FR: 40-60rpm. La estrategia de frecuencias elevadas se empleó para permitir menor pico de presión inspiratoria (PIP) y conseguir Vm altos y así reducir el volutrauma.
- -
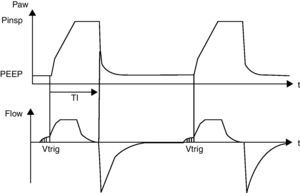
Tiempos inspiratorios (Ti) y espiratorios (Te): están determinados por las constantes de tiempo pulmonar. En el recién nacido prematuro puede ser suficiente entre 0,25 y 0,35 s. Ti demasiado cortos provocan un déficit del volumen tidal (Vt) o volumen corriente (Vc), y Te demasiado cortos un atrapamiento de gas alveolar en la espiración. Se aconseja mantener una relación inspiración:espiración de 1:2 a 1:5 según patologías. No es recomendable relaciones inversas (Ti>Te). La morfología de la curva de flujo inspiratorio así como la medición de la constante de tiempo nos permite intentar ajustar los tiempos a los cambios que se vayan produciendo.
- -
PIP: influye en la oxigenación al aumentar la presión media en la vía aérea y en la ventilación por el aumento en el Vc y la ventilación minuto alveolar. Se ha de emplear la menor PIP necesaria para obtener un Vt entre 4-6ml/kg.
- -
Presión de distensión continua al final de la espiración (PEEP): evita el colapso alveolar y mejora la ventilación al reclutar unidades alveolares. Aumenta la presión media en la vía aérea (MAP), mejorando la oxigenación. Incrementos de PEEP>6cmH2O pueden no ser efectivos para mejorar la oxigenación, ya que pueden disminuir el retorno venoso y aumentar la resistencia vascular pulmonar. Es importante tener en cuenta el proceso y la situación fisiopatológica. Aumentar la PEEP disminuye el Vt y el Vm, pudiendo provocar una menor eliminación de CO2. En ocasiones son necesarias estrategias de reclutamiento valorando la eficacia de la oxigenación y la repercusión hemodinámica. Se recomienda una PEEP entre 4-6cmH2O.
- -
MAP: mantiene el volumen pulmonar mejorando la oxigenación.
- -
Flujo: entre 6 y 10 l/min según el peso. El aumento del flujo con limitación de presión producirá un llenado más rápido del pulmón, alcanzando la PIP en un tiempo más corto (onda cuadrada) lo que aumenta la MAP. Flujos elevados superiores a 10 l/min a través de tubos endotraqueales pequeños pueden producir disminución del Vt.
- -
Concentración de oxígeno inspirado (FiO2): incrementa la presión alveolar de oxígeno.
Las siguientes estrategias ventilatorias se han ido incorporando en el soporte respiratorio del recién nacido:
Ventilación sincronizadaLos modos de ventilación sincronizada se caracterizan porque el ventilador inicia respiraciones mecánicas en respuesta al esfuerzo respiratorio del paciente7. En la tabla 1 se muestran las principales estrategias de ventilación sincronizada y sus principales características. La clave de la sincronización radica en que en el circuito existan sensores capaces de captar el inicio del esfuerzo inspiratorio del paciente y que provoquen una respuesta inmediata del ventilador con el envío de un ciclo respiratorio. Existen diferentes tipos de señales como los movimientos abdominales, presión en la vía aérea, impedancia torácica, presión esofágica o cambios de flujo en la vía aérea, siendo estos últimos los más eficaces.
Características de los sistemas de ventilación sincronizada
| Modos | Características | ||||
| Trigger | Asistencia inspiratoria en cada respiración | FR ventilador | Ti | PIP | |
| SIMV | Sí | No | Fijo | Fijo | Fijo |
| A/C | Sí | Sí | Variable | Fijo | Fijo |
| PSV | Sí | Sí | Variable | Variable | Fijo |
A/C: ventilación asistida controlada; FR: frecuencia respiratoria; PSV: ventilación con presión de soporte; SIMV: ventilación mandataria intermitente sincronizada.
En esta modalidad, el ventilador asiste sincronizadamente un número fijo de ciclos por minuto seleccionados por el clínico. Si la frecuencia del paciente es superior a la programada en el ventilador, se intercalarán respiraciones espontáneas y respiraciones asistidas. Las respiraciones espontáneas no asistidas representan un mayor trabajo respiratorio. Si el Ti no es idéntico entre el paciente y el ventilador, el paciente puede terminar su esfuerzo respiratorio y producirse la espiración mientras el ventilador continúa en fase inspiratoria, provocando asincronismo.
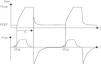
Ventilación asistida/controladaEn esta modalidad ventilatoria todos los esfuerzos inspiratorios del paciente son asistidos por el ventilador y si el paciente no los tiene, el ventilador garantiza un número de respiraciones programadas por el clínico (fig. 1). El niño puede activar el respirador en cualquier momento del ciclo siempre que su inspiración supere la sensibilidad programada. Debe ajustarse la frecuencia del ventilador alrededor de un 10% inferior a la del recién nacido, para que actúe como frecuencia de rescate. El Te debe ser más largo que el Ti para evitar la PEEP inadvertida. El operador controla la PIP y el Ti.
Ventilación con presión de soporteEs una forma de ventilación ciclada por flujo y limitada por presión, en la que el inicio y la duración de la fase inspiratoria están controlados por el paciente8. El ventilador reconoce el inicio de la inspiración, aumenta la presión según el valor programado, reconoce el final de la inspiración y cesa la fase de presión inspiratoria. Esto ocurre cuando el flujo entregado disminuye a un porcentaje determinado del pico de flujo inspiratorio del mismo ciclo, y como máximo al terminar el Ti ajustado en el respirador. En algunos ventiladores se puede seleccionar el porcentaje de flujo, y la inspiración finalizará cuando el flujo entregado disminuya según el porcentaje de flujo inspiratorio seleccionado por el clínico.
La diferencia por lo tanto entre ventilación con presión de soporte (PSV) y ventilación asistida/controlada (A/C) es que la duración de la inspiración está controlada por el paciente y es variable en relación propable con la patología de base y dependiendo de la constante tiempo pulmonar, siendo por lo tanto modalidad ciclada por flujo.
Para el manejo práctico se ha de ajustar el Ti a un valor superior al realizado por el paciente. Es aconsejable utilizarla asociada a volumen garantizado. Si los Ti espontáneos del paciente son inferiores a 0,2 s puede fracasar; suele disminuir la MAP, al acortarse el Ti. No es aconsejable su uso en patologías agudas asociadas a constantes pulmonares muy disminuidas.
EvidenciaLos resultados individuales o combinados de los estudios aleatorizados no indican un beneficio significativo de la sincronización, comparado con la ventilación convencional en cuanto a la supervivencia o hemorragia cerebral. Sin embargo, sí se han observado ventajas como la disminución de la sobredistensión pulmonar, menor necesidad de parálisis muscular y sedación, mejor intercambio gaseoso, permite utilizar presiones más bajas en la vía aérea, menor fluctuación en la presión arterial, disminuye el riesgo de volutrauma, facilita el entrenamiento muscular, acorta la duración de la ventilación invasiva y facilita el destete9–12.
Existe una limitación en la interpretación de los resultados de los estudios, principalmente en referencia a la displasia broncopulmonar, que viene determinada por los diferentes diseños y tamaño de estos estudios así como por las características de los recién nacidos incluidos.
No existe un consenso sobre cuál es la modalidad de ventilación sincronizada más óptima. La ventilación mandatoria intermitente sincronizada (SIMV) y la A/C, aunque conceptualmente son modalidades diferentes, en la fase aguda de la enfermedad pulmonar su comportamiento puede ser similar, si se emplean frecuencias respiratorias elevadas en SIMV. En la fase de destete, la A/C se ha mostrado más eficaz que la SIMV, acortando la duración de la ventilación mecánica9–14.
Con el uso de PSV se han descrito menor tasa de asincronismo, tiempo en el destete, fuga aérea, menor esfuerzo respiratorio en recién nacidos tras intervención cardiaca y una mejoría en la ventilación espontánea15,16. Para conseguir estos resultados es necesaria una adecuada maduración del centro respiratorio.
Las limitaciones que se han observado con la ventilación sincronizada están relacionadas con la inadecuada función del mecanismo de sincronización. Sensores de impedancia pueden ser activados por estímulos no respiratorios (hipo o latidos cardíacos). Sensores de presión y flujo pueden detectar falsas respiraciones con los cambios posturales, la presencia de agua en las asas del respirador o las fugas alrededor del tubo traqueal. La ausencia de trigger puede estar ocasionada por la no adquisición del umbral de sensibilidad, fallo en la detección de respiraciones espontáneas, oclusión u obstrucción del sensor. El retraso en la respuesta puede provocar un incremento en el esfuerzo respiratorio del recién nacido y asincronismo al final de la inspiración. La presencia de autociclado es más grave en la modalidad de A/C, dado el mayor riesgo de hiperventilación, hipocapnia y atrapamiento aéreo.
Ventilación con volumen ajustado o controladoExisten distintas formas de emplear la ventilación por volumen (limitada, controlada o con volumen garantizado)17 dependiendo básicamente del tipo de respirador empleado18 que puede medir el volumen en el respirador o en el paciente, el Vt actual inspiratorio o espirado, y ajustarlo a lo programado en la misma respiración o en la siguiente. Estas modalidades de volumen pueden emplearse con A/C, SIMV o PSV19.
Los potenciales efectos beneficiosos de este tipo de ventilación están basados en evitar la excesiva insuflación pulmonar manteniendo un volumen pulmonar y Vt estable. Se han descrito múltiples modalidades, siendo la más utilizada en nuestro medio el volumen garantizado.
Volumen garantizadoEs un modo de ventilación de flujo constante, limitado por presión y ciclado por tiempo en el que se entrega un Vc preseleccionado. Se caracteriza porque la presión aumenta o disminuye para alcanzar este Vc previamente determinado. Su principal ventaja es evitar volúmenes altos que pueden ocurrir durante la ventilación limitada por presión, sobre todo cuando hay variaciones en la distensibilidad o en la fase de recuperación de la enfermedad pulmonar aguda. Los ajustes en el PIP están determinados por la diferencia entre el Vt seleccionado y el Vt espirado, medido por un sensor de flujo, de tal forma que la PIP aumenta o disminuye en los ciclos ventilatorios siguientes, para mantener el Vt seleccionado…
Tiende a mantener un Vt más estable, con cambios de presión según sea necesario. Previene por tanto la sobredistensión y el volutrauma, la hipoventilación y el atelectrauma20. Estaría más indicado en procesos respiratorios en los que se producen cambios rápidos en la mecánica pulmonar (tras administración de surfactante, fase de recuperación de EMH).
En el manejo práctico hemos de comprobar si existen pérdidas alrededor del tubo endotraqueal (TE). Si son superiores a 30-40%, no se recomienda usar volumen garantizado (VG), dado que el Vt espirado está infravalorado. También pueden surgir problemas cuando se ajustan frecuencias respiratorias de rescate inferiores a 35 ciclos por minuto.
Una de las dificultades del empleo del VG es la elección del Vc óptimo. Diversos estudios sugieren el empleo de valores ente 4- 6ml/kg, siendo importante la fisiopatología y el momento del proceso. Se ha observado al comparar SIMV con SIMV/VG que con este último se consigue un intercambio de gases más estable con menor MAP y sin efectos adversos21. Potencialmente puede minimizar la sobredistensión pulmonar, al disminuir la variabilidad del Vt, disminuir la hipocapnia y favorecer el destete22.
Asociado a PSV también se ha observado Vt más estable y MAP más baja y estable frente a ventilación con A/C, SIMV21,22.
Un metanálisis reciente ha demostrado una reducción en muerte y/o de displasia bronco-pulmonar (DBP) empleando ventilación por volumen en comparación con ventilación limitada por presión23.
Estrategias ventilatorias híbridasPresión regulada con control de volumenEs una modalidad ciclada por flujo, en la que la presión se ajusta según el volumen administrado. Se establece el Vt a administrar y un valor máximo de PIP. La primera respiración es controlada por volumen y permite calcular la PIP necesaria para entregar el volumen, según la distensibilidad pulmonar (CI). En la siguiente respiración el flujo es variable. Esta modalidad presenta los mismos patrones de flujo y presión que modalidades limitadas por presión, pero controla el volumen en cada respiración y ajusta la PIP en la siguiente. Las mediciones del Vt se realizan en el respirador, por lo que debe compensarse el espacio muerto.
Volumen asegurado con control de presiónEn cada respiración se combina el control por presión y volumen. Cada respiración comienza como un ciclo de presión soporte, con flujo variable. El respirador mide el volumen entregado cuando el flujo inspiratorio ha disminuido a un nivel prefijado, evaluando si ha entrado todo el volumen programado. Si es así, se continúa con el ciclo respiratorio iniciando la espiración como un ciclo típico de presión soporte ciclado por flujo. Si no es así, se modifica el flujo para permitir la entrada de todo el volumen, alargando el tiempo inspiratorio e incrementando el PIP hasta que se entrega todo el flujo programado24.
Otras estrategias ventilatoriasVentilación proporcional asistidaEn esta modalidad la presión aplicada es autocontrolada para cada respiración espontánea. Frecuencia, tiempo y tasa de inflación del pulmón son controladas por el paciente. La presión aplicada aumenta en proporción al Vt y el flujo inspiratorio generado por el paciente, que puede ser reforzado para disminuir el trabajo respiratorio25.
Ventilación controlada por volumen minuto o mandataria minutoEn esta modalidad, se modifica la frecuencia respiratoria en relación con poco o excesivo esfuerzo respiratorio. Si el Vm cae por debajo del nivel establecido, los ciclos controlados por volumen son administrados a una frecuencia constante26.
Técnica de insuflación traqueal continuaLa inyección de un flujo de gas continuo en la parte distal del tubo endotraqueal disminuye el espacio muerto anatómico, facilita el lavado de CO2 y reduce las necesidades de presión y Vt24. Se administra a 0,5ml/min, junto con otras formas de ventilación
Aspectos prácticos de la ventilación mecánica neonatalIndicación y objetivosLos principales objetivos cuando se inicia ventilación mecánica son conseguir una oxigenación y ventilación adecuadas, con el mínimo daño pulmonar, sin repercusión hemodinámica ni otros efectos adversos y minimizando el trabajo respiratorio.
No existen unos criterios universales para la indicación de la asistencia respiratoria invasiva en el periodo neonatal. Por otra parte, el uso generalizado de la ventilación no invasiva o el tratamiento con surfactante han modificado sus indicaciones. Algunos criterios gasométricos propuestos serían5:
- -
Hipoxemia grave (PaO2<50-60mmHg con FiO2≥0,6; PaO2<60mmHg con FiO2>0,4 en prematuros de menos de 1.250g).
- -
Hipercapnia grave (PaCO2>65mmHg con pH<7,25).
- -
Apnea o dificultad respiratoria que precise reanimación tras el fracaso de la ventilación no invasiva
Por otra parte, existe una dificultad en la recomendación de los objetivos gasométricos cuando estamos empleando ventilación mecánica en el recién nacido. Puede ser seguro mantener la oxigenación en unos rangos de PaO2 de 50-60mmHg o de pulsioximetría de 88-92% en recién nacidos pretérmino y PaO2 de 50-70mmHg o SatO2 de 90-95% en recién nacidos a término5. En cuanto al valor de la PaCO2, podemos considerar seguro mantener unos valores entre 45-55mmHg. Hemos de considerar la hipercapnia permisiva (PaCO2 hasta 65 con pH>7,25) en la fase crónica de la enfermedad.
Ventilación suave o hipercapnia permisivaLa hipercapnia permisiva es una estrategia de tratamiento en pacientes que reciben ventilación asistida en la que se aceptan niveles relativamente altos de PaCO2, evitando la búsqueda agresiva de normocapnia así como ventilar con Vt altos, reduciéndose potencialmente el daño pulmonar27–30. Paralelamente puede mejorar el gasto cardíaco al reducir la MAP fijada y proteger contra la hipoperfusión y el daño hipóxico desencadenado por la hipocapnia. Sin embargo, el rango ideal o seguro para la PCO2 en esta población vulnerable todavía no ha sido establecido31. La estrategia recomendada sería reducir PIP, con ello disminuye el Vt para mantener una PaCO2 entre 45-55mmHg con pH por encima de 7,24. En cuanto a la evidencia, en la revisión realizada por Woodgate et al.32 no se encontraron pruebas de que la hipercapnia permisiva redujera la incidencia de muerte o enfermedad pulmonar crónica a las 36 semanas, la hemorragia intraventricular grado 3 o 4 o la leucomalacia periventricular. No hay evidencia suficiente para establecer una recomendación generalizada para el uso de la hipercapnia permisiva en el recién nacido.
Destete respiratorioLas decisiones relativas al destete, entendido este como el proceso de disminución progresiva del soporte respiratorio con mayor participación del esfuerzo respiratorio del paciente, se han realizado habitualmente de forma subjetiva, basadas en juicios clínicos y determinadas frecuentemente por la práctica (individual o institucional) y según preferencias33. En casos de patología leve, puede realizarse fácilmente, pero si existe patología severa, o a ella se suma prematuridad (apneas, debilidad muscular...), el destete puede resultar más dificultoso. En los últimos años, estrategias nuevas como el empleo mas generalizado de la CPAP-nasal y/o ventilación no invasiva (antes de la intubación o después de la extubación), nuevas modalidades de ventilación mecánica invasiva o el conocimiento de la mecánica pulmonar del paciente a pie de cama, están cambiando nuestra aproximación a la retirada de la ventilación mecánica invasiva34. Para iniciar el destete debemos considerar el desarrollo madurativo del pulmón, la enfermedad pulmonar de base, si existen complicaciones secundarias como infección, edema de vía aérea superior, atelectasia, ductus arterioso persistente o shock. Además es necesaria la presencia de un buen control central de la respiración así como una buena fuerza muscular e integridad de pared torácica con un adecuado estado metabólico y reserva energética. Por ello iniciaremos el destete cuando el niño esta clínicamente «estable», las necesidades de ventilación mecánica van disminuyendo y el motivo de inicio de la ventilación mecánica está solucionándose. Debe tener un intercambio de gases adecuado y además presentar un esfuerzo respiratorio espontáneo eficiente.
¿Cómo realizar el destete?- -
Para realizar la disminución del soporte respiratorio tendremos en cuenta algunos principios como reducir primero el parámetro potencialmente más dañino (volutrauma, atelectrauma, daño por oxígeno), realizar un cambio cada vez, evitando grandes cambios y valorando la repercusión clínica y/o gasométrica del mismo.
- -
Considerar los parámetros determinantes de la oxigenación (FiO2 y MAP) y de la ventilación (Vm que depende del Vt y de la FR) (tabla 2).
Tabla 2.Recomendaciones para el destete respiratorio basándonos en parámetros gasométricos
Oxigenación Ventilación Determinantes - FiO2- MAP - Vt- FR- Volumen minuto (FR x Vt) Pauta/secuencia – ↓ FiO2<0,4– Si PaO2alta y PaCO2normal:- ↓ PIP/Vt- ↓PIP/valorar Vt y PEEPPaCO2baja- ↓PIP (valorar Vt) y FRPCO2alta- ↓PEEP o Ti y/o- ↑ FR – Si PaCO2baja y PaO2alta- ↓PIP o- ↓Vt- ↓FR– Si PaCO2baja y PaO2normal- ↓FR– Si PaCO2y PaO2bajas- ↓PEEP- ↑FR Aspectos prácticos - Si FiO2>0,4: optimizar hemoglobina/hematocrito- Evitar oscilaciones bruscas en la oxigenación, realizando cambios suaves en la FiO2- Evitar MAP bajas, para mantener adecuado volumen alveolar - Intentar mantener Vm normal: 240-360ml/kg/min- Mantener Vt≥4-5ml/kg- Evitar FR<20-25rpm (en SIMV) FR: frecuencia respiratoria; MAP: presión media en la vía aérea; PIP: pico de presión inspiratoria; PEEP: presión de distensión continua al final de la espiración; SIMV: ventilación mandataria intermitente sincronizada;Vm: volumen minuto; Vt: volumen tidal.
- -
Según la estrategia respiratoria valorar cuál es el parámetro a modificar (tabla 3). De momento no hay evidencia suficiente para aconsejar una estrategia óptima de destete, pero algunos estudios sugieren menor duración de la ventilación mecánica cuando se emplea en fase de destete, ventilación sincronizada (A/C o SIMV) frente a IMV, y parece que pueda ser más eficaz emplear estrategias que apoyan todas las respiraciones espontáneas (A/C) frente al empleo de SIMV con FR<20 en relación con la extubación35. El empleo de PSV en fase de retirada del soporte respiratorio disminuye el trabajo respiratorio, pero son necesarios más estudios para una recomendación generalizada. En relación con el empleo de ventilación controlada por volumen frente a limitada por presión, se ha demostrado menor mortalidad y/o DBP, menor duración de ventilación mecánica, junto con menor número de complicaciones (neumotórax, hemorragia intraventricular), empleando estrategias con control de volumen. El empleo de volumen controlado permite disminuir el volutrauma, y la hipocapnia, además de permitir un autodestete progresivo según mejora el pulmón36. En el momento actual, varios estudios han sugerido la conveniencia de emplear Vt en torno a 5ml/kg (4-6ml/kg)37.
Tabla 3.Estrategia de destete y extubación según la modalidad ventilatoria
Modalidad Estrategia A/C - Disminuir PIP para Vt adecuado>4ml/kg- Disminuir FR rescate a 25-30- Alimentar trigger para trabajar músculo respiratorio- Extubar directamente de A/C o pasar a SIMV SIMV - Disminuir FR- Disminuir PIP para Vt adecuado>4ml/kg- Extubar cuando esté estable con SIMV 25-30rpm VG - Autodestete SIMV/PSV - Añadir PSV cuando SIMV<30rpm- Ajustar nivel de PSV para dar Vt adecuado>4ml/kg- Reducir SIMV lentamente- Extubar cuando estable con SIMV 15rpm A/C: ventilación asistida/controlada; FR: frecuencia respiratoria; PIP: pico de presión inspiratoria; PSV: ventilación con presión de soporte; SIMV: ventilación mandataria intermitente sincronizada; VG: Volumen garantizado; Vt: volumen tidal.
Los principales problemas que pueden dificultar el destete y/o extubación están relacionados con:
- -
Aumento del trabajo respiratorio por: aumento del trabajo elástico (neumonía, edema, ductus arterioso persistente, distensión abdominal, sobredistensión pulmonar), o aumento de las resistencias de la vía aérea (secreciones, obstrucción del TE, obstrucción de vía aérea alta), o aumento de la ventilación minuto (sepsis, acidosis, dolor…)
- -
Reducción de la capacidad respiratoria por frecuencia respiratoria baja del paciente (apneas, sedación, hipocapnia, alcalosis, infección del sistema nervioso central), disfunción muscular (malnutrición, alteración hidroelectrolítica, DBP) y enfermedades neuromusculares (distrofia muscular, afectación espinal, afectación diafragmática, bloqueo neuromuscular prolongado).
Ningún parámetro aislado discrimina de forma consistente el éxito o el fracaso en la extubación de un recién nacido. Se ha observado que la relación de respiraciones espontáneas/mecánicas de 1:2 tiene un valor predictivo positivo del 86% del éxito de la extubación38. Al analizar parámetros de mecánica respiratoria, aquellos niños con Vt>6ml/kg, Vm>309ml/kg/min, trabajo respiratorio<0172J/l, C>1ml/cmH2O/kg, R<176cmH2O/l/s, tienen mayor posibilidad de éxito en la extubación39. En otros estudios se ha concluido que el test de respiraciones espontáneas, CPAP nasal durante 3 min (fracaso si presentaba bradicardia durante más de 15 s o caída de la saturación<85% a pesar de aumento de FiO2 en un 15%) puede ser eficaz40. Su empleo ha permitido extubar desde FR y presiones en la vía aérea más elevada con relación a controles históricos41. De forma global, establecer la eficacia del esfuerzo respiratorio con un balance entre la capacidad respiratoria, el esfuerzo de los músculos y el trabajo respiratorio podría ser una estrategia predictiva de éxito en el destete y extubación34.
Estrategias que pueden ayudar a la extubación- 1.
El empleo de CPAP nasal al extubar, reduce la incidencia de efectos adversos tras extubación, incluyendo fracaso de la extubación y DBP42, siendo las cánulas binasales más eficaces en pretérminos menores de 28 semanas que las mononasales para reducir la necesidad de reincubación43.
- 2.
La IPPV nasal puede ser mejor que la CPAP nasal para prevenir el fracaso de la extubación o la reintubación en los más inmaduros44.
- 3.
Se ha comprobado que el empleo de metilxantinas previenen la reintubación45, siendo más eficaces en recién nacidos ocn peso<1.000 g y/o en<de 7 días de vida.
- 4.
La fisioterapia respiratoria reduce la reintubación, pero no la formación de atelectasias46. No existe evidencia para su empleo rutinario, solo bajo indicación individual.
- 5.
La dexametasona reduce la reintubación, pero sus efectos adversos no recomiendan su uso de forma rutinaria47. Dexametasona intravenosa periextubación debe restringirse a niños con riesgo de edema de la vía aérea y obstrucción como aquellos que han tenido intubaciones dificultosas, repetidas o prolongadas.
- 6.
La optimización de las medidas de confort y posturales previamente a la extubación.
- -
Obstrucción de la vía aérea: edema de glotis, estenosis subglótica.
- -
Atelectasia.
- -
No hay un consenso sobre los beneficios de la ventilación mecánica sincronizada en el seguimiento e incidencia de displasia broncopulmonar en el recién nacido. Pero basándonos en los aparentes efectos en la duración de la ventilación y las diferentes ventajas comentadas previamente, podemos concluir que el uso de la ventilación sincronizada es beneficioso (Recomendación A).
- -
La combinación de las diferentes modalidades de sincronización en el recién nacido prematuro puede disminuir el riesgo de lesión pulmonar (Recomendación A).
- -
El uso de volumen garantizado tiene efectos beneficiosos en el recién nacido prematuro (Recomendación A). Disminuyendo el riesgo de muerte y/o DBP, previene del volutrauma evitando un insuficiente Vt y mantiene más estables los gases sanguíneos. Pude minimizar los potenciales efectos adversos de la ventilación limitada por presión. No esta globalmente consensuado el Vt óptimo para los diferentes estadios de la enfermedad pulmonar o de las distintas modalidades ventilatorias.
- -
No existen estudios controlados que aporten evidencia suficiente para recomendar cómo ha de hacerse el destete, por lo que todavía la retirada de la ventilación mecánica implica mucho más arte que ciencia, pero deberá de hacerse de forma progresiva, disminuyendo primero aquellos parámetros potencialmente más perjudiciales, y las estrategias que soporten todos las respiraciones espontáneas pueden ser las formas más eficaces de destete (Recomendación A).
- -
En recién nacidos inmaduros, una vez asociadas metilxantinas (Recomendación A), sin administración previa de CPAP traqueal48 (Recomendación A), ya que esta aumenta la resistencia y el trabajo respiratorio, pasar directamente a CPAP nasal (Recomendación A) o IMV nasal (Recomendación A). Se ha comprobado que esta recomendación es eficaz para reducir el fracaso de extubación y disminuir la necesidad de oxígeno a los 28 días en recién nacidos pretérmino que han precisado ventilación mecánica. No se emplean esteroides preextubación de forma sistemática (Recomendación A).
Los autores declaran no tener ningún conflicto de intereses.
Félix Castillo Salinas. Servicio de Neonatología, Hospital Universitario Vall d’Hebrón, Barcelona, España.
Dolores Elorza Fernández. Sección de Neonatología, Hospital Universitario Donostia, San Sebastián, España.
Antonio Gutierrez Laso. Servicio de Neonatología, Hospital Universitario la Fe, Valencia, España.
Julio Moreno Hernando. Servicio de Neonatología, Hospital Universitario Sant Joan de Deu, Barcelona, España.
Manuel Gresa Muñoz. Servicio de Neonatología, Hospital Materno-Insular las Palmas, Las Palmas, España.
Marta Aguar Carrascosa. Servicio de Neonatología, Hospital Universitario la Fe, Valencia, España.
Gerardo Bustos Lozano. Servicio de Neonatología, Hospital Universitario 12 de octubre, Madrid, España.
José Ramón Fernández Lorenzo. Servicio de Neonatología, Complejo Universitario de Vigo, Vigo, España.
Jon López de Heredia Goya. Servicio de Neonatología, Hospital de Cruces, Barakaldo, España.
Enrique Salguero García. Servicio de Neonatología, Hospital Regional Carlos Haya, Málaga, España.
Xavier Miracle Echegoyen. Servicio de Neonatología, Hospital Clínic-Matenidad, Barcelona, España.
Juan Nuñez Solis. Servicio de Neonatología, Hospital Virgen de Rocio, Sevilla, España.
Maria Luisa Franco. Servicio de Neonatología, Hospital Universitario Gregorio Marañón, Madrid, España.
Jesús Pérez Rodríguez. Servicio de Neonatología, Hospital Universitario la Paz, Madrid, España.
El listado de autores se presenta en el Anexo 1.