La nutrición adecuada es uno de los objetivos primordiales en el manejo de los recién nacidos prematuros. Sin embargo, la falta de evidencia en cuanto a cuál es la mejor estrategia para alcanzar este objetivo da lugar a que exista una gran variabilidad en las prácticas de alimentación. Esta variabilidad podría estar relacionada con las diferencias que existen en la incidencia de complicaciones como la enterocolitis necrosante (ECN).
ObjetivoValorar la variabilidad en las prácticas sobre alimentación entre las unidades neonatales de la red SEN-1500.
Método Estudio transversal, mediante cuestionario, solicitando información sobre alimentación del recién nacido de muy bajo peso (RNMBP) (leche donada, momento de inicio, trófica, incrementos, fortificantes, probióticos) en el año 2013.
ResultadosContestaron 60/98 hospitales; la tasa de respuesta fue mayor en centros con más de 50RNMBP/año (30/31). El 67% tienen protocolo de alimentación, el 52% refieren variabilidad en su unidad y el 25% disponen de leche donada. Se inicia la alimentación en las primeras 48h, aunque se retrasa en las edades más bajas aun en ausencia de fallo hemodinámico. Además de la inestabilidad hemodinámica hay otras situaciones por las que se demora su inicio (ausencia de leche materna, CIR, flujo umbilical alterado, asfixia), mientras que raramente se retrasa por ausencia de meconio o por mantener un catéter umbilical. Por debajo de 25semanas la mitad comienzan directamente con incrementos progresivos en lugar de nutrición trófica. Los incrementos raramente alcanzan 30ml/kg/día. Casi todos usan fortificantes y vitaminas. El uso de probióticos es excepcional.
ConclusionesExiste gran variabilidad en la política de alimentación del RNMBP entre las unidades neonatales españolas. Aunque algunas diferencias en las prácticas de alimentación están justificadas por la falta de evidencia, hay intervenciones que sí han demostrado su eficacia, como disponer de un protocolo de alimentación (basado en pruebas) o tener acceso a leche donada; su implementación en todos los centros podría disminuir la incidencia de ECN y mejorar el estado nutricional de los RNMBP.
Proper nutrition is one of the primary objectives in the management of preterm infants. However, lack of evidence on the best strategy to achieve this objective has led to a great variability in feeding practices. This variability may be related to the differences in the incidence of complications, such as necrotising enterocolitis (NEC).
ObjectiveThe aim of this study is to assess the variability in clinical practice regarding enteral feeding in SEN-1500 Spanish network.
MethodAn observational study was conducted using a questionnaire sent out in 2013 requesting information about feeding very low birth weight (VLBW) neonates (bank milk, start time, trophic feeding, increases, fortifiers and probiotics).
ResultsResponses were received from 60 of the 98 hospitals. The response rate was higher in centres with more than 50VLBW/year (30/31). Just over two-thirds (67%) have feeding protocols, and 52% refer to variability within their unit. A milk bank is available in 25% of the units. First feeding occurs fairly evenly throughout first 48hours, although it is delayed in lower gestational ages, even when there is no haemodynamic failure. In addition to hemodynamic instability there are other situations when the start is delayed (absence of breast milk, CIR, altered umbilical flow, asphyxia), while it is rarely delayed by absence of meconium or maintain an umbilical catheter.Half of those under 25 weeks begin directly with progressive increases instead of trophic feeding. Increases rarely reach 30ml/kg/day. Almost all use fortification and vitamins. There was a significant use of probiotics at the time of the survey.
ConclusionsThere is great variability in enteral nutrition policies in VLBW in Spain. Although some differences are justified by the lack of evidence, there are other interventions that have proven to be effective, such as evidence-based protocols or access to donor milk. Implementation in all the units could reduce the incidence of NEC and improve the nutritional status.
El recién nacido (RN) prematuro nace durante un periodo crítico en el crecimiento y desarrollo del sistema nervioso. La nutrición del recién nacido de muy bajo peso (RNMBP) tiene como objetivo promover un crecimiento similar al que ocurre intraútero sin imponer estrés sobre sus inmaduras funciones metabólicas y excretoras. En la práctica lograr esto es difícil, debido a las dificultades que plantean los sistemas metabólico y digestivo aún inmaduros y a las patologías intercurrentes que presentan. El resultado es que en muchos casos ocurre un retraso en el crecimiento extrauterino que con frecuencia agrava un retraso intrauterino previo. Esta nutrición subóptima en un periodo tan importante puede tener consecuencias irreparables tanto en el crecimiento como en el desarrollo neurológico1,2.
Por ello la tendencia actual es evitar en lo posible la restricción del crecimiento extrauterino mediante una nutrición parenteral agresiva y precoz (con nutrientes cercanos a los que recibiría a través de la placenta) y una alimentación lo más temprana posible3.
Pero el mejor modo de lograrlo sigue sin estar claro; la evidencia disponible para muchos de los procedimientos que atañen a la alimentación del prematuro es pobre y explica la gran variabilidad en el modo en que se inicia y se continúa la alimentación entre los distintos países, entre hospitales del mismo país e incluso entre profesionales del mismo centro4. Esta variabilidad podría estar relacionada con las diferencias que existen en la incidencia de malnutrición posnatal o de enterocolitis necrosante (ECN). Diversos trabajos han mostrado que una protocolización adecuada de la alimentación logra reducir la incidencia de ECN y/o mejorar el nivel nutricional5,6.
En España la red SEN-1500 objetivó una restricción del crecimiento posnatal en RNMBP cuya intensidad difiere entre las distintas unidades1, así como una variabilidad en la incidencia de ECN, con centros en los que es excepcional frente a otros con una tasa elevada (mediana: 6,9%; rango intercuartil: 0,00-8,3)7.
La información sobre las prácticas de alimentación de los hospitales españoles es escasa. El objeto de este estudio es describir su variabilidad entre las distintas unidades de neonatología incluidas en la red SEN-1500.
Material y métodosEn 2013 se envió vía e-mail un cuestionario desde la secretaría de SEN-1500 al responsable de la red en cada hospital participante, relacionando cada centro con un número que de forma ciega nos facilitó el epidemiólogo. Se dejó abierta la posibilidad de que fuera él u otro miembro de su unidad quien contestara, pero refiriendo sus respuestas a la política de su unidad más que a su criterio particular. Para mejorar la tasa de respuesta fue necesario realizar una segunda petición general, y otra individualizada a los centros restantes.
Para la elaboración del cuestionario se tomó como base los ítems incluidos en el estudio de Klingenberg et al.4, que había sido capaz de evidenciar la variabilidad de prácticas sobre alimentación del prematuro a nivel internacional, y se añadieron algunos no recogidos en él. Un primer borrador fue monitorizado por los miembros de la unidad, corrigiendo la redacción de las preguntas que resultaron confusas. El cuestionario definitivo incluía 28 preguntas sobre nutrición del RN<32 semanas y/o <1.500g: 22 a alimentación, 5 a nutrición parenteral y una a describir cambios en su política nutricional en los 2años previos. Veinticinco eran preguntas cerradas de elección única, una de respuesta múltiple y dos de texto libre. Nueve de las preguntas permitían opcionalmente añadir comentarios. En 5 se estratificaba la población en 3 subgrupos de edad gestacional (EG) (entre paréntesis se añadía un peso orientativo): <25semanas (<700g); 25-27semanas (<1.000g); 28-31semanas (<1.500g).
En este trabajo se presentan los resultados referidos a las prácticas alimentarias en el año 2013 (momento de inicio, nutrición trófica [NT], volumen de incrementos, leche donada, fortificantes y probióticos).
Dado que SEN-1500 incluye hospitales de distintos niveles asistenciales, se compararon las prácticas entre aquellos con más de 50 RN<1.500g/año (unidades «grandes») y el resto mediante tablas de contingencia, usando como test de independencia el estadístico chi-cuadrado, o su equivalente no paramétrico (test exacto de Fisher) cuando alguna frecuencia fue inferior a 5. Todas las unidades grandes y 24/29 de las «pequeñas» atienden a <28semanas (<1.000g); los 5 restantes se han retirado al calcular las tasas para esas edades. Los resultados se presentan en forma de porcentajes.
Previamente a la realización de la encuesta se obtuvo autorización por la dirección de la red SEN-1500. Los datos se presentan agrupados, sin relacionarlos con centros concretos y siguiendo las leyes y normas de protección de datos en vigor (ley 41/2002 de 14 de noviembre; ley 15/1999 de 15 de diciembre); recibió la aprobación del comité de ética de investigación de Málaga.
ResultadosLa encuesta se dirigió a los 100 hospitales de la red SEN-1500. Dos fueron descartados por no disponer entonces de unidad neonatal. De los 98 restantes, respondieron 60 (61% de los encuestados), con una cobertura mayor entre las unidades grandes (30/31; 97%) que en el resto (29/67; 43%).
Respondieron hospitales de todas las comunidades autónomas excepto Baleares, Extremadura y Cantabria; el 95% eran hospitales de la red pública y el 73%, universitarios.
Disposición de protocolo escrito y variabilidadEl 67% (40/60) disponían de protocolo escrito sobre nutrición. Con independencia de ello, el 52% (31/60) manifestaron que existía variabilidad entre el personal de su unidad, y la consideraron: muy alta, 3% (2/60); alta, 5% (3/60); intermedia, 22% (13); baja, 46% (28/60), muy baja, 20% (12/60); 2 no contestaron.
Disponibilidad de leche donadaSolo el 8% (5/60) tenían banco de leche; eran 5 unidades grandes. El 17% (10/60) disponían de leche de banco externo (5 grandes y 5 pequeñas). El 75% (45/60) no tenían acceso a leche donada.
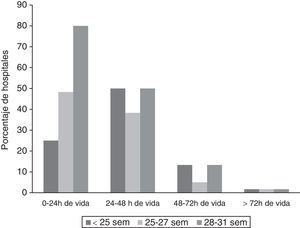
¿Cuándo empezar la nutrición enteral?La figura 1 muestra el momento en que se comienza la alimentación en RNMBP hemodinámicamente estables. «No contestaron» 5 hospitales que no atienden RN<28 semanas y uno que refiere retrasarla hasta disponer de leche materna (LM).
Nutrición trófica vs incrementos progresivos. Volumen de los incrementosSe definió NT como aquella que no superara 20-24ml/kg/día durante 4-7días. Hay centros que inician la alimentación mediante un periodo de NT seguido por otro de incrementos progresivos, y otros que lo hacen directamente en función de la tolerancia y sin periodo de NT previo.
Conforme aumenta la EG, disminuye el porcentaje de hospitales que realizan NT: 51% (29/55), 33% (19/57) y 5% (3/60) en RN<25, 25-27 y 28-31 semanas, respectivamente. Cuatro hospitales mantenían un periodo de NT de 2-3días, inferior al que definimos.
Todos aumentan 10-20ml/kg/día excepto 11 hospitales, que alcanzan 30ml/kg/día, y solo en los prematuros más grandes; esos 11 lo hacían sin NT previa.
Situaciones en donde se retrasa el inicio de la alimentaciónExisten diferencias marcadas en la importancia que se otorga a distintas indicaciones clínicas para retrasar o no la alimentación (tabla 1). Muchos hospitales comentaron tener en cuenta la combinación de varios de estos factores para tomar esa decisión.
Situaciones en donde se retrasa el inicio de la nutrición enteral
| Retraso alimentación | |
|---|---|
| Si no hay leche materna | 21 (35%) |
| Diagnóstico prenatal CIR | 22 (37%) |
| Diagnóstico flujo diastólico reverso o ausente en arteria umbilical | 26 (43%) |
| Asfixia perinatal | 53 (88%) |
| Hasta eliminación de meconio | 5 (8%) |
| Cateterización de arteria umbilical | 10 (17%) |
| Inestabilidad hemodinámica | 60 (100%) |
La tabla 2 muestra la variabilidad respecto al uso de alimentación continua vs bolo, así como del volumen y la frecuencia de estos.
Modo de administración de la nutrición enteral según edad gestacional
| Bolos | |||||||
|---|---|---|---|---|---|---|---|
| Edad gestacional | Nutrición enteral a débito continuo | Total bolos | Cada 2h (12 tomas) | Cada 3h (8 tomas) | Cada 4h (6 tomas) | Otro método | Total |
| < 25 semanas | 19 (35%) | 32 (58%) | 6 (11%) | 22 (40%) | 4 (7%) | 4 (7%) | 55 |
| 25- 27 semanas | 17 (30%) | 37 (66%) | 8 (16%) | 24 (42%) | 5 (9%) | 2 (4%) | 57 |
| 28- 31 semanas | 7 (12%) | 51 (85%) | 8 (13%) | 41 (68%) | 2 (3%) | 2 (3%) | 60 |
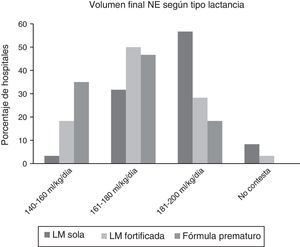
La figura 2 muestra los volúmenes finales en función del tipo de alimento. Se alcanzan mayores volúmenes con LM sola que cuando se fortifica o se usa fórmula de prematuro, pero persistiendo una estimable variabilidad en los 3 tipos de alimentación.
FortificantesSu uso es generalizado, si bien el modo de utilizarlos difiere considerablemente de unos centros a otros.
El 93% (56/60) los usan de manera habitual, el 3% (2/60), en pacientes seleccionados, y 2centros no los utilizan nunca. De los 58 que los usan, el 93% (54/58) utilizan el volumen de leche como criterio para iniciar la fortificación (35/54 al alcanzar 100-120ml/kg/día).
El 24% (14/58) suspenden el fortificante al alcanzar determinado peso, el 7% (4/58) a determinada edad, el 55% (32/58) cuando lactan al pecho, el 10% (6/58) al alta hospitalaria, y el 3% (2/58) lo mantienen al alta.
El 64% (37/58) inician la fortificación a dosis bajas, incrementándola progresivamente; el resto lo hacen directamente a dosis completas.
El 55% (32/58) preparan el fortificante a pie de cuna en cada toma; el 14% (8/58) lo hacen en la unidad guardándolo refrigerado 12-24h; el 31% (18/58) lo preparan en biberonería/dietética, la mitad de ellos en cada toma y el otro 50% refrigerándolo.
VitaminasEl 95% (58/60) añaden vitaminas a la LM fortificada: el 35% (21/60) un polivitamínico, el 38% (23/60) vitamina D y el 20% (12/60) una combinación de ambas.
Alimentación al altaDe los RNPT<1.000g que siguen con LM exclusiva en el momento del alta, en el 82% (49/60) no recomiendan fortificante salvo que el RN no tenga una ganancia ponderal adecuada, mientras que en el 15% (9/60) lo siguen manteniendo. Cuando reciben lactancia mixta o artificial, en el 72% (43/60) se recomienda mantener fórmula de prematuros; en el 15% (9/60), de inicio, y en el 10% (6/60), de bajo peso. Dos hospitales no contestaron.
ProbióticosSolo 2 hospitales usaban probióticos en el momento de la encuesta: uno de manera habitual y otro en casos determinados. Ambos usaban una combinación de Lactobacillus acidophilus y Lactobacillus biphidus.
Tamaño de las unidadesEl anexo 1 muestra el porcentaje de aplicación de cada una de las medidas descritas en función de que tuvieran más o menos de 50 ingresos de RNMBP al año.
DiscusiónEl presente estudio aporta información sobre la práctica clínica con respecto a la alimentación del RN<32semanas y/o 1.500g. A pesar de las limitaciones inherentes a los estudios mediante cuestionario, creemos que refleja de forma bastante aproximada las prácticas que se están llevando a cabo en nuestro país y pone de manifiesto una falta de homogeneidad en la aplicación de muchas de ellas.
La tasa de respuesta fue muy elevada en las unidades grandes, pero menor en las pequeñas, posiblemente porque muchas de ellas no atienden o ingresan pocos neonatos <28semanas de gestación y muchas preguntas se referían específicamente a este grupo de edad. En las que respondieron, las prácticas alimentarias analizadas se aplican de forma similar que en las unidades más grandes.
Hay prácticas de alimentación que no han demostrado una mayor eficacia que otras, por lo que la variabilidad es probablemente poco trascendente; en cambio, existen algunas medidas que tienen un cuerpo de evidencia suficiente para apoyar una recomendación determinada. Así, y si nos referimos a la reducción del riesgo de ECN, el uso de LM, la protocolización del régimen de alimentación (con recomendaciones avaladas por la evidencia) y, probablemente, el uso de determinados probióticos han demostrado ser factores protectores.
En 2013 solo el 25% de los hospitales encuestados disponían de leche donada. El uso de fórmula dobla el riesgo de ECN frente a la leche de banco8, por lo que una mayor disponibilidad de esta conduciría a una mejora en los resultados. Un reciente trabajo destaca la amplia variabilidad en el uso de LM y de banco en la alimentación del RNMBP en los hospitales españoles, así como en las medidas que favorecen la disponibilidad de leche de la propia madre9.
En los servicios de neonatología el régimen de alimentación del RNMBP debe estar estandarizado según la evidencia más reciente. Esta medida ha demostrado disminuir la incidencia de ECN5,10. En nuestra encuesta solo el 66% tenían protocolo escrito e, incluso así, el 37% admitían variabilidad a pesar de tenerlo. Ese porcentaje aumenta hasta el 75% entre los que no tienen protocolo escrito.
Mención aparte merecen los probióticos. Recientes estudios coinciden en mostrar una reducción tanto en la tasa de ECN como de mortalidad con determinadas cepas y asociaciones de probióticos11-16. En el momento en que se realizó el estudio solo 2 unidades los utilizaban, aunque creemos que habrán aumentado desde entonces. Probablemente deban recomendarse aún más en los centros con la tasa de ECN más elevada.
Hay otras prácticas en las que la evidencia no es tan clara; es el caso del momento de inicio, la indicación de NT y su duración, o el volumen durante la fase de incrementos. Si bien existen ensayos y metaanálisis sobre estos puntos17,18, a menudo los casos a los que nos enfrentamos no están recogidos en los criterios de inclusión de los mismos; generalmente incluían pocos niños de extremado bajo peso o excluían expresamente los que presentaban retraso de crecimiento, alteración en el dópler, problemas hemodinámicos o hipoxia. Hay estudios que advierten que la velocidad con la que se había introducido la alimentación era mayor en los casos que presentaron ECN19. Asimismo, estudios observacionales muestran las mejores tasas de ECN utilizando protocolos de alimentación extremadamente lentos20,21, lo cual podría conducirnos a extender esta política a neonatos que en realidad tendrían poco riesgo de ECN.
En ocasiones el problema radica en que se apliquen pruebas de determinados estudios en poblaciones que expresamente fueron excluidas de ellos22. En este sentido es conveniente señalar que el momento de iniciar la alimentación no parece influir en el riesgo de ECN y que la NT es tan segura como el ayuno, pero siempre y cuando el paciente esté hemodinámicamente estable; o que los incrementos de 30ml/kg/día parecen ser tan seguros como los de 20ml/kg/día, pero solo se ha demostrado en niños >1.000g y después de un periodo de una semana de NT23,24. Es posible que una mirada atenta a las recientes guías de práctica clínica ayuden a limitar una aplicación errónea de la literatura y a homogeneizar algunas de estas prácticas23-30.
En nuestro estudio encontramos una actitud más prudente respecto a la introducción de la alimentación en los prematuros más pequeños, de forma acorde a su mayor riesgo de ECN. En la mayoría de centros españoles la alimentación se inicia pronto, en primer o segundo día de vida. Esta actitud es consecuente con el cuerpo de evidencia actual, que aconseja evitar el ayuno prolongado en todos los RNMBP hemodinámicamente estables e iniciar la alimentación con aportes tróficos que ayudarán a la maduración intestinal31,32.
Sí encontramos diferencias en la fase de incrementos posteriores: incluso en los RN más inmaduros, la mitad de los hospitales encuestados proceden a incrementar la alimentación desde el primer día, mientras que la otra mitad mantiene un periodo de NT. El porcentaje de centros en los que se incrementan los aportes desde el inicio aumenta en edades más altas. La evidencia en este punto también es pobre: aunque hay estudios que muestran que retrasar los incrementos no aumentaría el riesgo de ECN18, hay otros que sugieren lo contrario33.
Respecto al volumen de los incrementos, son pocos los que alcanzan los 30ml/kg/día, aun en los de más EG. Ninguno utiliza volúmenes tan altos en los de edades inferiores a 28semanas, lo cual parece adecuado habida cuenta de que actualmente no existe evidencia suficiente para recomendar incrementos ≥30ml/kg/día en <1.000g18.
Con respecto a los factores que retrasan el inicio de la nutrición enteral, existe también mucha variabilidad. Un amplio ensayo muestra que en prematuros <35semanas con retraso de crecimiento intrauterino (CIR) y dóppler umbilical patológico, sin fármacos vasoactivos, iniciar la enteral en el segundo día vs el sexto no modifica el riesgo de ECN y acorta el tiempo hasta alcanzar la enteral completa34. La falta de LM fresca o donada también justifica para algunos centros retrasar la alimentación, pero no debería serlo la existencia de catéter umbilical35.
Respecto al modo de administrar la leche, los hospitales españoles utilizan tanto bolos como alimentación a débito continuo. Aunque ambos métodos pueden conllevar beneficios y riesgos teóricos, no hay evidencia suficiente para recomendar uno u otro modelo36,37.
Con respecto al uso de fortificantes y vitaminas, la uniformidad es mayor: la mayoría de hospitales los añaden a la LM; esta política es acorde a la evidencia actual de que la fortificación durante el periodo hospitalario asocia un mejor crecimiento sin incrementar el riesgo de ECN38. Los fortificantes son introducidos cuando se alcanza un volumen de 100-120ml/kg/día y se retiran habitualmente al alcanzar LM exclusiva al pecho si la curva de crecimiento es buena. En cambio, existe más variabilidad respecto al modo de prepararlos; el fortificante se modifica en la leche con el paso de las horas, lo que justifica añadirlo en el momento de la toma. El 28% conservaban la preparación refrigerada durante 12-24h.
Con relación a la alimentación recomendada en el momento del alta, encontramos que en los niños que recibían lactancia artificial o mixta la mayoría de los centros mantienen temporalmente una fórmula de prematuros, mientras que porcentajes inferiores usan fórmula de inicio estándar o de bajo peso. Las pruebas actualmente disponibles son poco consistentes como para optar por una u otra actitud; probablemente los volúmenes de leche que toman los lactantes con fórmula estándar serán mayores, compensando así su menor concentración de nutrientes. Un reciente metaanálisis indica que las fórmulas de bajo peso podrían incrementar la tasa de crecimiento hasta los 18meses cuando se comparan con la fórmula estándar, pero que no existe evidencia para hacer una recomendación firme a este respecto39.
Respecto a los niños que son dados de alta recibiendo lactancia materna exclusiva, la mayor parte de centros no recomiendan mantener la fortificación y la reservan solo para los casos en los que no se obtiene una ganancia ponderal adecuada. Actualmente no existe evidencia que apoye la fortificación de forma sistemática después del alta40.
Limitaciones del estudioComo otros estudios basados en cuestionarios, la información obtenida podría no coincidir plenamente con las prácticas reales. El grupo de estudio incluye únicamente centros pertenecientes a SEN-1500; no obstante, creemos que la amplia cobertura de los centros que aportan más pacientes a esta red confiere una buena representatividad a nivel nacional para este tipo de unidades; la menor respuesta de centros más pequeños o la posibilidad de que estos estén menos representados posibilita que algunas medidas pudieran ser distintas en centros de menor nivel asistencial. La información recogida se corresponde con las prácticas en el año 2013, por lo que es posible que algunas se hayan modificado desde entonces.
ConclusionesExiste una gran variabilidad en la política de alimentación de los niños de menos de 1.500g en las unidades neonatales españolas. En algunas prácticas la variabilidad se puede justificar por falta de evidencia; sin embargo en otras, como el uso de leche donada o disponer de protocolos basados en pruebas, la variabilidad en la práctica no está justificada porque su uso ha mostrado una reducción en la frecuencia de ECN.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la colaboración en el estudio de los siguientes hospitales: Complejo Hospitalario Universitario de Albacete, Hospital General Universitario de Alicante, Hospital Torrecárdenas (Almería), Hospital de Cruces (Baracaldo), Hospital de la Santa Creu i Sant Pau (Barcelona), Hospital Universitario Vall d’Hebron (Barcelona), Hospital Clínico (Barcelona), Instituto Universitario Dexeus (Barcelona), SCIAS Hospital de Barcelona (Barcelona), Hospital de Basurto (Bilbao), Hospital Infanta Margarita (Cabra), Hospital Universitario Puerta del Mar (Cádiz), Hospital Universitario Santa Lucía (Cartagena), Hospital General de Castellón, Complejo Hospitalario de Ciudad Real, Complejo Hospitalario Reina Sofía (Córdoba), Hospital General Universitario de Elche, Hospital Sant Joan de Déu (Esplugues de Llobregat), Hospital de Fuenlabrada, Hospital Universitario de Getafe, Hospital de Cabueñes (Gijón), Hospital Dr. Josep Trueta (Girona), Hospital Virgen de las Nieves (Granada), Hospital General de Granollers, Hospital Juan Ramón Jiménez (Huelva), Complejo Hospitalario Ciudad de Jaén, Hospital General de Jerez (Jerez de la Frontera), Hospital Juan Canalejo (La Coruña), Hospital Materno-Insular (Las Palmas), Hospital Severo Ochoa (Leganés), Hospital General de la Rioja (Logroño),Complejo Hospitalario de León, Hospital Universitario 12 de Octubre (Madrid), Hospital Universitario La Paz (Madrid), Hospital Universitario San Carlos (Madrid), Hospital Universitario Puerta del Hierro (Majadahonda),Complejo Hospitalario Carlos Haya (Málaga), Hospital Parque San Antonio (Málaga), Hospital Costa del Sol (Marbella), Hospital Universitario Virgen de la Arrixaca (Murcia), Hospital Central de Asturias (Oviedo), Hospital Virgen del Camino (Pamplona), Hospital del Bierzo (Ponferrada), Complejo Hospitalario de Pontevedra, Hospital Clínico Universitario de Salamanca, Hospital Donostia (San Sebastián), Complejo Hospitalario de Santiago (Santiago de Compostela), Hospital Virgen del Rocío (Sevilla), Hospital Nuestra Señora de Valme (Sevilla), Hospital Virgen Macarena (Sevilla), Hospital Universitario JuanXXIII (Tarragona), Hospital Universitario Nuestra Señora de Candelaria (Tenerife), Hospital Virgen de la Salud (Toledo), Hospital Clínico Universitario (Valencia), Hospital Universitario La Fe (Valencia), Hospital del Río Hortega (Valladolid), Complejo Hospitalario Xeral-Cies (Vigo), Hospital Txagorritxu (Vitoria), Hospital Clínico Universitario Lozano Blesa (Zaragoza), Hospital Miguel Servet (Zaragoza), Complejo asistencial de Zamora.