La proteína S100β se ha propuesto como posible biomarcador en patología neurológica, tanto crónica como aguda. Los valores normales de esta proteína están bien definidos en adultos, no así en niños, en los que los valores séricos parecen variar con la edad. Nuestro objetivo es describir valores de referencia de S100β sérica en niños de 0 a 14 años.
Material y métodosEstudio prospectivo en 257 niños sanos. Se establecieron 3 grupos por edad (menores de 12 meses, de 12 a 24 meses y mayores de 24 meses).
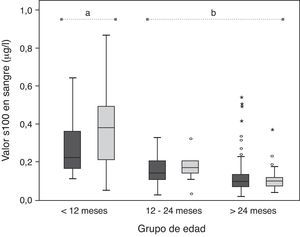
ResultadosSe incluyó a 179 niños y 78 niñas. La edad media ± DE fue de 5,5 ± 3,75 años. La concentración sérica media de la proteína S100β en todo el grupo fue 0,156 (0,140-0,172) μg/l. En los menores de 12 meses, la concentración sérica de S100β fue de 0,350 (0,280-0,421) μg/l; 0,165 (0,139-0,190) μg/l en el grupo entre 12 y 24 meses y 0,121 (0,109-0,133) μg/l en el grupo de niños mayores de 24 meses. Se observó una relación inversa entre la edad y la concentración sérica de S100β, que desciende conforme se incrementa la edad. No se observaron diferencias en cuanto al sexo.
ConclusionesLa concentración de S100β permanece estable a partir de los 2 años de edad, siendo posible establecer unos valores de referencia de S100β para mayores de 2 años. En los 2 primeros años de vida, la concentración de S100β sérica es más elevada cuanto menor es la edad del niño. No se observan diferencias en el valor de S100β sérica entre ambos sexos.
S100β protein has been proposed as a potential biomarker for both chronic and acute neurological disorders. Reference values of this protein are well defined in adults but not in children, in whom serum levels appear to vary with age. Reference values for serum S100β in children from 0 to 14 years are presented.
Materials and methodsA prospective study was conducted on 257 healthy children, who were divided into three age groups (under 12 months, 12 to 24 months and over 24 months).
ResultsThe study included179 boys and 78 girls, with a mean age of 5.5 (3.75) years. The mean serum concentration of protein S100β was 0.156 (0.140-0.172) μg/l. In children under 12 months, serum S100β concentration was 0.350 (0.280-0.421) μg/l; 0.165 (0.139-0.190) μg/l in the group between 12 and 24 months and 0.121 (0.109-0.133) μg/l in children older than 24 months. An inverse relationship was observed between age and serum S100β, which declines as age increases. No differences were observed between sexes.
ConclusionsThe concentration of S100β remains stable after two years of age, being possible to establish a baseline of S100β for over two years. During the first two years of life, S100β serum concentration is higher, the lower the age of the child. No differences in serum S100β levels between sexes are observed.
El empleo de biomarcadores se ha mostrado útil en el manejo de distintas patologías. Los datos en población pediátrica suelen ser escasos debido a las limitaciones en la realización de estudios de investigación. Por ello, el comportamiento de los distintos biomarcadores, estudiados inicialmente en adultos, suele extrapolarse a los niños, como ha ocurrido con la proteína S100β. Esta proteína, localizada fundamentalmente en la astroglía y en las células de Schwann1, es secretada por los astrocitos como una citocina con efecto neurotrófico y gliotrófico2-4. En condiciones normales, se detecta en concentraciones mínimas en sangre periférica. Su vida media es de 25 min-2 h5-8. Es una proteína de interés en patología neurológica aguda, como el traumatismo craneal o la encefalopatía hipóxico-isquémica neonatal. En el manejo del traumatismo craneal se han propuesto estrategias diagnósticas alternativas a la tomografía craneal basada en biomarcadores9,10.
En adultos sanos se han descrito valores de S100β sérica entre 0,02-0,05μg/dl11-14. Estos valores no resultan aplicables a niños, ya que los niveles séricos de S100β parecen variar con la edad1,3,15, siendo más elevados en los primeros 3 años de vida16. Además, las concentraciones séricas de S100β varían según el método de determinación utilizado17. Todos estos aspectos dificultan el establecimiento de unos valores de referencia en niños que, sin embargo, son imprescindibles para poder utilizar esta proteína en diferentes supuestos diagnósticos y pronósticos.
Por ello, el objetivo del presente estudio es determinar las concentraciones séricas de S100β en niños sanos desde el nacimiento hasta los 14 años de edad en nuestro medio (Hospital Universitario Central de Asturias).
Pacientes y métodosSe realizó un estudio descriptivo, de carácter prospectivo y aprobado por el Comité Ético de Investigación Clínica Regional, en el Hospital Universitario Central de Asturias (HUCA), entre junio del 2008 y mayo del 2010. Se obtuvo un consentimiento informado firmado por los padres o tutores de todos los niños incluidos en el estudio.
Se recogieron muestras de sangre en niños sanos de 0 a 14 años dentro del estudio preoperatorio para intervenciones menores. Junto a estas muestras, se incluyeron muestras de sangre de niños atendidos en Urgencias de Pediatría, a los que se extrajo sangre por distintos procesos. Fueron excluidas del estudio aquellas muestras procedentes de niños con patologías que pueden elevar la concentración sérica de S100β, tales como la afectación aguda o crónica del sistema nervioso central (SNC), fracturas óseas, síndrome de Down, insuficiencia renal, retraso del desarrollo y las muestras de los niños que habían tenido una crisis febril en la semana previa a la extracción de la sangre.
Se establecieron 3 grupos de edad: menores de 12 meses, entre 12 y 24 meses y mayores de 24 meses.
Todas las muestras fueron recogidas en tubos sin anticoagulante y enviadas al Servicio de Bioquímica Clínica (Laboratorio de Medicina) del HUCA. Se centrifugaron a 3000rpm durante 10 min (Labofuge 400R; Heraeus, Boadilla, España). A continuación, se separó el suero y se congeló a –80°C hasta su análisis. La cuantificación de la proteína S100β se realizó en muestras de suero mediante tecnología de quimioluminiscencia en un analizador Cobas e-601 (Roche Diagnostics, Mannheim, Alemania), que utiliza una técnica sándwich compuesta por 2 incubaciones y con un tiempo total de 18 min. Cada determinación se realizó 2 veces, según la recomendación del fabricante, siendo el límite inferior de detección de 0,005μg/l y el coeficiente de variabilidad de la técnica<2%.
Análisis de datosEl análisis estadístico se realizó utilizando el programa SPSS versión 18 (SPSS Inc, Chicago, EE. UU.). Los datos se expresan en medias ± desviación estándar (DE), medianas y el intervalo de confianza (IC) del 95%. Se determinó la normalidad de los datos en base al análisis de los gráficos Q-Q. Por ello, las diferencias entre grupos se analizaron mediante el estadístico t de Student en el caso de comparaciones entre 2 grupos, así como a través del análisis de varianza multifactorial (Anova factorial), y posterior análisis post hoc HSD Tukey, para aquellas comparaciones con más de 2 grupos. Se consideró significativa una probabilidad inferior a 0,05.
ResultadosSe incluyó en el estudio a 257 pacientes, de los cuales 179 fueron niños (69,7%) y 78 niñas (30,4%). Más de la mitad de las muestras (67,3%) procedían de estudios preoperatorios.
La edad media ± DE de los niños fue de 5,5 ± 3,75 años, siendo la mediana de 4,76 años. En las niñas, la edad media fue de 4,61 ± 4,19 años y la mediana de 3,40 años. No se observaron diferencias estadísticamente significativas en la edad entre niños y niñas (t de Student, p=0,096). El 26,8% de los niños eran menores de 2 años.
La concentración sérica media de la proteína S100β en el conjunto del grupo fue de 0,156 (0,140-0,172) μg/l. Por grupos de edad, fue 0,350 (0,280-0,421) μg/l en los niños menores de 12 meses; 0,165 (0,139-0,190) μg/l en el grupo entre 12 y 24 meses y 0,121 (0,109-0,133) μg/l en el grupo de niños mayores de 24 meses.
Teniendo en cuenta el sexo de los pacientes, la concentración fue significativamente superior en las niñas (0,191 [0,153-0,230] μg/l) que en los niños (0,141 [0,126-1,156] μg/l) (t de Student, p=0,018). Al analizar por grupos de edad, las diferencias entre ambos sexos no fueron significativas (p=0,137, p=0,690 y p=0,129, respectivamente).
En el análisis de variancia multifactorial los grupos definidos por el factor edad presentaron unas concentraciones medias en sangre de proteína S100β significativamente diferentes (p<0,001), mientras que las concentraciones medias de la proteína de los grupos establecidos por el factor sexo no difieren (p=0,141). El efecto de la interacción entre ambos factores fue significativo (p=0,017), lo cual indica que las diferencias en la concentración de la proteína observadas entre los distintos grupos de edad no son las mismas en ambos sexos. En mujeres los valores séricos de S100β parecen más elevadas que en varones (aunque las diferencias no fueron estadísticamente significativas) sobre todo en el grupo de menor edad. En relación con las diferencias observadas entre los grupos de edad, el análisis post hoc mostró que la concentración de la proteína fue significativamente más elevada en el grupo de individuos menores de 12 meses que en los otros 2 grupos (fig. 1).
Concentraciones de la proteína S100β sérica en función de la edad. Los resultados se muestran también desglosados por sexos (gris oscuro para varones y gris claro para mujeres). Los grupos de edad entre los que se observan diferencias significativas vienen representados por las letras «a» (< 12 meses) y «b» (12-24 meses y > 24 meses).
Los percentiles e IC del 95% fueron calculados para estos 3 grupos (tabla 1). En el grupo de menores de un año y en el grupo entre 1 y 2 años no fue posible calcular el IC del 95% para todos los percentiles por el tamaño de la muestra.
Concentraciones de S100β sérica en los 3 grupos de edad considerados en el estudio, expresadas como media e intervalo de confianza (IC) del 95%
| Percentil | Concentración de proteína S100β μg/l (IC del 95%) | ||
|---|---|---|---|
| Menores de 12 meses (n=33) | 12-24 meses (n=36) | Mayores de 24 meses (n=188) | |
| 2,5 | 0,076 | 0,030 | 0,043 (0,027-0,048) |
| 5 | 0,119 | 0,043 | 0,048 (0,041-0,051) |
| 10 | 0,145 | 0,066 (0,025-0,111) | 0,053 (0,049-0,060) |
| 25 | 0,187 (0,148-0,244) | 0,113 (0,087-0,138) | 0,071 (0,064-0,078) |
| 50 | 0,296 (0,209-0,428) | 0,168 (0,127-0,193) | 0,100 (0,093-0,107) |
| 75 | 0,483 (0,383-0,630) | 0,209 (0,175-0,244) | 0,135 (0,125-0,148) |
| 90 | 0,645 | 0,276 | 0,206 (0,178-0,236) |
| 95 | 0,734 | 0,328 | 0,246 (0,228-0,456) |
| 97,5 | 0,830 | 0,331 | 0,410 (0,249-0,520) |
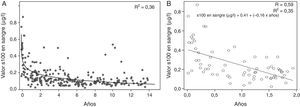
En el análisis de regresión se observó una relación inversa entre la edad y la concentración sérica de proteína, que desciende conforme se incrementa la edad, siendo este descenso más acusado en los primeros años de vida. El análisis específico de la concentración de la proteína en pacientes de hasta 2 años muestra una relación lineal entre la concentración y la edad, siendo el modelo obtenido significativo (Anova, p<0,001) (fig. 2).
A) Análisis de regresión: estimación curvilínea logarítmica realizada para el conjunto de todos los datos. Se muestra en la figura el ajuste del modelo (R2). B) Análisis de regresión lineal realizado para los datos procedentes de los pacientes de hasta 2 años. Se muestra en la figura el ajuste del modelo (R2 y R) y la ecuación de regresión lineal.
En los últimos años, existe un interés creciente por el uso de biomarcadores en distintas patologías y procesos biológicos siendo necesario que su determinación sea fácil, rápida y económica, así como conocer los valores normales de dichas proteínas en la población de estudio y su comportamiento en la patología en la que se quiere aplicar. En relación con la patología del SNC no disponemos aún de biomarcadores con una adecuada sensibilidad y especificidad. La proteína S100β puede tener un valor potencial en Pediatría para ser utilizada como biomarcador en diferentes fluidos biológicos como sangre periférica, de cordón umbilical, orina, líquido cefalorraquídeo, etc.
La investigación clínica con niños encuentra a menudo dificultades desde el punto de vista ético y legal, limitando el número de pacientes incluidos en los estudios. Esto conlleva que, de forma frecuente, se extrapolen los valores de adultos a los pacientes pediátricos. Sin embargo, la influencia de la edad, que conlleva un distinto desarrollo y maduración de los diferentes órganos y sistemas, asociada a periodos de gran crecimiento y a diferencias en el metabolismo hepático y renal, hace que no siempre sea posible esta extrapolación.
Este estudio, según nuestro conocimiento, es el primero realizado en España sobre concentraciones de S100β en pacientes pediátricos sanos, de ahí el gran interés de disponer de datos propios sobre el comportamiento de esta proteína en nuestro medio y con nuestro método de determinación (quimioluminiscencia).
Se utilizaron fundamentalmente muestras procedentes de estudios preoperatorios para intervenciones menores incluyéndose además muestras procedentes de niños con otros procesos (el grupo más numeroso pertenecía a niños con fiebre sin foco) y se observó que esta circunstancia no influía en los niveles de S100β séricos ni tampoco la presencia de bilirrubina en sangre, corroborando así lo descrito por Kleindienst et al. en adultos18.
Los primeros estudios con pacientes pediátricos no describían la posible influencia de la edad, pero se observó que las concentraciones eran más elevadas que en adultos. El estudio de Gazzolo et al. fue el primero en mostrar datos de pacientes pediátricos según la edad2. Así, en neonatos sanos los niveles descritos de S100β sérica son más elevados, disminuyendo posteriormente con la edad3,19. También se observan concentraciones de S100β más elevadas en neonatos de menor edad gestacional en otros fluidos biológicos20,21. La variación de la concentración sérica de esta proteína entre los primeros meses de la vida y las edades posteriores podría deberse a diferencias en la permeabilidad de la barrera hematoencefálica y la circulación cerebral, así como al papel funcional de la proteína, describiéndose una disminución progresiva de la concentración de S100β sérica. Este descenso podría reflejar una menor liberación de este factor trófico en una etapa más avanzada de maduración cerebral. Se describe además un posible incremento de la proteína S100β sérica desde los 7 años en adelante, en posible relación con el crecimiento en altura y con mayor elongación nerviosa2,15, hecho no observado en nuestra muestra. Esta hipótesis está basada en la presencia de S100β en los nervios periféricos y su acción estimulante del crecimiento de las dendritas2.
En estudios previos sobre concentraciones séricas de S100β en niños, se observa una escasez de datos sobre los primeros años de vida, siendo frecuente que el grupo de niños de menor edad sea el menos representado3 o bien no se describa el número de niños incluido en cada subgrupo de edad1, con la excepción del estudio realizado por Bouvier16. Posiblemente, esto sea debido a la dificultad de obtener muestras en este subgrupo de edad. Por ello, consideramos que este estudio con 69 niños en este rango de edad, proporciona datos muy interesantes para conocer el comportamiento de la proteína S100β en este grupo etario.
Observamos además la existencia de una relación inversa entre la concentración de S100β sérica y la edad, descrita previamente2, de forma que las concentraciones de S100β sérica son significativamente más elevadas en los 2 primeros años de vida, disminuyendo fundamentalmente a partir del año de vida hasta alcanzar un valor medio estable en todos los tramos de edad posteriores.
Se han propuesto distintas agrupaciones por edad y en los últimos años se han descrito valores de referencia de S100β sérica en niños mayores y menores de 3 años con valores medios de S100β similares al encontrado en nuestra muestra9,16,22. Las diferencias observadas entre los distintos trabajos que utilizan un método de determinación electroquimioluminiscente probablemente son debidas a la distinta distribución por edad de los niños incluidos. Según nuestros datos, la concentración sérica de S100β parece estable a partir de los 2 años de edad, con valores similares a los descritos en adultos9,22,23 de forma que podrían describirse unos valores de referencia para todos los niños mayores de 2 años de edad, siendo la concentración media de S100β sérica en este grupo 0,120μg/l (0,083) con un P50 de 0,100μg/l. En menores de 3 años, en una muestra de 186 niños, Bouvier propone agrupar los valores de referencia en subgrupos de edad (0-3 meses, 4-9 meses, 10-24 meses, 25-36 meses) sin encontrar diferencias significativas entre los distintos grupos16. Aunque es posible, efectivamente, que existan diferencias en la concentración sérica de S100β en los primeros meses de vida, estas agrupaciones nos parecen poco prácticas. En nuestra muestra identificamos 2 subgrupos de edad entre los menores de 2 años, con diferencias significativas entre ellos (p<0,001). Proponemos por ello valores de referencia para niños menores de un año, para niños entre 1 y 2 años y valores de referencia en niños mayores de 2 años. Como uno de los posibles usos clínicos de la proteína S100β sería su empleo en el manejo de niños con traumatismo craneal, esta agrupación por edad coincidiría con la propuesta para el manejo de esta patología24,25.
Gazzolo et al. describieron concentraciones de S100β más elevadas en mujeres21, atribuyéndolo al diferente patrón de maduración cerebral en ambos sexos, tanto en la vida intrauterina como en la edad adulta2 sin poder descartar además la posible interacción de las hormonas sexuales con S100β. Sin embargo, estudios posteriores no observaron estas diferencias en niños sanos3,26. En nuestra muestra, al comparar el valor de S100β entre varones y mujeres por grupos de edad (para evitar el sesgo que podría suponer la distinta distribución por edad), no se observan diferencias significativas en la concentración sérica de esta proteína. Sin embargo, en el grupo de menor edad, el valor de S100β sérica parece más elevado en mujeres.
Nos parece importante resaltar que los valores de referencia de S100β sérica descritos en este estudio son los primeros realizados en la población pediátrica española.
Limitaciones del estudio- 1.
Se trata de un estudio no multicéntrico, con lo cual los datos podrían no ser extrapolables a otras poblaciones pediátricas.
- 2.
El número de niños menores de 2 años es pequeño.
En una muestra de niños sanos en los que se analizaron los valores de S100β sérica se observó que:
- 1.
La concentración de S100β permanece estable a partir de los 2 años de edad, siendo posible establecer unos valores de referencia de S100β para mayores de 2 años.
- 2.
En los 2 primeros años de vida, la concentración de S100β sérica es más elevada cuanto menor es la edad del niño.
- 3.
No se observan diferencias en el valor de S100β sérica entre ambos sexos.
XI Convocatoria de ayudas a la Investigación Clínica y Epidemiología en Pediatría de la Fundación Ernesto Sánchez-Villares (2008). Presupuesto concedido: 2.500 euros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Fundación Ernesto Sánchez Villares, por la concesión de una beca dotada con 2.500 euros en la XI Convocatoria de Ayudas a la Investigación Clínica y Epidemiológica en Pediatría (2008) para el trabajo titulado: «Utilidad de la proteína S-100 beta en el estudio de los traumatismos craneoencefálicos leves en una población pediátrica».
A Roche Diagnostics, por su colaboración desinteresada para la realización de este trabajo.