El uso de la procalcitonina (PCT) se ha generalizado en la evaluación del lactante febril en urgencias. Este trabajo pretende evaluar si la introducción de la PCT ha cambiado el manejo del lactante febril hospitalizado y el coste/efectividad de dicho marcador.
Pacientes y métodosEstudio retrospectivo comparando 2 periodos: enero-diciembre de 2009 (sin PCT) y enero-diciembre de 2011 (uso rutinario de PCT). Se incluyó a los pacientes de 7 a 90 días de vida con fiebre ingresados en un hospital universitario y con analítica realizada. Se compararon porcentajes de infección bacteriana, uso de antibióticos, estancia hospitalaria y coste analítico. Se evaluó la PCT, la proteína-C reactiva (PCR), recuento leucocitario, score de Rochester y el lab-score propuesto por Galetto-Lacour para el diagnóstico de infección bacteriana.
ResultadosSe incluyó a 109 pacientes en el periodo 1 y 111 en el periodo 2 (de los cuales en 87 se dispuso de valor de PCT). La prevalencia de infección bacteriana, uso de antibióticos, repetición de analíticas y estancia hospitalaria fue similar en los 2 periodos. El coste analítico fue significativamente superior en el segundo periodo. La sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de la PCR (punto de corte 1mg/dl) fue 70,6; 58,1; 52,6 y 75% y de la PCT (punto de corte 0,5ng/ml) 41,7; 78,4; 57,7 y 65,6%.
ConclusionesEl uso de la PCT no parece haber tenido un impacto significativo en el manejo del paciente hospitalizado.
The use of procalcitonin (PCT) in the evaluation of the febrile infant in the emergency care unit has been widespread. The aim of this study is to assess whether the introduction of PCT has changed the management of hospitalised febrile infants and the cost/effectiveness of this marker.
Materials and methodsA retrospective study was performed comparing 2 periods: January-December 2009 (without PCT) and January-December 2011 (routine use of PCT). Infants aged 7 to 90 days with fever who were admitted to a university hospital and had a blood test performed were included in the study. Bacterial infection rate, antibiotic use, hospitalisation days, and analytical costs were compared. Evaluations were made using PCT, C-reactive protein (CRP), white cell count, Rochester score, and the lab-score proposed by Galetto-Lacour for the diagnosis of bacterial infection.
ResultsA total of 109 patients were included in period 1, and 111 in period 2 (87 of which had a PCT value). The prevalence of bacterial infection, use of antibiotics, number of blood tests, and days of hospital admission was similar in both periods. The blood test cost was significantly higher in the second period. Sensitivity, specificity, positive predictive value and negative predictive value were 70.6, 58.1, 52.6 and 75%, respectively for the CRP (cut-off 1mg/dL) and 41.7; 78.4; 57.7, and 65.6% for the PCT (cut-off value 0.5ng/ml).
ConclusionsThe use of PCT does not seem to have a significant impact on the management of the hospitalised febrile infant.
La fiebre es una de las causas más comunes de consulta pediátrica. La gran mayoría de estos episodios son debidos a infecciones víricas benignas y autolimitadas que no precisan tratamiento. Sin embargo, en los lactantes, y especialmente en los menores de 3 meses, esta fiebre puede representar una infección bacteriana grave (IBG) por lo que genera un número significativo de ingresos. La evaluación del lactante febril supone un reto diagnóstico que ha conducido al desarrollo de diferentes herramientas para intentar detectar los pacientes de mayor riesgo de IBG: scores clínicos como la escala de Yale1, marcadores sanguíneos valorados de forma aislada (proteína C-reactiva [PCR], procalcitonina [PCT], interleucina-6,…) o combinada (lab-score2) así como combinaciones clínico-analíticas (criterios de Rochester3).
La PCT ofrece potenciales ventajas en el diagnóstico precoz de infección bacteriana por su vida media más corta y su elevación más rápida, y es aparentemente un marcador más específico que la PCR en niños con IBG4. La mayoría de los estudios coinciden en que niveles bajos de PCT tienen un alto valor predictivo negativo (VPN) para la exclusión de bacteriemia y en la última década se ha introducido en muchos protocolos de manejo del niño con fiebre sin foco (FSF) en urgencias. Sin embargo, la PCT tiene también falsos positivos y falsos negativos (sensibilidad [S] entre el 70 y el 91% y especificidad [E] entre 59 y 85%5–7), hecho que condiciona que las decisiones clínicas no puedan basarse únicamente en este marcador.
La utilidad de la PCT como marcador evolutivo ha sido validada en diferentes estudios en adultos y su uso para iniciar o suspender el tratamiento antibiótico en pacientes adultos parece seguro y eficaz, contribuyendo a una reducción importante del uso de antibióticos8,9. Sin embargo, hay pocos trabajos que evalúen el resultado del uso rutinario de la PCT en la práctica clínica (indicación de ingreso, repetición de pruebas analíticas, uso de antibióticos, estancia hospitalaria) y su coste en pediatría.
Este trabajo pretende evaluar si la determinación de PCT ha cambiado en nuestro centro la valoración y el manejo del lactante febril hospitalizado, así como comparar la S, E, valor predictivo positivo (VPP) y VPN de diferentes marcadores/scores en esta población. También evalúa el coste añadido de PCR y PCT sobre los scores clínico-analíticos tradicionales.
Material y métodosEstudio descriptivo retrospectivo de 2 periodos de tiempo: enero-diciembre de 2009 (periodo 1: sin PCT) y enero-diciembre de 2011 (periodo 2: uso rutinario de PCT). El protocolo de manejo del lactante menor de 3 meses con fiebre fue el mismo durante los 2 periodos con la excepción del uso rutinario de la PCT en el periodo 2: para los lactantes de 1 a 3 meses con fiebre sin foco, nuestro protocolo se basa en los criterios de Rochester; para los neonatos el protocolo incluye analítica de sangre, orina y LCR, Rx tórax si clínica respiratoria, ingreso y valoración de antibióticos según clínica y resultados; y para los pacientes con diagnósticos específicos (bronquiolitis, infección de orina [ITU], neumonía, etc.) se aplicó el protocolo correspondiente. No se añadió al protocolo ninguna recomendación sobre la valoración de la PCT.
Se incluyó a los pacientes con edades entre 7 y 90 días ingresados con fiebre (definida como temperatura axilar igual o superior a 37,5°C) en un hospital universitario. Se excluyó a aquellos pacientes en los que no se realizó analítica sanguínea. Se recogieron los siguientes datos: filiación, clínica, hemograma, PCR inicial y máxima, PCT inicial y máxima, sedimento de orina (SO)/tira reactiva de orina (TRO), score de Rochester, lab-score (PCR+PCT+TRO) calculado con analítica inicial, hemocultivo (HC), urocultivo (UC), estancia hospitalaria, uso de antibióticos y número de analíticas solicitadas. En casos seleccionados se dispuso también de cultivo de líquido cefalorraquídeo (LCR), detección de virus respiratorios por reacción en cadena de la polimerasa o antígeno VRS en aspirado nasofaríngeo y radiografía de tórax.
Para la definición de IBG se utilizaron los mismos criterios que Maniaci10, en resumen:
- •
IBG confirmada: si infección bacteriana focal en la exploración física (diferente a otitis media), bacteriemia, ITU, meningitis, neumonía bacteriana o gastroenteritis bacteriana definidas respectivamente por: HC positivo a un patógeno, UC por sondaje con más de 50.000UFC de un solo germen o entre 10.000 y 49.000 si además se acompañaba de SO patológico (>5 leucocitos por campo) o TRO patológica (nitritos o leucocitos positivos), cultivo de LCR positivo o bacteriemia con pleocitosis en LCR, cultivo positivo de líquido pleural o radiología compatible con neumonía bacteriana más cultivo de esputo o HC positivo a un patógeno respiratorio y, por último, coprocultivo positivo.
- •
IBG posible: si UC por sondaje con 10.000-49.000 UCF/ml de un solo germen con SO y TRO normal o si radiología compatible con neumonía pero sin confirmación bacteriológica en HC, cultivo de esputo o líquido pleural.
- •
No IBG: En el resto de los casos.
En el caso de UC con múltiples gérmenes se consideró como ITU confirmada si había >50.000UFC de un germen predominante, y como ITU posible si había 50.000UFC de varios gérmenes sin dominancia, independientemente del resultado del SO.
Los datos sobre costes analíticos se obtuvieron a partir del laboratorio de nuestro centro a fecha de diciembre de 2013: hemograma: 4,29 euros/determinación; PCR: 3,68 euros/determinación; PCT: 20,15 euros/determinación.
Se realizó el análisis de forma conjunta de todos los pacientes y también por subgrupos: pacientes con buen estado general, pacientes con FSF, pacientes con SO/TRO normal y pacientes menores de un mes. Se analizó la S, E, VPP y VPN de la PCT y PCR para diferentes puntos de corte (PCT ≥ 0,26; ≥0,5; ≥1; ≥2ng/ml; PCR ≥ 1; ≥2,75; ≥4; ≥10mg/dl), criterios de Rochester3, SO (punto de corte: ≥5 leucocitos/campo y ≥10 leucocitos/campo) y lab-score (punto de corte ≥ 3)2,11 para el diagnóstico de IBG. Para el cálculo del lab-score se utilizó el resultado del SO en el caso de que no se dispusiera del resultado de la TRO.
Se analizó si el uso sistemático de la determinación de PCT había influido en el mayor/menor uso de antibióticos, estancia hospitalaria y repetición de analíticas.
Se consideró antibioticoterapia adecuada aquella situación en la que se prescribió antibiótico en pacientes con diagnóstico de IBG (posible o confirmada) y la no prescripción de antibióticos en los pacientes no IBG.
Se recogieron los datos a partir de las historias clínicas y registros del laboratorio en una hoja de cálculo (Microsoft Office Excel 2007) y se analizaron con el paquete estadístico SPSS 15.0 para Windows. Para la comparación de variables dicotómicas se utilizó el test de chi-cuadrado y para la comparación de variables cuantitativas el test de Student o U de Mann-Whitney con niveles alfa=0,05. Se realizaron curvas ROC para la valoración del rendimiento de la PCR, PCT y leucocitosis en el diagnóstico de IBG posible o confirmada utilizando los datos obtenidos de los pacientes del periodo 2 con PCT disponible.
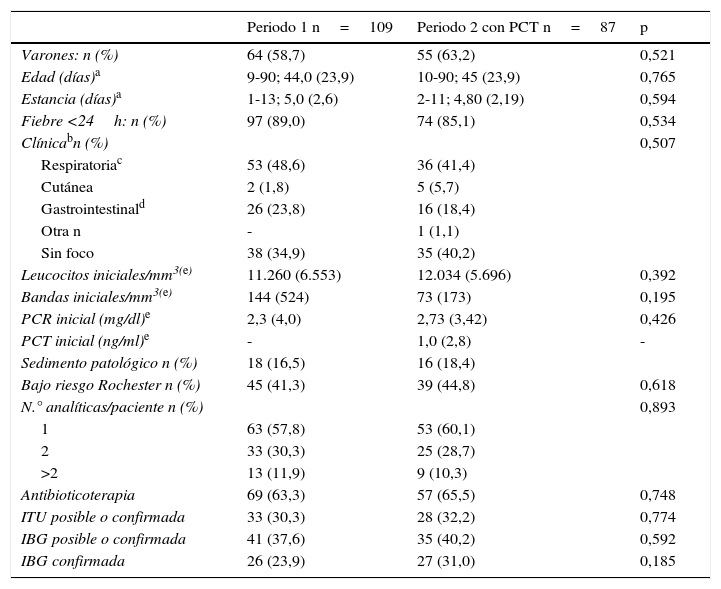
ResultadosSe incluyó a 220 pacientes: 109 en el periodo 1 y 111 en el periodo 2; en este segundo periodo solo se dispuso de resultado de PCT en 87 pacientes. De los 220 pacientes, 78 (35,4%) tenían menos de 30 días de vida y 80 (36,4%) eran pacientes con FSF. Las características demográficas, clínicas y analíticas iniciales se recogen en la tabla 1, sin diferencias estadísticamente significativas entre los 2 periodos.
Características clínicas y analíticas en los 2 periodos
| Periodo 1 n=109 | Periodo 2 con PCT n=87 | p | |
|---|---|---|---|
| Varones: n (%) | 64 (58,7) | 55 (63,2) | 0,521 |
| Edad (días)a | 9-90; 44,0 (23,9) | 10-90; 45 (23,9) | 0,765 |
| Estancia (días)a | 1-13; 5,0 (2,6) | 2-11; 4,80 (2,19) | 0,594 |
| Fiebre <24h: n (%) | 97 (89,0) | 74 (85,1) | 0,534 |
| Clínicabn (%) | 0,507 | ||
| Respiratoriac | 53 (48,6) | 36 (41,4) | |
| Cutánea | 2 (1,8) | 5 (5,7) | |
| Gastrointestinald | 26 (23,8) | 16 (18,4) | |
| Otra n | - | 1 (1,1) | |
| Sin foco | 38 (34,9) | 35 (40,2) | |
| Leucocitos iniciales/mm3(e) | 11.260 (6.553) | 12.034 (5.696) | 0,392 |
| Bandas iniciales/mm3(e) | 144 (524) | 73 (173) | 0,195 |
| PCR inicial (mg/dl)e | 2,3 (4,0) | 2,73 (3,42) | 0,426 |
| PCT inicial (ng/ml)e | - | 1,0 (2,8) | - |
| Sedimento patológico n (%) | 18 (16,5) | 16 (18,4) | |
| Bajo riesgo Rochester n (%) | 45 (41,3) | 39 (44,8) | 0,618 |
| N.° analíticas/paciente n (%) | 0,893 | ||
| 1 | 63 (57,8) | 53 (60,1) | |
| 2 | 33 (30,3) | 25 (28,7) | |
| >2 | 13 (11,9) | 9 (10,3) | |
| Antibioticoterapia | 69 (63,3) | 57 (65,5) | 0,748 |
| ITU posible o confirmada | 33 (30,3) | 28 (32,2) | 0,774 |
| IBG posible o confirmada | 41 (37,6) | 35 (40,2) | 0,592 |
| IBG confirmada | 26 (23,9) | 27 (31,0) | 0,185 |
Se diagnosticó IBG en 85 pacientes (38,6% del total de pacientes). Aunque el porcentaje de pacientes ingresados con IBG (posible o confirmada) fue discretamente mayor en el periodo en que se dispuso de PCT (37,6% en periodo 1 vs. 40,2% en el periodo 2 en pacientes con PCT realizada) la diferencia no fue significativa (p=0,59).
La prevalencia de IBG (posible o confirmada) fue similar en los pacientes con edades <1 mes y >1 mes (39,4 y 37,5% respectivamente; p=0,77) y en la mayoría de casos se trató de ITU.
Un total de 42 de los pacientes del primer periodo y 28 de los pacientes con PCT disponible del segundo periodo eran menores de un mes. La prevalencia de IBG posible o confirmada en este subgrupo de pacientes en los 2 periodos fue del 35,5 y 39,2%, respectivamente (p=0,76). Tampoco hubo diferencias estadísticamente significativas en el uso de antibióticos entre los 2 periodos (66,6 y 78,6%; p=0,28).
El número de analíticas realizadas y el porcentaje de pacientes que recibieron antibióticos fueron similares en los 2 periodos (tabla 1). Si comparamos la estancia entre los pacientes del periodo 1 y los pacientes del periodo 2 con PCT realizada (media de 2,6 y 2,2 días, respectivamente) la diferencia tampoco fue significativa (p=0,71).
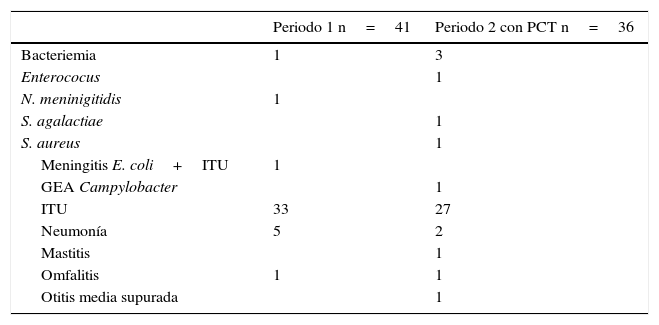
En la tabla 2 se detallan los diagnósticos de los pacientes con IBG posible o confirmada en los 2 periodos.
Diagnósticos de los pacientes con IBG posible o confirmada en los 2 periodos
| Periodo 1 n=41 | Periodo 2 con PCT n=36 | |
|---|---|---|
| Bacteriemia | 1 | 3 |
| Enterococus | 1 | |
| N. meninigitidis | 1 | |
| S. agalactiae | 1 | |
| S. aureus | 1 | |
| Meningitis E. coli+ITU | 1 | |
| GEA Campylobacter | 1 | |
| ITU | 33 | 27 |
| Neumonía | 5 | 2 |
| Mastitis | 1 | |
| Omfalitis | 1 | 1 |
| Otitis media supurada | 1 |
De los 4 pacientes con bacteriemia (1 en periodo pre-PCT y 3 en periodo 2 con PCT realizada) todos tenían fiebre de menos de 12 h de evolución. Dos presentaban leucopenia, todos tenían PCR superior a 1mg/dl (concretamente 6,9mg/dl; 1,4mg/dl; 1,5mg/dl y 8,9mg/dl) y los valores de PCT fueron 0,24ng/ml; 0,38ng/ml y 1,07ng/ml.
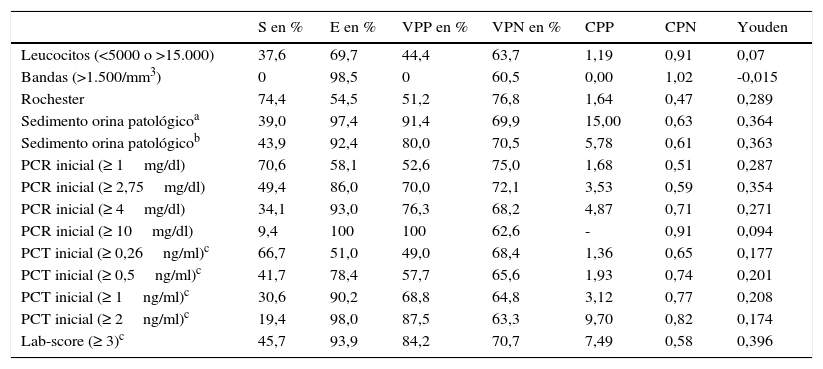
En la tabla 3 se muestran la S, E, VPP y VPN de los diferentes parámetros clínico-analíticos (con diferentes puntos de corte) para el diagnóstico de IBG posible o confirmada. El criterio más sensible fue el score de Rochester; el más específico, valores de PCR ≥ 10mg/dl (aunque >1.500 bandas/mm3, PCT ≥2ng/ml o SO patológico tuvieron especificidades muy similares). El que mostró mejor VPP fue la PCR ≥ 10mg/dl (100%) y el de mejor VPN los criterios de Rochester (76,8%). Los índices de Youden máximos fueron 0,424 para una valor de PCR de 2,35mg/dl y de 0,345 para un valor de PCT 0,351ng/ml.
Sensibilidad, especificidad, valores predictivos, coeficientes de probabilidad (CP) y índices de Youden de diferentes parámetros para IBG (posible o confirmada) en el conjunto de todos los pacientes (n=220)
| S en % | E en % | VPP en % | VPN en % | CPP | CPN | Youden | |
|---|---|---|---|---|---|---|---|
| Leucocitos (<5000 o >15.000) | 37,6 | 69,7 | 44,4 | 63,7 | 1,19 | 0,91 | 0,07 |
| Bandas (>1.500/mm3) | 0 | 98,5 | 0 | 60,5 | 0,00 | 1,02 | -0,015 |
| Rochester | 74,4 | 54,5 | 51,2 | 76,8 | 1,64 | 0,47 | 0,289 |
| Sedimento orina patológicoa | 39,0 | 97,4 | 91,4 | 69,9 | 15,00 | 0,63 | 0,364 |
| Sedimento orina patológicob | 43,9 | 92,4 | 80,0 | 70,5 | 5,78 | 0,61 | 0,363 |
| PCR inicial (≥ 1mg/dl) | 70,6 | 58,1 | 52,6 | 75,0 | 1,68 | 0,51 | 0,287 |
| PCR inicial (≥ 2,75mg/dl) | 49,4 | 86,0 | 70,0 | 72,1 | 3,53 | 0,59 | 0,354 |
| PCR inicial (≥ 4mg/dl) | 34,1 | 93,0 | 76,3 | 68,2 | 4,87 | 0,71 | 0,271 |
| PCR inicial (≥ 10mg/dl) | 9,4 | 100 | 100 | 62,6 | - | 0,91 | 0,094 |
| PCT inicial (≥ 0,26ng/ml)c | 66,7 | 51,0 | 49,0 | 68,4 | 1,36 | 0,65 | 0,177 |
| PCT inicial (≥ 0,5ng/ml)c | 41,7 | 78,4 | 57,7 | 65,6 | 1,93 | 0,74 | 0,201 |
| PCT inicial (≥ 1ng/ml)c | 30,6 | 90,2 | 68,8 | 64,8 | 3,12 | 0,77 | 0,208 |
| PCT inicial (≥ 2ng/ml)c | 19,4 | 98,0 | 87,5 | 63,3 | 9,70 | 0,82 | 0,174 |
| Lab-score (≥ 3)c | 45,7 | 93,9 | 84,2 | 70,7 | 7,49 | 0,58 | 0,396 |
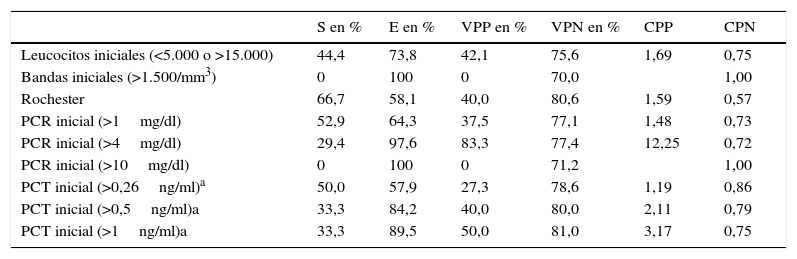
Analizando el subgrupo de pacientes que ofrece más dificultades en su manejo (FSF y SO normal) los resultados fueron similares (tabla 4). De los 24 pacientes con FSF y SO normal en los que se dispuso de PCR y PCT, utilizando los valores propuestos en el «lab score»11 como punto de corte (PCR ≥4mg/dl, PCT ≥0,5ng/ml), 2 de los 5 pacientes con IBG posible o confirmada tenían ambos marcadores negativos.
Sensibilidad, especificidad, valores predictivos y coeficientes de probabilidad (CP) en pacientes con fiebre sin foco y sedimento de orina normal (<10 leucocitos/campo) para IBG posible o confirmada (n=61)
| S en % | E en % | VPP en % | VPN en % | CPP | CPN | |
|---|---|---|---|---|---|---|
| Leucocitos iniciales (<5.000 o >15.000) | 44,4 | 73,8 | 42,1 | 75,6 | 1,69 | 0,75 |
| Bandas iniciales (>1.500/mm3) | 0 | 100 | 0 | 70,0 | 1,00 | |
| Rochester | 66,7 | 58,1 | 40,0 | 80,6 | 1,59 | 0,57 |
| PCR inicial (>1mg/dl) | 52,9 | 64,3 | 37,5 | 77,1 | 1,48 | 0,73 |
| PCR inicial (>4mg/dl) | 29,4 | 97,6 | 83,3 | 77,4 | 12,25 | 0,72 |
| PCR inicial (>10mg/dl) | 0 | 100 | 0 | 71,2 | 1,00 | |
| PCT inicial (>0,26ng/ml)a | 50,0 | 57,9 | 27,3 | 78,6 | 1,19 | 0,86 |
| PCT inicial (>0,5ng/ml)a | 33,3 | 84,2 | 40,0 | 80,0 | 2,11 | 0,79 |
| PCT inicial (>1ng/ml)a | 33,3 | 89,5 | 50,0 | 81,0 | 3,17 | 0,75 |
En el subgrupo de pacientes menores de un mes (n=28) el VPN de la PCT (punto de corte 0,5ng/ml) fue de 75%: de los 20 pacientes con PCT < 0,5ng/ml, 5 fueron diagnosticados de IBG.
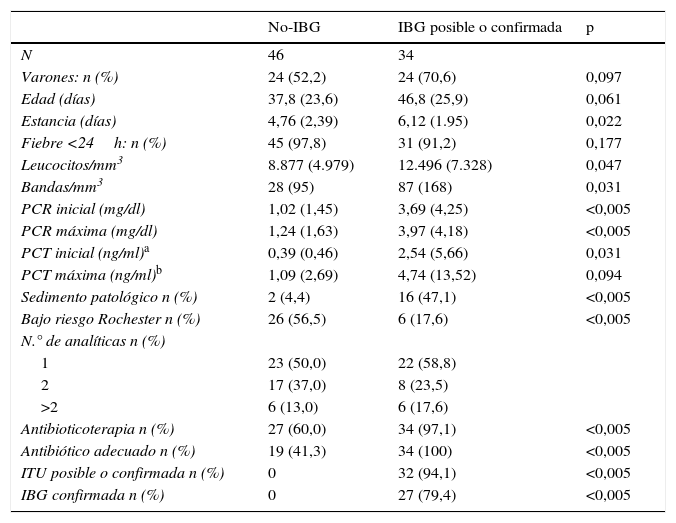
Si consideramos solo los pacientes con FSF (n=80), 35 pacientes (43,8%) tenían una IBG confirmada o posible (94% ITU). Las características clínicas y analíticas, según tuvieran IBG o no, se describen en la tabla 5. Los valores iniciales de PCR, PCT y leucocitos y el valor máximo de PCR fueron significativamente diferentes en los pacientes con IBG comparados con los no-IBG, no así el valor máximo de la PCT, que fue similar en los 2 grupos.
Características de los pacientes con fiebre sin foco clasificados según IBG (n=80)
| No-IBG | IBG posible o confirmada | p | |
|---|---|---|---|
| N | 46 | 34 | |
| Varones: n (%) | 24 (52,2) | 24 (70,6) | 0,097 |
| Edad (días) | 37,8 (23,6) | 46,8 (25,9) | 0,061 |
| Estancia (días) | 4,76 (2,39) | 6,12 (1.95) | 0,022 |
| Fiebre <24h: n (%) | 45 (97,8) | 31 (91,2) | 0,177 |
| Leucocitos/mm3 | 8.877 (4.979) | 12.496 (7.328) | 0,047 |
| Bandas/mm3 | 28 (95) | 87 (168) | 0,031 |
| PCR inicial (mg/dl) | 1,02 (1,45) | 3,69 (4,25) | <0,005 |
| PCR máxima (mg/dl) | 1,24 (1,63) | 3,97 (4,18) | <0,005 |
| PCT inicial (ng/ml)a | 0,39 (0,46) | 2,54 (5,66) | 0,031 |
| PCT máxima (ng/ml)b | 1,09 (2,69) | 4,74 (13,52) | 0,094 |
| Sedimento patológico n (%) | 2 (4,4) | 16 (47,1) | <0,005 |
| Bajo riesgo Rochester n (%) | 26 (56,5) | 6 (17,6) | <0,005 |
| N.° de analíticas n (%) | |||
| 1 | 23 (50,0) | 22 (58,8) | |
| 2 | 17 (37,0) | 8 (23,5) | |
| >2 | 6 (13,0) | 6 (17,6) | |
| Antibioticoterapia n (%) | 27 (60,0) | 34 (97,1) | <0,005 |
| Antibiótico adecuado n (%) | 19 (41,3) | 34 (100) | <0,005 |
| ITU posible o confirmada n (%) | 0 | 32 (94,1) | <0,005 |
| IBG confirmada n (%) | 0 | 27 (79,4) | <0,005 |
Valores de edad, estancia, leucocitos, bandas, PCR y PCT expresados como media (DE).
Recibieron antibioticoterapia adecuada el 72,5% de los pacientes del periodo 1 y el 73,6% de los pacientes en los que se dispuso de valor de PCT en el periodo 2, sin que la diferencia fuera estadísticamente significativa.
El coste analítico de los pacientes en el periodo 2 fue el triple que en el periodo 1 (11,1 euros/paciente de media (SD 4,95) en el periodo 1 y 38,7 euros (SD 16) en el periodo 2 con PCT, p=0,000).
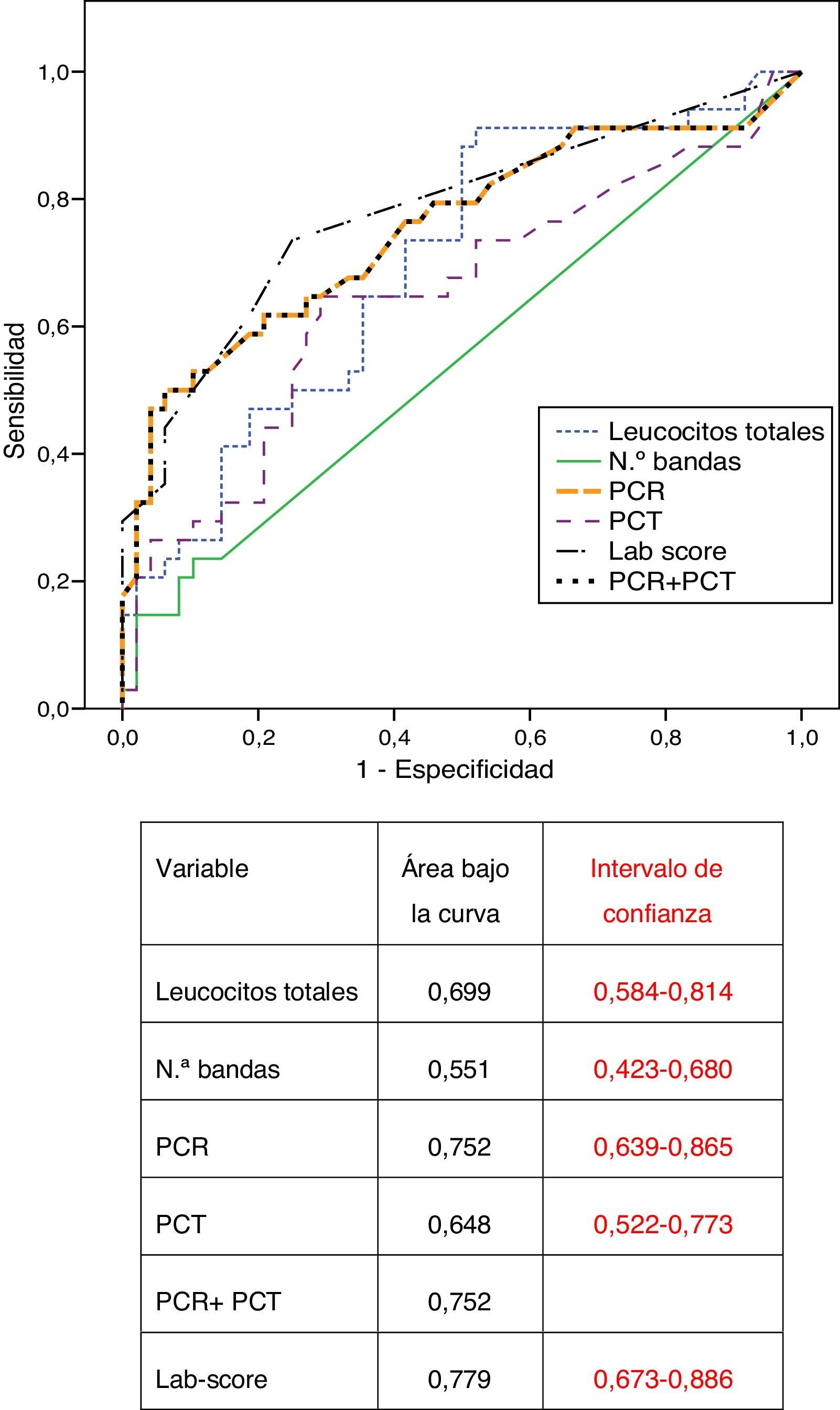
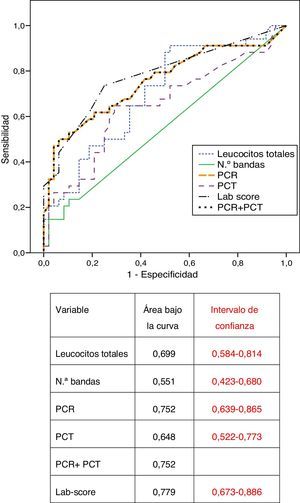
En la figura 1 se representan las curvas ROC obtenidas para la PCR, PCT, leucocitosis, bandas, PCR+PCT y lab-score. El área bajo la curva para la PCR fue superior a la de la PCT (0,752 y 0,648 respectivamente) pero esta diferencia no fue estadísticamente significativa (p=0,196). El lab-score muestra un área bajo la curva discretamente superior al uso de la PCR de forma aislada o junto con la PCT, pero tampoco alcanza significación estadística (p=0,399).
DiscusiónLa PCT se introdujo en nuestro hospital en el año 2010. Inicialmente solo se solicitaba en casos seleccionados, pero a partir de 2011 se pasó a utilizar de forma rutinaria en la evaluación del lactante febril. Los resultados de este estudio muestran que la utilización rutinaria de PCT no ha cambiado el manejo de los pacientes menores de 3 meses hospitalizados.
La mayoría de los estudios publicados en pediatría sobre PCT se han realizado en pacientes con FSF en urgencias5,6,12,13. Estos estudios apoyan la utilidad de la PCT como marcador predictivo de enfermedad bacteriana potencialmente grave (bacteriemia, sepsis, sepsis de origen urinario y neumonía grave) en este escenario.
Los valores predictivos de la PCT que obtuvimos fueron significativamente diferentes a los publicados en series que incluían pacientes menores de 36 meses tratados en urgencias7: en nuestro estudio el VPN osciló entre 63 y 81% para los diferentes puntos de corte de PCT (0,26ng/ml; 0,5ng/ml; 1ng/ml), muy lejos de los valores cercanos al 100% de otros estudios. Esta diferencia podría deberse a que nuestro trabajo incluye solo pacientes ingresados: es una población seleccionada con una prevalencia de IBG superior a la de los estudios realizados en urgencias (mayor porcentaje de pacientes con edades <1 mes, no cumplir criterios de bajo riesgo de Rochester, etc.). La prevalencia de IBG confirmada en nuestro estudio fue 31,3%, similar al 26,4% del estudio de Bressan11 pero claramente superior a la de estudios como el de Maniaci10 (9,7%).
El estudio multicéntrico de Fernández-López14 compara diferentes marcadores en 352 niños de 1-36 meses de edad con FSF en urgencias y concluye que el mejor marcador es la PCT con un punto de corte de 0,53ng/ml (S=65,5%; E= 94,3%). En nuestro estudio, un punto de corte similar (PCT 0,5ng/ml) solo obtuvo una S del 41,7%, y una E del 78,4%.
En cuanto a la PCR, observamos que con un punto de corte de 1mg/dl se alcanza una S del 70% y un VPN del 75% (superior a lo que obtuvimos con la PCT), aunque el VPP y la E fueron bajos (75 y 58,1% respectivamente). De hecho, de los 12 pacientes ingresados con FSF, SO normal y PCR<1mg/dl, solo uno tuvo una IBG (ITU), con una PCT inicial de 0,18ng/ml. De los 24 pacientes con FSF y SO normal no hubo ningún caso de IBG posible o confirmada que tuviera PCR<1mg/dl y PCT>0,5ng/ml.
Analizando el lab-socre propuesto por Galetto-Lacour et al. en 2008, hemos obtenido valores similares a los publicados por Bressan11 con S=45,7% y E=93,9% para un punto de corte de 3, por lo que tampoco este score parece ofrecer ventajas claras sobre la PCR de forma aislada.
En el metaanálisis publicado en 20105 se concluye que la principal virtud de la PCT es descartar la presencia de IBG. Por lo tanto, esperaríamos encontrar o un menor número de ingresos o un mayor porcentaje de pacientes con diagnóstico final de IBG en el periodo en el que se dispuso de PCT. El hecho de que esto no suceda en nuestro estudio podría atribuirse a un número insuficiente de pacientes para alcanzar significación estadística o a la falta de confianza en este marcador de los pediatras que indicaron el ingreso: 19 de los 87 pacientes ingresados durante el periodo 2 tenían FSF, SO normal y valores de PCT<0,5ng/ml.
En los últimos años se han publicado múltiples estudios en los que se determinan puntos de corte óptimos de la PCT para el diagnóstico de IBG, diferenciación entre enfermedad vírica y bacteriana y diferenciación entre infección bacteriana invasiva y no invasiva (pielonefritis vs. cistitis15,16). Estos puntos de corte oscilan entre 0,12ng/ml y 1ng/ml. Esta variabilidad puede contribuir en parte a la baja confianza absoluta en este marcador.
Buendía17, a través del diseño de un modelo económico de costo-efectividad estructurado, utilizando la técnica de análisis de decisiones, compara la PCT, la PCR y los criterios de Rochester para el diagnóstico de IBG en el lactante menor de 3 meses y demuestra el mayor coste que implica la PCT. En nuestro estudio objetivamos un coste analítico 3 veces superior en el periodo en el que se solicitó PCT en comparación con el primer periodo. Dado que en ambos periodos no hay diferencias en el porcentaje de pacientes ingresados con diagnóstico final de IBG y que el porcentaje de pacientes con antibiótico adecuado es similar, no parece que en nuestro caso el uso de la PCT haya supuesto tampoco un ahorro.
Nuestros hallazgos también coinciden con los resultados de otros estudios que valoran el efecto del uso de la PCT: Lacroix18 en el estudio prospectivo comparando el lab-score con los marcadores tradicionales (PCR, leucocitos y bandas) no encuentra diferencias en la prescripción de antibióticos o ingreso hospitalario.
El temor a que al ir añadiendo marcadores (sin retirar los antiguos) pueda condicionar un número superior de ingresos y tratamientos antibióticos por hallarse elevado solo uno de los parámetros (es decir, ingresar pacientes por PCT elevada exclusivamente) no se confirmó en nuestro estudio: en el periodo 1 ingresaron 13 pacientes con FSF y bajo riesgo de IBG según los criterios de Rochester y 18 en el periodo 2 (11,9 vs. 16,2%; p=0,36). El número de pacientes con FSF, bajo riesgo según criterios de Rochester y PCR inferior a 1mg/dl fue similar en ambos periodos (9 y 10 pacientes, respectivamente).
Las debilidades de nuestro estudio son su naturaleza retrospectiva, el reducido número de pacientes con FSF y el hecho de que pacientes considerados como no IBG recibieran tratamiento antibiótico, sin poder garantizar en estos casos que no tuvieran IBG.
A pesar de la menor calidad científica de los estudios retrospectivos, consideramos que el evaluar y compartir los resultados de introducir nuevas herramientas diagnósticas en la práctica habitual es imprescindible para una buena práctica clínica.
En resumen, en nuestro centro el empleo de la PCT en el manejo del lactante febril menor de 3 meses hospitalizado no resultó en una disminución del uso de antibióticos, número de analíticas ni estancia hospitalaria. Tampoco parece haber mejorado la selección de los pacientes que son ingresados (% IBG similar en el periodo en que se utilizó la PCT de forma rutinaria y en el periodo sin PCT) aunque este dato debería ser confirmado en un estudio prospectivo que asignara de forma aleatoria la realización/no realización de PCT y valorara si hay diferencias en el porcentaje de pacientes que ingresan.
Los biomarcadores nos proporcionan una información adicional a la valoración clínica, pero también pueden suponer un coste añadido significativo, no solo por el coste de la misma prueba sino porque puede inducir a realizar tratamientos o ingresos. En el caso del lactante febril hospitalizado menor de 3 meses, en el que la ITU es el principal diagnóstico de IBG, la introducción de la PCT no parece haber tenido un impacto clínico significativo en nuestro centro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.