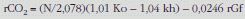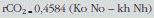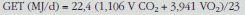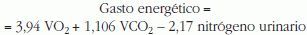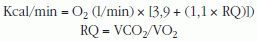Se revisa en este artículo la importancia del estudio del metabolismo energético y sus métodos de valoración en los niños. Clásicamente se han utilizado ecuaciones antropométricas para la predicción de los requerimientos energéticos, pero en muchos estados fisiológicos y patológicos existen discrepancias entre los valores estimados y los reales, por lo que deben emplearse mediciones directas del consumo energético. El método del agua doblemente marcada es el patrón oro para la medición del gasto energético total en períodos prolongados; se utiliza preferentemente en investigación. La calorimetría indirecta se considera el patrón de referencia para la determinación del gasto energético en reposo en la práctica clínica, si bien no ofrece datos del consumo energético en condiciones reales de vida y presenta limitaciones técnicas que impiden su uso en algunos pacientes críticos. Se analizan otros métodos que intentan solventar los problemas de medición, basados en datos de frecuencia cardíaca, temperatura, sensores de movimiento y métodos combinados.
The present article reviews the importance of the study of energy metabolism and its methods of assessment in children. Classically, energy requirements have been assessed by predictive equations based on anthropometric data. However, there are several physiologic and pathogenic states that may cause discrepancies between estimated and real values and consequently direct measurements of energy expenditure should be used. The gold standard to assess total energy expenditure during prolonged periods is the doubly labeled water method, which is mainly used for research studies. The best approach for resting energy expenditure determination in the clinical setting is indirect calorimetry. However, this method does not provide data on energy consumption under free-living conditions and its use in some critical care patients is restricted by technical limitations. Several other approaches to assess activity have been developed, based on heart rate, body temperature measurements, motion sensors and combined methods.
El conocimiento del metabolismo energético es necesario para diseñar estrategias nutricionales correctas1–4. Cobra especial importancia en el tratamiento de los pacientes críticamente enfermos2–6, sobre todo en niños6–15, debido a su reserva energética menor16,17. Se ha estimado una incidencia de algún grado de malnutrición proteicocalórica del 16–55,4%18,19 e incluso del 72%14 en los niños ingresados en unidades de cuidados intensivos. Algunos estudios han mostrado que, sobre todo en los primeros días de estancia en unidades de cuidados intensivos pediátricos (UCIP), el soporte nutricional no cubre los requerimientos8,11,20,21 (incluso alcanzando sólo el 20 % o menos20). Sin embargo, a medida que se alarga la estancia en la unidad tiende a excederlos8,11. La malnutrición se relaciona con una mayor morbilidad8,9,18,19 y mortalidad8,18. Por otra parte, el aporte excesivo de nutrientes, tal como se recomendaba hace años, también tiene consecuencias deletéreas, al crear un compromiso respiratorio22–24 y al alterar la funcionalidad hepática24.
Los requerimientos energéticos diarios (RED) engloban el gasto energético en reposo (GER), la actividad física, el efecto termogénico de los alimentos y el crecimiento1–3,25,26. El GER representa el consumo del metabolismo basal (MB, tasa metabólica basal)27 más el consumo de energía que supone el mantener una actividad en vigilia en situación de reposo muscular1,28,29. Algunos autores asimilan GER y MB1,30,31, aunque el GER es un 8-10 % más elevado28,29, debido a que para la medición del MB se exige un ayuno de 12h y reposo completo previo de 8h, mientras que para el GER los períodos de ayuno y reposo son más reducidos.
Aunque desde hace años existen ecuaciones diseñadas para predecir las necesidades energéticas a partir de las características antropométricas32–40, validadas en diversos estudios y publicadas por la Organización Mundial de la Salud (OMS) en 198541, muchos estados tanto fisiológicos como patológicos pueden causar importantes discrepancias entre los valores estimados y los reales2,5,7,30,42–112.
Las variaciones en el GER están en relación con el peso19,25,32–53 (la influencia de la altura es controvertida1,32–34,37,52), la masa corporal magra30,38,39,42–47,52–58,63, el sexo1,32–37,43,44,47–50,59–61,63, la edad1,2,16–18,32,34,37,43,44,47,63, factores genéticos63 incluyendo el peso de los padres45,57,64,65 y el grupo étnico44,45,57,59,61, y factores medioambientales tales como la temperatura43,66. Influyen, asimismo, la actividad simpática67,68 y la situación clínica y nutricional8,19,36,37,43–45,52–54,59,69–75. La actividad física es el componente más variable del gasto energético total (GET)1. También el coste energético de una actividad varía en función del peso45,48,49, composición corporal45,48-49,58,61, edad48,58 y grupo étnico45,57–59,61. El efecto termogénico de la alimentación (energía requerida para la ingestión y digestión de los alimentos) depende de su composición22,76, de la vía por la que se administre76,77 y de la situación basal del individuo41,78.
Gasto energético en el niño sanoLa influencia del crecimiento sobre el MB viene condicionada porque la masa del tejido muscular aumenta proporcionalmente más que la del tejido orgánico (hígado, riñones, etc.)16,17,44. Como los órganos son metabólicamente más activos que el músculo, el MB expresado en kilogramos de peso disminuye a lo largo de los años1,16,17,44,58–60.
El crecimiento supone un 35 % de los RED durante los primeros 3 meses de vida1, que disminuyen progresivamente (6 % a los 6 meses, 5 % a los 12 meses30, 3 % en el segundo año de vida1,25), y posteriormente permanece en torno al 1 o 2 % hasta la adolescencia1.
En los niños, la actividad física parece consumir menos de lo estimado históricamente112. En niños de 5 años se han encontrado porcentajes del GET debidos a la actividad física de alrededor del 16 y 17 % (± 7–11 %)47,112.
Gasto energético en la enfermedadEstimar el GER en la enfermedad es difícil dada la variabilidad de las respuestas clínicas y metabólicas a los distintos niveles de gravedad1,3,72–74 y a la evolución en el tiempo. El fallo cardíaco incrementa el GER75 pero, simultáneamente, desciende la actividad física, con lo que los RED pueden estar descendidos2. La fiebre incrementa el GER, y en situación de diarrea es preciso considerar el incremento en las pérdidas energéticas con las heces1.
La desnutrición causa importantes diferencias en el gasto energético8,19,69,80–82. Condiciona un gasto energético menor por una disminución del GER82 y un menor efecto termogénico de la dieta83. No obstante, por kilogramo de peso se ha encontrado un GET mayor en pacientes desnutridos, aun siendo el global menor, tanto en adultos80 como en niños19,81. La MB se elevaría en los estadios tempranos de la rehabilitación nutricional70,71,84.
El gasto energético global de los individuos obesos es mayor al ser mayor su peso43,61,62. Sin embargo, estas personas tienen menos tejido metabólicamente activo (masa libre de grasa) por kilogramo de peso corporal42,43, y por ello pueden tener un GER menor por kilogramo de masa corporal37,42,43.
Gasto energético en el paciente críticoAnte cualquier estrés o agresión se establece una respuesta común a cualquier enfermedad crítica o traumatismo grave, que sólo difiere por su gravedad y duración86–91. Es un complejo proceso metabólico generalizado que aparece originado por la interacción de mediadores tisulares y del endotelio vascular, células inflamatorias y el sistema neuroendocrino79,86–88. Persigue la movilización de sustratos y energía para hacer frente a la inflamación y la reparación tisular, a expensas de la masa magra corporal86,89–91. Se caracteriza por una respuesta hiperdinámica con incremento de la temperatura corporal5,86,88–91, de la producción de CO2, del consumo de oxígeno5,86–91 y glucosa, glucogenólisis, proteólisis, lipólisis, y ciclado fútil de sustratos5,86,88–91. Puede mantenerse semanas e incluso meses87. Sin embargo, la cronología de la elevación del gasto energético se ha visto altamente variable en el paciente crítico, tanto en adultos92 como en niños8,9,12,14,81,89,90,93. Aunque siempre existe hipercatabolismo88,91, el hipermetabolismo como reacción a la agresión no es tan prevalente como se creía8,9,94–100; además, la respuesta al estrés en los niños no es tan marcada ni tan hipermetabólica como en los adultos8,9,96,97,100, y se demuestra hipometabolismo en muchas ocasiones8,9,14,15,93,96–100; no obstante, algunos niños críticamente enfermos presentan claras elevaciones del metabolismo energético8–10,81,93,97,101–103.
La respuesta hipermetabólica individual no es realmente predecible a través de las ecuaciones o fórmulas estándar para los sujetos normales3,8–10,12–15,20,81,89,94,96–101,103–106. El grado de hipermetabolismo o hipometabolismo del paciente crítico se determina relacionando el gasto energético predicho con el gasto energético medido (definido como índice metabólico, normal 90-110%105). Otros autores utilizan la relación entre el gasto energético preoperatorio y el gasto energético postoperatorio80.
Algunos autores han encontrado distinto gasto energético según los diagnósticos9,14,15,106, mientras que otros no lo han podido objetivar8,21. El GER no sirve como marcador biológico de gravedad, aunque algunos estudios han encontrado alguna correlación entre la gravedad de la enfermedad9,10,15 y la elevación del GER5,18,90,93,103.
El gasto energético varía de día en día y está influenciado por múltiples factores: sedación (lo disminuye8,9; no está tan claro el efecto de la relajación muscular8,9,81,87,106,107), temperatura9,15,108–110 (la fiebre incrementa el gasto energético9,85,109,110, la hipotermia lo disminuye109,110), ventilación mecánica (lo disminuye)12,102,111, inotrópicos (lo incrementan)8,67,94, administración de nutrición (lo incrementa8,22,106), cuidados generales (lo incrementan transitoriamente111, pero si son adecuados, el efecto global es una disminución112), etc. En los adultos desnutridos la elevación del GER con la agresión parece limitada80, no así en los niños8,981.
Métodos de estudio del gasto energéticoLas mediciones directas del GET hasta hace pocos años no han estado disponibles en la práctica clínica diaria, aunque sí en la investigación1,2. El método más usado está basado en el agua doblemente marcada1,2,113–123, considerado el patrón oro1,2. También se han empleado estudios de equilibrio energético21,85,122. Otra forma de medir el GET es mediante monitores que incorporan medidas de intercambio de calor124,125,126-131, sensores de movimiento50,51,124–147. Se acepta como índice de GET la medición de la frecuencia cardíaca minuto a minuto1.
Sin embargo, las mediciones realizadas habitualmente en la práctica clínica son mediciones del GER, generalmente por calorimetría indirecta2,3. El GER supone aproximadamente el 70 % de los RED2,39, y en sujetos sanos puede oscilar entre el 45 y el 70 % según la edad y el estilo de vida1. Para pacientes críticamente enfermos, el GER con frecuencia se sitúa entre el 75 y el 100 % del GET148.
Cuantificación de la actividad físicaPara llegar al GET normalmente se multiplica el GER por un factor de actividad. En los niños, el comité de expertos de la ONU recomendó reducir o incrementar en un 15 % los requerimientos para aquellas poblaciones menos o más activas que el promedio, ofreciendo definiciones de éstas, a partir de los 6 años de edad1. Para cuantificar la actividad física, los investigadores se han basado históricamente en los cuestionarios self-report140,142,143,149,150, pero se tiende a sobreestimar la intensidad y duración de la actividad física151, y en los niños, no es valorable152,153. La observación directa es útil en pediatría140,142,151,152; se han diseñado y validado escalas específicas para categorizar su intensidad154–156; y, además, existen tablas que asignan a cada actividad un coste energético58. No obstante, la observación directa requiere mucho tiempo y habilidad por parte del observador140,142 y es muy cara140,142,152–154.
Otros métodos empleados para la medición de la actividad física son los monitores de frecuencia cardíaca144–147,157–162,151,152,163 e instrumentos de medida de movimiento48,49,124–147,149–154,156,163–165.
Métodos antropométricosLa primera aproximación a la cuantificación del consumo energético la realizaron Holliday y Segar166, estableciendo unos aportes para la rehidratación intravenosa en función del peso, asumiendo que el gasto energético se equipara a la necesidad de agua (100kcal/kg/día = 100ml/kg/día). En realidad, todos los mamíferos necesitan 140ml/kg/día por cada 100kcal/kg/día. Utilizando esta equivalencia fisiológica, Darrow elaboró una tabla que aún se utiliza, aunque de forma menos extendida (tabla 1), y creó el concepto de caloría metabolizada, equivalente al actual GER167.
Se han publicado más de 200 ecuaciones43. La ecuación de Harris y Benedict32 se ha utilizado con frecuencia desde su publicación (1919) para predecir el GER en individuos adultos sanos y de peso normal. Sin embargo, existen evidencias de que la frecuencia de error en la estimación del GER es alta usando esta ecuación40,41,43,69,168 (por lo general, sobreestimación39,40,69,168). No es adecuada para estimar el gasto energético de individuos desnutridos69. No está adaptada a la población pediátrica, aunque se puede utilizar a partir de los 10 años de edad; Caldwell y Kennedy validaron el uso de una ecuación diseñada por Harris y Benedict para su utilización en menores de 3 años en 1981 (tabla 2)33. Fleisch34 desarrolló fórmulas para el cálculo del gasto energético en función del sexo y la superficie corporal y Talbot35 y Lewis et al36 diseñaron tablas de gasto energético en niños. En 1985, Schofield evaluó los datos de 114 estudios sobre gasto energético y publicó otras ecuaciones para niños y adultos (tabla 2). También en la edad pediátrica se han encontrado sobreestimaciones del gasto energético con las fórmulas predictivas47,51,53,169. En general, la fórmula de Schofield37 se ha encontrado como la más eficaz49,169,170.
Fórmulas predictivas más usadas en niños para el cálculo del gasto energético en reposo (kJ/24h)
| Autor(es) | Fórmula |
| Lactantes (< 2 años) | |
| Caldwell y Kennedy33 | 22 + (31,05 × P) + (1,16 × A) |
| Niños | |
| Varones | |
| Fleisch34 1–12 años | 24 × SC × [54 – (0,885 × E)] |
| Fleisch34 13–19 años | 24 × SC × (42,5 – [0,643 × (E 13)]) |
| Schofield37 < 3 años | (0,0007 × P) + (6,349 × A) – 2,584 |
| Schofield37 3–10 años | (0,082 × P) + (0,545 × A) × 1,736 |
| Schofield37 11–18 años | (0,068 × P) + (0,574 × A) + 2,157 |
| Mujeres | |
| Fleisch34 1–12 años | 24 × SC × (54 – [1,045 × E]) |
| Fleisch34 13–19 años | 24 × SC × (42,5 – [0,778 × (E – 11)]) |
| Schofield37 < 3 años | (0,068 × P) + (4,281 × A) – 1,730 |
| Schofield37 3–10 años | (0,071 × P) + (0,677 × A) × 1,553 |
| Schofield37 11-18años | (0,035 × P) + (1,9484 × A) + 0,837 |
| Adultos | |
| Varones | |
| Harris y Benedict32 | 66 + 13,8 × P + 5 × A – 6,8 × E |
| Mujeres | |
| Harris y Benedict32 | 655 + 9,5 × P + 1,9 × A – 4,7 × E |
Las ecuaciones de Schofield dan los resultados en MJ. 1MJ = 1.000kJ; 1kJ = 4,184kcal.
A: altura en m; E: edad en años; P: peso en kg; SC: superficie corporal.
Las ecuaciones predictivas anteriormente citadas se utilizan habitualmente para el tratamiento clínico de niños enfermos, cuando en realidad fueron diseñadas para estimar las necesidades de niños sanos en su vida cotidiana y con un nivel normal de actividad física170, por lo que no son adecuadas para el cálculo de los requerimientos energéticos en situación de enfermedad8–10,12,14,20,81,89,96–100. El número de casos en estos estudios ha sido limitado, salvo algunos con más de 40 niños12,14,15,81,106. En general, se ha encontrado que las fórmulas sobreestiman el gasto energético8,9,14,81,96,99,100, aunque también se han encontrado infraestimaciones9,10,15,97. Tampoco se ha visto a posteriori que sean útiles14 fórmulas diseñadas para niños con ventilación mecánica15. Las dificultades de medir el peso corporal en el paciente críticamente enfermo introducen más incertidumbre aún en las estimaciones basadas en características antropométricas2,6,9,105. Para intentar aproximarse a las demandas energéticas en estas situaciones, se publicaron para adultos coeficientes de estrés5,94, y se encontraron sobreestimaciones con su uso94,103. En niños también se han empleado las predicciones por Harris y Benedict8,81,97,101 y Schofield8,97 con distintos coeficientes de estrés (1,3101, 1,597 y los dos anteriores87); igualmente se han objetivado sobreestimaciones del gasto energético81,101.
Método del agua doblemente marcadaEsta técnica está considerada una de las más exactas a la hora de medir el gasto energético en individuos viviendo libremente1,113,118. Como se ha indicado, proporciona un patrón oro desde el que medir la exactitud de otras técnicas a la hora de estimar el GET1,48,49,57,58,61,113,128,147,158–162. Fue validada en seres humanos a principios de la década de 1980113,119. Se ha objetivado una buena correlación de este método con la calorimetría indirecta tanto en adultos120,121 como en lactantes y niños122,123,171. Puede proporcionar, además, información precisa del gasto energético por actividad física1,45,48,49,52,57,58,61, de las tasas de producción de CO2128,131, de la ingesta de agua y de las pér-didas insensibles113,122. No obstante, el relativo alto precio del agua oxígeno-18115,126,128,131,142,160 (una dosis dura generalmente 14 días y cuesta aproximadamente 800-1.000 euros), la necesidad de un espectrómetro de masas26,58,113–115,118–123,128,159 y el alto nivel de experiencia técnica requerido160 han limitado la extensión del uso de este método a la investigación clínica. Igualmente, la duración prolongada de los estudios y el que no existan preparados de isótopos intravenosos limita su utilización en pacientes críticos.
La técnica requiere la administración oral (dosificación según el peso) de agua marcada con isótopos estables (no radiactivos), 2H2O y H218O, y la medición de su contenido en muestras biológicas (p. ej., orina) a lo largo del tiempo. La medición se basa en el equilibrio de las moléculas de oxígeno en el agua corporal y en el CO2 espirado. Puesto que el 18O se elimina como agua y como CO2, mientras que el 2H (deuterio) sólo como agua, la diferencia en las concentraciones de 2H2O y H218O expresa la producción de CO2113–118. La producción de CO2 es un índice de los RED, y éstos se calculan mediante ecuaciones respirométricas clásicas (ecuación de Weir y adaptaciones de ésta) a partir de la composición de la dieta172,173 (v. Anexo).
Teoría del método del agua doblemente marcada
Para el cálculo de la tasa diaria media de producción de CO2 puede usarse la ecuación de Lifson y McClintock117 o alguna modificación de ésta, por ejemplo:
donde N es el agua corporal total en moles, ko es la tasa de eliminación de 18O, kh es la tasa de eliminación de 2H, y rGf es la tasa estimada de pérdida de agua isotópicamente fraccionada, igual a 1,05N (1,01 ko – 1,04 kh)121
Las tasas de eliminación de los isótopos 18O y 2H pueden calcularse por el método de los 2 puntos usando la diferencia en el exceso de porcentaje atómico (APE) de las muestras del punto inicial (i) y final (f) y el tiempo entre la recogida de orina, como sigue:
donde APE es el enriquecimiento isotópico de la muestra con respecto a la muestra basal (predosis)45,58. Este método ahorra la recogida continua de orina45
También puede emplearse la ecuación R2 de Speakman198 para el cálculo de la tasa de producción de CO2, usando el espacio de dilución de 2H52. Otros autores calculan la producción de CO2 a partir de los espacios de dilución y las tasas de fraccionamiento del deuterio y del 18O por medio del método multipunto y la ecuación:
donde ko y kh son las tasas de fraccionamiento del 18O y del deuterio, respectivamente, y No y Nh son los espacios de dilución del 18O y del deuterio, respectivamente, o la ecuación:
donde 18O (QO) y 18H (QH) representan los cambios diarios en los espacios de dilución de 18O y 18H, respectivamente25 Una vez conocida la producción de CO2 se calcula el GET mediante la ecuación de Weir174:
donde el VO2 se calcula mediante la división del VCO2 por el cociente alimentario (food quotient)115,174. Esto implica asumir que el cociente alimentario es equivalente al RQ (VO2 = VCO2/cociente alimentario)113,115,121. El cociente alimentario es calculado desde la composición en macronutrientes de la dieta como describieron Black et al176. Habitualmente se emplean diarios para recoger la ingesta dietética de 7 días45,48,58,150, aunque para niños a veces se reduce esta duración50. Se han utilizado cocientes alimentarios de 0,87; 0,855; 0,855; 0,855; 0,87, y 0,87 para las edades de 3, 6, 9, 12, 18, y 24 meses, respectivamente175
Se deben realizar correcciones para el fraccionamiento isotópico del agua perdida en la respiración y de forma transcutánea (no en el sudor)64,113–117,150
Esta técnica proporciona información acerca del GET promedio y de los patrones de actividad física en un período de 7–14 días, pero no valora variaciones rápidas en el gasto energético ni informa del patrón de actividad física a lo largo de cada período de 24 h1,161. La máxima precisión se ha encontrado con períodos de 6 a 7 días en el neonato y el niño y de 14 en el adulto115,117. La precisión es adecuada si la duración del estudio está entre 0,5 y 3 vidas medias biológicas del 2H2O117. Dos vidas medias biológicas suponen 3–14 días en neonatos (5 días121) y niños y en torno a 14–28 en adultos115.
CalorimetríaCalorimetría directaEstá considerada el patrón oro para la determinación del GET en el laboratorio157. Proporciona una determinación del gasto energético mediante la medición de la producción de calor en un ambiente cerrado6,168. Permite computar las pérdidas de calor por radiación, convección y evaporación. Estudios realizados con fuentes de calor secas y húmedas mostraron una precisión del 1 o 2 % con este método, del 3 % en un estudio clínico respecto a la calorimetría indirecta168. Aunque es un método excelente para medir el gasto energético, es una técnica extremadamente cara6. El coste de una cámara metabólica es aproximadamente de 350.000 euros y requiere personal especializado.
Calorimetría indirectaEs la utilizada habitualmente en la práctica clínica para mediciones del GER2,3. Aunque la calorimetría indirecta permite la medición del gasto energético de forma repetida, sin ser invasiva2,3, no puede usarse fácilmente para medir a sujetos durante su vida cotidiana127.
Es el método de elección para los niños críticamente enfermos, aunque no puede medir el gasto energético en todos ellos por razones técnicas que se comentarán más adelante6,8,9,14,15,99,107,174–176. Los calorímetros transportables no siempre están disponibles en muchos centros15. Si lo están, requieren validación y personal experto en su tratamiento15,177. Su precio (20.000-100.000 dólares) es el mayor inconveniente en su uso para la monitorización6, y hasta el momento no se ha demostrado un efecto claramente favorable de la calorimetría indirecta, ni en la situación general ni en la mortalidad del paciente crítico178, y ni siquiera en el balance nitrogenado o el peso178,179.
Fundamentos teóricosLa calorimetría indirecta mide, mediante el análisis de los gases inspirados y espirados, el consumo de oxígeno (VO2) y la producción de CO2, y permite calcular la cantidad de energía producida en el organismo2–4,6,180, mediante fórmulas como la de Weir172:
Es necesario asumir que este intercambio gaseoso se destina exclusivamente a la degradación oxidativa de sustratos2–4,6,177,180. Las vías metabólicas que no utilizan oxígeno (p. ej., la glucólisis anaerobia) no aparecen reflejadas178. Es necesario asumir también que el nitrógeno producido en la oxidación proteica es recuperado por completo en la orina181 o añadir el nitrógeno eliminado por pérdidas insensibles (5–8mg/kg en niños)182. No obstante, en el cómputo total del gasto energético por la fórmula de Weir, la importancia del nitrógeno urinario es pequeña3. Sin la medición del nitrógeno urinario, el gasto energético se modificaría sólo en < 1171-2%29,116, calculándose según la ecuación172:
Hay situaciones clínicas en que las mediciones no son válidas: períodos de compensación de acidosis metabólica o alcalosis, hipoventilación, inestabilidad hemodinámica174, hemodiálisis (al no tenerse en cuenta la eliminación de CO2 a través del dializado)183.
Usos clínicosMedición del GER. Las mediciones hechas habitualmente en clínica son mediciones del GER, que se deben realizar en una sala a oscuras29 (tras haber descansado 8h en el domicilio1,27–29,38–40,43,44,61 y 1531 o 301,27–29,38–40,43,44,61 min en el laboratorio) y en decúbito supino porque la simple actividad muscular de mantenerse sentado puede incrementar el consumo energético en un 8%29. Para eliminar la termogénesis inducida por la dieta, se exige un período de ayuno de 12 h1,27–29,38–40,43,44,53, si bien algunos autores consideran suficiente un ayuno de 2h para la medición del GER158,159. Si no se seda al paciente o no se suspende la alimentación, la calorimetría refleja el gasto energético en ese momento, no el GER. Van Lanschot et al94 consideraron los valores de gasto energético medidos por calorimetría en UCI como GET, pero otros autores han añadido factores de actividad, aun estando el paciente sometido a ventilación mecánica5,97,101.
Otras utilizaciones clínicas. Midiendo el consumo de oxígeno se puede estimar de forma indirecta las calorías quemadas durante actividades específicas122,147 (mediante la ecuación de Fick: kcal = VO2máx [l/min] × 4,825 [kcal/lO2])180. Así, la intensidad del ejercicio aeróbico se relaciona con el consumo máximo de oxígeno realizado generalmente en una cinta rodante o una bicicleta estática57.
La calorimetría indirecta permite la medición de la utilización de sustratos, asociando los valores de nitrógeno ureico2,3,168,181. Se determina el nitrógeno ureico en orina de 24h, al que habría que añadir el nitrógeno urinario no ureico (es el 10 % del nitrógeno urinario182,184; en niños se estima en 55mg/kg/día182), el N de las pérdidas insensibles182, y en especial si existe insuficiencia renal, los cambios en el pool de nitrógeno ureico (Nu no eliminado [mg] = [BUN2 – BUN 1] × 10 × [0,6 × peso])184. El RQ puede ayudar a valorar si es adecuada la nutrición11 y su efecto respiratorio4.
La calorimetría indirecta permite también la medición del gasto cardíaco y del espacio muerto respiratorio (Vd/Vt) si se cuenta con medición de gases en sangre arterial y venosa185.
Para algunos autores, la calorimetría indirecta es una herramienta útil a la hora de predecir el éxito del destete de la ventilación mecánica, valorando la elevación de VO2 que se produzca186 (otros autores han argumentado que esta elevación podría deberse también a una elevación de catecolaminas y no sólo a un mayor trabajo de los músculos respiratorios187).
TécnicasCalorimetría de circuito cerrado. Se respira en un circuito cerrado una mezcla de gases a la que se ha añadido oxígeno en concentración conocida. El CO2 que sale se extrae y mide, de tal forma que el aire sirve para ser respirado de nuevo188. Se han encontrado problemas de sobreestimación con esta técnica1, y es muy sensible a fugas141. La ventaja es que no requiere medición de concentración ni de flujo de oxígeno189. Se ha empleado en investigación135,189.
Calorimetría de circuito abierto. Requiere una medición exacta del volumen y flujo respiratorios y de las fracciones inspiradas y espiradas de oxígeno y CO23,4,179,180,183. Todos los calorímetros están equipados para medir las concentraciones de oxígeno y CO2 en los gases espirados, así como el flujo del aire espirado, la temperatura, la presión barométrica y el tiempo. Se utilizan sensores de oxígeno electroquímicos120 (polarográficos168,174) o paramagnéticos, que aprovechan la mayor susceptibilidad magnética del oxígeno respecto a otros gases26,57,85,158–160,188,189. El CO2 se suele medir por absorción de infrarrojos26,57,120,122,158–160,177,186,188,189. Los sensores de flujo más habitualmente usados son neumotacógrafos60,61,88,148,168,171, turbinas134,174, anemómetros de hilo caliente o medidores de flujo ultrasónico. No obstante, la mayoría de los instrumentos se hacen progresivamente menos exactos cuando la fracción inspirada de oxígeno (FiO2) se eleva por encima del 50 al 60%6. Las fluctuaciones en la FiO2 parecen menores cuando el oxígeno proviene de una bombona en lugar de proceder de una toma general de pared188.
Los calorímetros se calibran con el test de combustión de etanol y utilizando mezclas de concentración de oxígeno y CO2 conocidas29,188. Han de tenerse en cuenta, además, las condiciones de temperatura, humedad y presión atmosférica29,175,176,188,189.
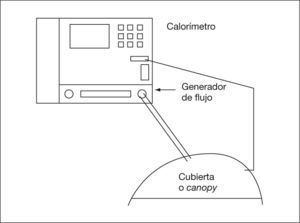
Utilización en respiración espontánea. En respiración espontánea, el uso del sistema requiere el empleo de cubiertas sobre la cabeza del paciente que se sellan sobre el pecho y los hombros26,30,40,52,85,188 (fig. 1) o de una mascarilla y/o una pieza bucal con una pinza nasal39,40,48,62,69,133,134,158,161,189 (con sistema de no reinhalación)158,159,189 durante todo el período de estudio. La diferencia entre ambos sistemas se ha observado en menos del 1%40, aunque las piezas bucales o mascarillas pueden causar ansiedad159 (mal toleradas en niños pequeños), artefactándose los resultados por los cambios en el patrón respiratorio. Las cubiertas reciben el nombre de canopy30 y se fabrican de policarbonato transparente. Existen diferentes tamaños de canopy: neonatal, pediátrico (3–20kg) y para adultos. El canopy tiene una entrada de aire con un flujo constante de 12l/min para niños menores de 20kg y de 30–40l/min para mayores, donde se monitorizan los gases inspiratorios y una salida por donde se extrae el aire26,33. El flujo ha de ser constante y suficiente para evitar el rebreathing120,188, por lo que para el test de esfuerzo ha de ser mayor (se han utilizado flujos de 100l/min en adultos)120. Debe retirarse el vapor de agua de los circuitos para evitar errores85. Las fugas de aire pueden producir errores de un 3 % en las mediciones. En caso de utilizarse un canopy, ha de esperarse un tiempo para que se equilibren los gases en su interior (20, 25 y 30min en estudios en niños de 2, 1, y 0,5kg). Se ha validado la realización de calorimetría en lactantes pretérmino con aportes de FiO2 de hasta 0,4 en canopy188.
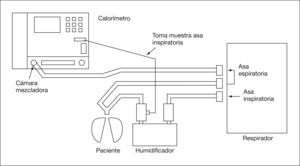
Utilización en ventilación mecánica. Se analiza la FiO2 en la rama inspiratoria9,15,188 y el volumen espirado y gases (O2 y CO2) en la rama espiratoria (fig. 2). Es aconsejable conectar la toma distal al humidificador que sirve como cámara mezcladora de gases, asegurando una FiO2 más constante14, y alejada del tubo endotraqueal para evitar mezclas con gases espirados. La FiO2 no debe ser mayor de 0,68,9,15,98,174,188.
Para que las mediciones representen de forma válida y fiable el consumo energético de 24h, el paciente debe hallarse en equilibrio estable6,177; éste se obtiene cuando la variabilidad del VO2 y del VCO2 es inferior al 5%38,43,174,179-10%38,103,108,174,179 y la del RQ está por debajo del 5%103,108 durante al menos 30min108,179. Para otros investigadores, 5min de esta situación serían suficientes36,73,108,149,175,179, también en pacientes críticos108,179; esta duración se ha validado en estos últimos190. Otros autores emplean un período de estabilización de 10 min9.
En 1h se intercambian aproximadamente 15l de CO2 y oxígeno, cuyos depósitos corporales son de 20 y 1l, respectivamente, por lo que si la medición dura menos de 1h, el error puede ser del 10% para la VCO2 y del 1% para el VO2191. Sin embargo, la mayoría de estudios en niños usan mediciones de 2051,59,97 a 30min14,15,31,45,48,61,176. Algunos trabajos han empleado 45 min9,44,53,60. Un estudio en nuestro servicio demostró que las mediciones de 30min en la UCIP se correlacionan bien con las mediciones de 24h seguidas14. La mínima duración publicada en series de niños (sanos) es de 15min, con la que se obtuvo una buena reproducibilidad en dos mediciones (r = 0,87)52. Algunos estudios en niños utilizan la media de dos estudios como valor definitivo del GER45.
Los coeficientes de correlación encontrados para mediciones repetidas del GER en niños han sido altos47,50,55. En el paciente críticamente enfermo se acepta una variabilidad en el día menor de un 7-10 % según la duración del estudio103,108,176,190.
La cuantificación de gases en el asa inspiratoria supone una pérdida de volumen que puede producir hipoventilación en niños con volúmenes tidales bajos. Es preciso, por lo tanto, asegurarse de que los volúmenes ventilatorios siguen siendo suficientes tras la colocación del calorímetro. No deben emplearse nebulizaciones durante el período de estudio174, ni otros gases distintos al oxígeno, nitrógeno o CO2 en el circuito8,14,15.
Las fluctuaciones en la FiO2 parecen menores en volumen control que en ventilación mecánica intermitente (IMV)173. Se han realizado mediciones con respiradores de flujo continuo188, si bien se requieren analizadores de oxígeno y CO2 especialmente sensibles y precisos; la mayoría de calorímetros comercializados98 no cumple estas características. La asociación de presión positiva telespiratoria mayor a 5103 o 10174 cmH2O o altas presiones inspiratorias o presiones medias elevadas pueden dificultar también las mediciones, al poder modificar el intercambio gaseoso. Asimismo, variaciones en la temperatura y la humedad pueden condicionar errores189,183.
Las fugas alrededor del tubo endotraqueal son frecuentes en niños, sobre todo debido al uso de tubos sin balón. En caso de existir fugas, éstas pueden alterar considerablemente (hasta un 45%192) los resultados98,192,193, aunque para algunos autores no parecen hacerlo si no son audibles y son menores del 20 %193 (se considera que una fuga no es audible si no supera el 7,5 % del volumen tidal188). Muchos estudios no han tenido en cuenta las fugas20,93,97 o sólo han realizado estudios en niños con tubos con balón8,99,107 o incluyendo niños con una diferencia inferior al 5%9 o al 10%14,15 o al 15%8 entre el volumen tidal inspiratorio y espiratorio.
Estudios de balance energéticoConsisten en la cuantificación de la ingesta energética diaria junto con mediciones de pérdida o ganancia de peso. Se han usado como método de referencia para comparar otras técnicas de medición del GET21,85,122,157. Requieren una exhaustiva recopilación de todos los aportes energéticos y un período de estudio suficiente para poder detectar cambios en los depósitos corporales157. Estos estudios también se han empleado en UCIP21.
Otros métodos de cuantificacion del gasto energéticoMonitorización de la frecuencia cardíacaEs sencilla161,163, barata y bien aceptada por los niños, y es posible su aplicación a gran escala161. Normalmente la relación frecuencia cardíaca-gasto energético se describe como lineal157,160, también en niños151, sobre todo entre frecuencias de 110 a 150 lat./min163, pero no existe evidencia de que esta relación sea fuerte durante períodos de niveles bajos o muy altos de actividad157,161,163. Además, la relación entre la frecuencia cardíaca y el gasto energético es única para cada individuo y existen múltiples factores que pueden alterarla (ansiedad, medicaciones, etc.)151,152, lo cual cuestiona su efectividad como medida aislada160. No obstante, la monitorización de la frecuencia cardíaca se ha empleado también para medir el gasto energético en condiciones de enfermedad95,162.
La monitorización de la frecuencia cardíaca puede ayudar, además, a identificar la frecuencia, intensidad y duración del patrón diario de actividad física158,160. A su vez, la relación entre el consumo de oxígeno y la frecuencia cardíaca está influenciada por la proporción de masa muscular activa y por el carácter continuo o intermitente de la actividad. El nivel de entrenamiento físico de los niños es otro factor limitante144,194,195: un niño entrenado tiene un volumen de eyección mayor y, por ello, una frecuencia cardíaca más baja para cualquier actividad y una respuesta menor al ejercicio194.
En conjunción con otros datos, la monitorización de la frecuencia cardíaca ha demostrado mejorar las estimaciones de algunos modelos predictivos51,95.
Método FLEX-HR. Este método se desarrolló para combatir los factores individuales en la relación frecuencia cardíaca-gasto energético y actividad física152. El FLEX-HR crítico se define como la frecuencia cardíaca que discrimina entre frecuencia cardíaca en reposo y durante el ejercicio en ese individuo161. Este valor se obtiene a partir la elaboración de curvas de regresión para la frecuencia cardíaca frente al VO2 en reposo y durante distintas actividades en el laboratorio159–161. Luego se realizan registros minuto a minuto de la frecuencia cardíaca en condiciones reales1,160,161. En la parte del día en que la frecuencia cardíaca se encuentra por encima del FLEX-HR159,161 se calcula el gasto energético con la ecuación de regresión obtenida en las actividades de alta intensidad durante el procedimiento de calibración157. Las relaciones entre frecuencia cardíaca y VO2 pueden diferir en condiciones reales por factores no controlados en los protocolos de calibración (temperatura ambiental, fármacos, variaciones día a día en la relación frecuencia cardíaca-VO2163, postura, intensidad de la actividad muscular, fatiga, estado posprandial, etc.). Los niños muestran una inclinación natural hacia patrones de actividad física intensa de inicio brusco y corta duración161,151, contrarios al ejercicio estandarizado empleado para la calibración de este método161.
Como única medida, diversos estudios han encontrado mediante el método FLEX-HR (descrito a continuación) valores medios de GET comparables con los valores medios obtenidos por agua doblemente marcada159,161,162 o calorimetría158, por lo que el último informe de la FAO/OMS/ONU utilizó estudios realizados con este método1. Pero aunque su correlación es buena para comparaciones de grupo, muestra falta de precisión a nivel individual158,161,162.
Temperatura corporal centralLa temperatura corporal central se ha usado en condiciones de laboratorio para estimar el GET. Bajo condiciones muy controladas, existe una relación estrecha entre la temperatura corporal central y el GE196. En las condiciones de la clínica habitual, sin embargo, no se ha visto que muestre buena correlación con el gasto energético95,197. Sin embargo, cuando se combina con otras herramientas de medida del gasto energético, puede añadir una dimensión valiosa, por lo que se ha incluido como variable en varias ecuaciones de regresión15,110. Por su naturaleza invasiva, la temperatura corporal central es impracticable para estudiar individuos en condiciones de vida normales.
Medición del flujo de calorLa producción y pérdida de calor es producto del metabolismo y, por ello, la medición de la pérdida de calor mediante un sensor de flujo de calor se ha sugerido como un indicador preciso del total de calorías corporales quemadas. Aunque su correlación con el gasto energético como variable independiente es insuficiente para predecir el gasto energético (sí se ha visto una buena correlación de la temperatura cutánea con VO2 y VCO2 durante la actividad física), su medición puede mejorar la estimación del gasto energético usada en combinación con otros parámetros126,128,130,131. En los últimos años se han desarrollado y comercializado dispositivos que incorporan un sensor de flujo de calor en monitores que estudian varios parámetros simultáneamente (flujo de calor, acelerometría, respuesta galvánica de la piel, temperatura cutánea, temperatura cercana al cuerpo, y algunos, además, frecuencia cardíaca) y los convierten en gasto energético mediante ecuaciones de regresión. Ejemplos son el monitor SenseWear Pro Armband (BodyMedia Inc., Pittsburgh, PA; tabla 3) y el HealthWear Armband (Roche Diagnostics, Indianapolis, IN). Miden la diferencia de temperatura entre dos sensores, uno situado en contacto con la piel y otro en el lado del monitor expuesto al ambiente. Del total de la energía térmica disipada registran específicamente la parte correspondiente a la convección de calor. Se colocan sobre el brazo, entre la piel y el lado del Armband expuesto al ambiente126,128,130,131. La localización en el brazo se prefiere otras como la frente o el tronco. Localizaciones más periféricas, como las muñecas, manos, dedos y pies, están sujetas a una excesiva movilidad y cambios vasculares periféricos frecuentes. Estos monitores se han empleado tanto en sujetos sanos como enfermos124,125,128–131, aunque no en situaciones críticas.
Modelos comerciales de acelerómetros usados en niños
| Actigraph | ||
| Model 7164, Shalimar, FL; MTI Actigraph, Fort Walton Beach, FL (antiguamente llamado MTI/CSA)126,133,138,139,141,143,149,156 | DirecciónEmplazamiento | Uniaxial. Plano verticalLínea media o cadera141,149. Pierna126,141. Cintura escapular en posición axilar anterior1 |
| Muchos estudios en niños138,139,141,143,149,156 | Resistencia al aguaIntervalosPesoCoste | NoMínimo 1s. Usados 15 s156-1min141,14985g819,00 el lector; 350,00 la unidad |
| Actiwatch (nueva versión Actical)141,154,193 | Dirección | Omnidireccional141. Triaxial154 |
| Estudios en niños141,154 | EmplazamientoResistencia al aguaIntervalosPesoCoste | Cadera y pierna141. Rodeando cintura, monitor en base de columna lumbar154Sí (nueva versión)Usado 1min141,15416,5g725,00 lector; 500,00 software; 450,00 por unidad |
| Wam (versión más pequeña del Actigraph [modelo 7164, Computer Science Applications, Shalimar, FL])48,49,133,138–140,164 | DirecciónEmplazamientoResistencia al agua | UniaxialMuñeca138, cadera140. Parte baja de la espalda48,49No |
| Estudios en niños48,49,138–140 | IntervalosPeso | 1s-1min43g (5,1 × 3,8 × 1,5cm) |
| Caltrac136,137,141,142,151,153,164,195 (ahora CTI, Stay Healthy) | Dirección | Vertical |
| Muchos estudios en niños29,137,141,142,151,153,195 | EmplazamientoResistencia al aguaIntervalosPesoCoste | Muñeca, cadera o parte baja de la espalda164No?78g99,95 por unidad |
| TriTraoR3D126,135,136,140,142,144,152,164 (Professional Products Inc., Madison, WI) | DirecciónEmplazamiento | TriaxialCadera135. Cintura escapular en posición axilar medial126 |
| Estudios en niños140,142 | Resistencia al aguaIntervalosPesoCoste | NoUsado de 1 min142170 g (11,1 × 6,7 × 3,2cm)500,00 el nuevo producto RT3 |
| RT3 | ||
| Triaxial Research Tracker (Stayhealthy Inc., Monrovia, CA)126 | DirecciónEmplazamiento | TriaxialCintura escapular en posición axilar anterior o medial |
| Es la nueva versión del anterior | Resistencia al aguaIntervalosPesoCoste | 1s-1minAprox. 1/3 de TriTrac500,00 |
| SenseWear Armband (BodyMedia Inc., Pittsburgh, PA)126,127,130,131 | DirecciónEmplazamiento | BiaxialParte posterior126 o lateral131 del brazo derecho (izq126) en posición humeral media126,127,131 |
| Contiene acelerómetro, monitor de frecuencia cardíaca y termocoupler | Resistencia al agua | No (escasa) |
| Estudios en niños125 | IntervalosPesoCoste | 1 min126,13185g (85,3mm × 53,4mm × 19,5mm)Aprox. 1.000 |
Podómetros. Son sensores de movimiento que miden los pasos dados y los convierten a gasto energético mediante ecuaciones de regresión144. Aunque en teoría no informan de otra actividad que no sea los pasos dados, Sequeira et al165 demostraron que los podómetros podrían diferenciar entre varios niveles de actividades ocupacionales en adultos (sedestación, bipedestación). Sin embargo, el trabajo intenso no es distinguido del moderado, pues el primero contiene una gran proporción de trabajo estático, imposible de medir con un podómetro144.
Acelerómetros. Un acelerómetro es un tipo de sensor de movimientos capaz de detectar aceleración y desaceleración en una o más direcciones49,126,164, al generarse dentro del sensor una corriente eléctrica proporcional al grado de aceleración producido126. Mediante curvas de regresión (que incluyen generalmente las características antropométricas, edad y sexo del individuo) convierten la aceleración detectada en calorías127,131,135. Los acelerómetros se desarrollaron originalmente en 1976 por el National Institute of Health en un intento de simplificar la medición del gasto energético durante la actividad física, pero la validez y fiabilidad del prototipo inicial nunca fueron documentadas132. Se han empleado para medir la actividad física y el GET en sujetos en condiciones de vida normales48,49,124,125,128–131,156,195. Generalmente son ligeros, apenas dificultan las actividades normales y son capaces de registrar datos de forma continuada durante largos períodos de tiempo127. En la tabla 3 se muestra una descripción breve de varios modelos existentes en el mercado, y se citan algunos estudios realizados con ellos. Un acelerómetro uniaxial mide la aceleración en el plano vertical130,136, mientras que los acelerómetros biaxiales y triaxiales son sensibles a los movimientos en dos y tres dimensiones, respectivamente126,134,136,143. Un acelerómetro triaxial puede ser más sensible al mayor rango de movimientos de los niños143. Sin embargo, las diferencias entre acelerómetros se han atribuido a la precisión de sus ecuaciones más que a los monitores en sí136.
Muy usada en niños49, sobre todo en estudios de obesidad48,156, existe un incremento progresivo en el uso de la acelerometría como método de estudio en niños enfermos125,195, al igual que en adultos124,128–130. Existen múltiples estudios de validación realizados con estos monitores126–131,133–136,147,164, también en niños137–144,149,152–154, que muestran buena correlación con el gasto energético medido por calorimetría indirecta126,127,129,130,131,133–137,139,141,142,144,147, o agua doblemente marcada128,138,164. Para la medición de la actividad física se correlacionan adecuadamente con la frecuencia cardíaca140, cuestionarios143,149 u observación directa143,153,154. A pesar de que la OMS juzga que las estimaciones del GET mediante agua doblemente marcada han sustituido en gran parte a las basadas en métodos calorimétricos o sensores de movimiento, considera estos últimos todavía útiles, dada la incapacidad del primero para proporcionar estimaciones de las variaciones del gasto energético y de la actividad física día a día1.
La mayoría de los trabajos publicados con acelerómetros no miden el GER, sino que lo estiman127,134. Fruin y Rankin127 examinaron la fiabilidad y validez del SenseWear Armband durante el reposo y el ejercicio comparado con la calorimetría indirecta. No encontraron diferencias en reposo entre las mediciones de gasto energético por el SenseWear Armband y la calorimetría indirecta con alta correlación entre ambos métodos (r = 0,76; p < 0,004). La estimación del gasto energético mediante el SenseWear Armband demostró ser más reproducible que la calorimetría indirecta cuando se compararon las sesiones sesiones en reposo (r = 0,93; p < 0,001). Esta mayor fiabilidad posiblemente se deba a que el GER en el SenseWear Armband se estima mediante la edad, el sexo y el peso y no es realmente medido127.
Las críticas generales a los acelerómetros montados sobre cinturones incluyen la incapacidad para detectar movimientos del brazo126,134,135, ciclismo134,135,151, locomoción en una pendiente134,146 y/o trabajo externo del tipo de empujar, levantar o llevar objetos126,133,135,146,151 (se ha encontrado con acelerómetros triaxiales infraestimaciones del 8–21 % del gasto energético en pendiente, del 53-68% en bicicleta134 y mayores del 35–45 % en la vida cotidiana141). También se ha criticado a los acelerómetros que pueden entorpecer la actividad física intensa150 y que exista variabilidad en los resultados dependiendo de dónde se coloquen133,151. La necesidad de convertir unidades de medida de actividad física en unidades de gasto energético puede suponer otra fuente de error151. El empleo de ecuaciones específicas para cada actividad se ha propuesto como un medio para mejorar la exactitud de las estimaciones134,131,136.
Métodos combinadosEn los últimos años se han realizado varios intentos de combinar sensores con objeto de conseguir una mayor precisión. Por ejemplo, los monitores SenseWear Armband y HealthWear Armband recogen aproximadamente 21 parámetros (incluyendo flujo de calor, acelerometría, respuesta galvánica de la piel —empleada como un indicador de la pérdida de calor por evaporación131–, temperatura cutánea, temperatura cercana al cuerpo)126,127,130,131. Así, la combinación de la monitorización de la frecuencia cardíaca con un sensor de movimiento ha demostrado mejorar la precisión en un 2 %, sobre cada uno de estos métodos empleados por separado144,146,147. Desde el punto de vista económico, un simple podómetro puede costar sólo entre 15 y 30 euros, y el sensor de movimiento más sofisticado, 1.000 euros.
En el futuro, la combinación de las determinaciones del GER por calorimetría indirecta junto con el empleo de monitores multisensor podría mejorar las estimaciones de los RED en la práctica clínica.