El ductus arterioso persistente (DAP) es una patología muy prevalente en el recién nacido pretérmino (RNPT), que puede relacionarse con mayor morbimortalidad en los prematuros más inmaduros. Estudios recientes han valorado la utilidad del propéptido natriurético cerebral (proBNP) en su diagnóstico. El objetivo fue evaluar la eficacia diagnóstica del proBNP como marcador de sobrecarga hemodinámica en el DAP y su capacidad para identificar la necesidad de tratamiento.
Pacientes y métodosEstudio retrospectivo observacional, que incluyó a RNPT menores de 32 semanas de gestación y/o 1.500 g, con estudio ecocardiográfico y determinación de niveles de proBNP. Se comparó por subgrupos en función de la presencia de DAP y sus características hemodinámicas.
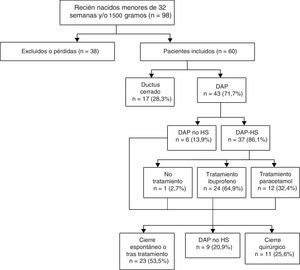
ResultadosDe los 60 pacientes incluidos, el 71,7% presentó DAP, el 86% de los cuales fue hemodinámicamente significativo (DAP-HS). Todos, salvo uno, recibieron tratamiento médico con ibuprofeno o paracetamol. El 29,7% de los DAP-HS precisó cierre quirúrgico.
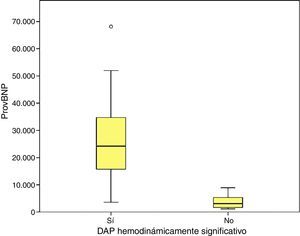
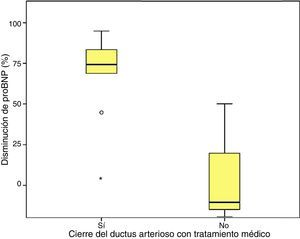
Se encontraron valores superiores de proBNP en los pacientes con DAP-HS (33.338±34.494,47pg/mL; p=0,000), respecto a los pacientes con ductus cerrado o no hemodinámicamente significativo. Los pacientes que precisaron cirugía también presentaron valores más elevados (30.596,8±14.910,9pg/mL; p=0,004). El grupo en el que se constató cierre ductal tras tratamiento farmacológico presentó mayor descenso de los niveles de proBNP (68±24,69% vs. –12,22±99,4%; p=0,030). Mediante curva ROC se calculó valor de corte de proBNP para el diagnóstico de DAP-HS que fue de 9.321,5pg/mL (E 100%, S 94,6%).
ConclusionesLos niveles de proBNP se relacionan con la presencia o ausencia de ductus persistente hemodinámicamente significativo y sus variaciones con la respuesta al tratamiento. Valores elevados también se relacionan con la necesidad de cirugía.
Patent ductus arteriosus (PDA) is a prevalent condition in preterm infants, and may be related to increased morbidity and mortality in the most immature newborns. Recent studies have examined the usefulness of brain natriuretic propeptide (proBNP) in the diagnosis of this pathology. The aim of the study was to evaluate the diagnostic efficacy of proBNP as a marker of hemodynamic overload in PDA.
Paients and methodsA retrospective study was conducted on preterm infants less than 32 weeks of gestation and/or weight less than 1500 grams. Echocardiogram and determination of proBNP levels were performed on all patients. Comparison was made by subgroups according to the presence of PDA and their haemodynamic characteristics.
ResultsOf the 60 patients enrolled, 71.7% had PDA, of which 86% had haemodynamically significant patent ductus arteriosus (HS-PDA). All of them, but one, received medical treatment with ibuprofen or acetaminophen. Surgical closure was required in 29.7% of HS-PDA.
Higher values of proBNP were found in patients with HS-PDA (33338±34494.47pg/mL; p=.000) compared with patients with closed or non-haemodynamically significant ductus arteriosus. Higher values were also found in patients who required surgical closure of PDA (30596.8±14910.9; p=.004). A greater decrease inproBNP levels was found in the group of patients which duct closure after pharmacological treatment (68±24.69% vs -12.22±99.4%; p=.030). ProBNP cutoff-level for HS-PDA was calculated by ROC curve and it was 9321.5pg/mL (Specificity: 100%, Sensitivity: 94.6%).
ConclusionsProBNP levels are related to the presence or absence of haemodynamically significant patent ductus arteriosus; and its variations with treatment response. High values are also related to the need for surgical closure of PDA.
El ductus arterioso (DA) es una estructura vascular que comunica la arteria aorta con la arteria pulmonar durante la vida fetal, produciendo un cortocircuito entre la circulación pulmonar y sistémica. En la mayoría de los recién nacidos a término, el DA se cierra en los primeros 3 días de vida; sin embargo, en los recién nacidos pretérmino (RNPT) con peso al nacimiento inferior a 1.500g o menores de 32 semanas de gestación (SEG), la incidencia de DA persistente (DAP) es elevada, aumentando de forma inversamente proporcional a la edad gestacional y el peso al nacimiento. Aproximadamente el 20% de los recién nacidos menores de 32 SEG, presentan DAP, mientras que lo hacen más del 50% de los recién nacidos de extremado bajo peso (< 1.000 g)1,2.
La aparición de los síntomas depende de la magnitud del cortocircuito izquierda-derecha a través del DAP y de la capacidad del recién nacido para manejar la sobrecarga de volumen producida, que suele ser menor cuanto más inmaduro sea.
Los RNPT con DAP hemodinámicamente significativo (DAP-HS) pueden no desarrollar signos clínicos y, si los desarrollan, suele ser a partir de los 2-3 primeros días de vida, cuando mejora la enfermedad pulmonar. Sin embargo, los RNPT tratados con surfactante pueden presentar síntomas de forma más precoz, debido a la disminución de la resistencia pulmonar que conlleva la administración de surfactante3,4.
Debido al retraso en la aparición de síntomas clínicos, en el RNPT de muy bajo peso, diversos autores han propuesto el despistaje sistemático mediante ecocardiografía a las 48-72 h de vida5,6.
El DAP-HS puede ser una causa importante de morbimortalidad en los RNPT más inmaduros (sobre todo de menos de 28 SEG y 1.000 gramos), produciendo síntomas de bajo gasto cardiaco, empeorando la enfermedad respiratoria por hiperaflujo pulmonar e incrementando el riesgo de patologías como enterocolitis necrosante (ECN), hemorragia intraventricular (HIV), retinopatía de la prematuridad (ROP), insuficiencia renal (IR) con oligoanuria o incluso, aunque se trate de un tema controvertido, displasia broncopulmonar (DBP)7,8. Aunque a día de hoy es un tema de amplio debate, la tendencia actual en muchas unidades neonatales es utilizar medidas conservadoras en el manejo del DAP y solo tratar farmacológicamente los casos en los que se considera hemodinámicamente significativo por la clínica o los hallazgos ecocardiográficos9-12.
Tampoco existe claro consenso en cuanto a los criterios ecocardiográficos para considerar un DAP hemodinámicamente significativo, pero los más aceptados en la actualidad son el diámetro del ductus mayor de 1,5mm, la presencia de flujo retrógrado en más del 30% de la diástole en aorta descendente, la distensión importante de la aurícula izquierda (con relación AI/Aorta mayor a 1,4) o la velocidad del Doppler transductal menor a 2m/s9.
El tratamiento quirúrgico se reserva para los casos en que el tratamiento médico fracasa o está contraindicado13,14.
La situación respiratoria, la hipotensión arterial con descenso más significativo de la presión arterial diastólica, así como los hallazgos ecocardiográficos indicativos de repercusión hemodinámica, son los criterios más utilizados para establecer la indicación del tratamiento del DAP. Sin embargo, en ocasiones la valoración ecocardiográfica puede ofrecer dudas sobre la repercusión hemodinámica y hasta la fecha no existen marcadores bioquímicos fiables que apoyen la existencia o no de esta y que permitan apoyar al estudio ecocardiográfico en la toma de decisiones.
Recientemente, se han publicado varios estudios que proponen al propéptido natriurético cerebral (proBNP) como marcador bioquímico del DAP-HS. Estos estudios han demostrado que la determinación de los niveles de proBNP en los primeros días de vida puede ser útil para evaluar el compromiso hemodinámico y contribuir en la toma de decisiones terapéuticas15,16. Sin embargo, no está claro que las variaciones en sus niveles, si se determinan de forma seriada, sean útiles para predecir el cierre con el tratamiento17,18.
Los péptidos natriuréticos son una familia de péptidos estructuralmente similares pero no relacionados genéticamente, que desempeñan un papel importante en la regulación de la homeostasis renal, cardiovascular y endocrina, y sus concentraciones en sangre se relacionan adecuadamente con el grado de disfunción del ventrículo izquierdo, la gravedad de los síntomas y las presiones de llenado de las cavidades cardiacas en el contexto de insuficiencia cardiaca19.
El presente estudio analiza la contribución de los niveles de proBNP en el diagnóstico del DAP y en la estimación del compromiso hemodinámico en recién nacidos prematuros con edad gestacional menor de 32 semanas y/o peso menor de 1.500 g.
Material y métodosSe realizó un estudio retrospectivo observacional, descriptivo y analítico, que incluyó RNPT de menos de 1.500 g de peso al nacimiento y/o menos de 32 SEG, ingresados en la Unidad de Cuidados Intensivos Neonatales del Hospital Infantil Miguel Servet entre el 1 de junio de l2013 y el 31 de enero del 2015. Desde dicha fecha se determinan de forma sistemática en nuestra unidad los niveles de proBNP de forma paralela al cribado ecocardiográfico del DAP.
Se incluyó a un total de 60 RNPT con edad gestacional menor a 32 semanas y/o peso al nacer menor a 1.500 g.
El protocolo de actuación para el despistaje del DAP en nuestra unidad incluye la realización de estudio ecocardiográfico en las primeras 48-72 h de vida en todos los recién nacidos con menos de 28 semanas de edad gestacional y/o peso menor a 1.000 g y en aquellos que con mayor edad gestacional o peso presentan sospecha clínica (empeoramiento de la situación hemodinámica o respiratoria con aumento de necesidad de soporte ventilatorio, soplo a la auscultación, acidosis metabólica) o factores de riesgo pre o posnatales de DAP como sobrecarga hídrica, ausencia de maduración con corticoides, hijo de madre diabética o sepsis. Asimismo, se realizó extracción analítica previa al inicio del tratamiento, con determinación de hematimetría, iones, creatinina y proBNP coincidiendo en el tiempo con la ecocardiografía, que fue realizada en todos los casos por un cardiólogo pediátrico, el cual desconocía el resultado de la determinación de proBNP, con el equipo ALOKA ProSound Alpha7 (Hitachi®). Las muestras se analizaron con el kit NT-proBNP (Roche Diagnostic®) y los resultados se expresaron en pg/ml. La determinación de proBNP no precisó incrementar la cantidad de muestra sanguínea realizada habitualmente para la determinación bioquímica de rutina.
El tratamiento farmacológico del DAP empleado en nuestro centro es el ibuprofeno por vía intravenosa (3 dosis cada 24 h, la primera a 10mg/kg y la segunda y tercera a 5mg/kg) y en los casos en que este está contraindicado (trombocitopenia, ECN, HIV, hemorragia activa o insuficiencia renal), se emplea como alternativa paracetamol por vía intravenosa (durante 5 días a 15mg/kg cada 6 h).
Posteriormente, se realizaron niveles seriados de proBNP coincidiendo con los controles ecocardiográficos. Se realizó control ecocardiográfico a aquellos pacientes que recibieron tratamiento, dentro de las 24 h siguientes a la finalización de cada ciclo farmacológico, decidiéndose en ese momento nueva tanda de tratamiento en caso de persistir criterios de DAP-HS o actitud expectante si el ductus estaba cerrado o permanecía abierto pero sin criterios de compromiso hemodinámico.
Se estableció el diagnóstico de DAP-HS sobre la base de los criterios ecocardiográficos previamente definidos9.
Fueron excluidos los RNPT a los que no se les realizó la evaluación ecocardiográfica y bioquímica (por fallecimiento previo al despistaje del DAP o por ser mayores de 28 SEG y 1.000 g sin sospecha clínica de DAP), aquellos que presentaban otra patología cardiaca importante, que generase sobrecarga circulatoria (salvo el DAP), aquellos con signos ecocardiográficos de hipertensión pulmonar que contraindicaban el tratamiento en el momento de la evaluación ecocardiográfica y los que presentaron sepsis clínica en el momento del estudio cardiológico y analítico. Se definió sepsis clínica como el aumento de marcadores de infección acompañado de síntomas, como alteraciones en la temperatura, vómitos, irritabilidad, taquipnea o taquicardia y episodios recurrentes de apnea. El motivo de exclusión se debió a que los niveles de proBNP pueden encontrarse aumentados en situaciones de infección sistémica sin presentar DAP20.
El protocolo de estudio fue aprobado por el Comité ético de investigación clínica de Aragón.
Para la obtención de los datos se realizó una revisión de las historias clínicas de los pacientes, recogiendo variables antenatales y del periodo neonatal inmediato (tipo de embarazo (único o gemelar), sexo, motivo del parto, administración de corticoides prenatales, edad gestacional, antropometría al nacimiento, test de Apgar, reanimación en la sala de partos, administración de surfactante endotraqueal), variables de evolución neonatal (soporte respiratorio y hemodinámico, desarrollo de DBP, ECN, HIV, IR, sepsis tardía, ROP y defunción), hallazgos ecocardiográficos, ecografía cerebral y determinaciones analíticas (hemograma, iones, creatinina y niveles seriados de proBNP).
Análisis estadísticoTodos los datos se registraron en una base de datos con el paquete estadístico SPSS statistics 21.0 y fueron analizados en la misma.
Se realizó un estudio descriptivo para conocer frecuencias, medidas de tendencia central y medidas de dispersión. El estudio analítico se realizó mediante el test de Kolmogorov-Smirnov y el test de Saphiro-Wilk para análisis de normalidad de las variables cuantitativas, y para la comparación de dichas variables entre los subgrupos se utilizó el test de la U de Mann-Whitney (2 muestras con datos independientes), el test de Wilcoxon (2 muestras con datos relacionados) y el test de Kruskal-Wallis (varias muestras con datos independientes). Para las variables cualitativas se utilizó el test de la chi al cuadrado o test exacto de Fisher.
ResultadosSe obtuvo una muestra de 60 pacientes, con una edad gestacional media de 27,88±2,18 semanas y un peso medio al nacimiento de 954,22±271,20 g. Las características descriptivas de la muestra y causas del parto prematuro se exponen en las tablas 1 y 2.
Motivo del parto prematuro
| Motivo del parto | Frecuencia (%) |
|---|---|
| Dinámica de parto y/o rotura prematura bolsa | 24 (40) |
| Crecimiento intrauterino restringido y/o Doppler patológico | 12 (20) |
| Corioamnionitis | 11 (18,3) |
| Preeclampsia materna | 3 (5) |
| Síndrome de HELLP materno | 3 (5) |
| Desprendimiento de placenta | 3 (5) |
| Riesgo de pérdida de bienestar fetal | 2 (3,3) |
| Prolapso de cordón | 2 (3,3) |
El algoritmo de actuación diagnóstico-terapéutico del DAP se refleja en la figura 1.
De entre los pacientes de menos de 28 SEG y/o menos de 1.000 g de peso al nacimiento, el 75,6% de la muestra presentó DAP (85,3% de estos fueron DAP-HS).
Se dividió la muestra en 2 subgrupos, el primero correspondiente a los pacientes con DAP-HS (n=37) y el segundo a los pacientes sin DAP-HS (n=23), incluyendo este grupo a los pacientes con DAP pero no hemodinámicamente significativo y a los pacientes con el DA cerrado en la primera ecografía.
No se encontraron diferencias en los datos relativos al nacimiento, salvo en la variable del peso, siendo menor en los pacientes con DAP-HS (902,35±288,29g vs. 1.037,65±222,36g; p=0,018).
Se encontraron diferencias estadísticamente significativas entre ambos grupos en cuanto a la necesidad de soporte respiratorio, siendo este mayor en el grupo con DAP-HS (tabla 3).
Necesidad de soporte respiratorio en relación al diagnóstico de DAP-HS
| DAP-HS | DAP no HS | p | |
|---|---|---|---|
| % | % | ||
| Ventilación mecánica | 88,9% | 58,3% | 0,006 |
| VAFO | 37,1% | 4,3% | 0,004 |
| Ventilación mecánica a los 28 días de vida | 29,4% | 4,5% | 0,036 |
| CPAP a los 28 días de vida | 58,8% | 41,2% | 0,190 |
| Oxígeno a las 36 semanas de edad corregida | 37,5% | 9,1% | 0,019 |
| Oxígeno al alta | 23,1% | 0% | 0,026 |
CPAP: presión positiva continua en la vía aérea; VAFO: ventilación de alta frecuencia oscilatoria.
No se encontró correlación estadísticamente significativa entre los niveles de proBNP y la edad gestacional y el peso al nacimiento.
Se encontraron diferencias estadísticamente significativas entre los niveles de proBNP de los RNPT con DAP y aquellos en los que se evidenció cierre ductal en la primera ecografía (29.773±33.778,74pg/ml vs. 3.722,5±2.669,76; p=0,000); entre los que presentaron DAP-HS y los que no tenían DAP con afectación hemodinámica (33.338,1±39.325,6pg/ml vs 3.390,7±2.338,3pg/ml; p=0,000). Dentro del subgrupo de RNPT sin DAP-HS, en un total de 6 pacientes se evidenció DAP pero sin signos ecocardiográficos de repercusión hemodinámica; en este subgrupo los niveles de proBNP fueron de 4.387,1±2.260,2pg/ml, encontrando diferencias estadísticamente significativas respecto al grupo con DAP-HS (p=0,000).
Los niveles de proBNP iniciales fueron también significativamente mayores en los RNPT que finalmente precisaron ligadura quirúrgica (30.596,82±14.910,94pg/ml vs. 19.221,13±32.891,21pg/ml; p=0,004).
Finalmente, se comprobó que el porcentaje de descenso de los niveles de proBNP fue significativamente mayor en el grupo en el que se constató cierre ductal tras el tratamiento (68±24,69% vs. –12,22±99,4%; p=0,030) (figs. 2 y 3).
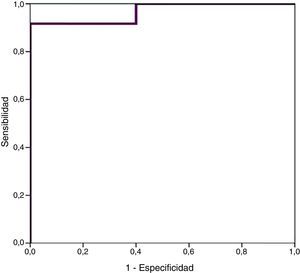
Mediante curvas ROC se calcularon los puntos de corte óptimos en nuestra población en relación con el diagnóstico de DAP, DAP-HS y riesgo de precisar ligadura quirúrgica (tabla 4; fig. 4).
El DAP es una patología prevalente entre los RNPT, que aumenta de forma inversamente proporcional a la edad gestacional y peso al nacimiento.
Puede ser una causa importante de morbimortalidad en los recién nacidos más inmaduros, aumentando el riesgo de desarrollar determinadas patologías propias de esta población e incluso se ha especulado con un mayor riesgo de desarrollar DBP si bien este hecho sigue siendo controvertido7,8,21. Por este motivo, las estrategias para conseguir su cierre son aun motivo de debate, ya que la optimización de su manejo mediante la selección de los pacientes candidatos a tratamiento es clave para reducir probablemente dicha morbimortalidad pero sin tratar a aquellos que no lo precisen, ya que el tratamiento presenta efectos adversos12,22.
En los últimos años continúa la controversia sobre los criterios y el momento idóneo para el tratamiento del DAP, sin existir indicaciones universalmente aceptadas para su manejo. Así, las estrategias han ido modificándose, desde estrategias ya menos empleadas, como el tratamiento profiláctico en los primeros días de vida, hasta llegar en la actualidad a estrategias dirigidas a tratar a aquellos RNPT con DAP con compromiso hemodinámico9,13,21,23.
En nuestra población, el 71,7% de los pacientes presentó DAP en la primera ecografía, cifra algo superior a lo referido en la bibliografía, donde se refieren tasas en torno al 50% para la presencia de DAP en los RNPT de menos de 32 SEG y/o menos de 1.500g de peso al nacimiento24, si bien en otras series alcanza el 60-70%25. En nuestra serie este dato se ve influenciado porque la exclusión de aquellos que no tuvieran realizada ecocardiografía influía fundamentalmente en la franja entre 28 y 32 SEG.
De entre los pacientes de menos de 28 SEG y/o menos de 1.000g de peso al nacimiento, el 75,6% de la muestra presentó DAP (85,3% de estos fueron DAP-HS).
En nuestra muestra, se encontró una asociación entre los niveles de proBNP en las primeras 48-72 h de vida y la presencia de DAP, lo que, en la línea de lo expuesto por otros autores26,27, parece indicar que los niveles de proBNP son un parámetro fiable para predecir la presencia o ausencia de DAP.
Además, el 61,7% presentó DAP-HS, objetivándose niveles de proBNP en estos pacientes superiores a los encontrados en el grupo sin DAP-HS (que incluía a aquellos con ductus abierto pero no hemodinámicamente significativo y aquellos con ductus arterioso cerrado). Teniendo en cuenta únicamente a los pacientes con DAP, también se objetivó que el proBNP es capaz de diferenciar a aquellos con afectación hemodinámica. Mediante curva ROC, se obtuvo un valor de corte óptimo para el DAP-HS en nuestra población de 9.321,50pg/ml, con una sensibilidad del 91,7% y una especificidad del 100%, lo que supone que, en nuestra población, una concentración plasmática de proBNP por encima de este valor es indicativa de DAP-HS, apoyando a la ecocardiografía en la indicación de tratamiento médico. El punto de corte obtenido, además, también presenta una sensibilidad óptima, de forma que, por debajo de este nivel, pocos casos con DAP-HS quedan sin identificar. Sobre la base de estos hallazgos, nuestro estudio confirma que los niveles de proBNP son un parámetro fiable para identificar el DAP con afectación hemodinámica. En línea con este resultado, en otras poblaciones17,27,28 se ha tratado el DAP sobre la base de las determinaciones analíticas de este marcador bioquímico, sin esperar a la realización de ecocardiografía, confirmándose que sólo un pequeño porcentaje de DAP-HS no recibe tratamiento mediante esta estrategia y pocos pacientes son tratados innecesariamente. En cualquier caso, creemos razonable no apoyarse exclusivamente en los niveles de proBNP de cara a la indicación de tratamiento y que la ecocardiografía continúa siendo el método gold standard para el diagnóstico del DAP. Los niveles de proBNP deberían ser considerados como una herramienta adicional a la ecocardiografía.
Por otro lado, en consonancia con otras series17,27, se ha constatado que el porcentaje de disminución de los niveles de proBNP se correlaciona bien con el cierre del DAP, prediciéndolo con fiabilidad si esta caída es significativa29.
Asimismo, en nuestro población se objetivó que los niveles de proBNP iniciales se relacionan con una mayor incidencia de cierre quirúrgico del ductus17, aunque en este caso la utilidad clínica para predecir el tratamiento quirúrgico se ve limitada por una especificidad y una sensibilidad reducidas, y la importante controversia respecto a esta alternativa que hace que la variabilidad entre unidades de Neonatología sea muy importante.
En conclusión, los resultados obtenidos en nuestra población permiten confirmar comunicaciones previas18,19,26-28 en las que los niveles de proBNP se han relacionado con la sobrecarga hemodinámica producida por el DAP en el RNPT. Este marcador se relaciona con la presencia o ausencia de DAP hemodinámicamente significativo y sus variaciones con la respuesta al tratamiento.
La presencia de unos niveles elevados de proBNP apoyan a los hallazgos ecocardiográficos en la necesidad de tratamiento médico y su disminución informa adecuadamente de la buena respuesta a éste.
Aunque la ecocardiografía es y seguirá siendo el método diagnóstico principal del DAP, los hallazgos de nuestro trabajo permiten proponer el proBNP como una herramienta adicional a esta en el diagnóstico y seguimiento evolutivo del DAP, pudiéndonos apoyar en sus niveles a la hora de tomar decisiones en su manejo.
En cualquier caso, es necesario realizar estudios prospectivos con un mayor tamaño muestral para obtener puntos de corte más fiables en los niveles de proBNP en relación a esta patología30.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado como comunicación oral en el 63.° Congreso de la Asociación Española de Pediatría (Bilbao, junio del 2015). Premio Mención Especial a las mejores comunicaciones orales del 63.° Congreso de la AEP (Bilbao, junio 2015).