El índice neutrófilo-linfocito (INL) es un biomarcador inflamatorio fácilmente calculable a partir del recuento diferencial de leucocitos. El objetivo de este estudio es analizar el papel del INL en la detección de apendicetomías negativas, y comparar su utilidad con otros factores clínicos, ecográficos y de laboratorio previamente descritos.
MétodosEstudio retrospectivo en pacientes menores de 16 años con sospecha de apendicitis aguda intervenidos en nuestra institución entre 2017-2020, que fueron divididos en 2 grupos según hallazgos histológicos apendiculares: Grupo AN: apendicitis negativa; ausencia de inflamación y grupo AP: apendicitis positiva; presencia de inflamación en la pared apendicular. Se analizaron las características demográficas, clínicas, ecográficas y de laboratorio.
ResultadosSe incluyeron 1.269 pacientes (1.244 en el grupo AP; 25 en el grupo AN), sin diferencias demográficas entre ellos. Los pacientes del grupo AN presentaron un porcentaje significativamente menor de náuseas y vómitos en comparación con el grupo AP (p<0,001) y menor diámetro ecográfico apendicular (8,1±2,1 vs. 9,7±2,8mm; p<0,001). Los recuentos de leucocitos, neutrófilos e INL fueron significativamente superiores en el grupo AP (p<0,001), así como la proteína C reactiva (18,6 vs. 2,6; p=0,005). El análisis mediante curva ROC mostró que el INL fue el parámetro con mayor AUC (0,879) para el diagnóstico de apendicitis negativa, con un punto de corte de 2,65 con una sensibilidad del 84,2% y una especificidad del 83,8% máximas.
ConclusionesEl INL es el parámetro preoperatorio que mejor distingue a los pacientes sin apendicitis aguda. Los valores inferiores a 2,65 deben hacernos sospechar otra causa diferente a la apendicitis.
The neutrophil-to-lymphocyte ratio (NLR) is an inflammatory biomarker that is easily calculated with data from the differential white blood cell count. The aim of our study was to analyse the role of the NLR in the detection of negative appendectomies and to compare its usefulness with other clinical, sonographic and laboratory factors previously described.
MethodsWe conducted a retrospective study in patients aged less than 16 years who underwent appendectomy in our hospital between 2017 and 2020. We divided patients into 2 groups based on appendiceal histological findings: NA group (negative appendicitis: absence of appendiceal inflammation) and PA group (positive appendicitis: presence of inflammation in any layer of the appendiceal wall). We analysed demographic, clinical, sonographic and laboratory characteristics.
ResultsWe included a total of 1269 patients, 1244 in the PA group and 25 in the NA group, with no differences between groups in demographic characteristics. The proportion of patients that presented with nausea and vomiting was significantly smaller in the NA group compared to the PA group (P<.001), and there were no other differences in symptoms. The appendiceal diameter on ultrasound was significantly smaller in the NA group (8.1±2.1 vs. 9.7±2.8mm; P<.001). The white blood cell and neutrophil counts and the NLR were significantly higher in the PA group (P<.001), as was the level of C-reactive protein (18.6 vs. 2.6; P=.005). The ROC curve analysis revealed that the NLR was the parameter with the highest AUC (0.879) for the diagnosis of negative appendicitis, with a cut-off point of 2.65 for a maximum sensitivity of 84.2% and specificity of 83.8%.
ConclusionThe NLR is the preoperative parameter that best discriminates patients without acute appendicitis. Values of less than 2.65 should make clinicians contemplate diagnoses other than appendicitis.
La apendicitis aguda (AA) es la urgencia quirúrgica más frecuente en la edad pediátrica1. La progresión natural de la inflamación aguda a la perforación y la peritonitis típicamente transcurre en un intervalo de unos pocos días2. El diagnóstico precoz y preciso de la AA es crucial para evitar la perforación del apéndice, que puede causar morbilidad grave o incluso la muerte si no se trata3. Por lo tanto, idealmente, la apendicitis debería diagnosticarse y tratarse antes de la rotura del apéndice, limitando a la vez el número de apéndices normales operados, lo que se conoce como apendicetomía negativa (AN)4. En el pasado, varios estudios justificaban la alta tasa de AN en base a la necesidad de evitar la perforación del apéndice. Se suponía que la morbilidad asociada a la AN no era tan grave en comparación con el riesgo de perforación del apéndice5.
Sin embargo, en los últimos años se ha descrito que la AN se asocia a estancias hospitalarias más largas, una mayor morbilidad y costes más altos en comparación con la apendicetomía en pacientes con apendicitis no perforada6. Por ello, numerosos estudios han intentado mejorar la precisión del diagnóstico de AA y reducir la tasa de AN mediante la aplicación de escalas clínicas y técnicas de imagen7,8. Parámetros analíticos como el recuento de leucocitos y la proteína C reactiva (PCR) se encuentran elevados en diversas afecciones inflamatorias, incluyendo la AA. Distintos autores han intentado establecer puntos de corte para predecir el diagnóstico preoperatorio de AA, con resultados contradictorios9,10.
El índice neutrófilo-linfocito (INL) es un biomarcador inflamatorio fácilmente calculable a partir del recuento diferencial de leucocitos. Su papel en la predicción de la peritonitis y los abscesos intraabdominales postoperatorios en niños se ha descrito recientemente11,12. No obstante, su utilidad en la predicción de la apendicetomía negativa no se ha descrito hasta la fecha. El objetivo de este estudio es analizar el papel del INL en la detección de apendicetomías negativas, y comparar su utilidad con otros factores clínicos, ecográficos y de laboratorio previamente descritos.
MétodosSe llevó a cabo un estudio retrospectivo en pacientes menores de 16 años con sospecha de apendicitis aguda intervenidos en nuestra institución entre enero de 2017 y diciembre de 2020. Se dividió a los pacientes en 2 grupos según los hallazgos histológicos apendiculares: grupo AN: apendicitis negativa; ausencia de inflamación y grupo AP: apendicitis positiva; presencia de inflamación en la pared apendicular. El grupo AP incluyó a pacientes con inflamación leve de la mucosa apendicular, inflamación transmural y perforación de la pared con signos de inflamación. El estudio histológico del apéndice cecal lo llevaron a cabo los mismos 2 patólogos en todos los pacientes. Se excluyó a pacientes sometidos a apendicetomía incidental como parte de otra intervención o apendicetomías diferidas o de intervalo tras tratamiento conservador por apendicitis perforada. El diagnóstico se confirmó mediante ecografía abdominal en todos los casos.
Se analizaron las características demográficas, los factores clínicos, el tiempo de evolución, los hallazgos ecográficos y los de laboratorio. En lo concerniente a los factores clínicos, se recogieron la presencia de dolor en la fosa ilíaca derecha, fiebre (definida como temperatura ≥37,5°C), náuseas, vómitos, diarrea, estreñimiento, disuria, anorexia y síntomas de vías respiratorias altas. Los hallazgos ecográficos incluyeron el diámetro apendicular, la presencia de inflamación periapendicular, fluido peritoneal o pélvico, linfadenopatía adyacente o apendicolito. Se obtuvieron datos de laboratorio de las analíticas de sangre realizadas en el servicio de urgencias a la llegada del paciente, incluyendo recuento diferencial de leucocitos (valores absolutos de leucocitos, neutrófilos, linfocitos, monocitos, basófilos y eosinófilos), bioquímica (ionograma, glucosa, urea, fibrinógeno) y PCR. El INL se calculó dividiendo el valor absoluto de neutrófilos por el de linfocitos. El protocolo del estudio se adhirió a los principios de la Declaración de Helsinki de 1975 y fue aprobado por la junta de revisión institucional y el comité ético del hospital. El consentimiento informado no fue necesario debido a la naturaleza retrospectiva del estudio y la anonimización de los datos de laboratorio recogidos, de acuerdo con las guías institucionales.
Los datos se recogieron en hojas de Microsoft Excel® versión 2010 (Redmond, WA, EE. UU.), y se analizaron con el software SPSS® Statistics versión 22 (Chicago, IL, EE UU). La distribución de las variables numéricas se comprobó mediante las pruebas de Kolmogorov-Smirnov y de Shapiro-Wilk. Las variables continuas con distribución normal se expresaron como media y desviación estándar (DE) y se compararon mediante la prueba t de Student para muestras independientes. En el caso de las variables continuas que no seguían una distribución normal, los datos se resumieron como mediana y rango intercuartílico (RIC) y se compararon con la U de Mann-Whitney. Las variables categóricas se expresaron mediante frecuencia absolutas (n) y porcentajes (%), y se analizaron con la prueba Chi-cuadrado o, de no poderse aplicar, el test exacto de Fisher. Se realizó un análisis de regresión logística binomial para determinar qué características clínicas y ecográficas se asociaban a la apendicitis positiva versus la apendicitis negativa. Se calcularon odds ratio (OR) con sus intervalos de confianza del 95%. A continuación, se realizó un análisis multivariado incluyendo las variables positivas en el análisis bivariado. Se generaron curvas características operativas del receptor (ROC) para las variables continuas. Se calculó el área bajo la curva (AUC) y se identificaron puntos de corte apropiados para determinar la sensibilidad y la especificidad (índice de Youden)13. Todos los análisis estadísticos se realizaron a 2 colas, y se definió la significación estadística como una p<0,05.
ResultadosSe incluyeron 1.269 pacientes (793 varones y 476 mujeres) con una edad mediana al diagnóstico de 10,5 años (RIC: 8,1-12,9). Se dividieron en 2 grupos según hallazgos histológicos apendiculares (1.244 en el grupo AP y 25 en el grupo AN), sin diferencias en las características demográficas entre ellos. En lo respectivo a la clínica, en el grupo AN hubo un porcentaje significativamente menor de pacientes con náuseas y vómitos en comparación con el grupo AP (p<0,001), sin diferencias en el resto de los síntomas. En cuanto a los hallazgos ecográficos, el diámetro ecográfico apendicular fue de 8,1±2,1 en el grupo AN, significativamente menor que en el grupo AP (9,7±2,8; p<0,001). La presencia de inflamación periapendicular también fue significativamente menos frecuente en pacientes sin apendicitis en comparación con el grupo AP (56 vs. 83,6%; p<0,001). No se encontraron diferencias en el resto de los hallazgos ecográficos. Las características demográficas, manifestaciones clínicas y hallazgos ecográficos de los pacientes de cada grupo se presentan en la tabla 1. El análisis multivariado no encontró correlación alguna entre las variables con asociación positiva en el análisis bivariado: náuseas (p=0,075), vómitos (p=0,218) e inflamación periapendicular (p=0,063).
Características demográficas, clínicas y ecográficas de los 2 grupos
| Grupo AP (n=1.244) | Grupo AN (n=25) | OR (IC 95%) | Valor de p | |
|---|---|---|---|---|
| Sexo; n (%)VarónMujer | 778 (62,5%)466 (37,5%) | 15 (60%)10 (40%) | 1,11 (0,50-2,50) | 0,795 |
| Edad (años); mediana (RIC) | 10,5 (8,1-12,8) | 11,7 (9,8-14) | — | 0,032 |
| Síntomas asociados; n (%)Dolor FIDFiebreNáuseasVómitosDiarreaEstreñimientoDisuriaAnorexiaSíntomas vías respiratorias altas | 951 (76,4%)376 (30,2%)844 (67,8%)735 (59,1%)156 (12,5%)55 (4,4%)93 (7,5%)480 (38,6%)68 (5,5%) | 19 (76%)8 (32%)6 (24%)5 (20%)3 (12%)1 (4%)1 (4%)7 (28%)2 (8%) | 1,02 (0,41-2,59)0,92 (0,39-2,15)6,68 (2,65-16,86)5,78 (2,15-15,49)1,05 (0,31-3,55)1,11 (0,15-8,35)1,93 (0,26-14,5)1,62 (0,67-3,90)0,66 (0,15-2,88) | 0,9890,848<0,001<0,0010,9360,9190,5100,2800,583 |
| Tiempo de evolución (horas); mediana (RIC) | 24 (12-36) | 24 (16,5-48) | — | 0,263 |
| Diámetro apendicular eco (mm); media±DE | 9,7±2,8 | 8,1±2,1 | — | 0,002 |
| Hallazgos ecográficos; n (%)Inflamación periapendicularFluido peritoneal/pélvicoLinfadenopatía adyacenteApendicolito | 1.040 (83,6%)812 (65,3%)385 (30,9%)342 (27,5%) | 11 (56%)17 (68%)8 (33,3%)2 (8%) | 4,0 (1,79-8,95)0,88 (0,37-2,07)0,95 (0,41-2,23)4,36 (1,02-18,6) | <0,0010,7770,9100,030 |
AN: apendicitis negativa; AP: apendicitis positiva; DE: desviación estándar; eco: ecografía; FID: fosa ilíaca derecha; IC: intervalo de confianza; OR: odds ratio; RIC: rango intercuartílico.
El análisis de los hallazgos de laboratorio reveló diferencias significativas en el recuento diferencial de leucocitos. Los recuentos de leucocitos y neutrófilos y el INL fueron significativamente mayores en el grupo AP (p<0,001). En cambio, los pacientes en el grupo AN tuvieron recuentos mayores de linfocitos, monocitos, basófilos y eosinófilos en comparación con los del grupo AP, todas ellas diferencias significativas. La mediana del nivel de PCR en el grupo AN fue 2,6, significativamente menor en comparación con el grupo AP (18,6; p=0,005). No hubo diferencias significativas en el recuento plaquetario o los niveles de fibrinógeno, glucosa, urea e iones. La tabla 2 compara los hallazgos analíticos al ingreso en ambos grupos.
Comparación de los valores analíticos al ingreso en los 2 grupos
| Grupo AP | Grupo AN | Valor de p | |
|---|---|---|---|
| Leucocitos (103/μl) | 15.395 (12.252-18.300) | 7.400 (6.425-9.150) | <0,001 |
| Neutrófilos(103/μl) | 12.337 (9.299-15.366) | 4.181 (3.185-6.320) | <0,001 |
| Linfocitos (103/μl) | 1.621 (1.120-2.278) | 2.111 (1.629-2.927) | 0,001 |
| Monocitos (103/μl) | 824,5 (576,2-1.115,8) | 572 (500-838) | 0,003 |
| Eosinófilos (103/μl) | 72,1 (25-182) | 207 (44,4-275) | 0,009 |
| Basófilos (103/μl) | 34 (18,8-52,6) | 44,5 (36,5-66,3) | 0,005 |
| INL | 7,6 (4,4-12,4) | 1,9 (1,1-3,0) | <0,001 |
| Plaquetas (/μl) | 279.000 (237.000-323.000) | 286.000 (236.000-328.000) | 0,663 |
| PCR (mg/l) | 18,6 (5,3-53,7) | 2,9 (0,8-19,3) | 0,005 |
| Glucosa (mg/dl) | 97 (87-110) | 90 (85-100) | 0,065 |
| Urea (mg/dl) | 27 (22-32) | 30 (22-33) | 0,984 |
| Fibrinógeno (mg/dl) | 409 (323-519) | 346 (281-455) | 0,051 |
| Electrolitos (mmol/l)SodioPotasioCloro | 137,2 (135,8-139)4 (3,8-4,2)103 (101-106) | 139 (137,1-140,5)4,1 (3,8-4,3)105 (103-107) | 0,0620,5850,110 |
AN: apendicitis negativa; AP: apendicitis positiva; INL: índice neutrófilo-linfocito; PCR, proteína C reactiva.
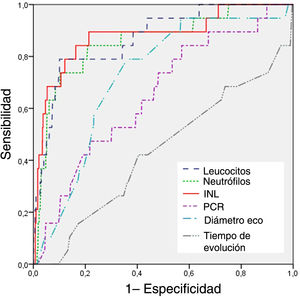
El análisis de la sensibilidad y de la especificidad de las variables continuas mediante curvas ROC (tabla 3) mostró que el INL era el parámetro con el mayor AUC (0,879) para el diagnóstico de apendicetomía negativa. Se estableció un punto de corte de 2,65 con una sensibilidad del 84,2% y una especificidad del 83,8% máximas y un valor predictivo positivo del 95,7%. El AUC del INL fue significativamente superior en comparación con los del recuento de neutrófilos (0,871), el recuento leucocitario (0,857) y el diámetro ecográfico del apéndice (0,723), diferencias que fueron estadísticamente significativas (p<0,001). Las curvas ROC de los hallazgos de laboratorio, el diámetro ecográfico apendicular y el tiempo de evolución para la predicción de la apendicitis negativa se muestran en la figura 1.
Área bajo la curva ROC para la apendicetomía negativa,
| AUC (IC 95%) | Punto de cote | Sensibilidad | Especificidad | P | |
|---|---|---|---|---|---|
| INL | 0,879 (0,788-0,971) | 2,65 | 84,2% | 83,8% | <0,001 |
| Neutrófilos (103/μL) | 0,871 (0,790-0,951) | 7600 | 78,9% | 89,6% | <0,001 |
| Leucocitos (103/μL) | 0,857 (0,765-0,949) | 9200 | 73,7% | 89,8% | <0,001 |
| Diámetro eco (mm) | 0,723 (0,623-0,823) | 8,0 | 78,9% | 63,9% | 0,003 |
| PCR (mg/L) | 0,652 (0,532-0,772) | 24,5 | 84,2% | 42,7% | 0,023 |
| Tiempo de evolución (horas) | 0,433 (0,294-0,573) | 18 | 42,1% | 59,5% | 0,320 |
AUC, área bajo la curva; eco, ecografía; IC, intervalo de confianza; INL, índice neutrófilo-linfocito; PCR, proteína C reactiva.
La significación estadística se definió como AUC> 0,600 y P <0,05.
En este estudio retrospectivo unicéntrico se analizaron datos de 1.269 pacientes sometidos a apendicetomía en nuestro hospital en los últimos 4 años para determinar el papel del INL como predictor de la apendicetomía negativa, comparándolo con factores clínicos, ecográficos y de laboratorio empleados con anterioridad. En función de nuestros hallazgos, el INL puede considerarse el parámetro preoperatorio con la sensibilidad y la especificidad más altas para la predicción de la ausencia de apendicitis en casos con sospecha clínica.
Históricamente, el dogma quirúrgico justificaba una tasa de AN de hasta el 15-25% para evitar resultados negativos como la perforación, la peritonitis, los abscesos o estancias hospitalarias prolongadas14. En niños, la tasa que se consideraba aceptable era aún mayor, quizá debido a la dificultad de realizar una anamnesis y examen físico fidedignos en niños pequeños. No obstante, hace tiempo que se ha abandonado la posición de que la tasa de AN está inversamente relacionada con la tasa de apendicitis perforada5. Las tasas de AN reportadas han disminuido considerablemente en la última década con la urgencia de modalidades de imagen avanzadas, como la ecografía y los estudios de imagen por cortes4,15.
La literatura actual describe tasas de AN de entre el 1 y el 10%16,17. Esta variabilidad podría deberse a diferencias en las definiciones de apendicitis y apendicetomía negativa aplicadas por las instituciones en el cálculo de la tasa de AN, ya que la mayoría de los estudios publicados no proveen definiciones basadas en los hallazgos patológicos. Aunque la inflamación transmural del apéndice es la definición más común, algunas instituciones, como nuestro hospital, incluyen la inflamación o ulceración de la mucosa como signo de apendicitis temprana. La tasa de AN en nuestro estudio fue del 2%, similar a la reportada recientemente en la población pediátrica9.
A pesar de su ubicuidad, diagnosticar la apendicitis aguda puede ser mucho más complicado en niños que en adultos, pues los hallazgos de la anamnesis y el examen físico en niños pueden ser atípicos y resultar difícil obtenerlos en un niño poco cooperador18,19. Tras revisar todos los casos de AN en nuestro hospital en los últimos 4 años, concluimos que los factores clínicos tampoco eran útiles para identificar los falsos positivos. En nuestro estudio, el porcentaje de pacientes que presentó con náusea y vómitos fue mayor en el grupo AP que en el grupo AN, aunque no hubo diferencias significativas en ninguno de los otros síntomas. Por lo tanto, es necesario utilizar otras pruebas para orientar el diagnóstico de apendicitis en la infancia.
La ecografía abdominal, que es el patrón de oro de imagen en la edad pediátrica, también puede ser menos informativa que en pacientes adultos por las dificultades en su realización. Además, como la ecografía es una técnica operador dependiente, su sensibilidad y especificidad para el diagnóstico de apendicitis dependen de la experiencia del radiólogo con pacientes pediátricos20. En nuestro hospital se realiza una ecografía en todos los pacientes pediátricos con sospecha de apendicitis. El diámetro apendicular fue significativamente mayor en el grupo AP (9,7mm), lo que se debe a la inflamación progresiva de la pared del apéndice, que causa un aumento en el diámetro que progresa desde la punta hacia la base. Un punto de corte de 8mm permitía la identificación de la apendicetomía negativa con una sensibilidad del 80%, lo que fue similar a estudios anteriores20,21. La presencia de inflamación periapendicular es el otro hallazgo ecográfico encontrado con mayor frecuencia en pacientes con AA. Sin embargo, en el análisis multivariado no fue útil para distinguir a los pacientes que resultaron no tener apendicitis en base a los hallazgos histopatológicos, lo que podría explicarse en parte por la baja tasa de AN en nuestro centro.
Por otro lado, los parámetros analíticos se determinan con facilidad y, al contrario que el diagnóstico de imagen, no requieren cualificaciones o experiencia para su obtención o interpretación ni aumentan los costes incurridos por el paciente o el hospital22. En lugar de utilizar los parámetros analíticos como valores dicotómicos (presente o ausente, según un punto de corte establecido), se decidió tratarlos como variables continuas para evaluar su rendimiento conforme cambiaba el umbral de discriminación. No obstante, debido a la relativa escasez de las AN (25/1.269 apendicetomías) las curvas ROC fueron algo irregulares.
Nuestros resultados sugieren que el INL funciona bien como una variable continua, con un AUC de 0,879, una sensibilidad del 84,2% y una especificidad del 83,8% aplicando un punto de corte de 2,65. Es el parámetro que identifica a pacientes sin apendicitis con mayor precisión, seguido del recuento de neutrófilos (AUC=0,871) y el de leucocitos (AUC=0,857). Goodman et al. fueron los primeros en proponer que el INL era más útil que el recuento leucocitario en el diagnóstico de la AA23. En los años siguientes se realizaron estudios para investigar la asociación entre el INL y la gravedad de la AA, el abordaje clínico y las complicaciones12,24,25. No obstante, el papel del INL como predictor de la apendicetomía negativa en niños no se ha descrito hasta la fecha, por lo que nuestro estudio representa una exploración inicial sobre este tema. Se ha demostrado que el recuento de neutrófilos es más útil que el de leucocitos tanto para el diagnóstico de AA como para la evaluación del grado de apendicitis simple o complicada26. En cualquier caso, el INL aumenta la precisión diagnóstica con respecto a los recuentos de neutrófilos y de leucocitos porque la respuesta inmune desencadenada por factores infecciosos, isquémicos o inflamatorios produce un aumento del recuento de neutrófilos mediado por factores de crecimiento en progenitores hematopoyéticos y un descenso en el recuento de linfocitos debido a la apoptosis mediada por el factor de necrosis tumoral alfa (TNF-α)27. En este contexto, el INL también es un marcador más precoz de la respuesta de fase aguda en comparación con la PCR, ya que los neutrófilos reunidos en la médula ósea responden con más rapidez a la inflamación aguda. En cambio, la proteína C reactiva se tiene que sintetizar en el hígado en respuesta a la activación de la interleucina 6 y la vía de las citocinas, lo que resulta en un retraso28. Por añadidura, comparado con la PCR, el INL solo requiere una prueba sencilla que no aumenta el coste de la atención del paciente y que se puede calcular con facilidad con parámetros que están incluidos en el hemograma.
Las limitaciones de este estudio se derivan de su diseño unicéntrico y retrospectivo. Además, debido a la baja frecuencia de la AN, hubo una gran diferencia en el tamaño de los dos grupos. Aun así, se encontraron diferencias significativas en parámetros analíticos entre ambos grupos que permitirían identificar a pacientes en los que deberían evitarse las apendicetomías negativas, ya que son intervenciones innecesarias que suponen una carga considerable tanto para los pacientes como para el sistema de salud.
ConclusionesEl INL es el parámetro preoperatorio que mejor distingue a los pacientes sin apendicitis aguda. Los valores inferiores a 2,65 deben hacernos sospechar otra causa diferente a la apendicitis. Es una herramienta de cribado simple y de bajo coste que debería tenerse en consideración para evitar apendicetomías negativas.
FinanciaciónEsta investigación no recibió ninguna subvención específica de organismos de financiación del sector público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.