La tuberculosis (TB) continúa siendo un reto en la edad pediátrica. Las dificultades en su diagnóstico y la escasa experiencia en su tratamiento en la infancia y adolescencia son algunas de las razones para considerar la necesidad de centros especializados en tuberculosis pediátrica y priorizar a la población pediátrica en los programas de control de tuberculosis, especialmente en países de baja incidencia. Descripción de casos de tuberculosis pediátrica tratados en un centro ambulatorio especializado en TB.
Pacientes y métodosAnálisis retrospectivo de datos epidemiológicos y clínicos de casos de TB en pacientes menores de 18 años en el período de enero de 2007 a junio de 2017.
ResultadosSe identificaron 46 casos de TB, con una edad media de 5 años (RIC: 1,75-13,25). Treinta casos (65,2%) se identificaron en contexto de cribado por exposición conocida a la TB. En 36 pacientes (78%), la duración mediana de los síntomas fue de 2 semanas, y los síntomas más frecuentes fueron tos (54%) y fiebre (48%). La radiografía de tórax fue anormal en el 73,9% de los pacientes, y se realizó TC en el 82,2%, cuyos hallazgos proporcionaron claves importantes para la decisión de tratar en el 85,3%. A pesar de recogerse distintas muestras microbiológicas, solo se confirmó el diagnóstico en 12 casos (26,1%). Las pruebas de cultivo y/o de amplificación de ácidos nucleicos fueron positivas en el 33,3% de las muestras de esputo, el 28,1% de las de lavado broncoalveolar y el 12,9% de las de aspirado gástrico. La TB pulmonar fue el diagnóstico más frecuente (n=31), seguida de la TB pleural (n=6), la linfadenitis tuberculosa (n=3), la uveítis (n=2), la TB ósea, la TB diseminada, la TB cerebelar y el eritema nudoso (cada uno, n=1).
ConclusionesLa TB en la edad pediátrica es un marcador epidemiológico de transmisión reciente de Mycobacterium tuberculosis en la comunidad. Debe hacerse todo lo posible para recoger muestras microbiológicas antes de iniciar el tratamiento. Un equipo pediátrico especializado permite la realización de un diagnóstico preciso incluso en ausencia de confirmación microbiológica.
paediatric tuberculosis (TB) disease continues to be challenge. Difficulties in its diagnosis and limited experience on its treatment in children are some of the reasons to consider the need for specialized paediatric TB centres and to prioritize children in tuberculosis control programmes, particularly in low-incidence countries. We describe the paediatric tuberculosis cases managed in a specialized paediatric outpatient TB centre.
Patients and methodsWe conducted a retrospective analysis of epidemiological and clinical data on TB cases in patients aged less than 18 years in the period ranging from January 2007 to June 2017.
ResultsWe identified 46 cases of TB. The median age of the patients was 5 years (IQR: 1.75-13.25). Thirty cases (65.2%) were identified through screening following exposure to TB. Thirty-six children (78%) presented with a median duration of symptoms was 2 weeks, the most frequent being cough (54%) and fever (48%). The findings of the chest radiograph were abnormal in 73.9% of patients, and a CT scan was performed in 82.2%, the findings of which contributed significantly to the decision to treat in 85.3%. Despite collection of different microbiological specimens, diagnostic confirmation was possible in only 12 cases (26.1%). The results of culture and/or nucleic acid amplification tests were positive in 33.3% of samples of sputum, 28.1% of bronchoalveolar lavage and 12.9% of gastric aspirates. The most frequent diagnosis was pulmonary TB (n=31), followed by pleuropulmonary TB (n=6), lymph node disease (n=3), uveitis (n=2), bone tuberculosis, disseminated TB, cerebellar tuberculoma and erythema nodosum (each n=1).
ConclusionsTuberculosis in children is an epidemiological indicator of recent transmission of Mycobacterium tuberculosis in the community. Efforts must be made to collect microbiological specimens before initiating treatment whenever possible. Management by an experienced paediatrics team allows an accurate diagnosis even when microbiologic confirmation is not possible.
La presentación clínica de la tuberculosis (TB) en la edad pediátrica difiere de la presentación en la edad adulta, por lo que la TB supone un reto en la infancia y en la adolescencia: a) el riesgo de desarrollar la enfermedad tras el contagio es mayor en la población pediátrica, y el período de latencia más corto en comparación con adultos; b) la probabilidad de desarrollar TB extrapulmonar o enfermedad grave es mayor en niños; c) las manifestaciones clínicas y radiológicas son variables y a menudo inespecíficas, y d) la obtención de muestras microbiológicas es más difícil en niños, y muchos casos infantiles son paucibacilares1–4.
La TB en niños es un indicador epidemiológico importante, ya que representa un evento centinela de transmisión reciente de Mycobacterium tuberculosis en la comunidad, lo que revela fallas del sistema de salud pública en el control de la TB3–5. El cribado de contactos de casos de enfermedad y la administración de profilaxis en individuos susceptibles de desarrollar la enfermedad (especialmente en niños) son medidas recomendadas para minimizar su transmisión4,6.
En Portugal, la incidencia y los casos notificados de TB han disminuido en aproximadamente un 40% en la última década, y Portugal se considera un país de baja incidencia desde el año 20157. Hasta el 2016 se encontraba vigente una política sanitaria de vacunación universal con el bacilo de Calmette-Guérin (BCG), año a partir del cual se pasó a la vacunación selectiva de grupos de riesgo8. La incidencia estimada para 2017 fue de 5,8/100.000 niños de 0 a 4 años y 1,8 casos/100.000 niños de 5 a 14 años9. En ese año, los casos importados de TB ascendieron al 19,5% del total notificado en Portugal, un porcentaje bajo en comparación con otros países de la Unión Europea y el Espacio Económico Europeo (33,1%)9.
Dado el contexto epidemiológico, nos planteamos la importancia de mejorar las instituciones sanitarias en las que se diagnostican y tratan los pacientes con TB, especialmente los menores. En Portugal hay una red de centros ambulatorios de TB dentro del Servicio Nacional de Salud en los que se evalúa y trata a pacientes con TB sospechada o confirmada. Estos centros están asociados a distintos hospitales para permitir una investigación exhaustiva hasta que se llega a un diagnóstico. Solo 2 de estos centros tienen pediatras y un equipo multidisciplinar especializados en TB. El primero de ellos es el Centro de Referencia de Tuberculosis Infantil en Portugal del Norte, en activo desde el año 2010. El objetivo del estudio fue describir los casos de TB en niños y adolescentes manejados en este centro de referencia durante un periodo de 10 años.
MétodosEstudio transversal retrospectivo en centro de TB en el que los menores son manejados por pediatras especializados en TB. En 2017, el centro recibió 233 visitas iniciales y 485 visitas de seguimiento. Se identificaron casos de TB en pacientes menores de 18 años consultando los datos del Sistema Nacional de Vigilancia de la TB de 2007 a 201710.
Se revisaron los historiales clínicos, recogiendo la información pertinente en una base de datos electrónica. Se recogieron datos de variables demográficas (sexo, edad, asistencia a guardería o colegio), antecedentes médicos (enfermedades previas, estado de vacunación, uso de medicación), el motivo y el origen de la derivación para consulta en el centro de TB y del caso índice cuando había información disponible. Con respecto a los casos sospechados de TB, se recogieron datos sobre la clínica (síntomas y su duración), los resultados de pruebas inmunológicas (prueba de la tuberculina [PT] y ensayo de liberación de interferón-gamma [IGRA, por sus siglas en inglés]), los hallazgos de la radiografía de tórax, la tomografía computarizada (TC), de otras pruebas de imagen y de la broncoscopia, en caso de haberse realizado. Se consideró la PT positiva si la induración tenía un diámetro ≥5mm en niños inmunodeprimidos o menores de 5 años sin vacunar, o un diámetro ≥10mm en niños vacunados menores de 5 años o en niños mayores de 5 años independientemente del antecedente de vacunación6. También se recogió información sobre las muestras microbiológicas obtenidas (aspirado de jugo gástrico, esputo, lavado broncoalveolar [LBA], líquido cefalorraquídeo [LCR], líquido pleural, biopsia), los resultados de la tinción de Ziehl-Neelsen (ZN), las técnicas de amplificación de ácidos nucleicos (TAAN) y/o cultivos y la visualización de granulomas en el estudio histológico.
Se clasificó la TB según su forma clínica como pulmonar o extrapulmonar, y los casos como «posible», «probable» o «confirmado» en base a las definiciones establecidas por el Centro Europeo para la Prevención y Control de Enfermedades (ECDC)11.
Por último, se recogieron datos sobre el tratamiento farmacológico, incluyendo los fármacos utilizados, dosificación y duración del tratamiento, eventos adversos y adherencia.
Los datos se recogieron y analizaron con el paquete estadístico IBM SPSS Statistics® versión 24. Las variables continuas se presentan como mediana y rango intercuartílico (RIC) y las categóricas como frecuencias absolutas y relativas. El protocolo de estudio fue aprobado por el Comité Ético y el Consejo Administrativo del centro.
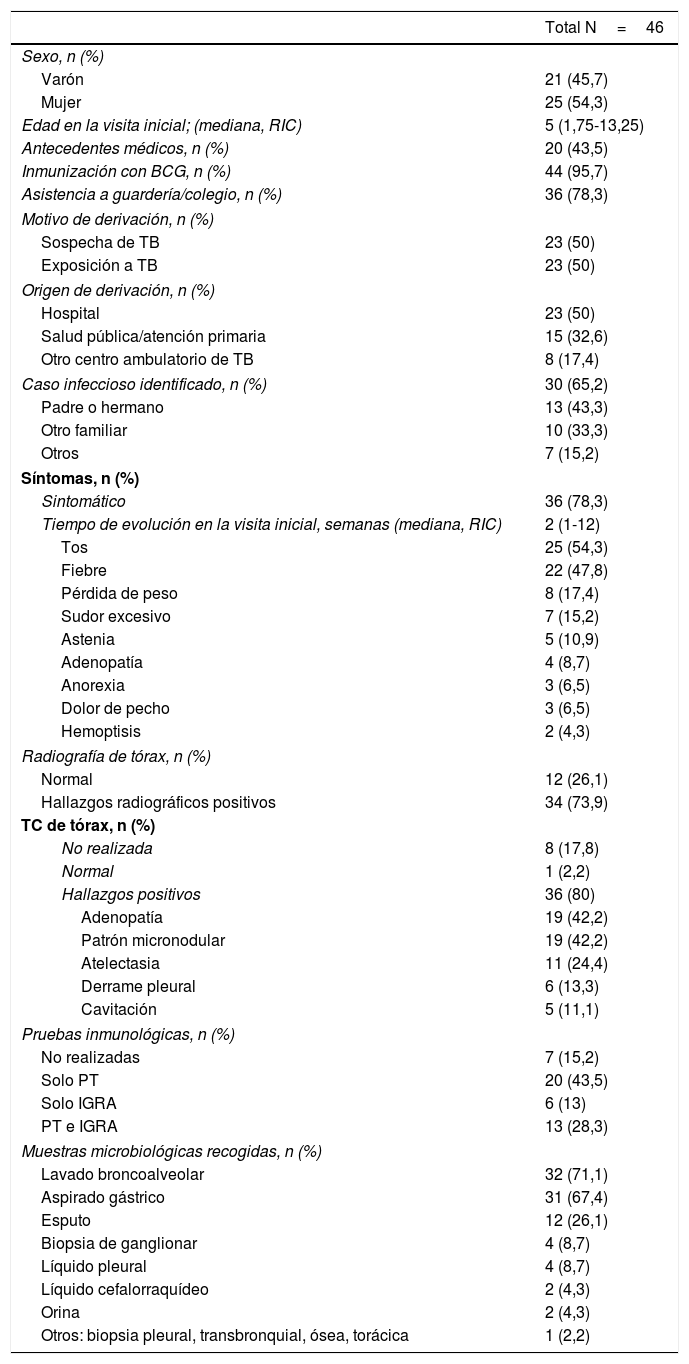
ResultadosMuestraSe identificó un total de 46 casos de TB, el 54,3% en niñas (tabla 1). La edad media en el momento de la visita inicial fue de 5 años, y 24 pacientes (52,2%) eran menores de 6 años. Casi todos los pacientes habían sido vacunados con BCG (95,7%), con excepción de un lactante de 11 meses que no cumplía los nuevos criterios para vacunación con BCG8 y un adolescente inmigrante procedente de Guinea-Bissau. También hubo un adolescente residente en Angola. Todos los pacientes eran inmunocompetentes exceptuando un caso de linfohistiocitosis hemofagocítica familiar.
Características demográficas, clínicas y de imagen de los pacientes y muestras microbiológicas que apoyaron el diagnóstico
| Total N=46 | |
|---|---|
| Sexo, n (%) | |
| Varón | 21 (45,7) |
| Mujer | 25 (54,3) |
| Edad en la visita inicial; (mediana, RIC) | 5 (1,75-13,25) |
| Antecedentes médicos, n (%) | 20 (43,5) |
| Inmunización con BCG, n (%) | 44 (95,7) |
| Asistencia a guardería/colegio, n (%) | 36 (78,3) |
| Motivo de derivación, n (%) | |
| Sospecha de TB | 23 (50) |
| Exposición a TB | 23 (50) |
| Origen de derivación, n (%) | |
| Hospital | 23 (50) |
| Salud pública/atención primaria | 15 (32,6) |
| Otro centro ambulatorio de TB | 8 (17,4) |
| Caso infeccioso identificado, n (%) | 30 (65,2) |
| Padre o hermano | 13 (43,3) |
| Otro familiar | 10 (33,3) |
| Otros | 7 (15,2) |
| Síntomas, n (%) | |
| Sintomático | 36 (78,3) |
| Tiempo de evolución en la visita inicial, semanas (mediana, RIC) | 2 (1-12) |
| Tos | 25 (54,3) |
| Fiebre | 22 (47,8) |
| Pérdida de peso | 8 (17,4) |
| Sudor excesivo | 7 (15,2) |
| Astenia | 5 (10,9) |
| Adenopatía | 4 (8,7) |
| Anorexia | 3 (6,5) |
| Dolor de pecho | 3 (6,5) |
| Hemoptisis | 2 (4,3) |
| Radiografía de tórax, n (%) | |
| Normal | 12 (26,1) |
| Hallazgos radiográficos positivos | 34 (73,9) |
| TC de tórax, n (%) | |
| No realizada | 8 (17,8) |
| Normal | 1 (2,2) |
| Hallazgos positivos | 36 (80) |
| Adenopatía | 19 (42,2) |
| Patrón micronodular | 19 (42,2) |
| Atelectasia | 11 (24,4) |
| Derrame pleural | 6 (13,3) |
| Cavitación | 5 (11,1) |
| Pruebas inmunológicas, n (%) | |
| No realizadas | 7 (15,2) |
| Solo PT | 20 (43,5) |
| Solo IGRA | 6 (13) |
| PT e IGRA | 13 (28,3) |
| Muestras microbiológicas recogidas, n (%) | |
| Lavado broncoalveolar | 32 (71,1) |
| Aspirado gástrico | 31 (67,4) |
| Esputo | 12 (26,1) |
| Biopsia de ganglionar | 4 (8,7) |
| Líquido pleural | 4 (8,7) |
| Líquido cefalorraquídeo | 2 (4,3) |
| Orina | 2 (4,3) |
| Otros: biopsia pleural, transbronquial, ósea, torácica | 1 (2,2) |
BCG: bacilo Calmette-Guérin; IGRA: ensayo de liberación de interferón-gamma (interferon-gamma release assay); PT: prueba de la tuberculina; RIC: rango intercuartílico; TB: tuberculosis; TC: tomografía computarizada.
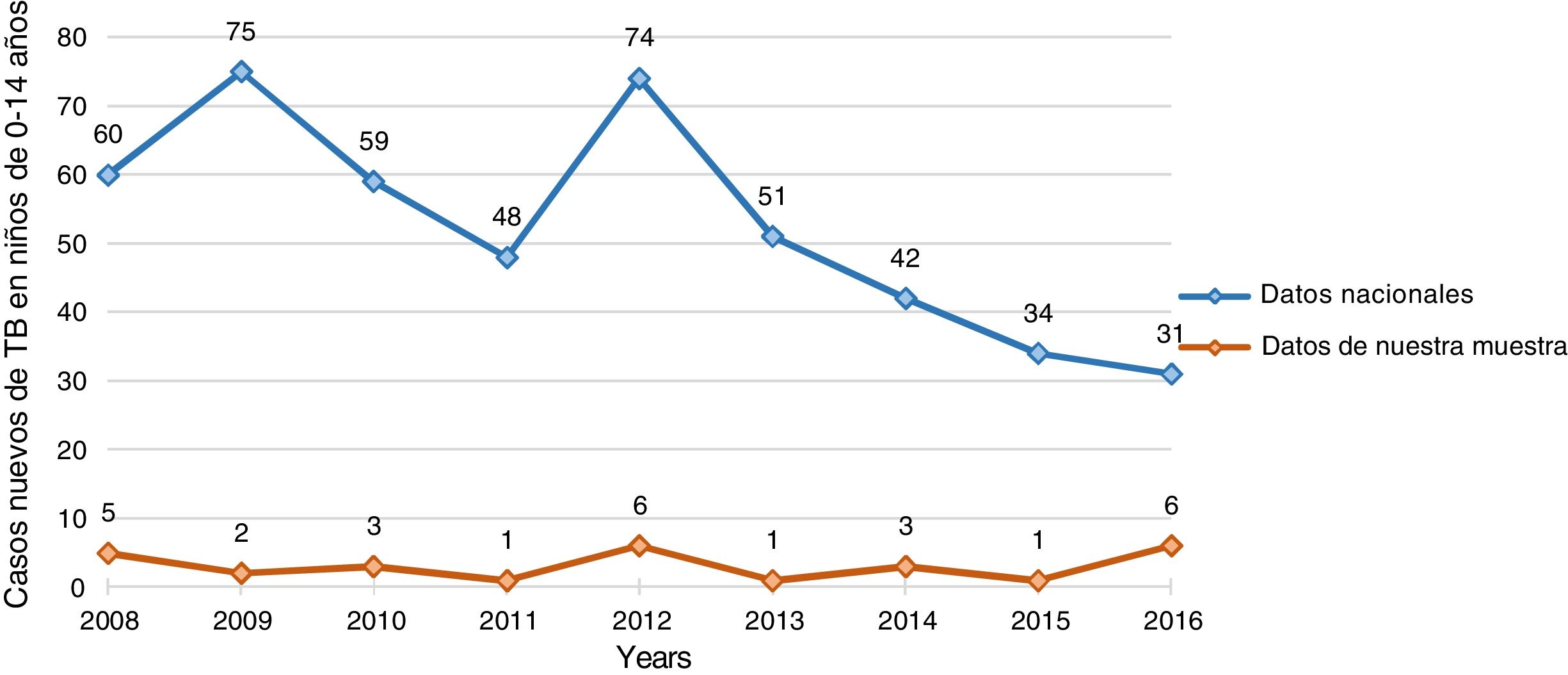
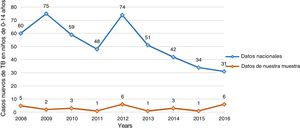
La figura 1 compara la distribución de casos nuevos en nuestra muestra de niños de 0 a 14 años con datos nacionales en Portugal.
El motivo de derivación fue sospecha de TB en 26 casos (50%) y exposición a TB en la mitad restante. El caso índice se identificó en 30 pacientes (65,2%), correspondiendo a un contacto familiar en el 76,6%.
DiagnósticoTreinta y seis pacientes (78,3%) desarrollaron síntomas, con una media de 2 semanas de evolución (RIC: 1-12) en la visita inicial. Los más frecuentes fueron tos (n=25; 54,3%) y fiebre (n=22; 47,8%), seguidos de pérdida de peso en 8 pacientes (17,4%) y sudores nocturnos en 7 (15,2%).
Se observaron alteraciones en la radiografía de tórax en 34 pacientes (73,9%); en 37 pacientes se realizó TC de tórax, con alteraciones sugestivas de TB en el 97,3%: adenopatía en 19 (51,4%), nódulos no calcificados en 19 (51,4%), atelectasia en 11 (29,7%), derrame pleural en 6 (16,2%) y cavitación en 5 (13,5%).
Se realizó la PT en 33 pacientes (71,7%) y el IGRA en 19 pacientes (41,3%), en la mayoría de los casos en contexto de estudio de contactos. El test utilizado en el IGRA fue el QuantiFERON-TB Gold® hasta mayo de 2015 y el QuantiFERON-TB Gold Plus® en adelante. El IGRA fue positivo en el 78,9% de los pacientes en que se realizó, y la PT en el 72,7%, con resultado positivo de al menos una de estas pruebas en el 85% de los pacientes. De los 13 pacientes en que se realizaron ambas pruebas, 6 (46,2%) tuvieron resultados positivos en ambas, mientras que en 6 los resultados fueron discordantes (46,2%). De los 12 pacientes con confirmación microbiológica por cultivo, 7 se hicieron la PT o el IGRA y tuvieron al menos un resultado positivo.
Se realizaron pruebas microbiológicas para detección de M. tuberculosis en todos los pacientes, mayoritariamente en el hospital (n=38; 84,4%). Se recogieron muestras de fluido gástrico en 31 pacientes (67,4%) y de esputo en 12 (26,1%). El jugo gástrico fue el tipo de muestra recogido con mayor frecuencia para el estudio microbiológico en niños menores de 5 años.
En 32 pacientes (71,1%) también se realizó broncoscopia con recogida de muestra de LBA. Las alteraciones macroscópicas observadas en dichas muestras fueron: inflamación de la mucosa endobronquial en 15 (46,9%), secreción mucopurulenta en 8 (25%), compresión bronquial extrínseca en 4, granulación en 3, afección de ganglios en 3 y estenosis bronquial en 2.
Otros procedimientos empleados con menor frecuencia en la obtención de muestras fueron la biopsia ganglionar (n=4), la toracocentesis (n=4), la recogida de orina (n=2), la recogida de LCR (n=2) y, en un paciente en cada caso, biopsia pleural, de masa pulmonar, de tejido bronquial y de tejido óseo, en todos los casos basada en la localización de la TB.
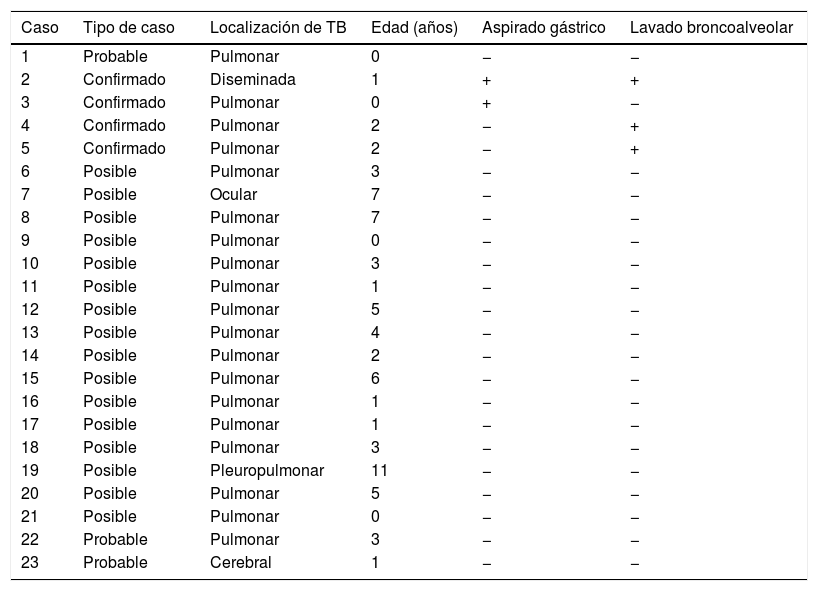
La tabla 1 detalla las muestras microbiológicas obtenidas en los pacientes. Se analizó la distribución de los resultados positivos de la tinción de ZN, los TAAN y los cultivos, observándose que en algunos pacientes se detectó M. tuberculosis en más de un espécimen. El cultivo y el TAAN fueron positivos, respectivamente, en el 75 y el 25% de las muestras de líquido pleural, el 33,3 y el 16,6% de las de esputo, el 21,9 y el 18,8% de las de LBA y el 12,9 y el 6,5% de los aspirados gástricos. El estudio patológico de las biopsias realizadas en 8 pacientes reveló un proceso inflamatorio granulomatoso en 7 (87,5%). La tabla 2 presenta datos de los 23 casos en que se recogieron muestras de jugo gástrico y de LBA. En 2 de ellos, la muestra obtenida mediante el procedimiento invasivo permitió la confirmación del diagnóstico.
Casos con obtención simultánea de muestras de aspirado gástrico y lavado broncoalveolar, y resultados positivos (+) y negativos (−) de pruebas de ampliación de ácidos nucleicos/cultivo
| Caso | Tipo de caso | Localización de TB | Edad (años) | Aspirado gástrico | Lavado broncoalveolar |
|---|---|---|---|---|---|
| 1 | Probable | Pulmonar | 0 | − | − |
| 2 | Confirmado | Diseminada | 1 | + | + |
| 3 | Confirmado | Pulmonar | 0 | + | − |
| 4 | Confirmado | Pulmonar | 2 | − | + |
| 5 | Confirmado | Pulmonar | 2 | − | + |
| 6 | Posible | Pulmonar | 3 | − | − |
| 7 | Posible | Ocular | 7 | − | − |
| 8 | Posible | Pulmonar | 7 | − | − |
| 9 | Posible | Pulmonar | 0 | − | − |
| 10 | Posible | Pulmonar | 3 | − | − |
| 11 | Posible | Pulmonar | 1 | − | − |
| 12 | Posible | Pulmonar | 5 | − | − |
| 13 | Posible | Pulmonar | 4 | − | − |
| 14 | Posible | Pulmonar | 2 | − | − |
| 15 | Posible | Pulmonar | 6 | − | − |
| 16 | Posible | Pulmonar | 1 | − | − |
| 17 | Posible | Pulmonar | 1 | − | − |
| 18 | Posible | Pulmonar | 3 | − | − |
| 19 | Posible | Pleuropulmonar | 11 | − | − |
| 20 | Posible | Pulmonar | 5 | − | − |
| 21 | Posible | Pulmonar | 0 | − | − |
| 22 | Probable | Pulmonar | 3 | − | − |
| 23 | Probable | Cerebral | 1 | − | − |
TB: tuberculosis.
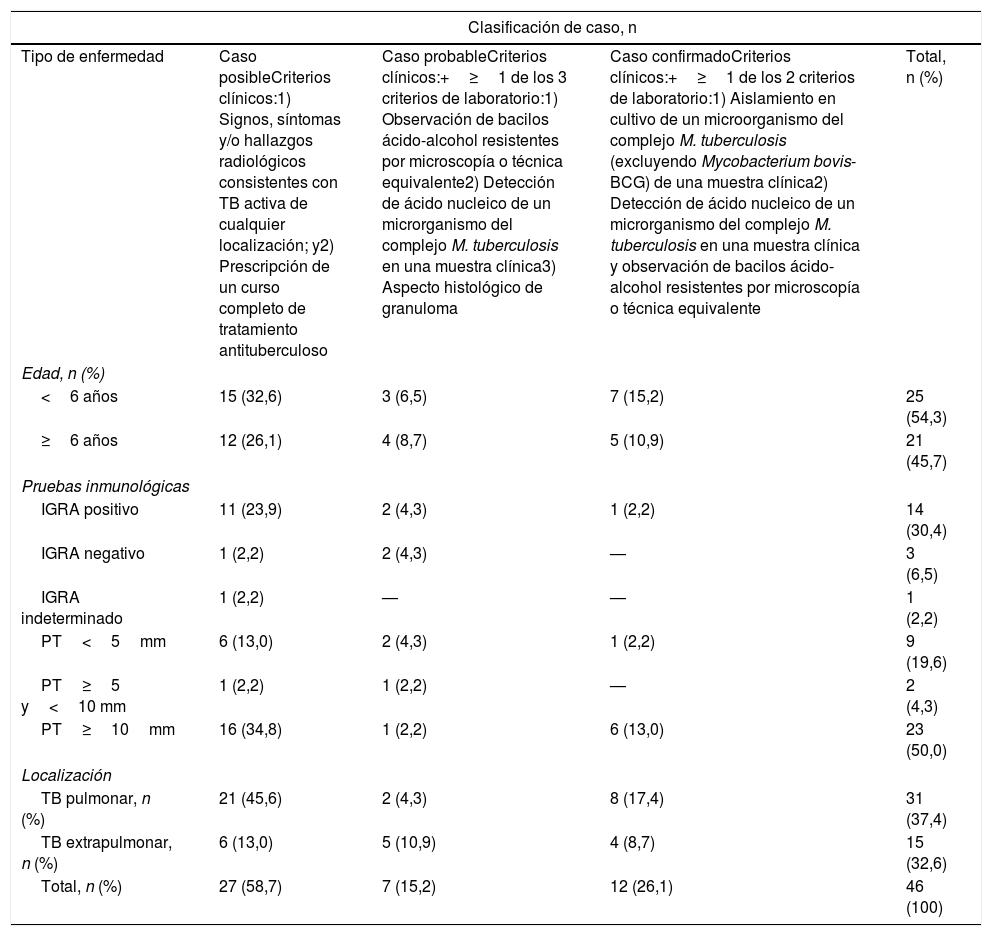
Del total de los casos, 12 se clasificaron como confirmados (26,1%), 6 como probables (13%) y 28 como posibles (60,9%) (tabla 3). La localización más frecuente de la TB fue la pulmonar (n=31; 67,4%); las formas extrapulmonares incluyeron TB pleuropulmonar (n=6), TB ganglionar (n=3), uveítis (n=2) y TB osteoarticular, TB diseminada, tuberculoma cerebelar y eritema nudoso (n=1 para cada forma). La tabla 3 presenta la distribución de casos por edad, resultados de pruebas inmunológicas y localización de la TB.
Distribución de los casos identificados según la clasificación del Centro Europeo para la Prevención y el Control de las Enfermedades y el tipo de tuberculosis
| Clasificación de caso, n | ||||
|---|---|---|---|---|
| Tipo de enfermedad | Caso posibleCriterios clínicos:1) Signos, síntomas y/o hallazgos radiológicos consistentes con TB activa de cualquier localización; y2) Prescripción de un curso completo de tratamiento antituberculoso | Caso probableCriterios clínicos:+≥1 de los 3 criterios de laboratorio:1) Observación de bacilos ácido-alcohol resistentes por microscopía o técnica equivalente2) Detección de ácido nucleico de un microrganismo del complejo M. tuberculosis en una muestra clínica3) Aspecto histológico de granuloma | Caso confirmadoCriterios clínicos:+≥1 de los 2 criterios de laboratorio:1) Aislamiento en cultivo de un microorganismo del complejo M. tuberculosis (excluyendo Mycobacterium bovis-BCG) de una muestra clínica2) Detección de ácido nucleico de un microrganismo del complejo M. tuberculosis en una muestra clínica y observación de bacilos ácido-alcohol resistentes por microscopía o técnica equivalente | Total, n (%) |
| Edad, n (%) | ||||
| <6 años | 15 (32,6) | 3 (6,5) | 7 (15,2) | 25 (54,3) |
| ≥6 años | 12 (26,1) | 4 (8,7) | 5 (10,9) | 21 (45,7) |
| Pruebas inmunológicas | ||||
| IGRA positivo | 11 (23,9) | 2 (4,3) | 1 (2,2) | 14 (30,4) |
| IGRA negativo | 1 (2,2) | 2 (4,3) | — | 3 (6,5) |
| IGRA indeterminado | 1 (2,2) | — | — | 1 (2,2) |
| PT<5mm | 6 (13,0) | 2 (4,3) | 1 (2,2) | 9 (19,6) |
| PT≥5 y<10 mm | 1 (2,2) | 1 (2,2) | — | 2 (4,3) |
| PT≥10mm | 16 (34,8) | 1 (2,2) | 6 (13,0) | 23 (50,0) |
| Localización | ||||
| TB pulmonar, n (%) | 21 (45,6) | 2 (4,3) | 8 (17,4) | 31 (37,4) |
| TB extrapulmonar, n (%) | 6 (13,0) | 5 (10,9) | 4 (8,7) | 15 (32,6) |
| Total, n (%) | 27 (58,7) | 7 (15,2) | 12 (26,1) | 46 (100) |
IGRA: ensayo de liberación de interferón gamma; PT: prueba de la tuberculina; TB: tuberculosis.
Fuente: European Centre for Disease Prevention and Control11.
M. tuberculosis fue susceptible a fármacos de primera línea en los 12 casos confirmados, aunque no se realizaron pruebas moleculares de sensibilidad a fármacos; en la mayoría de los casos se dispuso de las pruebas fenotípicas de susceptibilidad farmacológica del caso índice.
TratamientoLa mediana del tiempo trascurrido desde el contacto inicial con el sistema sanitario (hospital o clínica ambulatoria) hasta la instauración de tratamiento fue de 11 días (RIC: 6-17 días) en niños que presentaron con síntomas sugestivos de TB, y de 29 días (RIC: 16,5-81 días) en aquellos que fueron evaluados por estudio de contactos, diferencia que alcanzó la significación estadística.
Dado que el 73,9% de los casos (n=34) fueron probables o posibles, la decisión de iniciar tratamiento en estos pacientes se basó en criterios diferentes a la confirmación microbiológica. Se consideraron el contexto epidemiológico en 26 (76,5%), los signos y síntomas compatibles con TB en 27 (79,4%), las alteraciones de imagen en 29 (85,3%) y los resultados positivos de pruebas inmunológicas en 25 (73,5%). En 5 de estos pacientes (14,7%), los resultados de la tinción de ZN (n=1) o del TAAN (n=4) fueron positivos, lo que apoyó la prescripción de tratamiento.
En pacientes con contacto bacilífero conocido, la prescripción del tratamiento se basó en los resultados de las pruebas de sensibilidad antimicrobiana en el caso índice. Se prescribió régimen de tres fármacos con isoniazida, rifampicina y pirazinamida (HRZ) en el 59% de los pacientes, añadiéndose etambutol (E) en el 41% restante. La duración del tratamiento dependió de la evolución clínica y radiológica del paciente y la forma de enfermedad, con una mediana de duración de 7 meses (RIC: 6-12).
En algunos casos, la duración del tratamiento excedió los 6 meses habituales12,13: duración de 12 meses o superior en 9 pacientes con formas graves, tales como TB osteoarticular, diseminada o cerebral (siguiendo las recomendaciones vigentes), así como en casos de afectación pleuropulmonar extensa, reacción adversa grave o reacción paradójica al tratamiento inicial o con caso índice resistente a la isoniazida.
Las reacciones adversas a la medicación antituberculosa fueron escasas (15,2%) y, en su mayoría, leves. Dos pacientes desarrollaron reacciones adversas graves que requirieron prescripción de tratamiento alternativo: un paciente que desarrolló hepatitis autoinmune inducida por fármacos que recibió tratamiento de segunda línea con levofloxacino, amikacina, etionamida, cicloserina y corticoides14, y un adolescente con reacción a fármacos con eosinofilia y síntomas sistémicos (síndrome DRESS) en respuesta a la rifampicina15. En el segundo caso, se decidió retirar el tratamiento permanentemente por los siguientes motivos: clasificación de caso posible de TB (antecedente de contacto con caso de enfermedad activa resistente a la isoniazida, prueba inmunológica positiva y alteraciones radiológicas), la gravedad de la reacción adversa y la mejoría clínica y la ausencia de manifestaciones de TB activa en los años del seguimiento.
Dos lactantes (4,3%) con diagnóstico de TB pulmonar desarrollaron una reacción paradójica a una media de 9,5 semanas de tratamiento, con empeoramiento radiológico, agrandamiento de ganglios linfáticos, invasión bronquial y tuberculoma pulmonar en uno de ellos a pesar de exhibir mejoría clínica. En ambos, se cambió el tratamiento a prednisolona, con una dosis máxima inicial de 2mg/kg/día que se redujo gradualmente a lo largo de 2 a 5 semanas, consiguiéndose una mejoría clara.
Se apoyó a todos los pacientes con visitas y tratamiento directamente observado para garantizar la adherencia al tratamiento.
La única pérdida de seguimiento correspondió a un paciente que retornó a su país de origen. Todos los demás pacientes continuaron en seguimiento, completando el tratamiento y evolucionando a curación. Tan solo un paciente de 10 años que presentó con cavitaciones múltiples desarrolló secuelas importantes, en concreto nódulos pulmonares calcificados residuales, cavitaciones pulmonares, bronquiectasia por tracción y patrón obstructivo de gravedad moderada en pruebas de función pulmonar.
DiscusiónLos centros de referencia en TB pediátrica desempeñan un papel clave en la identificación precoz, cribado y diagnóstico de niños expuestos a la TB. La atención especializada que ofrecen posibilita el diagnóstico de estos pacientes en los estadios tempranos de la enfermedad o incluso antes del desarrollo de síntomas, como ocurrió en 10 de nuestros pacientes (21,7%)1,4.
Doce de los casos en nuestra muestra (26,1%) eran casos confirmados. Dentro del grupo de menores de 5 años, los resultados del cultivo fueron positivos en el 23,8% de los pacientes, en concordancia con la proporción reportada en un estudio realizado en el norte de Portugal entre los años 2000 y 200916. El porcentaje de casos confirmados en pacientes de 0 a 14 años en Europa durante el mismo período fue ligeramente menor (19,2%)17. Se ha demostrado que la obtención de otras muestras microbiológicas además de los aspirados gástricos aumenta el rendimiento de las pruebas para la confirmación de TB y puede ser útil para adaptar el tratamiento18,19.
En la muestra de estudio, el rendimiento diagnóstico del cultivo de muestras de LBA para la detección de M. tuberculosis fue superior en comparación con el cultivo de aspirados gástricos (en un tercio de los casos confirmados, el cultivo de LBA fue positivo y el de aspirado gástrico negativo). La mayoría de los estudios publicados han descrito un rendimiento superior con la combinación de ambos especímenes18.
La broncoscopia ha de contemplarse como un método adicional para la obtención de muestras microbiológicas (LBA, tejido endobronquial, biopsia mediante punción-aspiración con aguja fina transbronquial) cuando métodos menos invasivos resultan infructuosos1,19. Las imágenes obtenidas mediante la broncoscopia pueden proporcionar claves adicionales sobre la TB, de las que la compresión extrínseca de la vía aérea, identificada en el 12,5% de la muestra, es la reportada con mayor frecuencia (19-24%). Otros cambios macroscópicos descritos en la literatura que se observaron en nuestra muestra fueron la presencia de material caseoso intraluminal, tejido de granulación, inflamación de la mucosa endobronquial y erosión y ulceración de mucosas19.
Aunque la detección es positiva en el 85% de las pruebas inmunológicas, un resultado negativo del IGRA o la PT no excluye el diagnóstico de TB, y la sensibilidad de ambas pruebas es menor en pacientes inmunodeprimidos1,4,18,20. En casi la mitad de los pacientes de nuestra muestra en que se realizaron ambas pruebas, los resultados del IGRA y de la PT fueron discordantes, lo que fue consistente con la literatura18.
Ninguna de las pruebas disponibles en la actualidad ofrece un diagnóstico preciso de la TB pediátrica, por lo que, aunque es importante realizar el estudio microbiológico; es igualmente importante tener en cuenta las manifestaciones clínicas y considerar otros métodos4. Una encuesta europea de médicos e investigadores con experiencia en TB pediátrica encontró que el criterio en el que se basó la instauración de tratamiento antituberculoso sin confirmación microbiológica con mayor frecuencia fue el contexto epidemiológico (89%), seguido de la clínica (86%), las alteraciones radiológicas (77%), la edad del paciente (48%) y los resultados de las pruebas inmunológicas (45%)21. Estos porcentajes son similares a los encontrados en nuestro estudio (73,5-85,3%).
La selección del régimen terapéutico se basó en los resultados de las pruebas de sensibilidad antimicrobiana de la cepa de M. tuberculosis aislada en el paciente o caso índice y en las recomendaciones de la Organización Mundial de la Salud (OMS)13. No se realizaron pruebas moleculares rápidas, ya que el estudio cubre un período de tiempo en el que no se utilizaban de rutina, sino en caso de riesgo de TB multirresistente. En Portugal, la prevalencia estimada de resistencia a la isoniazida en 2018 era del 5,3% (según el informe más reciente, pendiente de publicación). La prescripción de terapia con 3 fármacos (HRZ) se basó en los datos de sensibilidad antimicrobiana del caso índice.
Fue necesario el uso de corticoides en pacientes con reacciones paradójicas12. Se especula que estas respuestas aparecen cuando el tratamiento revierte un proceso de disregulación inmune, con empeoramiento clínico o radiológico tras la instauración de tratamiento antituberculoso apropiado en ausencia de datos sugestivos de recurrencia u otro diagnóstico. Estas reacciones no son infrecuentes, y la proporción de niños sin infección por VIH que tuvieron reacciones paradójicas en nuestro estudio se encontraba dentro del rango de valores reportados en estudios más amplios (3,3-10,2%)22,23.
El perfil de seguridad de los regímenes empleados en la población pediátrica es excelente, lo que explica la baja incidencia de reacciones adversas en nuestra muestra; la monitorización bioquímica no es necesaria en esta población a menos que haya una justificación clínica1,12.
La ausencia de defunciones y la baja morbilidad observadas en nuestra muestra podrían atribuirse a varios factores: no hubo pacientes con infección por VIH, tan solo hubo un paciente con enfermedad neurológica, la minimización del impacto potencial de un nivel socioeconómico bajo por la gratuidad de la atención sanitaria y la medicación, y el uso de tratamiento directamente observado con un abordaje centrado en el paciente.
Otros factores relevantes fueron el seguimiento por un equipo pediátrico especializado en TB y las ventajas que conlleva la integración plena de centros de referencia en TB pediátrica en el programa nacional contra la TB. No obstante, es importante continuar educando al resto de los sanitarios y a la población general para garantizar el diagnóstico precoz de la TB en la población pediátrica.
ConclusionesLa identificación de niños con riesgo de contagiarse de TB, el diagnóstico precoz de la enfermedad y el tratamiento exitoso de los casos pediátricos son factores claves en la reducción de futuros casos de TB en adultos, la transmisión comunitaria y el desarrollo de secuelas. Aunque muchos casos no se confirman mediante pruebas de laboratorio, en presencia de clínica sugestiva de TB debería hacerse el mayor esfuerzo posible para recoger muestras microbiológicas antes de iniciar el tratamiento. El régimen farmacológico ha de seleccionarse en base a las guías clínicas vigentes y la respuesta clínica del paciente. El seguimiento por pediatras especializados en clínicas ambulatorias de TB en la comunidad permite un manejo más adecuado de la TB pediátrica, mientras que la asociación con hospitales de referencia es importante para posibilitar una investigación más extensa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.