Introducción
El quilotórax, o derrame pleural linfático, origina dificultad respiratoria grave en el recién nacido 1,2. La lesión del conducto torácico durante la cirugía cardiotorácica 1-4, y la trombosis en el sistema de la vena cava superior 1,2 son las causas más frecuentes de quilotórax secundario. El quilotórax congénito puede ser idiopático o estar asociado a enfermedades linfáticas generalizadas y a determinados síndromes como el Turner, Down o Noonan 1,2,5.
El diagnóstico se realiza mediante el análisis del derrame pleural, siendo éste estéril y presentando más de 1.000 cél./μl de predominio linfocitario, un contenido de triglicéridos mayor de 1,1 mmol/l y una apariencia lechosa, dependiendo del tipo de nutrición 2.
La suspensión de la alimentación enteral y los drenajes pleurales son las estrategias terapéuticas básicas en su manejo 1-4. Cuando los derrame pleurales son prolongados es necesario prevenir el desarrollo de complicaciones como las infecciones, la hipovolemia y la malnutrición 3,4. La cirugía se reserva para los quilotórax resistentes al tratamiento convencional 4.
En los últimos años la somatostatina, y su análogo octreótida, se han utilizado en el tratamiento del quilotórax, tanto en pacientes adultos como pediátricos 6-15. En esta nota clínica se describen los resultados obtenidos con el uso de este fármaco en los quilotórax neonatales diagnosticados en nuestra sección en los últimos 5 años.
Observación clínica
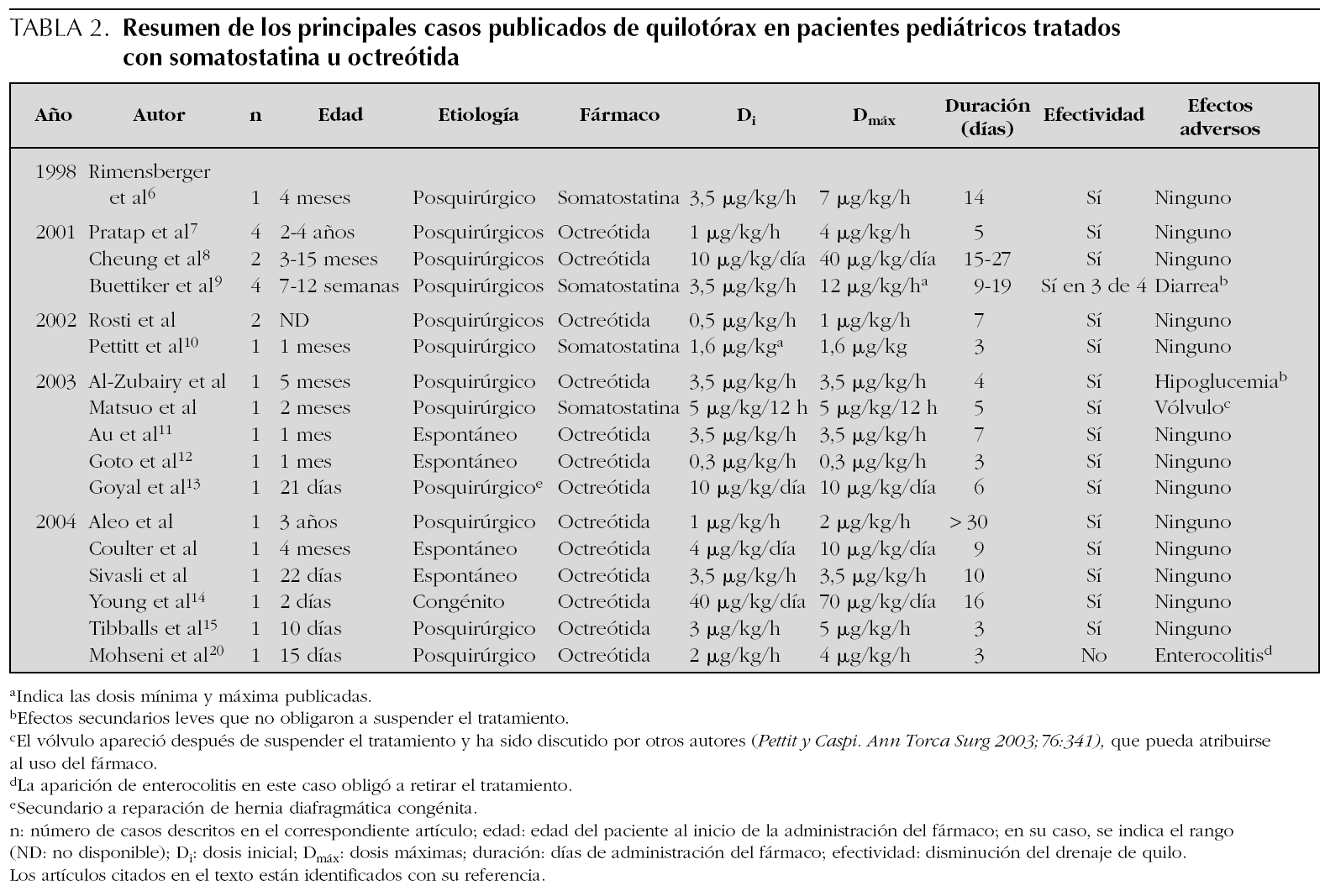
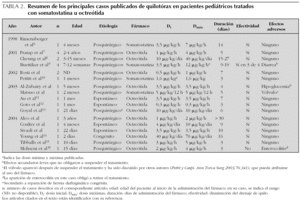
En la tabla 1 se muestran las principales características de los pacientes, del quilotórax y su tratamiento.
Paciente 1
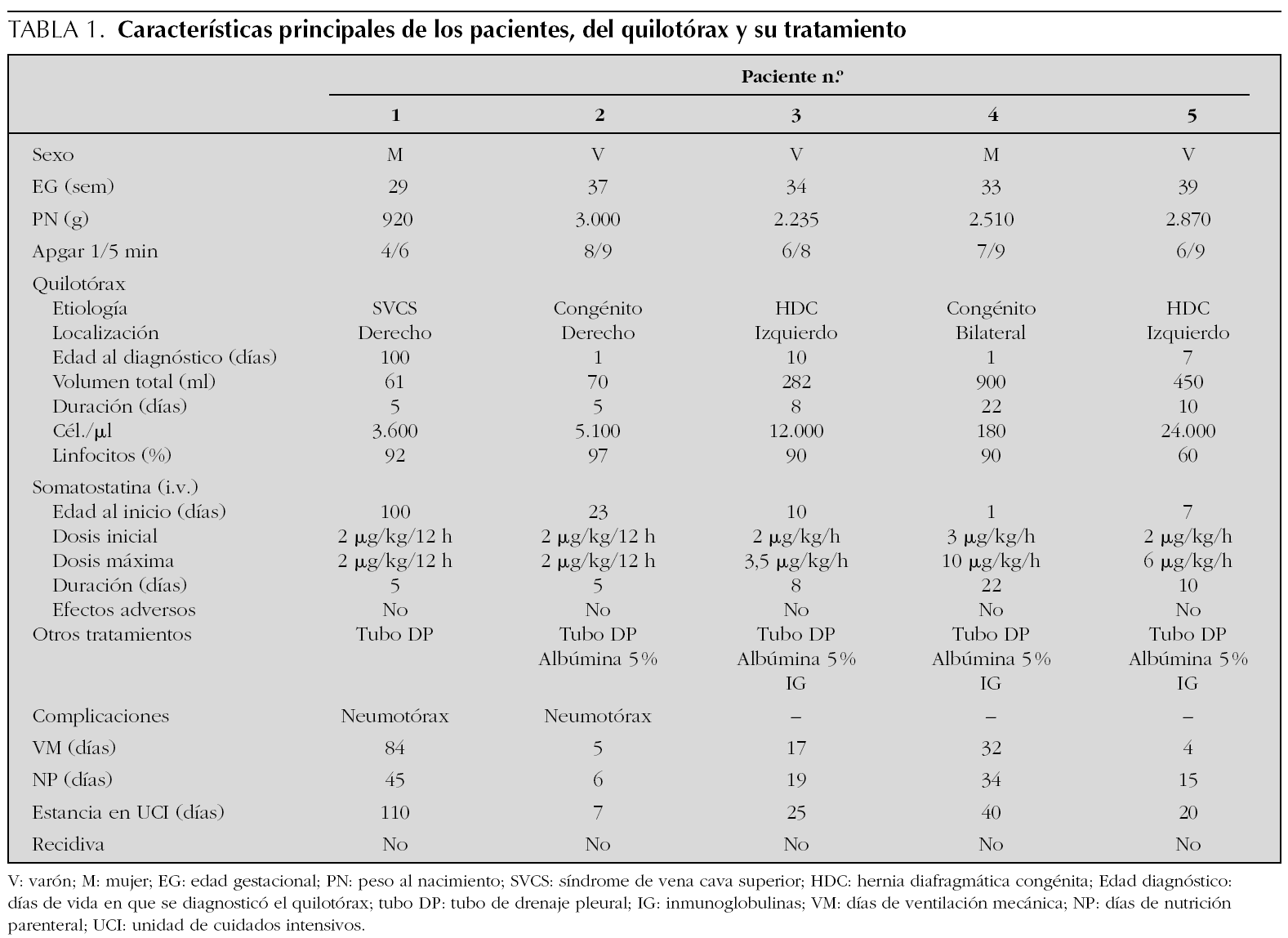
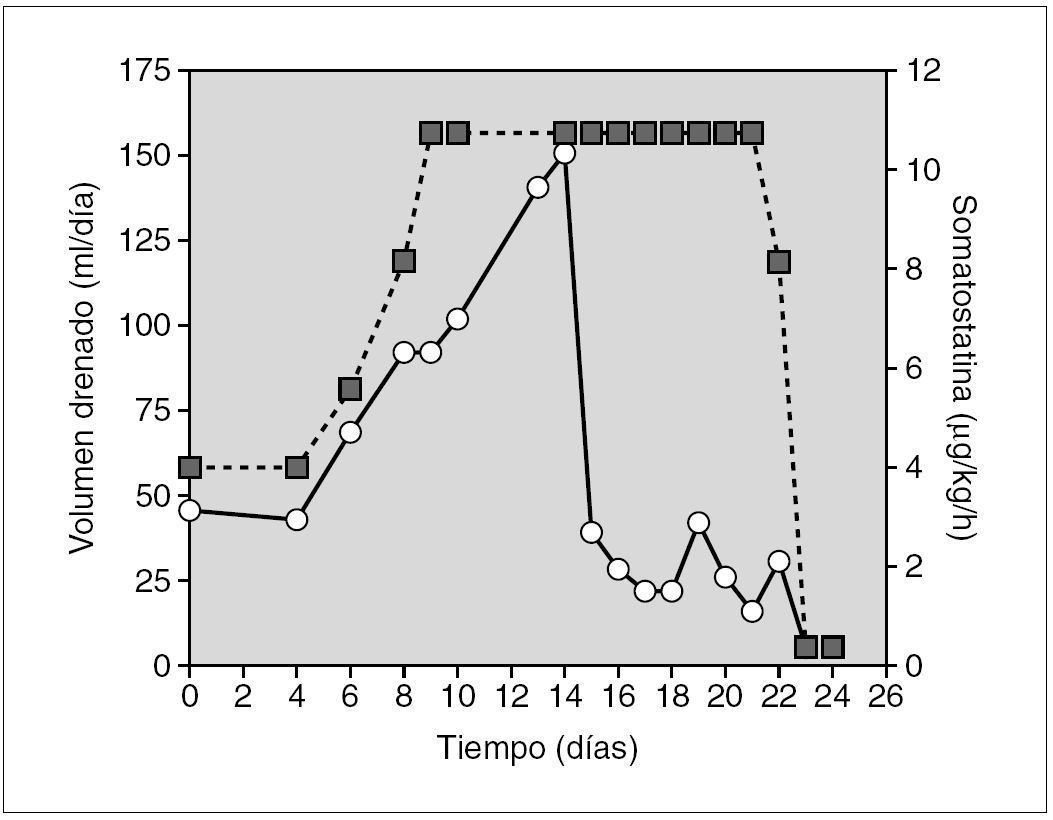
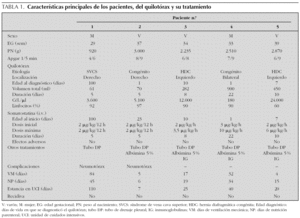
Recién nacida de 26 semanas de edad gestacional, con enfermedad de membrana hialina grado II y conducto arterioso que precisó cierre quirúrgico a los 9 días de vida. A los 26 días, portando un catéter venoso central, desarrolló una sepsis por Candida albicans, con síntomas compatibles con un síndrome de vena cava superior e insuficiencia respiratoria grave. Un estudio cardiológico mostró la disminución del retorno venoso en ventrículo derecho. Una semana después apareció quilotórax derecho. Con el tratamiento conservador se consiguió la resolución del derrame pleural. A los 100 días de vida tuvo una recidiva y se inició tratamiento con somatostatina a 2 μg/kg/12 h por vía intravenosa (i.v.), desapareciendo el derrame a las 48 h (fig. 1).
Figura 1.Efecto de la somatostatina sobre el volumen de drenaje linfático (círculos sobre línea continua), en el paciente 1 (secundario a trombosis de vena cava superior). En este paciente el volumen de drenaje linfático disminuyó de forma rápida y persistente tras la administración de somatostatina en bolos en dosis de 2 μg/kg/12 h (puntas de flecha).
Paciente 2
Recién nacido de 37 semanas de edad gestacional, diagnosticado en otro hospital de quilotórax congénito derecho. Un control ecográfico realizado la semana previa al parto reveló la existencia de un hidrotórax derecho y signos de hidropesía fetal. Tras el nacimiento, se confirmó el quilotórax. Se inició tratamiento convencional y octreótida en perfusión continua en dosis de 2 μg/kg/h i.v. A los 23 días de vida ante la persistencia del derrame pleural fue trasladado a nuestra sección. Se mantuvo el tratamiento convencional al que se añadió somatostatina, 2 μg/kg cada 12 h i.v., desapareciendo el derrame en 48 h.
Paciente 3
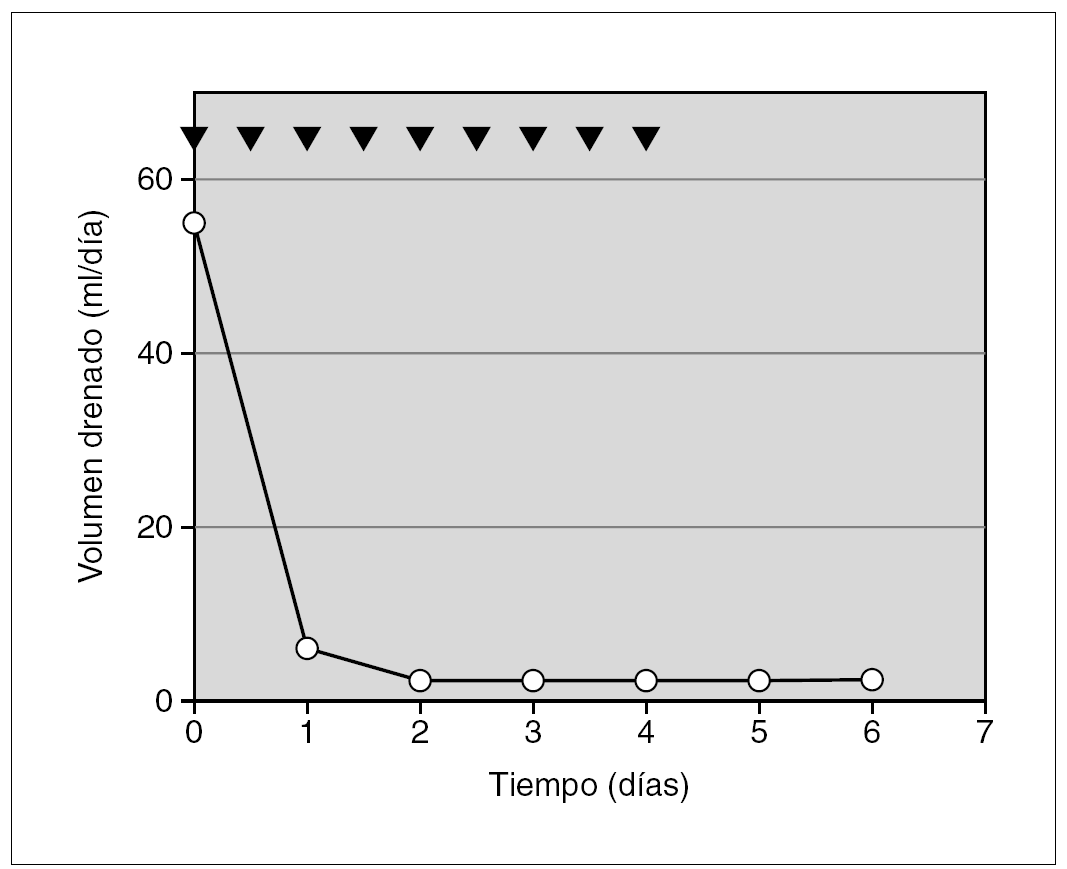
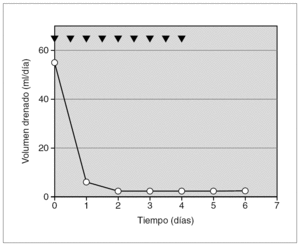
Prematuro de 34 semanas diagnosticado de hernia diafragmática congénita (HDC) izquierda. En el postoperatorio de la cirugía reparadora de la hernia apareció derrame pleural izquierdo, cuyo análisis confirmó el quilotórax. Se inició tratamiento convencional, al que se añadió somatostatina en perfusión en dosis de 2 μg/kg/h i.v. Al quinto día se aumentó la dosis hasta 3,5 μg/kg/h presentando una disminución del derrame pleural hasta su cese completo a los 8 días del inicio de la somatostatina (fig. 2).
Figura 2.Efecto de la somatostatina sobre el volumen de drenaje linfático (círculos sobre línea continua), en el paciente 3 (secundario a cirugía reparadora de una hernia diafragmática congénita). El fármaco se administró en perfusión continua i.v. (cuadrados sobre línea de puntos) en dosis iniciales de 2 μg/kg/h. Se incrementó hasta dosis máximas de 3,5 μg/kg/h, retirándose rápidamente tras el cese del drenaje linfático.
Paciente 4
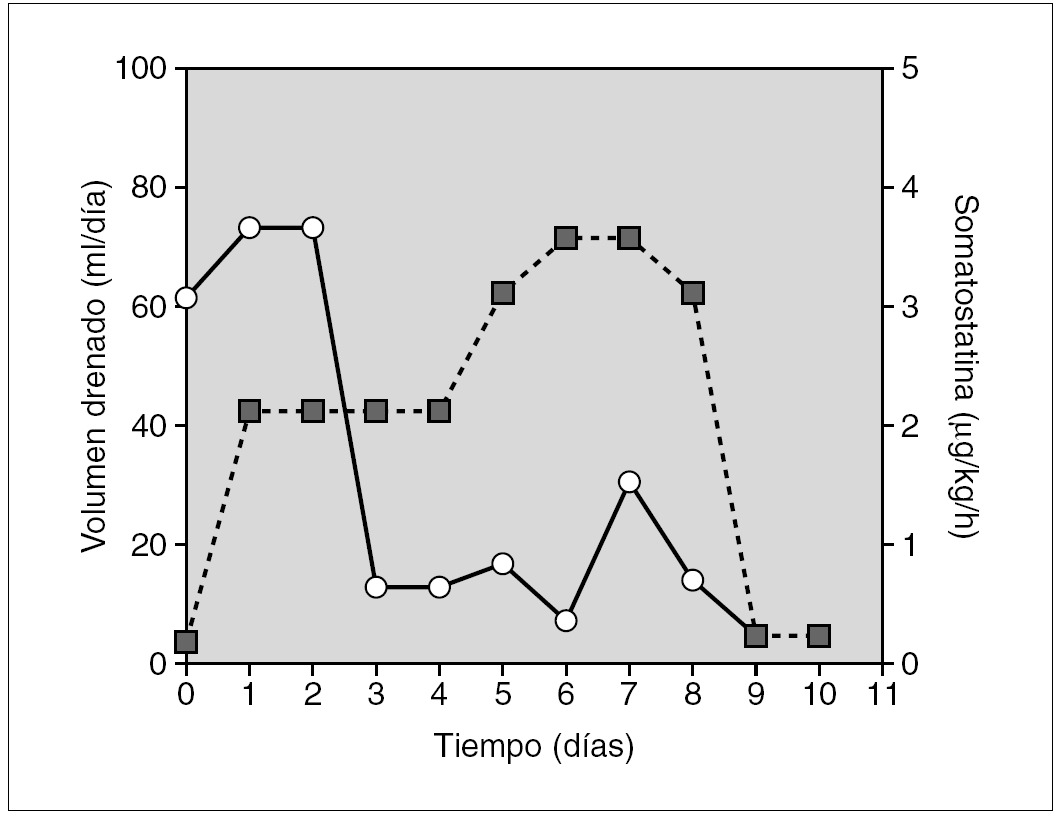
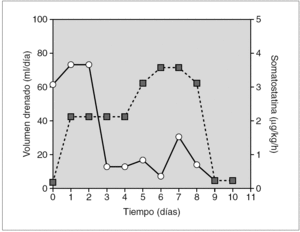
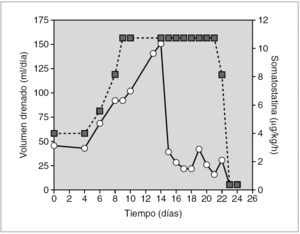
Prematura de 33 semanas diagnosticada de quilotórax congénito bilateral. Un control ecográfico realizado la semana previa al parto reveló la presencia de polihidramnios, hidrotórax fetal e hipoplasia pulmonar bilateral. Se administró una pauta de maduración pulmonar y se finalizó la gestación, intubándose y conectándose a ventilación mecánica al nacimiento. En el examen físico presentaba edemas e hipoventilación pulmonar bilateral. La radiografía de tórax mostró un derrame pleural bilateral, mayor en hemitórax derecho, cuyo análisis confirmó el quilotórax. El estudio cardiológico y el cariotipo fueron normales. Al tratamiento convencional se añadió somatostatina en perfusión en dosis iniciales de 3 μg/kg/h i.v. Al noveno día se aumentó hasta 10 μg/kg/h, consiguiéndose la remisión completa del derrame pleural a los 23 días (fig. 3).
Figura 3.Efecto de la somatostatina sobre el volumen de drenaje linfático (círculos sobre línea continua), en el paciente 4 (quilotórax congénito). El fármaco se administró en perfusión continua i.v. (cuadrados sobre línea de puntos) en dosis iniciales de 3 μg/kg/h, incrementándose hasta 10 μg/kg/h, dosis máximas publicadas en ese momento, ante la persistencia de volúmenes de drenaje elevados.
Paciente 5
Recién nacido de 39 semanas de edad gestacional, diagnosticado de HDC izquierda. En el postoperatorio de la cirugía reparadora de la hernia apareció el quilotórax. Se inició tratamiento convencional, al que se añadió somatostatina en perfusión continua en dosis de 2 μg/kg/h i.v. Al quinto día se aumentaron las dosis hasta 6 μg/kg/h presentando una disminución del derrame pleural hasta su cese completo a los 10 días del inicio de la somatostatina.
En todos los casos se redujo la somatostatina de forma rápida, sin observar en ningún niño ni efectos secundarios durante el tratamiento ni recidivas posteriores del derrame.
Discusión
El quilotórax es poco frecuente en pacientes pediátricos y su prevalencia varía ampliamente según su etiología 1,3. Su manejo se ha centrado principalmente en disminuir la ingesta oral, en reponer las pérdidas hidroelectrolíticas y en conseguir una adecuada ingesta caloricoproteica y un apropiado soporte respiratorio 1-3. Desde que se describiera por primera vez la utilización de somatostatina en un lactante con un quilotórax posquirúrgico 6, varios son los autores que han publicado sus resultados exitosos con el uso de este fármaco 7-15 (tabla 2).
En nuestra sección se han tratado con somatostatina cinco recién nacidos con quilotórax en los últimos 5 años. Tres quilotórax eran secundarios y dos congénitos. Entre los secundarios el primero apareció en una niña prematura que desarrolló una trombosis venosa profunda, en relación con el catéter venoso central, durante una infección por C. albicans. La prematuridad, la candidiasis sistémica, los catéteres centrales y los antecedentes de cirugía son los principales factores asociados a trombosis venosa, que a su vez puede dan lugar, como ocurrió en nuestro caso, a quilotórax secundarios si el territorio afectado es el de la vena cava superior 16-18. Éste parece ser el primer caso descrito en la literatura médica de quilotórax secundario a trombosis de vena cava tratado con éxito con somatostatina. Los otros quilotórax secundarios aparecieron tras la reparación quirúrgica de HDC. Esta complicación puede ocurrir hasta en un 27 % de los casos y se debe al traumatismo de los vasos linfáticos diafragmáticos 13. El segundo y cuarto paciente presentaron quilotórax congénitos. Ante el hallazgo en una ecografía prenatal de polihidramnios e hidrotórax fetal, como ocurrió en estos niños, la actitud terapéutica dependerá fundamentalmente de la edad gestacional, de la presencia de malformaciones asociadas, de la progresión a hidropesía y de la bilateralidad del hidrotórax 5,19. En los niños de nuestro estudio se decidió finalizar la gestación debido a la afectación pulmonar bilateral en un caso y la aparición de hidropesía fetal en otro.
Tras la confirmación diagnóstica se inició en todos los niños tratamiento conservador y somatostatina. En los primeros 2 pacientes se administraron las dosis mínimas eficaces descritas en la literatura médica 10, usándose dosis máximas 9 en el cuarto paciente. En los primeros 2 niños la disminución del derrame pleural ocurrió inmediatamente después de la administración de somatostatina 15, persistiendo su efecto en el tiempo (fig. 1). En los otros pacientes (3, 4 y 5) la disminución del volumen de drenaje linfático fue más progresiva, necesitando más días de tratamiento y dosis más altas (6-10 μg/kg/h) para conseguir el cese del derrame 15 (fig. 3). Aunque en estos pacientes el derrame pleural parece prolongarse a pesar del empleo de la somatostatina (lo que ha hecho que algunos autores pongan en duda su eficacia 15), nosotros creemos que la somatostatina sí mejoró la evolución y el pronóstico de los niños de nuestro estudio, disminuyendo los días y el volumen del derrame, lo que supuso una menor depleción proteico-linfocitaria, en especial en los quilotórax congénitos, caracterizados por presentar derrames elevados, prolongados y una elevada morbimortalidad.
En la literatura médica se ha usado indistintamente la somatostatina o su análogo octreótida, sin que se haya justificado en la misma la elección de uno o del otro. En nuestro caso, se usó siempre somatostatina, por un lado porque era el fármaco utilizado en los artículos inicialmente revisados 6,9,10 y por otra parte por la buena respuesta que se obtuvo con los primeros pacientes tratados.
Aunque nuestra experiencia apoya las observaciones de otros autores sobre la seguridad del fármaco 6-8,11-15, con efectos secundarios leves, transitorios e infrecuentes 9,10, recientemente se ha descrito la aparición de un cuadro de enterocolitis necrosante en un niño tratado con somatostatina 20. Este hecho podría ser el resultado de la hipoperfusión intestinal secundaria al efecto vasoconstrictor sobre los vasos sanguíneos del área esplácnica 8,9,12.
A pesar que sólo se han descrito casos clínicos aislados o pequeñas series de casos que no permiten alcanzar conclusiones estadísticas, sí parece útil el empleo temprano de la somatostatina en el tratamiento del quilotórax neonatal. Sin embargo, es necesaria la realización de estudios clínicos controlados y aleatorizados con el objeto de establecer claramente las indicaciones precisas, las dosis mínimas eficaces y la seguridad, tanto de la somatostatina como de la octreótida, para poder determinar su papel en el tratamiento de esta enfermedad.