La administración prenatal de MgSO4ha mostrado su eficacia en reducir la parálisis cerebral y la disfunción motora severa a los 2 años de edad.
El objetivo de este trabajo es estudiar la evolución clínica inicial de los neonatos menores de 29 semanas, que han recibido prenatalmente MgS04 con indicación neuroprotectora y dilucidar la asociación entre la dosis de magnesio administrada a la madre y las concentraciones de magnesio en suero neonatal.
Material y métodosEstudio prospectivo de cohortes en el que se incluyó a los neonatos menores de 29 semanas ingresados en la Unidad de Cuidados Intensivos Neonatales del Hospital Universitario de Vigo desde diciembre del 2012 hasta julio del 2015. Análisis comparativo de resultados perinatales, de morbimortalidad neonatal y magnesemia entre el grupo expuesto prenatalmente al sulfato de magnesio y un grupo control.
ResultadosSe incluyó a un total de 42 recién nacidos, en 28 de los cuales sus madres habían recibido MgSO4.
Se encontró significación estadística en la variable mortalidad. No hubo diferencias significativas en el resto de las variables estudiadas. Se obtuvo una correlación significativa entre la dosis total de MgSO4 recibida por la madre y los niveles de magnesio del recién nacido en las primeras 24 h de vida (r2 0,436; p<0,001).
ConclusionesSe ha obtenido una menor mortalidad en el grupo expuesto a MgS04. No se han encontrado efectos secundarios significativos derivados de la administración de MgS04. La dosis de MgSO4 recibida por las madres tiene una relación lineal con los niveles de magnesio obtenidos en los recién nacidos.
Antenatal magnesium sulphate (MgSO4) administration has shown to be effective in minimising cerebral palsy and severe motor dysfunction at the age of 2 years.
The aim of this study is to analyse the initial clinical outcome of preterm neonates less than 29 weeks who have received prenatal MgSO4, as well as to determine the relationship between the magnesium dose delivered to the mother and the magnesium concentration in the neonates.
Material and methodsA prospective cohort study was conducted on neonates of less than 29 weeks gestation admitted to the Neonatal Intensive Care Unit (NICU) of Hospital Universitario de Vigo from December 2012 to July 2015. Comparative analysis was performed on the perinatal outcomes, neonatal morbidity, mortality, and magnesium levels between the groups of neonates exposed to magnesium sulphate and the control group.
ResultsA total of 42 neonates were included in the study. The mothers of 28 of them had received MgSO4 as a neuroprotective agent.
Statistical significance was obtained in the mortality variable. There were no significant differences in the rest of studied variables. There was a significant correlation between the full dose of MgSO4 received by the mother and the levels of magnesium in the neonate in the first 24hours of life (r2 0.436; P<.001).
ConclusionsA lower mortality was observed in the group that had been exposed to MgS04. No significant side effects were found as a result of administering of MgS04. The MgS04 dose received by mother has a linear relationship with the magnesium levels obtained in neonates.
Aunque las tasas de supervivencia de los recién nacidos prematuros se han incrementado de manera importante en los últimos 20 años, la incidencia de parálisis cerebral infantil (PCI) se ha mantenido estable en el tiempo, probablemente debido al aumento de la supervivencia de recién nacidos prematuros extremos y, por tanto, de las morbilidades y lesiones neurosensoriales asociadas1,2.
El principal factor de riesgo para la PCI es el parto pretérmino, de tal manera que el 35% de las mismas se presentan en menores de 34 semanas3. La PCI es 70 veces más frecuente en menores de 28 semanas y 40 veces más frecuente en los nacidos entre las 28 a 32 semanas, en comparación con los recién nacidos a término4-7. El riesgo es inversamente proporcional a la edad gestacional.
Una revisión de la Cochrane Database of Systematic Reviews8 publicada en 2009 concluye que el MgS04 administrado a mujeres con un parto prematuro, sean cuales sean el motivo y la pauta de administración, reduce de manera significativa la parálisis cerebral y la disfunción motora severa a los 2 años de edad en los recién nacidos por debajo de 32 semanas.
Dos metaanálisis9,10 publicados en 2009 indican que el número necesario a tratar para prevenir un caso de PCI es de 63 gestantes.
Sin embargo, hay pocos trabajos que estudien la evolución inicial de los recién nacidos que han recibido MgS04 prenatalmente y que nos muestren la evolución durante el ingreso en el periodo neonatal. Existen en la literatura estudios que han comunicado una mayor incidencia de hipotonía, intubación en sala de partos, mayor necesidad de ventilación mecánica, persistencia de conducto arterioso, entre otros efectos adversos respiratorios, hemodinámicos11, neurológicos y digestivos7,12.
Por otro lado, existe una falta de consenso en cuanto a la dosis, el régimen estándar, la ventana terapéutica y la seguridad de su uso para la neuroprotección. La cantidad total de dosis de magnesio materna segura para los recién nacidos no se conoce, ya que su relación con la concentración de magnesio en suero neonatal no ha sido suficientemente estudiada13. Por tanto, aunque existe una ventana terapéutica en la que se observan los efectos neuroprotectores del magnesio, es conocido que a partir de determinados niveles de magnesemia en el recién nacido se eleva la morbimortalidad neonatal14.
El objetivo principal del presente estudio es valorar la evolución inicial de los pacientes ingresados en una Unidad de Cuidados Intensivos Neonatales (UCIN) de tercer nivel que han recibido MgSO4 neuroprotector, analizar la aparición de posibles efectos secundarios a la administración del mismo y, por último, dilucidar la asociación entre la dosis de magnesio administrada a la madre y las concentraciones de magnesio en suero neonatal.
Material y métodosSe ha realizado un estudio prospectivo de cohortes desde diciembre del 2012 hasta julio del 2015. Se han incluido en dicho estudio a los recién nacidos menores de 29 semanas, hijos de madres que han recibido MgSO4 con indicación neuroprotectora y que han ingresado en la UCIN del Complejo Hospitalario Universitario de Vigo. Se comparó a estos prematuros con un grupo control de la misma edad gestacional, nacidos en el mismo periodo. Se ha excluido a los recién nacidos con otros factores de riesgo que influyeron en una mala evolución inmediata, en nuestra serie un paciente polimalformado y otro que falleció en las primeras horas de vida tras un desprendimiento de placenta. Se escogió a los menores de 29 semanas por tratarse de un grupo de edad gestacional que es más subsidiario de necesitar maniobras avanzadas de reanimación en sala de partos, mayor soporte respiratorio con ventilación mecánica invasiva y por ser más susceptibles de presentar secuelas neurológicas1,5.
Se recogieron las siguientes variables perinatológicas: edad gestacional, peso, pequeño para la edad gestacional (definido como peso por debajo del percentil 10), sexo, gemelaridad, parto por cesárea, administración de corticoides prenatales, corioamnionitis (diagnosticada a través de estudio histológico), preeclampsia, diabetes gestacional y tiempo de rotura de bolsa amniótica.
Se analizó la necesidad en la primera hora de vida de reanimación cardiopulmonar (RCP) avanzada o intensa (definida por cualquiera de los 3 siguientes: intubación, masaje cardíaco, adrenalina), el Apgar en el 1° y el 5° min y el pH de arteria umbilical.
Se estudiaron una serie de variables hemodinámicas, respiratorias, neurológicas, digestivas, oftalmológicas e infecciosas.
Desde el punto de vista hemodinámico, se comprobó ecográficamente la persistencia de ductus arterioso, la necesidad de expansión de volumen y la administración de inotrópicos por hipotensión.
Para valorar la influencia del MgS04 desde el punto de vista respiratorio, se tuvieron en cuenta la necesidad de ventilación mecánica invasiva, la administración de surfactante, los días totales de oxigenoterapia, la presencia de displasia broncopulmonar (DBP) y su gravedad (según la definición del comité de estándares de la Sociedad Española de Neonatología de 2013)15 y la administración de corticoides por vía intravenosa para la DBP.
Se incluyeron en el trabajo variables digestivas tales como presencia de enterocolitis necrosante (NEC)16, el día de inicio de nutrición enteral y el día de vida en que se consiguió alimentación enteral exclusiva sin necesidad de aportes parenterales de ningún tipo.
Así mismo se analizó la evolución neurológica: desarrollo de hemorragia intraventricular (HIV) y leucomalacia periventricular; evolución oftalmológica: retinopatía del prematuro; infecciosa: sepsis nosocomial (definida por la positividad de un hemocultivo o por la combinación de elevación de reactantes de fase aguda y clínica de sepsis) y la mortalidad.
El régimen utilizado para la administración de MgSO4 con intención neuroprotectora en nuestro centro es el mismo que viene siendo utilizado para el tratamiento de la preeclampsia y/o prevención de la eclampsia13. La administración de MgSO4 se inicia con una dosis de carga de 4g a pasar en media hora y se continúa con una perfusión de 1g/h hasta que se produzca el parto. El MgSO4 debe de ser suspendido, si no se ha producido el parto, a las 24 h de haber iniciado la perfusión. Si tras la interrupción de la perfusión volviera a aparecer el riesgo de parto pretérmino inminente, se reiniciaría el tratamiento con MgSO4. Si han pasado menos de 6 h desde la suspensión de la perfusión, se continuaría con la dosis de mantenimiento, en caso contrario, se volvería a repetir el bolo inicial.
Para estudiar la relación entre la dosis total de magnesio recibida por las madres y la magnesemia en el recién nacido, se procedió a realizar dicha determinación en todos los prematuros cuyas madres habían recibido MgS04, dentro de las primeras 24 h de vida aprovechando la realización de una analítica por otro motivo.
Los datos se analizaron mediante el programa estadístico SPSS versión 21. El análisis de distribución de las variables se ha realizado mediante el test de Kolmogorov-Smirnov. El análisis de los parámetros cuantitativos se ha realizado según su distribución: test de t de Student y test de ANOVA para aquellos parámetros con distribución normal y, para no paramétricos, utilizamos el test U de Mann-Whitney. Las diferencias de las variables nominales se han analizado mediante test chi-cuadrado. Para determinar las correlaciones estadísticas significativas entre parámetros cuantitativos, se ha aplicado un análisis de regresión lineal. Se ha considerado que existen diferencias estadísticamente significativas cuando en el resultado de cualquiera de los análisis mencionados anteriormente la p ha sido < 0,05.
ResultadosSe obtuvo un tamaño muestral de 42 recién nacidos menores de 29 semanas, 28 expuestos prenatalmente a MgSO4 frente a 14 no expuestos.
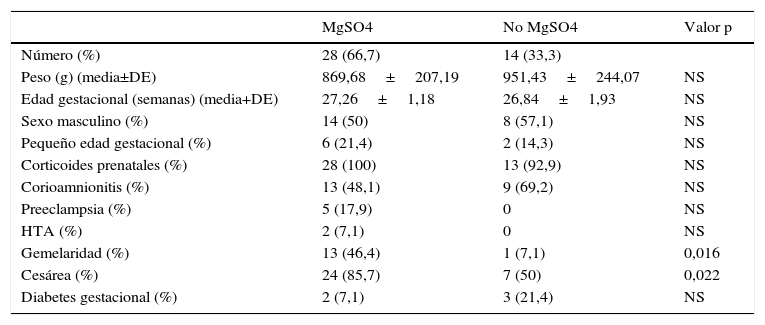
Ambos grupos tenían unas características perinatológicas generales similares, lo que permitió la comparación entre los grupos de tratados y no tratados. Se encontró mayor tasa de cesáreas (85,7%) y de gemelos (46,4%) en el grupo que habían sido tratados con MgSO4 (tabla 1), siendo estas diferencias estadísticamente significativas.
Variables perinatológicas
| MgSO4 | No MgSO4 | Valor p | |
|---|---|---|---|
| Número (%) | 28 (66,7) | 14 (33,3) | |
| Peso (g) (media±DE) | 869,68±207,19 | 951,43±244,07 | NS |
| Edad gestacional (semanas) (media+DE) | 27,26±1,18 | 26,84±1,93 | NS |
| Sexo masculino (%) | 14 (50) | 8 (57,1) | NS |
| Pequeño edad gestacional (%) | 6 (21,4) | 2 (14,3) | NS |
| Corticoides prenatales (%) | 28 (100) | 13 (92,9) | NS |
| Corioamnionitis (%) | 13 (48,1) | 9 (69,2) | NS |
| Preeclampsia (%) | 5 (17,9) | 0 | NS |
| HTA (%) | 2 (7,1) | 0 | NS |
| Gemelaridad (%) | 13 (46,4) | 1 (7,1) | 0,016 |
| Cesárea (%) | 24 (85,7) | 7 (50) | 0,022 |
| Diabetes gestacional (%) | 2 (7,1) | 3 (21,4) | NS |
DE: desviación estándar; HTA: hipertensión arterial; MgSO4: terapia con sulfato de magnesio prenatal; No MgSO4: no terapia con sulfato de magnesio prenatal; NS: no significativo.
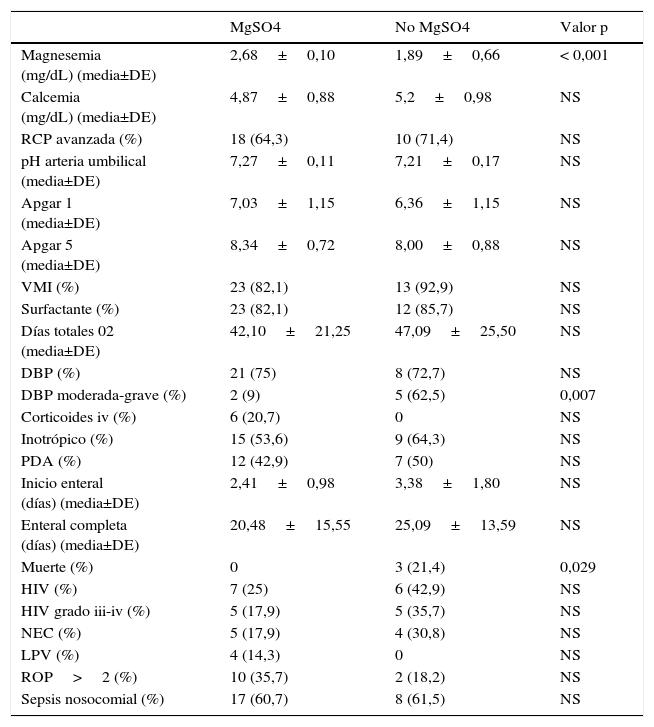
No se obtuvieron diferencias en la evolución entre ambos grupos en lo que respecta a necesidad de RCP avanzada, Apgar, pH de arteria umbilical, variables respiratorias, hemodinámicas, neurológicas, retinopatía superior a grado 2 y sepsis nosocomial (tabla 2). En cambio, sí se encontró una mayor mortalidad en el grupo no tratado con MgSO4 (21,4%), lo que resultó significativo estadísticamente. Así mismo, si bien el desarrollo de DBP fue similar en ambos grupos, el subgrupo de menores de 29 semanas no tratado con sulfato de magnesio presentó más casos de DBP moderada-grave (5 casos moderada-grave respecto a 2).
Resultados evolutivos
| MgSO4 | No MgSO4 | Valor p | |
|---|---|---|---|
| Magnesemia (mg/dL) (media±DE) | 2,68±0,10 | 1,89±0,66 | < 0,001 |
| Calcemia (mg/dL) (media±DE) | 4,87±0,88 | 5,2±0,98 | NS |
| RCP avanzada (%) | 18 (64,3) | 10 (71,4) | NS |
| pH arteria umbilical (media±DE) | 7,27±0,11 | 7,21±0,17 | NS |
| Apgar 1 (media±DE) | 7,03±1,15 | 6,36±1,15 | NS |
| Apgar 5 (media±DE) | 8,34±0,72 | 8,00±0,88 | NS |
| VMI (%) | 23 (82,1) | 13 (92,9) | NS |
| Surfactante (%) | 23 (82,1) | 12 (85,7) | NS |
| Días totales 02 (media±DE) | 42,10±21,25 | 47,09±25,50 | NS |
| DBP (%) | 21 (75) | 8 (72,7) | NS |
| DBP moderada-grave (%) | 2 (9) | 5 (62,5) | 0,007 |
| Corticoides iv (%) | 6 (20,7) | 0 | NS |
| Inotrópico (%) | 15 (53,6) | 9 (64,3) | NS |
| PDA (%) | 12 (42,9) | 7 (50) | NS |
| Inicio enteral (días) (media±DE) | 2,41±0,98 | 3,38±1,80 | NS |
| Enteral completa (días) (media±DE) | 20,48±15,55 | 25,09±13,59 | NS |
| Muerte (%) | 0 | 3 (21,4) | 0,029 |
| HIV (%) | 7 (25) | 6 (42,9) | NS |
| HIV grado iii-iv (%) | 5 (17,9) | 5 (35,7) | NS |
| NEC (%) | 5 (17,9) | 4 (30,8) | NS |
| LPV (%) | 4 (14,3) | 0 | NS |
| ROP>2 (%) | 10 (35,7) | 2 (18,2) | NS |
| Sepsis nosocomial (%) | 17 (60,7) | 8 (61,5) | NS |
DBP: displasia broncopulmonar; DE: desviación estándar; HIV: hemorragia intraventricular; iv: vía intravenosa; LPV: leucomalacia periventricular; MgSO4: terapia prenatal con sulfato de magnesio; No-MgSO4: no terapia prenatal con sulfato de magnesio; NEC: enterocolitis necrosante; PDA: persistencia ductus arterioso; RCP avanzada: reanimación cardiopulmonar avanzada; ROP > 2: retinopatía de la prematuridad superior a grado 2; VMI: ventilación mecánica invasiva.
Todos los recién nacidos y sus madres fueron incluidos en el estudio de la relación entre dosis de magnesio materna y la magnesemia neonatal. En el grupo que recibió tratamiento, 8 neonatos recibieron prenatalmente 4g, 12 neonatos más de 8g y en los restantes 8 neonatos a las madres se les administró entre 4 y 8g de MgSO4. La dosis media de magnesio que recibieron las madres fue de 10,09g, con una mediana de 7,5g14. Los niveles medios de magnesio en los recién nacidos expuestos fueron de 2,68mg/dL (mediana de 2,65mg/dL), hallándose diferencias significativas con la magnesemia en el primer día de vida de los no tratados con MgSO4 (tabla 3). Se ha podido establecer una correlación lineal estadísticamente significativa entre la dosis de MgSO4 recibida por las madres y la magnesemia de los recién nacidos obtenida dentro de las primeras 24 h de vida (r2=0,436; p<0,001). En nuestra serie la magnesemia máxima fue de 4,04mg/dL y correspondió a un niño cuya madre había recibido 20 g de MgSO4.
Niveles medios de magnesio y magnesemia por grupos de dosis materna administrada
| Magnesio | No magnesio | Valor p | |
|---|---|---|---|
| RN (N) | 28 | 14 | |
| Mg (mg/dL) (media±DE) | 2,68±0,10 | 1,89±0,66 | < 0,001 |
| No MgSO4 | MgSO4 ≤ 4g | MgSO4 > 4g y<8g | MgSO4 ≥ 8g | |
|---|---|---|---|---|
| RN (N) | 14 | 8 | 8 | 12 |
| Mg RN (mg/dL) (media±DE) | 1,89±0,66 | 2,39±0,13 | 2,40±0,11 | 3,07±0,16 |
| Valor p = 0,002 | ||||
Teniendo en cuenta la dosis de magnesio administrada a la madre y la magnesemia del recién nacido (tabla 3), se analizaron los datos con el objetivo de hallar una correlación entre el peso del recién nacido y la magnesemia, sin hallarse diferencias estadísticamente significativas entre ambas.
Así mismo, se compararon los niveles de magnesio en recién nacidos pretérmino cuya madre solamente había recibido el bolo de 4g de MgSO4 con los niveles en hijos de madres que no habían recibido magnesio. El grupo que había recibido el bolo de magnesio de 4g tenía una magnesemia media de 2,39mg/dL (mediana 2,3mg/dL) y el grupo que no había recibió magnesio presentaba en contraposición una magnesemia media 1,89mg/dL (mediana 1,86mg/dL), objetivándose entre ambos diferencias con significación estadística.
DiscusiónEn cuanto a la evolución inicial en sala de partos, no se han hallado diferencias significativas en la RCP, sin presentar mayor necesidad de reanimación avanzada, ni en puntaje de Apgar ni en valores de pH de arteria umbilical. Estos resultados coinciden con los de otras largas cohortes que ya apuntan a la seguridad del MgSO4 en estas circunstancias17.
Desde el punto de vista de la evolución respiratoria, no hubo diferencias en la necesidad de ventilación mecánica invasiva, surfactante y días totales de oxígeno, por lo que no puede atribuirse al MgSO4 ningún efecto secundario en este sentido, a diferencia de lo que se consideraba tradicionalmente, relacionándose la terapia de MgSO4 con una mayor depresión respiratoria18. El grupo de tratados desarrolló DBP de menor severidad.
Desde el punto de vista hemodinámico, la ausencia de efectos adversos también fue la norma coincidente con otros trabajos, no siendo mayor el número de ductus arterioso permeable ni la necesidad de inotrópicos19. En el resto de parámetros evolutivos no se han encontrado diferencias durante el periodo de ingreso en la Unidad Neonatal, observándose así que a nivel neurológico, el desarrollo de HIV y la leucomalacia fueron similares en ambos grupos. En este sentido, resulta interesante el estudio a largo plazo de estos niños para una valoración de su desarrollo psicomotor. A nivel digestivo, tampoco existe discordancia respecto al desarrollo de NEC, el inicio de la alimentación enteral y los días con los que alcanzaron la enteral completa. Así mismo, se obtuvieron resultados homogéneos en cuanto al desarrollo de retinopatía de la prematuridad a nivel oftalmológico y el desarrollo de sepsis nosocomial a nivel infeccioso.
La variable mortalidad sí que encontró diferencias en el grupo tratado con MgSO4. Nuevamente, el pequeño tamaño de la muestra hace que debamos tomar este resultado con mucha cautela y seguir recogiendo datos para futuras comparaciones. Debemos recordar que ya la Cochrane Database of Systematic Reviews de 200913 establece que cuando la administración de magnesio había sido exclusivamente con indicación de neuroprotección, la tasa combinada de muerte y parálisis cerebral a los 2 años se ve reducida en este grupo de niños9,20.
Cabe preguntarse si el éxito de la administración de MgSO4 en relación con la disminución de la mortalidad infantil se inicia ya en el periodo neonatal. Existen otros trabajos en la literatura donde también se recoge una menor mortalidad en el grupo tratado con MgSO417, sin haberse aclarado el mecanismo de acción. En los últimos años han aparecido estudios que relacionan la administración de MgS04 prenatal con un menor consumo de oxígeno a nivel del cerebro del recién nacido y una menor extracción tisular de oxígeno a dicho nivel (cFTOE)21.
Respecto a la dosis de magnesio administrada a las madres, se encontró una relación lineal entre esta y los niveles de magnesio en los recién nacidos menores de 29 semanas en las primeras 24 h de vida. Esta circunstancia permite establecer dosis maternas de seguridad que eviten efectos secundarios en el prematuro.
Los niveles medios de magnesio en los recién nacidos fueron de 2,68mg/dL, niveles inferiores a los 4,5mg/dL que se relacionan potencialmente con secundarismos y peor evolución clínica durante el periodo neonatal22. Es muy probable que la ausencia de efectos secundarios derivados de la administración de MgS04 en nuestra serie sea debida a que las dosis administradas a las madres fueron bajas, en líneas generales. En nuestro grupo de tratados, la magnesemia máxima fue de 4,04mg/dL y correspondió a un niño cuya madre había recibido 20g de MgSO4. Por lo tanto, podemos establecer un nivel de seguridad en los 20g totales administrados y las 16 h de perfusión continua, ya que a partir de esa dosis nos acercamos peligrosamente a niveles que asocian peores evoluciones.
En 8 de los 28 recién nacidos pretérmino cuyas madres habían sido tratadas con MgSO4 solo se pudo administrar el bolo inicial de 4g, por la inminencia del parto. Incluso en los hijos de estas madres, los niveles de magnesio fueron superiores y tenían significación estadística cuando se comparaban con los niveles en hijos de madres que no habían recibido magnesio. Por esta razón, recomendamos al menos la administración del bolo de 4g de magnesio a las madres de los pretérmino menores de 29 semanas, aunque el nacimiento sea inminente.
También recomendamos la determinación analítica de los niveles de magnesio en todos los recién nacidos cuyas madres hayan recibido dicho fármaco prenatalmente. En primer lugar, por el aumento de la mortalidad detectada a partir de niveles 4,5mg/dL de magnesemia22 y, en segundo lugar, por los ajustes que va a ser necesario realizar en las composiciones de las nutriciones parenterales que puedan recibir estos niños durante los primeros días de vida, hasta que se normalicen sus cifras de magnesio en sangre.
En conclusión, el MgSO4 se presenta como un fármaco que parece ser seguro a las dosis administradas en nuestro estudio, cuyas concentraciones séricas en las primeras 24 h de vida en el recién nacido mantienen un relación lineal con la dosis total de magnesio recibida por la madre.
Son necesarios estudios que realicen un seguimiento a largo plazo de los pacientes incluidos en este trabajo para valorar el impacto que la terapia con MgSO4 ejerce en el desarrollo neurológico posterior.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el personal de nuestra Unidad que colabora en el tratamiento de estos pacientes. Al doctor Pumarada, por su colaboración y por incentivarme a llevar a cabo este trabajo. Finalmente, y muy especialmente, a todos los pacientes y sus familias.