Los tumores corticosuprarrenales (TCS), derivados de células localizadas en la corteza suprarrenal, suponen menos del 0,2% del total de los tumores pediátricos1. Su incidencia presenta considerables variaciones geográficas, siendo mayor en el Sur de Brasil, habiéndose implicado factores genéticos predisponentes2. En España, se han registrado 21 casos en los últimos 30 años3. En ocasiones se asocian a síndromes como el de Li-Fraumeni, Beckwith-Wiedemann, complejo de Carney, hiperplasia suprrarenal congénita y MEN4.
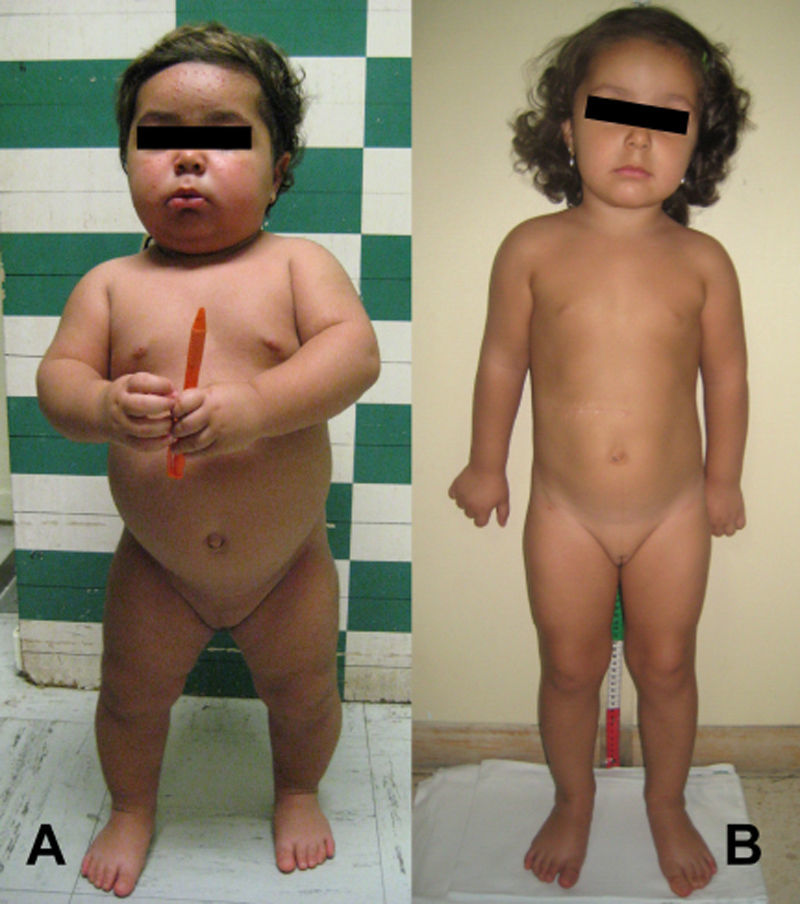
Presentamos el caso de una niña de 15 meses, que consultó por hiperpigmentación de labios mayores y vello púbico de seis meses de evolución. En la exploración se objetivó un fenotipo cushingoide con hirsutismo moderado y acné facial, así como pubarquia estadio III de Tanner, hipertrofia de clítoris e hiperpigmentación de labios mayores. El estudio bioquímico demostró niveles plasmáticos de ACTH normales; cortisol 21,4μg/dl (normal: 3,70–19,40); testosterona, 8,91g/mg (normal: 0,11–0,78); DHEA-S, 31,68μmol/l (normal: 0,01–0,53), y androstendiona >8,80ng/ml (normal: 0,50–4,80). La ecografía de abdomen objetivó una masa suprarrenal derecha, confirmada posteriormente por resonancia nuclear magnética (RNM). Tras adrenalectomía con resección completa de la masa tumoral, el estudio anatomopatológico fue informado como carcinoma suprarrenal. Posterior a la intervención, la evolución fue favorable, con disminución de la clínica de virilización e hipercortisolismo, así como de los niveles plasmáticos de testosterona, androstendiona, DHEA-S y cortisol. A los 12 meses de seguimiento, la niña se encuentra asintomática manteniendo cifras de las referidas hormonas dentro de la normalidad (fig. 1).
Los TCS infantiles presentan algunas características clínicas y biológicas peculiares: mientras la incidencia de la mayoría de los carcinomas infantiles aumenta con la edad, la de los TCS disminuye con la misma, presentando una distribución bimodal con un pico por debajo de los 4 años y otro menor en el periodo peripuberal1,4.
A pesar de su escasa prevalencia, este tipo de tumores han sido mejor definidos en los últimos años gracias al Registro Internacional de Tumores Adrenocorticales (IPACTR)5. Éste confirma el predominio de los TCS en niños menores de 4 años así como la mayor prevalencia del género femenino en pacientes menores de 3 años y adolescentes. Asimismo, verifica que hasta el 90% de los mismos son funcionantes y unilaterales, siendo la clínica virilizante la forma más frecuente de presentación y el carcinoma, la histología más habitual (85–90%). Con frecuencia, pueden detectarse signos y síntomas secundarios a la coexistencia de otra hipersecreción hormonal asociada, principalmente glucocorticoides, en cuyo caso además de la virilización existe clínica cushingoide.
Por otro lado, hasta el 50% de los TCS pueden asociar masa y dolor abdominal. En el caso de los carcinomas existe tendencia (50–60%) a la diseminación locorregional (riñón, peritoneo, peritoneo, diafragma y vena cava), hallándose metástasis a distancia en el 5% (hígado, pulmón, hueso y ganglios linfáticos).
El diagnóstico definitivo de los TCS se basa aparte de en las pruebas de laboratorio y de imagen, en el estudio histopatológico. Ante la sospecha de un TCS se recomienda la realización de una prueba de imagen dirigida a la evaluación del área suprarrenal. La ultrasonografía es útil como prueba de despistaje y para descartar extensión tumoral a la vena cava inferior o aurícula derecha4. La RM constituye la prueba de elección, permitiéndonos detectar la invasión vascular4,6 y lesiones en otros órganos.
El 18-Fluordesoxiglucosa-PET, es de ayuda tanto para el diagnóstico de recidivas locales como para la distinción entre adenomas y carcinomas y revelar metástasis5.
El último de los pilares diagnósticos es el estudio histopatológico, el cual está basado en los criterios de Weiss7, que si bien son aceptados en el diagnóstico de malignidad de TCS en adultos, algunos autores consideran que no son extrapolables a la población pediátrica8.
Respecto al estadiaje tumoral, los criterios adoptados por el IPACTR son los descritos por Sandrini5 (tabla 1). De este modo, en estadios localizados el tratamiento de elección es la cirugía. Si hubiera afectación ganglionar o metastásica, debería procederse a su resección siempre que fuese posible, siendo recomendable incluir a estos pacientes en protocolos con tratamiento adyuvante quimio y/o radioterapéutico9.
Criterios de estadiaje de los TCS
| Estadio | Definición |
| I |
|
| II |
|
| III |
|
| IV |
|
Respecto al pronóstico, los únicos parámetros clínicos que se han asociado invariablemente a un peor pronóstico son el tamaño tumoral y la resecabilidad5,10.
La tasa de supervivencia media de los niños con TCS se estima alrededor del 50%, que asciende hasta el 70% cuando se logra una resección completa4. La normalización hormonal ocurre en la semana siguiente a la cirugía y la clínica de virilización u otras asociadas tardan semanas o meses en desaparecer.
Agradecemos a la Dra. Ortega Salas su colaboración en el diagnóstico.