El síndrome de tortuosidad vascular es un infrecuente trastorno de origen genético que cursa con tortuosidad y estenosis de las circulaciones pulmonar, sistémica y/o coronaria.
Como consecuencia del tratamiento de las estenosis pulmonares puede producirse un cuadro de edema pulmonar conocido como síndrome de reperfusión pulmonar.
Presentamos el caso de un adolescente con un síndrome de tortuosidad vascular que presentó un síndrome de reperfusión pulmonar tras la colocación de varios stents en la arteria pulmonar izquierda. Tras el procedimiento, el paciente desarrolló de forma inmediata un cuadro de edema agudo de pulmón, con deterioro severo de su estado clínico, qué llegó a precisar asistencia con oxigenación por membrana extracorpórea para su recuperación.
Vascular tortuosity syndrome is a rare genetic disorder that causes tortuosity and stenosis of the pulmonary, systemic and / or coronary circulations.
As a result of treatment of pulmonary stenosis, symptoms of pulmonary edema, known as lung reperfusion syndrome, may occur.
The case is presented of an adolescent patient with vascular tortuosity syndrome who presented with a pulmonary reperfusion syndrome after multiple stent implants in the left pulmonary artery. After the procedure, the patient immediately developed an acute pulmonary edema with severe clinical deterioration, which required assistance with extracorporeal membrane oxygenation for recovery.
El síndrome de tortuosidad vascular es una enfermedad infrecuente, de origen genético1,2, que cursa con tortuosidad y estenosis de las circulaciones pulmonar, sistémica y/o coronaria. Hasta un 60% de los pacientes2 presentan estenosis de las arterias pulmonares centrales o de alguna de sus ramas lobares y/o segmentarias, provocando hipertensión del ventrículo derecho (VD), hipoxemia e insuficiencia cardíaca congestiva.
Tanto el implante de stents por cateterismo3 como la reconstrucción quirúrgica4, o los procedimientos híbridos5, han sido propuestos como medidas eficaces para el tratamiento de las estenosis pulmonares en estos pacientes. El síndrome de reperfusión pulmonar es una grave complicación de estos tratamientos. El mecanismo fisiopatológico de dicho síndrome y las maniobras para prevenirlos aún no están claramente establecidos.
Presentamos el caso de un paciente con síndrome de tortuosidad vascular que presentó un síndrome de reperfusión pulmonar tras el implante de stents pulmonares.
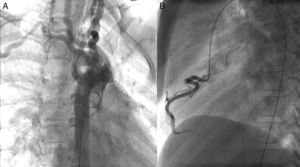
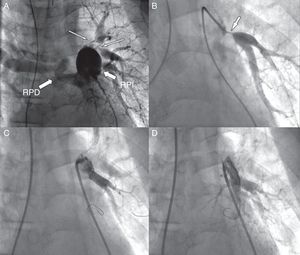
Caso clínicoSe trata de un paciente diagnosticado a los 3 años de un síndrome de tortuosidad vascular. Aunque presentaba tortuosidad de los troncos supraaórticos y las arterias coronarias (fig. 1) la afectación más grave se localizaba en la circulación pulmonar con tortuosidad y estenosis difusa en arterias lobares y segmentarias (fig. 2 A).
A) Angiografía del árbol pulmonar en la que se observa la tortuosidad de la rama pulmonar derecha (RPD), la gran dilatación de la rama pulmonar izquierda (RPI) y las estenosis filiformes (flechas) de 2 arterias segmentarias del pulmón izquierdo. B) Estenosis filiforme de una arteria segmentaria del lóbulo inferior izquierdo. C) La misma arteria segmentaria tras el implante de un stent. D) Angiografía tras el implante de 3 stents en la arteria lobar inferior izquierda y 2 arterias segmentarias.
Durante los siguientes años tras el diagnóstico, el paciente evolucionó hacia una estenosis progresiva de las ramas pulmonares con dilatación e hipertensión del VD. En el cateterismo diagnóstico se intentó implantar un stent coronario en una arteria lobar sin éxito. A los 10 años, el paciente presentó un síncope de esfuerzo en relación con bajo gasto. Se realizó un cateterismo cardíaco en el que se objetivó una presión del VD al 80% de la presión sistémica y se implantó un stent en el tabique interauricular para prevenir los episodios de síncope.
A los 13 años de edad, se realizó un nuevo cateterismo cardíaco, en el que se implantaron 3 stents en la rama lobar inferior izquierda y en 2 segmentarias de esta (fig. 2). Aunque el procedimiento cursó sin incidencias, el paciente inició de forma inmediata, en la sala de hemodinámica, un cuadro de dificultad respiratoria grave, con emisión por la boca de una gran cantidad de secreción rosada que precisó intubación y traslado urgente a la Unidad de Cuidados Intensivos Pediátricos (UCIP). En las horas siguientes, el paciente presentó un deterioro progresivo, con edema pulmonar masivo con opacificación pulmonar bilateral y signos ecocardiográficos de presión suprasistémica del VD. Ante la ausencia de respuesta a la ventilación con PEEP alta y la administración de óxido nítrico inhalado, junto con hipotensión arterial refractaria a la administración de volumen y perfusión de fármacos vasoactivos, se decidió su canulación y asistencia con oxigenación por membrana extracorpórea (ECMO).
El paciente mejoró progresivamente, pudiendo ser decanulado a los 9 días, dado de alta de la UCIP a los 37 días y de alta hospitalaria a los 77 días del ingreso. Actualmente, ha recuperado su situación clínica basal. En la tomografía computarizada realizada a los 9 meses del cateterismo, los stents implantados en la rama pulmonar izquierda están permeables.
DiscusiónEl síndrome de tortuosidad vascular es un trastorno infrecuente del tejido conectivo. Está causado por mutaciones en el gen SLC2A10 (20q13.12), que codifica el transportador de glucosa GLUT10 y se transmite de forma autosómica recesiva. Existen menos de 80 casos descritos en la literatura agregados en 34 familias. La ratio hombre:mujer es de 1:16.
Dicha mutación provoca una proliferación excesiva en la pared de las arterias que provoca tortuosidad y estenosis de los vasos afectados. Suele afectar a los troncos supraaórticos, las coronarias y el territorio vascular pulmonar. La afectación de los vasos pulmonares ocurre hasta en el 60% de los casos6. En los casos en los que las estenosis pulmonares son difusas, cursa con aumento de la presión en el VD.
Estos pacientes suelen presentar, tras su reparación vascular, un daño por reperfusión pulmonar por un incremento brusco del flujo sanguíneo pulmonar a áreas donde los vasos están habituados a trabajar con bajos flujos y a bajas presiones. Abdulaziz et al. recogen en su serie 7 pacientes con síndrome de tortuosidad a los que se realizó cirugía de reconstrucción pulmonar. Todos ellos desarrollaron daño por reperfusión de leve a moderado. Los primeros signos aparecieron en la primera hora poscirugía, al igual que en nuestro caso, con aumento de secreciones bronquiales e infiltrados pulmonares bilaterales en la radiografía que precisaron intubación hasta la resolución del daño por reperfusión. Ninguno de los pacientes precisó ECMO y solo uno de ellos ventilación de alta frecuencia. La severidad y la duración del edema fueron directamente proporcionales a la severidad en la enfermedad vascular pulmonar7.
El daño por reperfusión se ha descrito también en series de pacientes pediátricos con cardiopatía congénita del tipo atresia pulmonar con comunicación interventricular y colaterales aortopulmonares a los que se realiza cirugía de unifocalización8. Dichas colaterales muestran con frecuencia trayectos tortuosos con diversos grados de estenosis, una situación similar a la del síndrome de tortuosidad vascular. En la serie de Maskatia et al.8, de 65 procedimientos de unifocalización realizados, 42 (65%) presentaron daño pulmonar por reperfusión, siendo los principales factores de riesgo de esta complicación la realización de procedimientos de unifocalización bilaterales y el grado de estenosis previo de los vasos.
Otro contexto clínico en el que se describe el daño por reperfusión pulmonar ha sido en pacientes con enfermedad tromboembólica crónica tras la realización de angioplastia con balón. Incluso se ha propuesto en 2013 un nuevo índice para predecir el riesgo de edema por reperfusión pulmonar en estos pacientes9.
Asimismo parece que el daño pulmonar que presentan estos pacientes es idéntico al que presentan algunos pacientes tras el trasplante pulmonar, también conocido como fallo primario del injerto10.
Existen diversas hipótesis en cuanto a la patogenia del edema. Asija et al. buscaron marcadores biológicos que predijeran el riesgo de aparición del edema en un grupo de pacientes con atresia pulmonar con comunicación interventricular y colaterales aortopulmonares tras cirugía de unifocalización pulmonar sin encontrar diferencias significativas en ninguna de las moléculas estudiadas11. Tras descartar el origen cardiogénico del edema pulmonar y el daño por la circulación extracorpórea (CEC), varios autores apuntan a un origen multifactorial, dando importancia a factores como el mecanismo hidrostático, el daño capilar pulmonar por isquemia/reperfusión, la disrupción de vasos linfáticos o la denervación de la vasculatura8-10.
En cuanto a las actuaciones que podrían prevenir o minimizar el daño, se han propuesto la ultrafiltración continua durante la CEC para reducir el edema tisular, la administración de óxido nítrico tras el destete de la CEC, forzar diuresis, mantener las cifras de hemoglobina entre 12 y 14 g/dl o la ventilación mecánica con PEEP de 4-5cm de agua8. Finalmente, se ha postulado que una actuación al mismo tiempo sobre ambas ramas de la vasculatura pulmonar podría disminuir la aparición y/o la gravedad del síndrome de reperfusión, al redistribuir el flujo sobre un mayor territorio vascular12.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.