El síndrome de Miller-Dieker es una variedad de la lisencefalia, donde el cerebro se presenta con pocas circunvoluciones o ninguna, por lo que también se conoce como «cerebro liso»1–6.
Hay distintos grados de afección, desde formas más leves con paquigiria y persistencia de circunvoluciones hasta aquellas más graves con agiria completa1–6.
Pueden distinguirse dos tipos anatómicos de lisencefalia. El tipo I presenta una corteza cerebral similar a la de un feto de unas 12 semanas de gestación, donde se aprecia una capa marginal más externa con pocas células, una capa celular difusa que contiene neuronas piramidales y de otro tipo características de las capas inferiores de la corteza, una zona de neuronas heterotópicas en columnas y una banda más interna de sustancia blanca. En la lisencefalia tipo II el aspecto es muy distinto, las meninges están engrosadas y adheridas a la superficie cortical y sin circunvoluciones. La corteza se presenta como acumulaciones y disposiciones circulares de neuronas, sin organización o laminación reconocible, separadas por tabiques neurogliales y vasculares7–10.
Clínicamente se distinguen, dentro de la lisencefalia tipo I, una forma aislada y otra que conforma el síndrome de Miller-Dieker. La lisencefalia tipo II se clasifica en tres cuadros distintos: síndrome de Walker-Warburg, enfermedad muscular-ocular-cerebral y distrofia muscular congénita de Fukuyama1–3,6,8,10.
Lactante seguido en la consulta desde los 3 meses por retraso psicomotor, y fenotipo peculiar, cráneo turricéfalo, micrognatia, nariz algo respingona y corta, orificios antevertidos, orejas de implantación baja. Primer hijo de padres sanos no consanguíneos. Embarazo controlado en su país de origen (Marruecos), que informan como normal. Parto sin incidencias, eutócico, vaginal. Peso al nacimiento: 2.200g. Apgar 9/10.
A los 5 meses no consigue sostén cefálico, presenta un contacto visual defectuoso, hipotonía generalizada, tendencia a lateralización del cuello hacia la izquierda, microcefalia. Sin crisis convulsivas detectadas clínicamente, se aprecia en el electroencefalograma (EEG) alteraciones graves del trazado de base con amplitud alta y frecuencia rápida. A partir de los 6 meses comienza a presentar espasmos epilépticos compatibles con síndrome de West; en el EEG se aprecia hipsarritmia hipervoltada de difícil control clínico y electroencefalográfico, tratado con corticoides, así como diversos fármacos antiepilépticos. En la actualidad está controlado parcialmente con ácido valproico, vigabatrina y topiramato.
Al año de vida el sostén cefálico es nulo, con alteración cognitiva muy importante, con desconexión prácticamente absoluta del medio, hipertonía llamativa de músculos extensores paravertebrales con tendencia al opistótonos, e hipotonía de las cuatro extremidades.
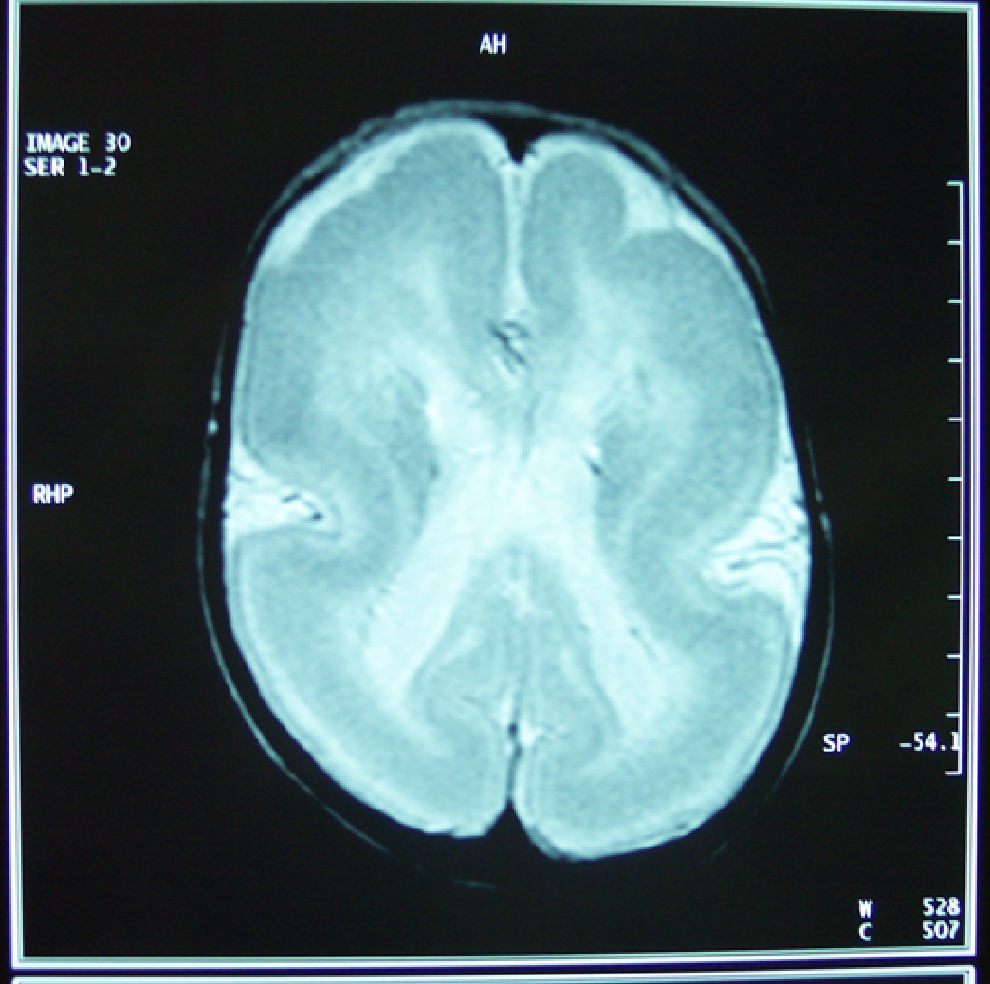
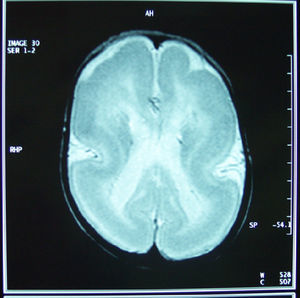
En las pruebas de neuroimagen (resonancia magnética craneal realizada a los 6 meses de edad), se aprecia una ausencia prácticamente completa de giros y surcos en los lóbulos occipitales y parietales, alternando con formación parcial de giros y surcos en los lóbulos temporales y frontales (paquigiria). Se evidencia un cuerpo calloso parcialmente formado, con ausencia de esplenio y rostrum (fig. 1).
Se buscan malformaciones asociadas y se aprecia una comunicación intrerauricular en el ecocardiograma; el resto del estudio (fondo de ojo, ecografía abdominal-renal) es normal.
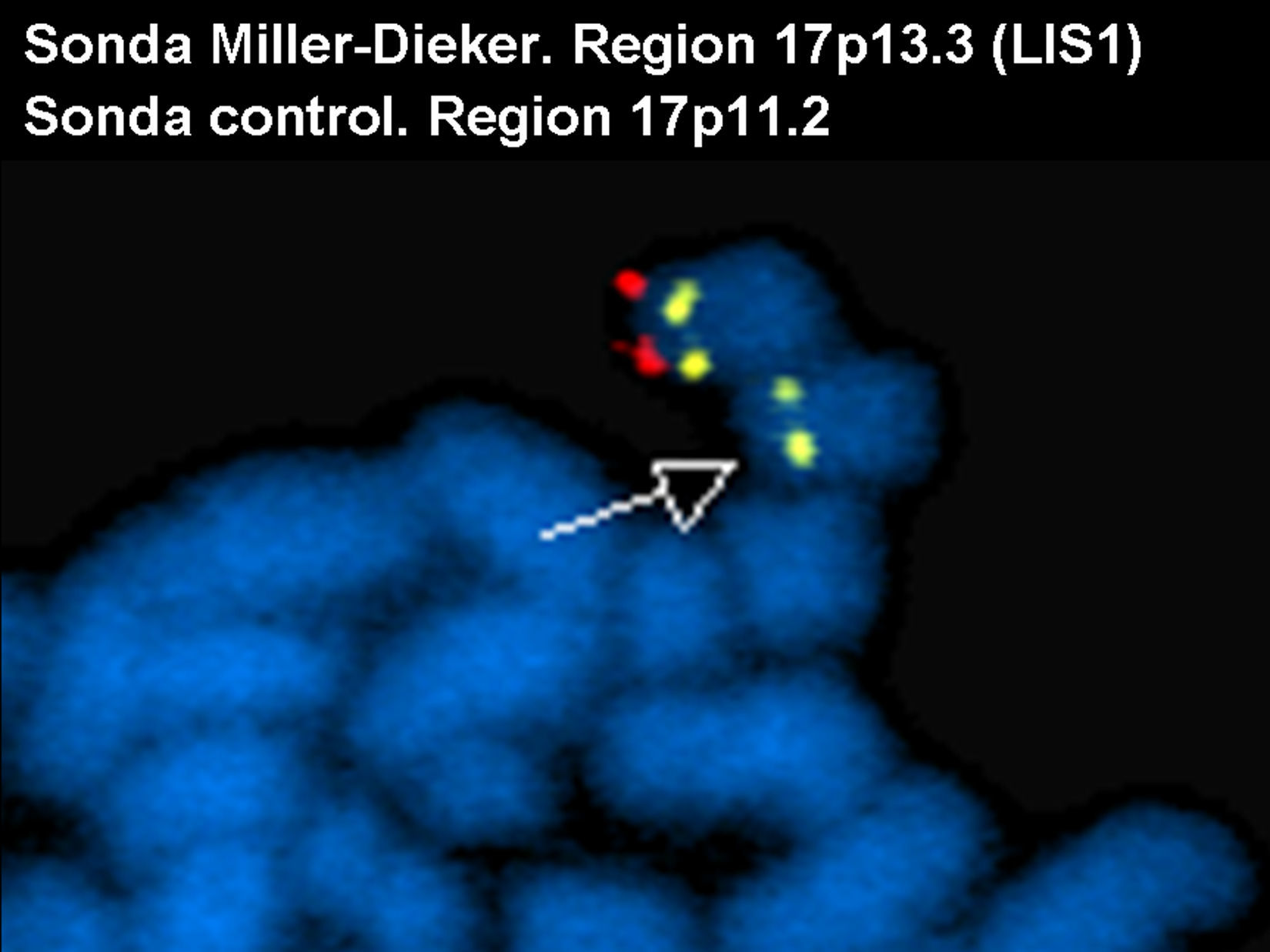
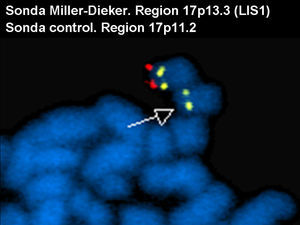
Se solicitó el cariotipo al laboratorio de citogenética del ECEMC (Estudio Colaborativo Español de Malformaciones Congénitas) donde se realizó el estudio cromosómico con bandas G de alta resolución (***) en linfocitos de sangre periférica. Este estudio puso de manifiesto que el número y la estructura de los cromosomas eran aparentemente normales. Ante la sospecha clínica de síndrome de Miller-Dieker, se aplicaron técnicas de hibridación in situ con fluorescencia (FISH) con la sonda específica para dicho síndrome, localizado en el brazo corto del cromosoma 17 (17p13.3) [locus LIS1 (Cytocell)], para descartar una microdeleción de dicha región. El resultado mostró una microdeleción en uno de los cromosomas del par 17 (fig. 2).
FISH con la sonda específica para la región 17p13.3 (locus LIS1) (rojo) y con la sonda control específica para la región 17p11.2 (amarillo). En la imagen se ve un cromosoma 17 con las dos señales (cromosoma normal) y otro cromosoma 17, con una sola señal (amarillo), lo que indica que ha perdido la región 17p13.3 que se marca en rojo. La flecha indica el cromosoma delecionado.
Cariotipo y FISH de los padres resultaron normales, por lo tanto la alteración en el niño se había producido de novo.
La lisencefalia se divide en tipo I y II; asimismo la lisencefalia tipo I se divide en una forma aislada y el síndrome de Miller-Dieker1–6. Clínicamente la lisencefalia tipo I se caracteriza por una microcefalia que no está presente al nacimiento, y que aparece durante los primeros meses. Suele haber aplanamiento bitemporal y mandíbula pequeña. Es característico que presente escasos movimientos, junto con una hipotonía general, que posteriormente evoluciona a una hipertonía con espasticidad, generalmente, durante el primer año de vida1,2,6–8. Asimismo, a partir de los 6-7 meses suelen aparecer espasmos infantiles característicos de un síndrome de West que luego evoluciona a síndrome de Lennox-Gastaut. El EEG suele ser anormal; hasta en un 75% de los casos se presenta con actividad rápida de amplitud alta, así como períodos de complejos de ondas agudas y lentas, entremezclados con períodos de depresión de voltaje2,10–13.
Cursan en su mayoría (salvo algún caso con paquigiria leve) con alteración neurocognitiva muy importante.
Las pruebas de neuroimagen nos ayudan a definir la extensión de la lesión, así como a obtener datos acerca de la lesión genética probable que fundamenta la lisencefalia tipo I. Se ha visto más relación con afección de campos posteriores si la alteración genética está relacionada con el cromosoma 17, mientras que suele afectar más a campos anteriores en los casos ligados al cromosoma X. Aparte de las alteraciones de las circunvoluciones suele apreciarse colpocefalia, con la dilatación ventricular propia, así como hipoplasia o agenesia del cuerpo calloso, y falta de desarrollo de las cisuras calcarinas4,8,9.
El síndrome de Miller-Dieker se diferencia de la forma más clásica o aislada de lisencefalia por una expresión fenotípica más compleja. Los pacientes presentan rasgos dismórficos que además del hundimiento bitemporal y mandíbula pequeña, que también se puede observar en la lisencefalia aislada, se aprecia nariz corta con orificios antevertidos, filtrum largo, labio superior sobresaliente con borde fino y sin relieve. Otros datos característicos del síndrome de Miller-Dieker son malformaciones cardíacas, renales, digitales y alteraciones de la vascularización retiniana1–8,10.
La etiología está relacionada principalmente con defectos genéticos. En la mayoría de los pacientes (hasta un 90%) se produce una deleción del cromosoma 17, subbanda p13.3, donde se localiza el gen Lis1, que codifica una proteína G, que desempañaría un papel clave en el desarrollo del telencéfalo, afectando a las corrientes de migración neuroblásticas, aunque no a la glía. Además de dicha deleción, también se ha observado un cromosoma 17 en anillo, así como afección del cromosoma 2 y el X5,7,14–19. La minoría de los casos, no relacionados claramente con el cromosoma 17, pueden tener causas infecciosas (citomegalovirus) o vasculares entre la décima y la décimosexta semana de gestación.
Es importante, una vez confirmado el diagnóstico, descartar translocaciones balanceadas en alguno de los progenitores, ya que el riesgo de recurrencias aumenta considerablemente. Asimismo, es importante un diagnóstico precoz mediante biopsia corial, teniendo en cuenta la posibilidad de mosaicismo germinal.
Agradecimiento especial por la inestimable ayuda, sin la que no hubiéramos podido llegar a un diagnóstico definitivo, al ECCEM.