El síndrome hepatopulmonar (SHP) es una enfermedad poco frecuente que afecta a pacientes de cualquier edad con enfermedad hepática aguda o crónica. Su diagnóstico se basa en la presencia de hipoxemia y la demostración de un cortocircuito pulmonar mediante ecocardiografía con contraste o gammagrafía de perfusión pulmonar. La angiografía es de utilidad para detectar fístulas macroscópicas. Se presentan 5 casos clínicos de edad pediátrica con diferente historia natural y evolución. A 2 de éstos se les diagnosticó SHP tipo 1, a otros 2 de tipo 2 y al quinto de tipo 1 y 2, lo que condicionó un enfoque terapéutico diferente en cada uno de los casos.
Hepatopulmonary syndrome is a rare disease that affects patients of any age with acute or chronic liver disease. Its diagnosis is based on the presence of hypoxemia and the demonstration of an intrapulmonary shunting by echocardiography with contrast or perfusion lung scanning. Pulmonary angiography is useful to demonstrate macroscopic arteriovenous communications. We describe five paediatric cases with a different natural history and evolution. Two of them were diagnosed with hepatopulmonary syndrome type 1, another two with type 2 and a fifth one with type 1 and 2, which required a different therapeutic approach in each case.
El síndrome hepatopulmonar (SHP) se define como una alteración en la oxigenación arterial debida al desarrollo de dilataciones intrapulmonares vasculares asociadas a una disfunción hepática1. Se ha descrito una prevalencia en la infancia del 9 al 20% asociada a la atresia de vías biliares, del 0,5% en los pacientes con trombosis portal y del 2 al 4% en otros tipos de cirrosis2,3. En el estudio de Noli et al se observó que el SHP aparece en un 8% de los niños con cirrosis o hipertensión portal grave2. No se conoce el mecanismo etiopatogénico exacto de formación de estas dilataciones vasculares pulmonares, pero la disminución del tono vascular pulmonar parece debida a un desequilibrio entre factores vasodilatadores y vasoconstrictores (los más estudiados son el óxido nítrico, el monóxido de carbono, la endotelina y el factor de necrosis tumoral alfa)4,5.
Clínicamente se manifiesta con disnea, platipnea, ortodesoxia (descenso de la presión parcial arterial de oxígeno [PaO2] superior o igual a 4mmHg o al 5% desde la posición decúbito supino hasta la bipedestación), acropaquias y cianosis labial. La ecocardiografía con contraste (suero salino) y la gammagrafía con macroagregados de albúmina marcados con tecnecio (Tc99m) permiten ver el paso del contraste a nivel sistémico, lo que orienta sobre la presencia de un cortocircuito de derecha a izquierda1,6,7. La angiografía pulmonar distingue 2 patrones. El tipo 1 o difuso y el tipo 2 o focal (menos frecuente) en el que se aprecian comunicaciones arteriovenosas focales6,8. No existe ningún tratamiento farmacológico efectivo. En el patrón tipo 2 es posible la embolización vascular1,6. El trasplante hepático resuelve este síndrome en más del 80% de los casos, aunque puede tardar meses en desaparecer1,8.
El propósito de este artículo es describir 5 casos de SHP estudiados en este hospital en los últimos 5 años con diferente historia natural y evolución (tabla 1).
Características clínicas de los pacientes
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | |
| Edad al diagnóstico de SHP | 15 años | 11 años | 2 años | 11 años | 8 meses |
| Sexo | Masculino | Femenino | Femenino | Femenino | Femenino |
| Enfermedad hepática | Atresia de vías biliares | Atresia de vías biliares | Cirrosis micronodulillar | Atresia de vías biliares | Atresia de vías biliares |
| PaO2 inicial | 53,3mmHg | 57mmHg | 37mmHg | 69mmHg | 43,3mmHg |
| Tipo de SHP | 2 | 1 | 1 y 2 | 2 | 1 |
| Tratamiento | Embolización | TOH | Embolización | Embolización | TOH |
| Evolución final | Asintomática | Asintomática | Fallecimiento | Asintomática | Fallecimiento |
PaO2: presión parcial arterial de oxígeno; SHP: síndrome hepatopulmonar; TOH: trasplante ortotópico de hígado.
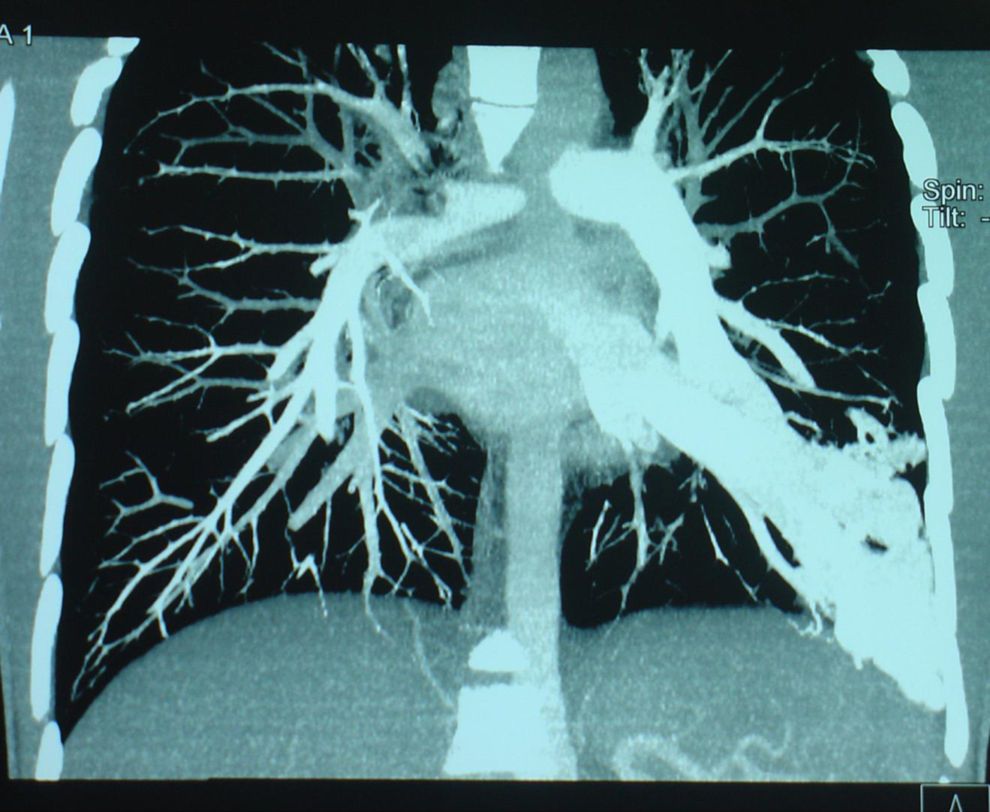
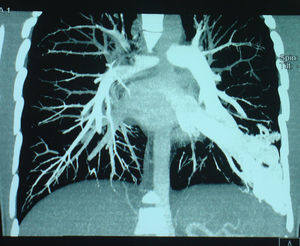
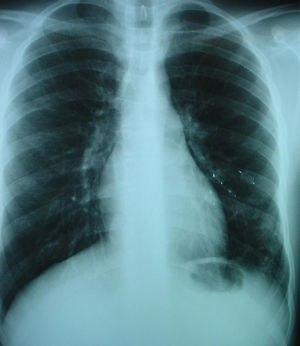
Paciente de 15 años de edad, intervenido mediante técnica de Kasai atípica a los 2 meses de vida por atresia de vías biliares, que presenta hipoxemia progresiva sin otra sintomatología acompañante. En la exploración física destacan acropaquias, uñas en vidrio de reloj y cianosis labial. Auscultación cardiopulmonar normal sin signos de dificultad respiratoria. Hepatomegalia de 2cm. Saturación arterial de oxígeno (SaO2) basal del 88% con ortodesoxia positiva. En la gasometría arterial (con fracción inspiratoria de oxígeno [FiO2] del 21%) se aprecia pH de 7,41, presión parcial arterial de dióxido de carbono (PaCO2) 36,5mmHg, PaO2 53,3mmHg, bicarbonato de 22,7mEq/l y exceso de bases de −1,3mEq/l. Se realiza una espirometría forzada, que es normal y una radiografía de tórax en la que se aprecia una condensación en el lóbulo inferior izquierdo. En la ecocardiografía se observa un corazón estructuralmente normal y, tras la inyección de contraste, un paso precoz a cavidades izquierdas, por lo que se sospecha la presencia de fístulas arteriovenosas pulmonares. La gammagrafía pulmonar de perfusión muestra la existencia de un cortocircuito de derecha a izquierda del 36%. Ante la sospecha de SHP tipo 2 se realiza una angiotomografía computarizada (angio-TC) pulmonar en la que se aprecia una imagen compatible con una fístula arteriovenosa de gran tamaño en la base pulmonar izquierda irrigada por la arteria pulmonar inferior y que drena a las venas pulmonares (fig. 1). Se realiza cateterismo cardíaco y se embolizan las arteriolas pulmonares aferentes más importantes con 4 plugs vasculares de Amplatzer® (fig. 2). Tras este procedimiento se observa una mejoría de la SaO2 ambiente al 95% y de la PaO2 a 80mmHg. Durante los 2 años de seguimiento posterior el paciente se encuentra asintomático, realiza vida normal y mantiene la SaO2 entre el 95 y el 96%.
Caso 2Paciente de 11 años, intervenida de atresia de vías biliares de forma paliativa mediante la técnica de Kasai a los 3 meses de vida, con aparición posterior de varices esofágicas por hipertensión portal, que presenta subcianosis labial y dificultad respiratoria al correr. En la exploración física se aprecian acropaquias y telangiectasias faciales y en el tórax superior. La auscultación cardiopulmonar es normal y no presenta signos de distrés respiratorio. Hepatomegalia de 2cm. La SaO2 fue del 91% con ortodesoxia positiva. La gasometría arterial (con FIO2 del 21%) muestra: pH 7,45, PaCO2 de 25,9mmHg, PaO2 de 57mmHg, bicarbonato de 21mEq/l y exceso de bases de −3mEq/l. La radiografía de tórax y la espirometría forzada son normales. En la ecocardiografía se observa un corazón morfológicamente normal, pero un paso precoz del contraste a cavidades izquierdas. La gammagrafía pulmonar de perfusión muestra un cortocircuito de derecha a izquierda del 30%. La angio-TC pulmonar es normal. Al diagnosticarse SHP tipo 1 se le administra tratamiento con oxígeno y se decide su inclusión en la lista de espera de trasplante hepático. Dieciocho meses después del diagnóstico se realiza un trasplante ortotópico de hígado (TOH) con buena evolución y desaparición progresiva de la hipoxemia con retirada de la oxigenoterapia a los 3 meses.
Caso 3Paciente de 2 años que ingresa por un cuadro de bronquitis aguda. Durante el ingreso presenta hipoxemia mantenida (SaO2 del 80 al 87%) a pesar de la resolución del cuadro obstructivo. En los antecedentes destaca que fue una recién nacida pretérmino intervenida por enterocolitis necrosante, portadora de una válvula de derivación ventriculoperitoneal y que presentó una colestasis neonatal con citólisis hepática atribuida a la nutrición parenteral que recibió. Posteriormente persistió la alteración de la función hepática con elevación de aminotransferasas y función de síntesis conservada, sin que se le realizara una biopsia. En la exploración física destacan acropaquias, polipnea y cianosis con una auscultación cardiopulmonar normal. Hepatomegalia de 2cm. La gasometría arterial (con FIO2 del 21%) muestra pH 7,50, PaCO2 de 44mmHg, PaO2 de 37mmHg, bicarbonato de 19mEq/l y exceso de bases de -1mEq/l. La radiografía de tórax es normal y la ecocardiografía con suero salino agitado mostró fístulas pulmonares sin signos de hipertensión pulmonar. En la gammagrafía pulmonar de perfusión se halla un patrón heterogéneo de captación con un cortocircuito de derecha a izquierda del 31% y en la hepática un patrón sugestivo de hepatopatía crónica avanzada. Se realiza una biopsia hepática que muestra cirrosis micronodulillar. En la angio-TC pulmonar se aprecian fístulas arteriovenosas en el lóbulo inferior derecho e izquierdo. Se le diagnostica SHP tipo 1 y 2 y se procedió a la embolización con coils de 4 fístulas sin incidencias. Se le da el alta con oxígeno domiciliario para mantener saturaciones del 90%. A los 2 meses reingresa por disfunción de la válvula de derivación ventriculoperitoneal, que se interviene y durante el período posquirúrgico presenta un cuadro de aumento de la polipnea, quejido e hipoxemia con SaO2 del 80 al 87% que requiere ventilación mecánica. Mantiene PaO2 inferior a 50mmHg con FIO2 al 21% por lo que se contraindica el TOH. Se realiza tratamiento empírico con ácido gárlico, con el objeto de mejorar la oxigenación, que no resulta efectivo. La paciente fallece por síndrome de distrés respiratorio tipo adulto con hipoxemia progresiva varios días después.
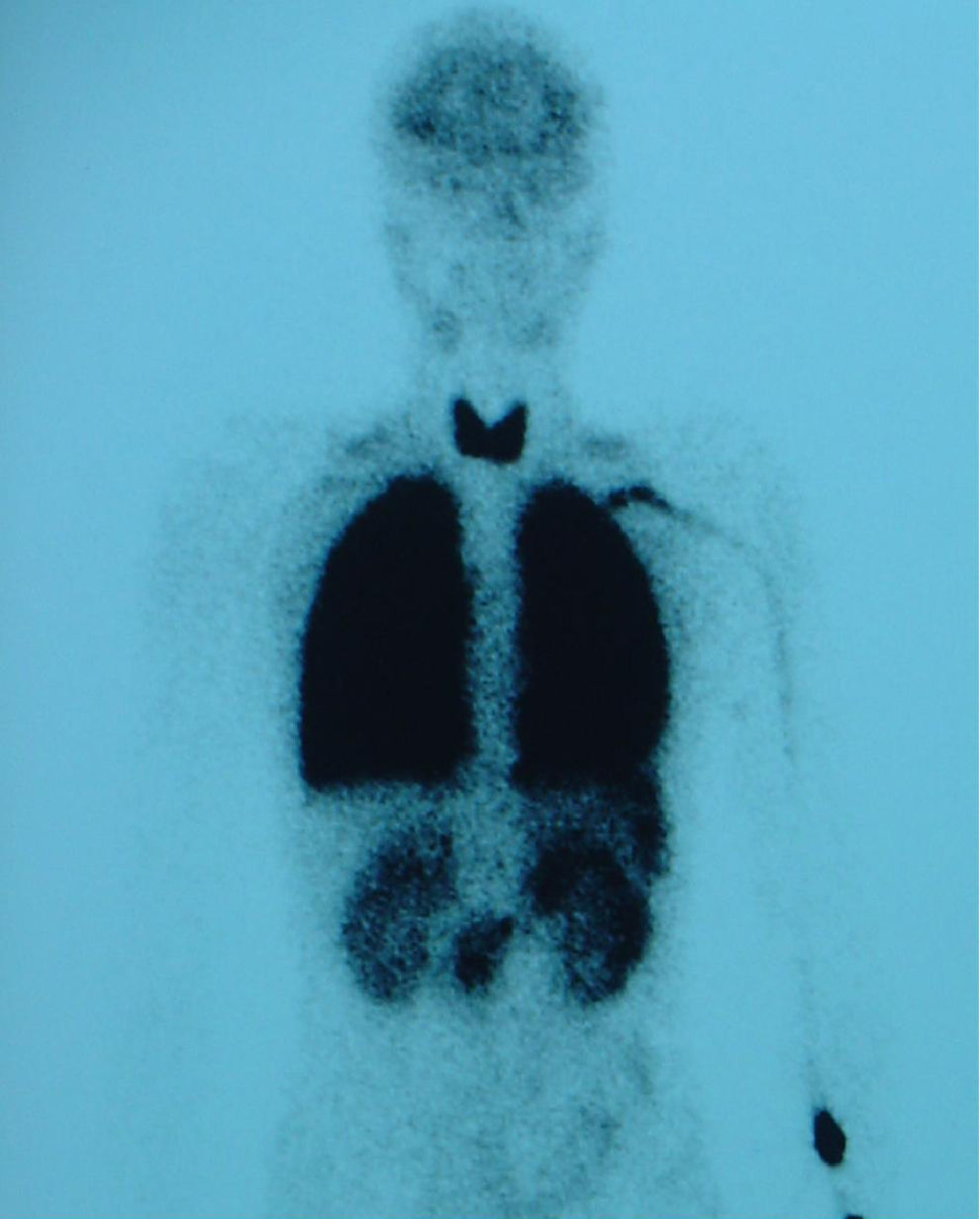
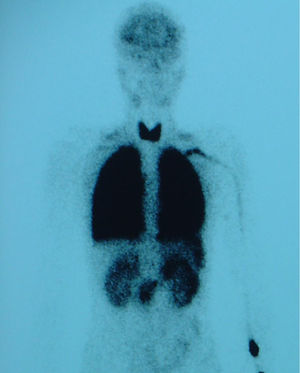
Caso 4Paciente de 11 años, trasplantada de hígado a los 7 meses de vida por atresia de vías biliares y en situación de cirrosis biliar por colangiopatía al momento de la consulta, que presenta episodios puntuales de cianosis central al correr y SaO2 basal del 93%. Al explorarla destacan acropaquias y cianosis labial. No presenta signos de dificultad respiratoria y la auscultación cardiorrespiratoria es normal. Ortodesoxia positiva. Hepatomegalia de 3cm. En la gasometría arterial (con FIO2 del 21%) se constata pH 7,46, PaCO2 de 27,5mmHg, PaO2 de 69mmHg, bicarbonato de 19,3mEq/l y exceso de bases de -3,2mEq/l. La espirometría forzada y la radiografía de tórax son normales pero en la ecocardiografía se aprecian 2 flujos sugestivos de fístulas, uno que desemboca en la aurícula derecha y el otro en la vena pulmonar izquierda. La gammagrafía pulmonar de perfusión muestra un cortocircuito de derecha a izquierda del 28% (fig. 3). En la angio-TC pulmonar se evidencia una fístula arteriovenosa periférica en el lóbulo inferior derecho. Tras el diagnóstico de SHP tipo 1 y 2, se realiza embolización de la fístula con coils, con mejoría parcial de la oxigenación, y posterior retrasplante hepático sin presentar complicaciones importantes tras su realización; se puede retirar a las 3 semanas el tratamiento con oxígeno.
Caso 5Paciente de 8 meses, intervenida mediante la técnica de Kasai a los 2 meses de vida por atresia de vías biliares con respuesta parcial por lo que se incluye en la lista de espera de trasplante hepático. Ingresa por síndrome febril, descompensación clínica de su insuficiencia hepática y dificultad respiratoria. En la exploración física destaca taquipnea con discreto tiraje intercostal y SaO2 basal del 94%. La auscultación cardiopulmonar es normal. Hepatomegalia de 2cm. La gasometría arterial (con FIO2 del 21%) muestra pH 7,31, PaCO2 de 43,9mmHg, PaO2 de 43,3mmHg, bicarbonato de 21,6mEq/l y exceso de bases de -4,5mEq/l. La radiografía de tórax es normal. En la ecografía abdominal se aprecia hipertensión portal y en la ecocardiografía se observa un corazón morfológicamente normal, con un paso precoz de contraste a cavidades izquierdas. La gammagrafía pulmonar de perfusión muestra un cortocircuito de derecha a izquierda del 24%. En la angio-TC pulmonar no se aprecian fístulas arteriovenosas macroscópicas. Se diagnostica SHP tipo 1 que se trata con oxigenoterapia hasta que posteriormente se realiza el TOH. La paciente fallece al mes de la intervención por una infección por adenovirus.
DiscusiónPara diagnosticar el SHP hay que demostrar la existencia de una alteración en la oxigenación arterial y dilataciones intravasculares pulmonares en el contexto de una enfermedad hepática1. El defecto en la oxigenación se valora como una PaO2 <80mmHg o un gradiente alveoloarterial de oxígeno (PA-aO2) ≥15mmHg con FIO2 del 21%. Según los valores de PaO2, y siempre que se tenga una PA-aO2 ≥15mmHg, podemos clasificar la gravedad de la enfermedad en leve (PaO2 ≥80mmHg), moderada (PaO2 ≥60–<80mmHg), grave (PaO2 ≥50–<60mmHg) o muy grave (PaO2<50mmHg)1,4,5. En el momento del diagnóstico, los pacientes de este estudio presentaban un grado moderado, grave o muy grave de la enfermedad con PaO2 que oscilaban entre 37 y 69mmHg. Además, si se observan las gasometrías arteriales, se puede ver que ninguno de éstos presentaba hipercapnia (PaCO2 ≥45mmHg) ya que estos pacientes suelen tener hipocapnia (PaCO2<35mmHg) con alcalosis respiratoria debido a la hipoventilación que presentan a causa de su enfermedad hepática avanzada1,8.
Para demostrar la existencia de dilataciones intravasculares pulmonares las pruebas más utilizadas son la ecocardiografía con contraste (suero salino agitado) y la gammagrafía con macroagregados de albúmina marcados con Tc99m. La primera se considerará positiva si tras la inyección de suero salino agitado en una vena sistémica aparecen microburbujas en la aurícula derecha y al cabo de 3 a 6 ciclos cardíacos éstas se ven en la aurícula izquierda, lo que indica la existencia de un cortocircuito pulmonar1,8–10. Se trata de una prueba muy sensible aunque poco específica, ya que en el 40% de los pacientes con cirrosis puede ser positiva sin tener una PA-aO2 elevada ni hipoxemia5–7. Estudios recientes indican como nuevo parámetro simple y factible para detectar un SHP en pacientes con cirrosis hepática el hallar un volumen de la aurícula izquierda ≥50ml11. La gammagrafía se considerará compatible con la presencia de un cortocircuito intrapulmonar si se capta una actividad en el cerebro o hígado ≥ 6%1,4. En todos los casos clínicos del presente estudio se encontró positividad en ambas pruebas.
Respecto a la enfermedad hepática causal, puede tratarse de una enfermedad hepática crónica o aguda1 y puede o no haber hipertensión portal4. También pueden tener una clínica similar al síndrome hepatopulmonar algunas enfermedades en las que existe un shunt portosistémico congénito con hipertensión portal sin enfermedad hepática (por ejemplo, la malformación de Abernethy tipo 1)4. Todos los pacientes de este estudio padecían una enfermedad hepática de larga evolución y en todos éstos existía hipertensión portal.
El síntoma más referido en estos casos fue la disnea y los signos más constantes la platipnea, la ortodesoxia, las acropaquias y la cianosis labial. Es frecuente la disnea de esfuerzo que progresa a disnea en reposo1,4. Los signos más frecuentes, pero no patognomónicos, son la platipnea y la ortodesoxia1,5,6,9. Otros hallazgos frecuentes son las arañas vasculares, las acropaquias y la cianosis labial1,4.
El control de la SaO2 por pulsioximetría es útil en el seguimiento de pacientes con formas moderadas y graves, sobre todo en niños y antes del TOH, aunque aporta más información la gasometría arterial. Una SaO2 inferior al 96% en la pulsioximetría tiene una sensibilidad del 100% y una especificidad del 88% para detectar pacientes con PaO2<60mmHg, y una SaO2 inferior al 94% tiene una especificidad del 93%. Se ha intentado utilizar la pulsioximetría como método de cribado para seleccionar a los pacientes con cirrosis a los que debe realizarse pruebas complementarias más agresivas para confirmar que padecen un SHP1,2,5,12. En todos los pacientes del presente estudio la SaO2 fue inferior o igual al 94% y se realizó una gasometría arterial en todos éstos, que presentaban una PaO2 inferior a 60mmHg, excepto en el cuarto caso.
La angiografía o la angio-TC pulmonar ayudan a diferenciar el SHP tipo 1 (difuso) del tipo 2 (fístulas focales)1,6,8. Los pacientes con formas avanzadas del tipo 1 y el tipo 2 presentan una peor respuesta al tratamiento con oxígeno1,8. Con la angio-TC se pudo detectar 1 caso de tipo 2 y 2 casos de tipo 1 y 2 en los que había componentes de difuso y de focal, hecho que permitió tomar una actitud terapéutica determinada en cada uno de estos.
Se han realizado estudios con diferentes fármacos (análogos de la somatostatina, betabloqueantes, inhibidores de la ciclooxigenasa, glucocorticoides, inmunosupresores, vasoconstrictores pulmonares, inhibidores del óxido nítrico, óxido nítrico inhalado, antibióticos, ácido gárlico, etc.) con resultados inciertos1,4,8. El único tratamiento farmacológico que se utilizó en los casos de este estudio fue el ácido gárlico, sin obtener mejoría de la oxigenación de la paciente. El mecanismo de acción exacto del ácido gárlico es desconocido. En el estudio de Najafi et al3 se observó, sobre todo en los pacientes de menor edad, una mejoría de la oxigenación en el 50% de los pacientes aunque esta mejoría no fue estadísticamente significativa.
Una opción terapéutica que ha demostrado ser eficaz para mejorar la oxigenación arterial de forma temporal es la embolización de la fístula focal en los casos de SHP tipo 21,6,13. En los casos del presente estudio con formas de este tipo hubo una mejoría clara de su hipoxemia en un paciente pero en los otros 2 esta mejoría no fue tan importante al tratarse de una forma mixta. Otros tratamientos paliativos como el shunt portosistémico transyugular y la cavoplastia (únicamente descrita como tratamiento efectivo en caso de síndrome de Budd-Chiari asociado) precisan más estudios1,4.
El TOH es el tratamiento que ofrece mejores resultados, aunque se ha descrito un 30% de fallecimientos tras el trasplante4,7,8. Se ha descrito una recuperación progresiva en más del 85% de los casos, en meses o incluso en años, de la oxigenación arterial y de los parámetros clínicos; este hecho indica la importancia de la disfunción hepática en la etiopatogenia de este síndrome1,4,5,8,14. También se ha descrito una regresión de la positividad en la ecocardiografía, es decir, del cortocircuito pulmonar15. Los pacientes de este estudio a los que se realizó TOH presentaron una recuperación de la oxigenación arterial en un período de días a 3 meses. En muchos estudios pediátricos se describe una mayor frecuencia de complicaciones postrasplante en los niños con SHP respecto a los que no padecen este síndrome2, aunque la supervivencia a largo plazo es similar en ambos casos4. En algunos estudios se ha determinado una supervivencia significativamente menor tras el TOH en aquellos pacientes con una PaO2 inferior a 50mmHg pretrasplante, hecho que puede ser motivo de contraindicación de realizar el TOH1,4,9,14. En el tercer caso clínico del presente estudio se contraindicó el trasplante por este motivo y el caso 5, también con una PaO2<50mmHg, falleció tras el trasplante. Algunos estudios apuntan a que debe replantearse la indicación de no realizar el TOH en caso de PaO2 inferior a 50mmHg ya que es el único tratamiento curativo para el SHP y, una vez realizado éste, se observa una supervivencia similar a la de los trasplantados de hígado sin SHP7,9.
Se han descrito recidivas del SHP tras el TOH o desarrollo del síndrome de hipertensión portopulmonar antes o después del TOH aunque es muy poco frecuente1,4,16 y no se observó en los pacientes de este estudio que sobrevivieron.
Se puede concluir que aunque sea una enfermedad poco frecuente se la tiene que considerar ante un niño con enfermedad hepática e hipoxemia. Tras confirmar el diagnóstico mediante gasometría, ecocardiografía con contraste y gammagrafía de perfusión pulmonar, la angiografía o la angio-TC permiten detectar aquellos casos susceptibles de tratamiento con embolización vascular. El resto de los casos tendrán que ser valorados para TOH.
La Fundació Universitària Agustí Pedro i Pons financió a la Dra. Sandra Rovira con una beca de formación.