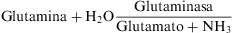El metotrexato es un antineoplásico muy utilizado y eficaz en neoplasias como las leucemias, los linfomas y los osteosarcomas. La toxicidad renal es un efecto secundario indeseable que se pretende evitar con una alcalinización urinaria e hiperhidratación eficaz.
En caso de intoxicación aguda se establece el uso de carboxipeptidasa G2, una enzima que provoca la hidrólisis del metotrexato en sus metabolitos inactivos.
Por su parte, el uso de glutamina durante el tratamiento oncológico previene parte de los efectos indeseables secundarios a éste.
Se presenta el caso clínico de un adolescente afectado de linfoma no hodgkiniano en tratamiento con glutamina, que tras la administración de un tercer ciclo de metotrexato (5g/m2) presentó un cuadro de insuficiencia renal que precisó la administración de carboxipeptidasa, con descenso no satisfactorio de las concentraciones de metotrexato en sangre, si bien no se pudo diferenciar la fracción activa del metabolito inactivo por carecer de esta técnica en España.
Se revisó la bibliografía sobre la interacción de glutamina y metotrexato y se discutió su fisiopatología sobre un posible papel de la glutamina como favorecedora de la toxicidad por metotrexato.
Methotrexate (MTX) is widely used as anticancer agent in various malignancies, including acute lymphoblastic leukaemia, lymphoma and osteosarcoma.
High doses of MTX may cause acute renal dysfunction. Nephrotoxicity is prevented by the use of alkalinization and hydration. More recently Carboxypeptidase-G2, a recombinant bacterial enzyme that rapidly hydrolyzes MTX to inactive metabolites, has become available for the treatment of acute nephrotoxicity.
On the other hand, glutamine is usually administered in oncology treatments to avoid other side effects.
We report a case of an adolescent who was diagnosed with T lymphoblastic lymphoma. He was receiving treatment with glutamine when the third course of methotrexate was administered (5g/m2) and he suffered a deterioration in his renal function.
Carboxypeptidase was used but the methotrexate serum concentration reduction was not satisfactory. The technique to assess the amount of enzyme-inactivated methotrexate by quantification of MTX metabolites is not available in our country, therefore, the concentrations of MTX may be overestimated.
The literature was reviewed to study the influence of glutamine on delayed methotrexate elimination which may lead to acute toxicity.
El metotrexato es un antifolato clásico y es uno de los agentes antineoplásicos más usado y estudiado; se administra en diversas neoplasias en dosis muy elevadas (3 a 12g/m2), en pacientes con función renal normal y se administra con hiperhidratación (3l/m2) y alcalinización1,2.
El metotrexato posee una estructura bioquímica similar al ácido fólico e inhibe competitivamente a la enzima dihidrofolato-reductasa, evitando la reducción de dihidrofolato a tetrahidrofolato (ácido folínico); actúa en forma específica en la fase S del ciclo de división celular, e inhibe la síntesis de ácido desoxirribonucleico, ácido ribonucleico, timidinatos y proteínas, por lo que las células que proliferan rápidamente se afectan más que las que crecen normalmente.
La administración de metotrexato en dosis altas es de vital importancia en los niños afectados de neoplasias, como leucemias, linfomas y osteosarcomas3.
En estos casos, el retraso en la eliminación de metotrexato y la exposición prolongada a este fármaco puede llevar a una toxicidad importante, sobre todo a un fallo renal agudo4–6 por una obstrucción renal secundaria al depósito de cristales de metotrexato y sus metabolitos (17-OH-metotrexato) en los túbulos renales, o bien por toxicidad directa del fármaco sobre estos túbulos.
Habitualmente, para prevenir estos problemas se establecen medidas tales como la hiperhidratación y la alcalinización urinaria1,2. También se administra ácido folínico para rescatar a órganos con alta tasa de recambio celular, como médula ósea y tegumentos, de la inhibición de la mitosis que ejerce el metotrexato.
En todo tratamiento con metotrexato se recomienda una estricta monitorización de las concentraciones, además de valorar la función renal5,6.
En caso de detectarse toxicidad, actualmente se ha incluido en el tratamiento una enzima bacteriana: carboxipeptidasa G2 (CPDG2), que provoca la hidrólisis del metotrexato en metabolitos no tóxicos, tales como el ácido 4-deoxi-4-amino-N10 metilpteroico (DAMPA) y el glutamato5,9,10.
Por su parte, se propone en pacientes oncológicos el uso del aminoácido glutamina como tratamiento y prevención de efectos secundarios de la quimioterapia11,12, dado que es una sustancia esencial en procesos metabólicos como el equilibrio acidobásico, el metabolismo de nutrientes y el control del balance entre catabolismo y anabolismo; es una sustancia importante en la regeneración de las células con alta proliferación, como las del tubo digestivo12.
Observación clínicaAdolescente de 14 años diagnosticado de linfoma linfoblástico T mediastínico, estadio iii, en tratamiento quimioterapéutico según protocolo Euro-LB 02 de la European Inter-Group Cooperation in Childhood Non Hodgkin Lymphoma, recomendado como tratamiento de referencia por la Sociedad Española de Hematología y Oncología Pediátrica.
Recibió el tercer ciclo de metotrexato en altas dosis (5g/m2 en infusión durante 24h) con las medidas de soporte habituales: alcalinización urinaria e hiperhidratación.
Se le administró tratamiento concomitante con ondansetrón, glutamina (5g/8h por mucositis grado iii en anterior ciclo de quimioterapia) y fluconazol (en dosis profilácticas por muguet orofaríngeo durante el protocolo de inducción IB).
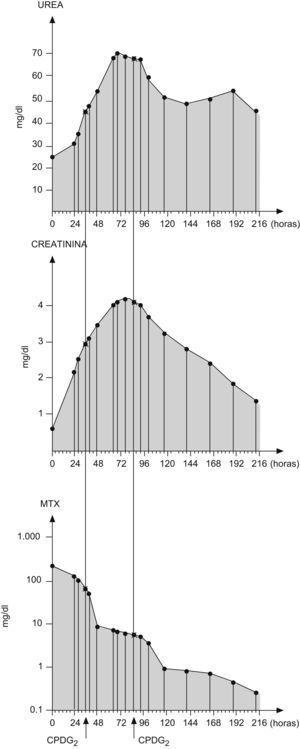
Tras finalizar la infusión de metotrexato, presentó edema facial moderado, presiones arteriales en límites normales para la edad y diuresis de 2,5cm3/kg/h, si bien insuficiente y con balance positivo en relación con la hiperhidratación administrada. Las concentraciones de metotrexato determinadas en plasma a las 24h fueron de 244,94μmol/l. La creatinina plasmática se incrementó de 0,50mg/dl antes del metotrexato a 2,30mg/dl a las 24h, y los valores de urea plasmática pasaron de 23mg/dl a 29mg/dl (tabla 1).
La función hepática y los iones no se alteraron.
Se intensificaron medidas de soporte habituales con ácido folínico según protocolo, se aumentó la hiperhidratación a 4.500cm3/m2 y se forzó la diuresis para mantenerla en 100cm3/m2/h como mínimo.
A las 34h del inicio del metotrexato y con signos de insuficiencia renal aguda (tabla 1), se administró la enzima carboxipeptidasa (50 U/kg por vía intravenosa durante 5 min) (fig. 1), con lo que se produjo un descenso en las concentraciones de metotrexato a 8,58μmol/l (tabla 2). Al ser un sustrato competitivo para la CPDG2, la perfusión de ácido folínico se suspendió 2h antes de su infusión y no se readministró hasta 2h después, como se indica en la ficha técnica del producto. Esta medicación es actualmente de «uso compasivo» en España, y se solicita autorización a la familia para su infusión.
Posteriormente, se realizaron determinaciones seriadas de metotrexato, en las que se detectaron concentraciones por encima de 6μmol/l mantenidas, con aumento progresivo de las cifras de urea y creatinina (tabla 2).
Por este motivo, se administró una segunda dosis de carboxipeptidasa a las 85 h de iniciar el metotrexato, la que fue menos eficaz que la primera, con un descenso del 96,4% en las concentraciones de metotrexato tras la primera administración de la enzima frente a un descenso del 24% tras la segunda dosis.
Se continuó con el tratamiento de rescate con ácido folínico e hiperhidratación hasta concentraciones de metotrexato inferiores a 0,2μmol/l.
Durante este período, las concentraciones de creatinina plasmática fueron aumentando progresivamente, con el valor más alto a las 78 h de haber iniciado el tratamiento con metotrexato, donde se detectó un aumento de 8,8 veces su valor basal (tabla 1).
Las concentraciones de urea y creatinina fueron descendiendo de forma progresiva hasta que a los 26 días tras la dosis de metotrexato se alcanzaron valores dentro de la normalidad, y se continuó con el siguiente ciclo de quimioterapia (metotrexato a 3g/m2 en 4h con hiperhidratación y alcalinización a 3.500cm3/m2/día), sin incidencias y con retirada concomitante del aporte de glutamina oral.
DiscusiónEn el presente artículo se aporta el caso de un adolescente en el que se desarrolló una intoxicación aguda por metotrexato tras la administración del tercer ciclo de éste, según protocolo Euro-LB 02, con parámetros de insuficiencia renal aguda1,4,7.
Al adolescente se le administraron 2 dosis de carboxipeptidasa2–4, con descenso en las concentraciones de metotrexato según se valora en gráfica.
La importante dificultad con la que uno se encuentra fue la imposibilidad de medir los metabolitos inactivos del metotrexato (DAMPA) tras una primera administración de la enzima carboxipeptidasa13,14, sin poder deslindar de las determinaciones de concentraciones séricas de metotrexato lo que realmente era fármaco activo y lo que era su metabolito inactivo.
Esto hizo que se utilizase una segunda dosis de carboxipeptidasa ante las concentraciones de metotrexato mantenidas de metotrexato (y DAMPA) tras la primera dosis2,3,6. Actualmente se acepta una segunda dosis de carboxipeptidasa en las primeras 48h si las concentraciones pretratamiento son mayores de 100μmol/l, como ocurría en el caso presentado.
La determinación de las concentraciones de metotrexato activo en sangre y sus metabolitos inactivos (DAMPA), en laboratorios especializados, se propone como fundamental en esta comunicación para decidir en qué niños se ha de administrar una segunda dosis de la enzima, habida cuenta de los efectos secundarios que se podrían evitar así como el alto coste económico de este producto, pues en la actualidad (enero 2009) no hay laboratorio farmacológico en España que determine esas concentraciones.
Por otra parte, y tras evaluar los antecedentes personales del niño, se valoró la ingesta de glutamina en dosis de 5 g cada 8h por la mucositis grados iii que en ciclos previos había presentado el niño9,12,15.
Dado que este aminoácido tiene importantes funciones en el recambio de las células epiteliales del intestino, facilitando su regeneración y disminuyendo el grado de mucositis tras la quimioterapia, se propuso su tratamiento como suplemento dietético16, si bien no se contempla su uso como tratamiento habitual en el protocolo de linfoma no hodgkiniano.
La glutamina tiene una función importante como transportador de amonio en sangre17. En el riñón está presente la enzima glutaminasa, que es quien provoca la liberación del amoníaco (NH3)
Ese amoníaco en el túbulo proximal renal se protona tomando hidrogeniones (H+) y pasa a amonio.
En estudios realizados en modelos animales a los que se administra suplementos de glutamina se ha constatado que en el túbulo proximal se obtiene un pH más ácido que el habitual, lo que podría facilitar la precipitación del metotrexato a ese nivel, si bien el pH distal urinario es el habitual por mecanismos compensadores renales.
También se ha descrito una disminución en la tasa de excreción del metotrexato de hasta un 65%, en ratas a las que se había administrado glutamina de forma concomitante15.
Todo esto hizo plantearse la suspensión de la administración de glutamina en los siguientes ciclos de metotrexato hasta que sus concentraciones se hallasen por debajo de 0,2μmol/l, sin detectar en ciclos posteriores toxicidad por metotrexato8, si bien con dosis de 3g/m2.
Por tanto, en el presente caso se ha confirmado la eficacia terapéutica de la enzima carboxipeptidasa9,10 como rescate de la intoxicación aguda por metotrexato. Sería también necesaria la determinación de las concentraciones hematológicas tanto de metotrexato activo como de sus metabolitos inactivos.
Por otra parte, hacen falta más estudios en cuanto a la interacción que pueda haber en la zona renal tras la administración de glutamina oral concomitante con altas dosis de metotrexato.