Sr. Editor:
El síndrome del pulmón seco (SPS) es una entidad clínica sobre la que se ha escrito poco y probablemente infradiagnosticada. Se han descrito sólo 9 casos en la bibliografía revisada 1-4, con una incidencia de 3,2-3,5 % de los recién nacidos prematuros con rotura prematura de membranas 1,2.
Se presenta como un estrés respiratorio severo en el período neonatal inmediato, siempre relacionado con la presencia de oligohidramnios, generalmente secundario a pérdida de líquido amniótico durante un período de tiempo más o menos prolongado.
Se suele presentar como un estrés respiratorio que empeora de forma brusca e hipoxemia severa en las primeras 12-18 h de vida con necesidad de soporte respiratorio agresivo. Sorprendentemente, el cuadro se resuelve en 12-24 h si el recién nacido sobrevive a dicho empeoramiento.
Se presenta un caso compatible con el diagnóstico de SPS en el que se muestra la evolución del mismo.
Un recién nacido, segundo gemelo, de sexo femenino nace en la semana 29 de una gestación gemelar, bicorial biamniótica que cursa con oligohidramnios de ambas bolsas desde la semana 18, después de la práctica de amniocentesis.
Ante la gravedad del oligohidramnios de la segunda bolsa se finaliza la gestación mediante cesárea, previa maduración fetal con dos tandas de betametasona.
El peso al nacer es de 1.175 g. El test de Apgar al minuto es de 4 y a los 5 min de 8. Nace cianótica, por lo que requiere reanimación en sala de partos con ventilación a presión positiva mediante bolsa y mascarilla. En la exploración destacan deformidad facial y alteración en la posición de las extremidades, atribuidas al oligohidramnios.
La analítica de ingreso, incluyendo gasometría arterial, es normal, excepto IL-6 de 519,20 U/ml (normal < 10 U/ml).
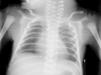
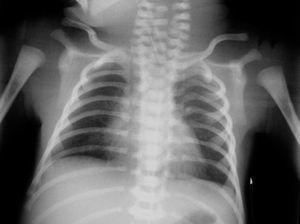
A los 30 min de vida presenta estrés respiratorio leve pero con saturaciones de oxígeno del 73-74 %, por lo que se realiza radiografía de tórax que no muestra alteraciones significativas del parénquima pulmonar y se inicia soporte respiratorio con CPAP nasal (presión de 5-6 cm de agua y FiO2 del 40-50 %). A las 6-8 h de vida se produce empeoramiento respiratorio brusco (fig. 1) y posteriormente hemodinámico que requiere intubación y ventilación mecánica agresiva (presión positiva al final de la espiración (PEEP) 4 cm, presión pico inspiratoria (PPI) máxima 40 cm y presión media de vía aérea (PAM) 11 cmH2O y FiO2 100 %), se administra surfactante bovino (2 dosis), óxido nítrico inhalado (NOi) a una concentración máxima de 20 partes por millón y drogas vasoactivas (dopamina 7 μg/kg/min y dobutamina 15 μg/kg/min), sin observarse cambios en la radiografía de tórax (fig. 2).
Figura 1.A) Diferencia alveoloarterial de oxígeno (DAaO2) en las primeras 48 h de vida.B)Índice de oxigenación en las primeras 48 h de vida.
Figura 2. Radiografía de tórax.
A partir de las 12-18 h de vida mejora significativamente y puede retirarse progresivamente el soporte inotrópico, el NOi y la asistencia respiratoria hasta parámetros ventilatorios mínimos, retirándose por completo en 24 h. Se procede a la extubación a las 72 h de vida sin necesidades suplementarias de oxígeno.
La otra gemela no presentó alteraciones respiratorias ni necesidad de oxígeno suplementario.
La pérdida de líquido amniótico como consecuencia de rotura prematura de membranas o tras amniocentesis se ha asociado a hipoplasia pulmonar y a alteraciones de la función pulmonar 5,6.
En general, la gravedad de la hipoplasia pulmonar secundaria a oligohidramnios depende del momento en que éste aparezca y del tiempo que se mantenga. Se ha observado mayor intensidad de la hipoplasia pulmonar si la rotura prematura pretérmino de membranas ocurre a menor edad gestacional y cuanto mayor tiempo discurre desde el inicio de pérdida de líquido amniótico y el nacimiento 7-10.
Los criterios diagnósticos engloban: a) nacimiento prematuro después de pérdida prolongada de líquido amniótico (de 4 o más días) o por alguna otra causa que comporte pérdida de fluido pulmonar y compresión pulmonar fetal; b) estrés respiratorio grave inmediatamente después del nacimiento, por lo que se requiere ventilación agresiva; c) importante mejoría en los requerimientos ventilatorios y de oxígeno durante las primeras 24-36 h de vida, con resolución total del cuadro en 48 h, y d) exclusión de otras patologías como el síndrome del estrés respiratorio o sepsis 1.
El mecanismo fisiopatológico del SPS se basa sólo en especulaciones; se estudia la hipótesis que por compresión externa y por la pérdida continua de líquido pulmonar fetal los bronquios pequeños y los bronquiolos se colapsarían y requerirían presiones elevadas para poder distenderlos y superar la fuerza capilar 10.
Sakai et al 3 refieren la imposibilidad de ventilar a estos niños incluso aplicando PAM de 30 cmH2O y sí, con la instilación intratraqueal de 1 ml de adrenalina (10 veces en 30 min) debido a que este fármaco podría ayudar a distender las vías aéreas colapsadas a bajas presiones ya que las fuerzas capilares no estarían implicadas, esto sugeriría un problema secundario al broncoespasmo causado por el oligohidramnios.
Se podría hablar en cierto modo, de hipoplasia pulmonar funcional por colapso alveoloarterial, que se resolvería con el reclutamiento alveolar. Esto daría respuesta a la inexplicable mejoría en relativamente pocas horas sin precisar después soporte respiratorio o administración de oxígeno, a diferencia de lo que ocurre en los pacientes afectados de hipoplasia pulmonar o de hipertensión pulmonar neonatal persistente.
En conclusión, el SPS es una entidad con toda probabilidad infradiagnosticada pero con unas manifestaciones clínicas reconocibles cuya epidemiología y patogenia requieren más estudios observacionales y experimentales para definirse mejor.
Correspondencia: Dra. S. Martínez Nadal.
Diagonal, 660. 08034 Barcelona. España.
Correo electrónico: neonatos@sciashdb.com